人教版化学九下:8.3.1 铁的冶炼 课件(共21张PPT)
文档属性
| 名称 | 人教版化学九下:8.3.1 铁的冶炼 课件(共21张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-13 15:03:24 | ||
图片预览






文档简介
(共21张PPT)
第八单元 金属和金属材料
课题3 金属资源的利用和保护
第1课时 铁的冶炼
学习目标-新课导入-新知探究-课堂小结-课堂训练
人教版-化学-九年级下册
1.了解知道常见的金属矿物。
3.掌握含杂质物质的有关化学方程式的计算。
学习目标
2.理解铁的冶炼方法和原理。
新课导入
金属活动性顺序表:
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
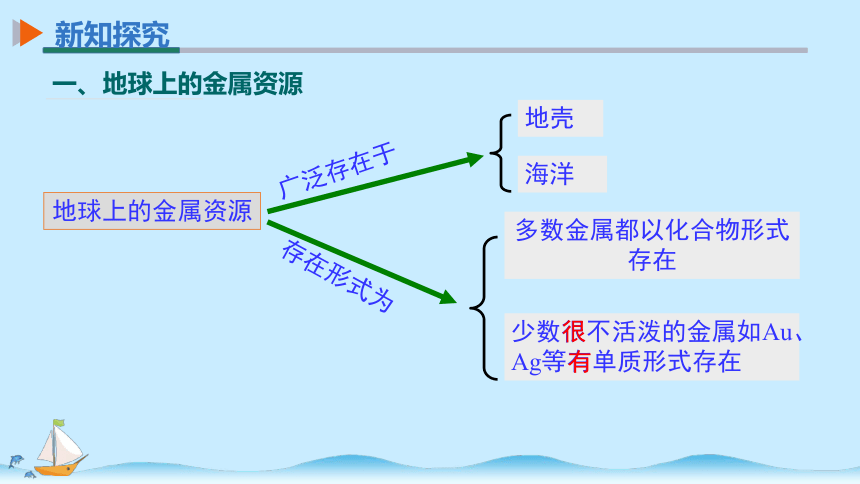
地球上的金属资源
广泛存在于
地壳
海洋
存在形式为
少数很不活泼的金属如Au、Ag等有单质形式存在
多数金属都以化合物形式存在
有
很
一、地球上的金属资源
新知探究
自然界以单质形式存在的金
自然界以单质形式存在的银
新知探究
赤铁矿: Fe2O3
黄铁矿: FeS2
菱铁矿: FeCO3
常见的金属矿石
新知探究
铝土矿: Al2O3
黄铜矿:CuFeS2
辉铜矿:Cu2S
新知探究
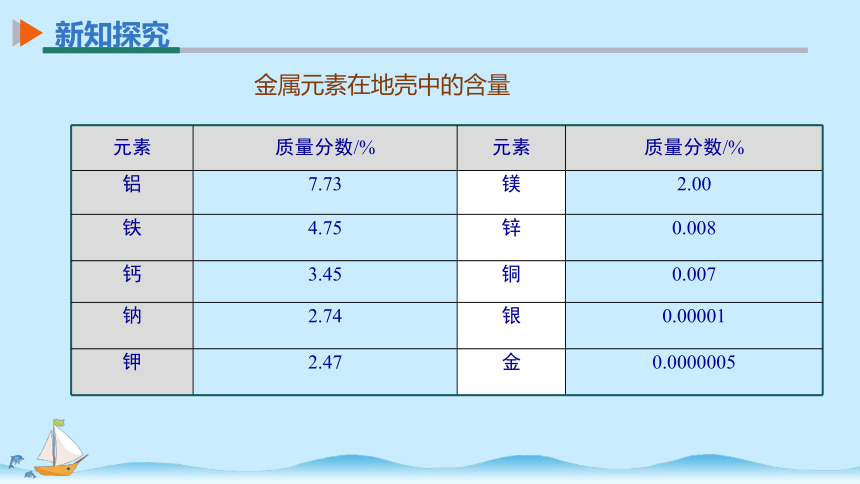
金属元素在地壳中的含量
元素 质量分数/% 元素 质量分数/%
铝 7.73 镁 2.00
铁 4.75 锌 0.008
钙 3.45 铜 0.007
钠 2.74 银 0.00001
钾 2.47 金 0.0000005
新知探究
二、铁的冶炼
新知探究
1.冶铁的目的
铁的化合物
铁单质
2.冶铁的化学原理
Fe2O3+3CO 2Fe+3CO2
高温
铁的冶炼(实验室)
新知探究
石灰水
Fe2O3
CO
A
B
Fe
注意:酒精灯B的作用:处理尾气,防止CO污染大气。
⑥熄灭点燃尾气的酒精灯
3.步骤:①通CO;
③点燃加热Fe2O3的酒精灯;
④停止加热Fe2O3;
⑤停止通CO;
现象:红棕色的物质变为黑色;澄清的石灰水变浑浊。
②点燃处理尾气的酒精灯;
新知探究
先
后
先停止
后停止
通CO气体
加热
实验开始时
实验结束时
通入CO气体
加热氧化铁
排净空气,防止爆炸
防止铁被氧化
CO
热源
早来晚走
迟到早退
新知探究
1.原料:
焦炭、石灰石、铁矿石
黄铁矿 FeS2
赤铁矿 Fe2O3
菱铁矿 FeCO3
磁铁矿 Fe3O4
2.原理:
在高温下,利用焦炭与氧气反应生成的一氧化碳把铁从铁矿石中还原出来。
Fe2O3+3CO 2Fe+3CO2
高温
3.主要设备:炼铁高炉
铁的冶炼(工业)
新知探究
将铁矿石中的 SiO2转变为炉渣
点燃
(1) C + O2 === CO2
高温
(2)C + CO2 === 2CO
生铁
出铁口
炉渣
出渣口
⑶ Fe2O3 + 3CO ===== 2Fe + 3CO2
高温
高炉气体
高炉气体
① 产生一氧化碳
② 提供热量
新知探究
认识铁矿石、氧化铁和铁;铁与生铁的关系
铁矿石
Fe2O3
Fe
混合物
化合物
(纯净物)
单 质
(纯净物)
生 铁
(主要含铁)
合 金
(混合物)
纯净物的质量
物质的纯度= ×100%
不纯物的总质量
新知探究
例:用1000 t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁多少 t
解:设理论上可以炼出含铁96的生铁的质量为x。
Fe2O3 ------------------2 Fe
160 2×56
1000t×80% x·96%
∵ 160 2×56
1000t×80% x·96%
∴ x=
2×56× 1000t×80%
160×96%
= 583 t
答:略。
新知探究
◆ 铁的冶炼
1.原料:焦炭、石灰石、铁矿石
2.原理:
在高温下,利用焦炭与氧气反应生成的一氧化碳把铁从铁矿石中还原出来
◆ 涉及杂质问题的计算
在实际生产时,所用的原料或产物一般都含有杂质,在计算用料和产量时,应注意杂质问题。
Fe2O3+3CO 2Fe+3CO2
高温
课题小结
课堂训练
1.下列矿石中,其主要成分不属于氧化物的是( )
A.铝土矿 B.菱铁矿 C.赤铁矿 D.磁铁矿
2.高炉炼铁中发生了下列反应:①高温下一氧化碳将铁矿石还原为铁;②高温煅烧石灰石;③灼热的焦炭和二氧化碳反应;④焦炭充分燃烧。其中属于化合反应的是( )
A.①和④ B.②和③ C.③和④ D.只有④
B
C
课堂训练
3.用1000 t含有氧化铁80%的赤铁矿石,理论上可以炼出97%的生铁的质量约是( )
A.560 t B.571 t C.577 t D.583 t
C
4.如图所示,用“W”形玻璃管进行微型实验。下列有关叙述不正确的是( )
A
A.a处发生反应的化学方程式是
B.b处观察到的现象是澄清石灰水变浑浊
C.此装置可节约用品,污染小,现象明显
D.尾气用燃着的酒精灯将其点燃,或用气球收集起来
课堂训练
5.(易错题)某化学小组的同学利用混有少量CO2的CO气体还原氧化铁,并验证反应后的气体产物。实验室现有如图所示实验装置(可重复使用)。按气体从左到右的方向,装置连接顺序正确的是( )
A.甲→乙→丙→丁 B.甲→丙→乙→丁
C.乙→甲→丙→甲→丁 D.乙→甲→丙→乙→丁
C
课堂训练
6.某化学兴趣小组利用如图所示装置进行实验,探究工业炼铁的化学原理,试按要求填空:
(1)硬质玻璃管中观察到的现象是__红色固体变为黑色__,写出一氧化碳和氧化铁反应的化学方程式:_____________________________
(2)实验中首先通入一氧化碳的目的_________________________________。
(3)装置中导管末端加一点燃的酒精灯的目的是__________________________。
(4)实验结束,先撤去酒精喷灯,继续通CO直至试管冷却的目的是_____
_____________________________。
排尽玻璃管内的空气,防止加热时爆炸
除去多余的CO,防止污染空气
防止生成的铁被空气中的氧气氧化
第八单元 金属和金属材料
课题3 金属资源的利用和保护
第1课时 铁的冶炼
学习目标-新课导入-新知探究-课堂小结-课堂训练
人教版-化学-九年级下册
1.了解知道常见的金属矿物。
3.掌握含杂质物质的有关化学方程式的计算。
学习目标
2.理解铁的冶炼方法和原理。
新课导入
金属活动性顺序表:
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
地球上的金属资源
广泛存在于
地壳
海洋
存在形式为
少数很不活泼的金属如Au、Ag等有单质形式存在
多数金属都以化合物形式存在
有
很
一、地球上的金属资源
新知探究
自然界以单质形式存在的金
自然界以单质形式存在的银
新知探究
赤铁矿: Fe2O3
黄铁矿: FeS2
菱铁矿: FeCO3
常见的金属矿石
新知探究
铝土矿: Al2O3
黄铜矿:CuFeS2
辉铜矿:Cu2S
新知探究
金属元素在地壳中的含量
元素 质量分数/% 元素 质量分数/%
铝 7.73 镁 2.00
铁 4.75 锌 0.008
钙 3.45 铜 0.007
钠 2.74 银 0.00001
钾 2.47 金 0.0000005
新知探究
二、铁的冶炼
新知探究
1.冶铁的目的
铁的化合物
铁单质
2.冶铁的化学原理
Fe2O3+3CO 2Fe+3CO2
高温
铁的冶炼(实验室)
新知探究
石灰水
Fe2O3
CO
A
B
Fe
注意:酒精灯B的作用:处理尾气,防止CO污染大气。
⑥熄灭点燃尾气的酒精灯
3.步骤:①通CO;
③点燃加热Fe2O3的酒精灯;
④停止加热Fe2O3;
⑤停止通CO;
现象:红棕色的物质变为黑色;澄清的石灰水变浑浊。
②点燃处理尾气的酒精灯;
新知探究
先
后
先停止
后停止
通CO气体
加热
实验开始时
实验结束时
通入CO气体
加热氧化铁
排净空气,防止爆炸
防止铁被氧化
CO
热源
早来晚走
迟到早退
新知探究
1.原料:
焦炭、石灰石、铁矿石
黄铁矿 FeS2
赤铁矿 Fe2O3
菱铁矿 FeCO3
磁铁矿 Fe3O4
2.原理:
在高温下,利用焦炭与氧气反应生成的一氧化碳把铁从铁矿石中还原出来。
Fe2O3+3CO 2Fe+3CO2
高温
3.主要设备:炼铁高炉
铁的冶炼(工业)
新知探究
将铁矿石中的 SiO2转变为炉渣
点燃
(1) C + O2 === CO2
高温
(2)C + CO2 === 2CO
生铁
出铁口
炉渣
出渣口
⑶ Fe2O3 + 3CO ===== 2Fe + 3CO2
高温
高炉气体
高炉气体
① 产生一氧化碳
② 提供热量
新知探究
认识铁矿石、氧化铁和铁;铁与生铁的关系
铁矿石
Fe2O3
Fe
混合物
化合物
(纯净物)
单 质
(纯净物)
生 铁
(主要含铁)
合 金
(混合物)
纯净物的质量
物质的纯度= ×100%
不纯物的总质量
新知探究
例:用1000 t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁多少 t
解:设理论上可以炼出含铁96的生铁的质量为x。
Fe2O3 ------------------2 Fe
160 2×56
1000t×80% x·96%
∵ 160 2×56
1000t×80% x·96%
∴ x=
2×56× 1000t×80%
160×96%
= 583 t
答:略。
新知探究
◆ 铁的冶炼
1.原料:焦炭、石灰石、铁矿石
2.原理:
在高温下,利用焦炭与氧气反应生成的一氧化碳把铁从铁矿石中还原出来
◆ 涉及杂质问题的计算
在实际生产时,所用的原料或产物一般都含有杂质,在计算用料和产量时,应注意杂质问题。
Fe2O3+3CO 2Fe+3CO2
高温
课题小结
课堂训练
1.下列矿石中,其主要成分不属于氧化物的是( )
A.铝土矿 B.菱铁矿 C.赤铁矿 D.磁铁矿
2.高炉炼铁中发生了下列反应:①高温下一氧化碳将铁矿石还原为铁;②高温煅烧石灰石;③灼热的焦炭和二氧化碳反应;④焦炭充分燃烧。其中属于化合反应的是( )
A.①和④ B.②和③ C.③和④ D.只有④
B
C
课堂训练
3.用1000 t含有氧化铁80%的赤铁矿石,理论上可以炼出97%的生铁的质量约是( )
A.560 t B.571 t C.577 t D.583 t
C
4.如图所示,用“W”形玻璃管进行微型实验。下列有关叙述不正确的是( )
A
A.a处发生反应的化学方程式是
B.b处观察到的现象是澄清石灰水变浑浊
C.此装置可节约用品,污染小,现象明显
D.尾气用燃着的酒精灯将其点燃,或用气球收集起来
课堂训练
5.(易错题)某化学小组的同学利用混有少量CO2的CO气体还原氧化铁,并验证反应后的气体产物。实验室现有如图所示实验装置(可重复使用)。按气体从左到右的方向,装置连接顺序正确的是( )
A.甲→乙→丙→丁 B.甲→丙→乙→丁
C.乙→甲→丙→甲→丁 D.乙→甲→丙→乙→丁
C
课堂训练
6.某化学兴趣小组利用如图所示装置进行实验,探究工业炼铁的化学原理,试按要求填空:
(1)硬质玻璃管中观察到的现象是__红色固体变为黑色__,写出一氧化碳和氧化铁反应的化学方程式:_____________________________
(2)实验中首先通入一氧化碳的目的_________________________________。
(3)装置中导管末端加一点燃的酒精灯的目的是__________________________。
(4)实验结束,先撤去酒精喷灯,继续通CO直至试管冷却的目的是_____
_____________________________。
排尽玻璃管内的空气,防止加热时爆炸
除去多余的CO,防止污染空气
防止生成的铁被空气中的氧气氧化
同课章节目录
