高二化学人教版(2019)选择性必修一 4.2.2电解原理的应用(24张ppt)
文档属性
| 名称 | 高二化学人教版(2019)选择性必修一 4.2.2电解原理的应用(24张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 7.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-14 13:03:16 | ||
图片预览




文档简介
(共24张PPT)
第四章
第2课时
电解原理的应用
第二节 电解池
化学反应与电能
APPLICATION OF ELECTROLYSIS PRINCIPLES
Electrolytic cell
Cl-、OH-
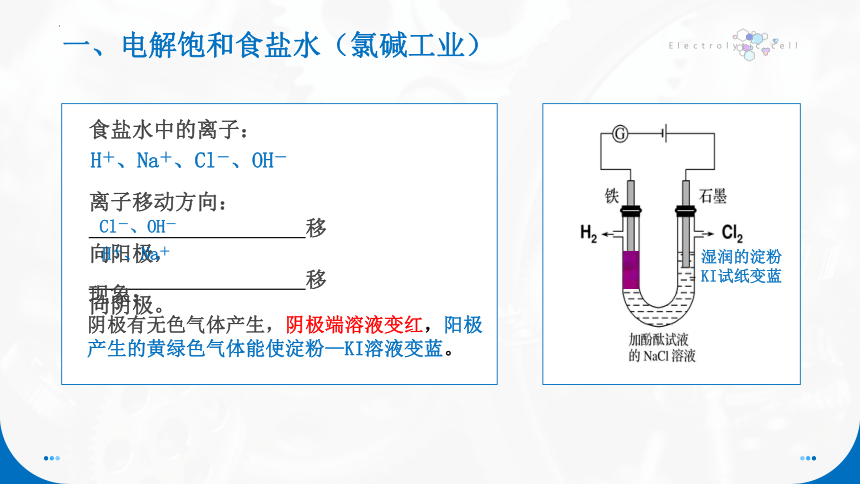
一、电解饱和食盐水(氯碱工业)
食盐水中的离子:
湿润的淀粉
KI试纸变蓝
离子移动方向:
移向阳极,
移向阴极。
现象:
阴极有无色气体产生,阴极端溶液变红,阳极产生的黄绿色气体能使淀粉—KI溶液变蓝。
H+、Na+
H+、Na+、Cl-、OH-
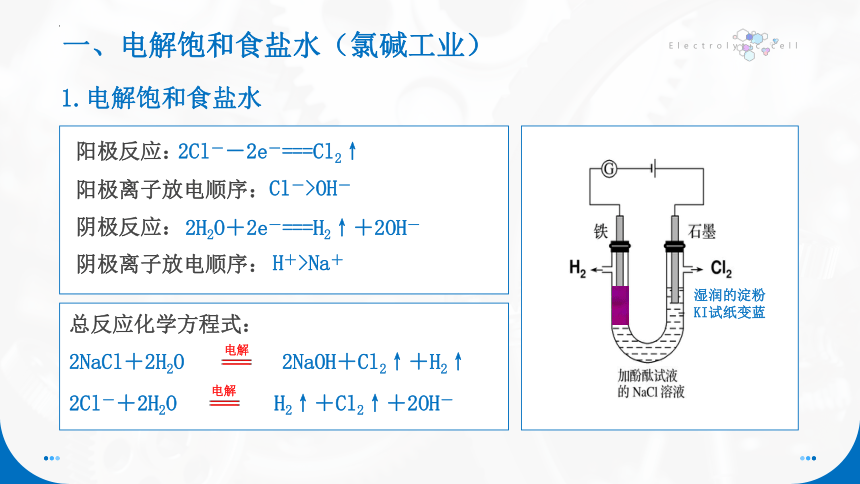
一、电解饱和食盐水(氯碱工业)
1.电解饱和食盐水
湿润的淀粉
KI试纸变蓝
阳极反应:
2Cl--2e-===Cl2↑
Cl->OH-
阳极离子放电顺序:
阴极反应:
2H2O+2e-===H2↑+2OH-
H+>Na+
阴极离子放电顺序:
总反应化学方程式:
2NaCl+2H2O 2NaOH+Cl2↑+H2↑
电解
2Cl-+2H2O H2↑+Cl2↑+2OH-
电解
一、电解饱和食盐水(氯碱工业)
思考:上述装置的缺点
(1)H2和Cl2 混合不安全。
(2)Cl2会和NaOH反应,会使得到的NaOH不纯。
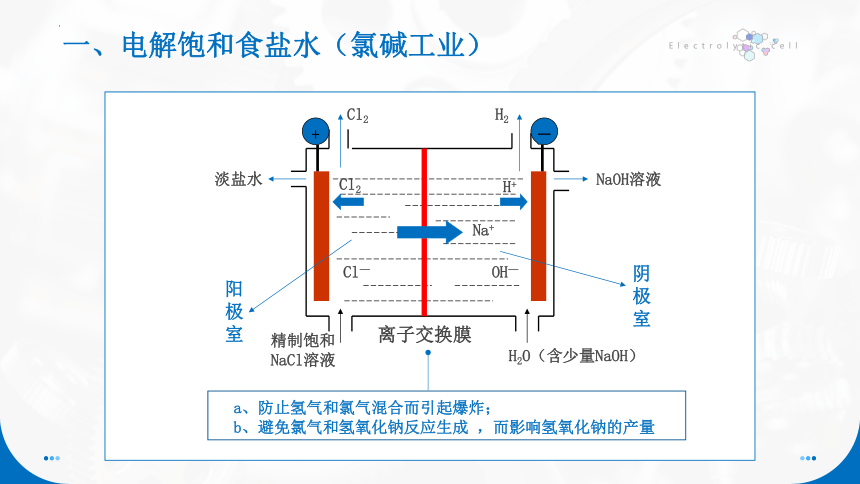
一、电解饱和食盐水(氯碱工业)
(1)生产设备名称:离子交换膜电解槽
阴极:碳钢
阳极:钛
阳离子交换膜:只允许阳离子通过
(Cl-、OH-离子和气体不能通过),把电解槽隔成阴极室和阳极室。
3.离子交换膜法制烧碱
Cl2+2NaOH =NaCl+NaClO+H2O
遇火或强光会爆炸
(2)离子交换膜的作用:
a.防止H2和Cl2混合而引起爆炸;
b.避免Cl2和NaOH反应影响NaOH的产量。
一、电解饱和食盐水(氯碱工业)
-
+
Cl2
Cl2
Cl—
H2
Na+
H+
OH—
淡盐水
NaOH溶液
精制饱和NaCl溶液
H2O(含少量NaOH)
离子交换膜
阳极室
阴极室
a、防止氢气和氯气混合而引起爆炸;
b、避免氯气和氢氧化钠反应生成 ,而影响氢氧化钠的产量
一、电解饱和食盐水(氯碱工业)
粗盐的成分:
这些杂质会与碱性物质反应生成沉淀,损坏离子交换膜。
4.精制食盐水
除杂过程
一、电解饱和食盐水(氯碱工业)
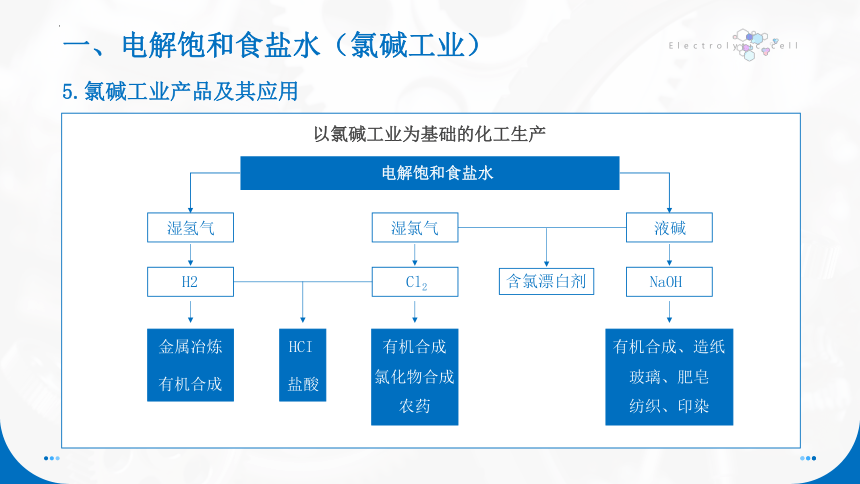
5.氯碱工业产品及其应用
以氯碱工业为基础的化工生产
电解饱和食盐水
湿氢气
湿氯气
液碱
H2
Cl2
含氯漂白剂
NaOH
金属冶炼
有机合成
HCI
盐酸
有机合成
氯化物合成
农药
有机合成、造纸
玻璃、肥皂
纺织、印染
一、电解饱和食盐水(氯碱工业)
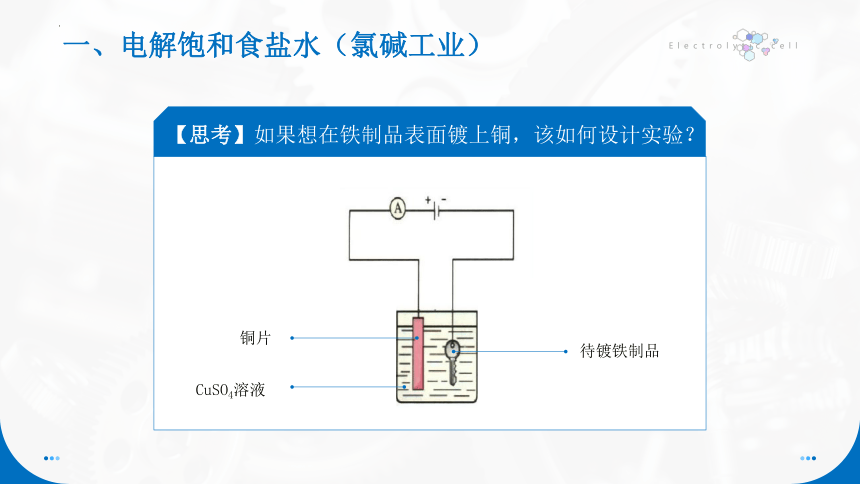
【思考】如果想在铁制品表面镀上铜,该如何设计实验?
铜片
CuSO4溶液
待镀铁制品
二、电镀
使金属增强抗腐蚀能力,增加美观和表面硬度。
+
镀件
镀层金属
-
含镀层金属离子的盐溶液
镀层金属通常是一些在空气中或溶液里不易起变化的金属和合金
3.电镀的特点
阳极本身参加电极反应;电解质溶液的浓度保持不变。
阳极:镀层金属
阴极:待镀金属制品(即镀件)
1.概念
应用电解原理在某些金属表面镀上一层其它金属或合金的过程。
2.主要目的
二、电镀
电镀摆件及电镀金杯
电镀车间
三、电解精炼
黄铜矿
粗铜(含有锌、铁、镍、银、金、铂等微量杂质)
如果用粗铜制电线会大大降低其导电能力
三、电解精炼
镍铁精炼炉
铜精炼阳极炉车间
三、电解精炼
精铜精炼:
CuSO4溶液
①电极式:
阳极:Cu - 2e- = Cu2+
阴极:Cu2+ + 2e- = Cu
②电镀液:
含Cu2+离子的电解质溶液
Fe - 2e- = Fe2+
Zn - 2e- = Zn2+
Ni - 2e- = Ni2+
三、电解精炼
1.粗铜作阳极,纯铜作阴极。
2.阳极放电的金属有锌、铁、镍和铜,而银、金、铂等金属
不放电形成阳极泥,同时阴极只有Cu2+放电,所以能够将杂质除去
3.Cu2+的浓度有所下降。
精铜精炼
四、电冶金
1.金属冶炼:
由于电解是最强有力的氧化还原手段,所以电解法是冶炼金属的一种重要方法。对于冶炼Na、Ca、Mg、Al这样的活泼金属,电解法几乎是唯一可行的工业方法。
2.原理
使矿石中的金属离子获得电子变成金属单质的过程。
Mn+ + ne- = M
四、电冶金
3.冶炼金属的方法
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
电解法
热还原法
加热法
物理提取法
四、电冶金
熔融NaCl
阴极
阳极
e-
e-
Na+
Cl-
总反应:2NaCl(熔融) === 2Na+Cl2↑
电解
4.电解熔融NaCl制金属钠
阳极:
2 Cl-- 2e- = Cl2↑
阴极:
2 Na++2e- = 2Na
四、电冶金
阴极:
阳极:
总反应:
4Al3+ + 12e- = 4Al
6O2- - 12e- = 3O2↑
2Al2O3(熔融) === 4Al + 3O2↑
电解
助熔剂:冰晶石(Na3AlF6 六氟合铝酸钠)
冰晶石
5.电解熔融Al2O3制金属铝
石墨
石墨
阴极
四、电冶金
电有机合成
四、电冶金
1.关于电解NaCl水溶液,下列叙述正确的是( )
A.电解时在阳极得到氯气,在阴极得到金属钠
B.若在阳极附近的溶液中滴入KI试液,溶液呈棕色
C.若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
B
课堂练习
四、电冶金
2.以硫酸铜溶液做电解液,对含有杂质Fe、Zn、Ag的粗铜进行电解精炼,下列叙述正确的是( )
①粗铜与直流电源负极相连
②阴极发生的反应为Cu2+ +2e-=Cu
④杂质Ag以Ag2SO4的形式沉入电解槽形成阳极泥
③电路中毎通过0.5mol电子,得到精铜质量为16g
A、 ① ③
D、 ② ③
C、 ③ ④
B、 ② ④
D
课堂练习
3.电解装置如图,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。已知:3I2+6OH-=IO3-+5I-+3H2O,下列说法正确的是( )
A.右侧发生的电极方程式:O2+4e-+2H2O=4OH-
B.电解槽内发生反应的总化学方程式是:
KI+3H2O=KIO3+3H2↑
C.电解结束后,右侧溶液中不可能含有IO3-
D.如果用阳离子交换膜代替阴离子交换膜,电解槽内反应的总化学方程式不变
四、电冶金
B
课堂练习
第四章
化学反应与电能
Electrolytic cell
感谢您的观看
THANK
第四章
第2课时
电解原理的应用
第二节 电解池
化学反应与电能
APPLICATION OF ELECTROLYSIS PRINCIPLES
Electrolytic cell
Cl-、OH-
一、电解饱和食盐水(氯碱工业)
食盐水中的离子:
湿润的淀粉
KI试纸变蓝
离子移动方向:
移向阳极,
移向阴极。
现象:
阴极有无色气体产生,阴极端溶液变红,阳极产生的黄绿色气体能使淀粉—KI溶液变蓝。
H+、Na+
H+、Na+、Cl-、OH-
一、电解饱和食盐水(氯碱工业)
1.电解饱和食盐水
湿润的淀粉
KI试纸变蓝
阳极反应:
2Cl--2e-===Cl2↑
Cl->OH-
阳极离子放电顺序:
阴极反应:
2H2O+2e-===H2↑+2OH-
H+>Na+
阴极离子放电顺序:
总反应化学方程式:
2NaCl+2H2O 2NaOH+Cl2↑+H2↑
电解
2Cl-+2H2O H2↑+Cl2↑+2OH-
电解
一、电解饱和食盐水(氯碱工业)
思考:上述装置的缺点
(1)H2和Cl2 混合不安全。
(2)Cl2会和NaOH反应,会使得到的NaOH不纯。
一、电解饱和食盐水(氯碱工业)
(1)生产设备名称:离子交换膜电解槽
阴极:碳钢
阳极:钛
阳离子交换膜:只允许阳离子通过
(Cl-、OH-离子和气体不能通过),把电解槽隔成阴极室和阳极室。
3.离子交换膜法制烧碱
Cl2+2NaOH =NaCl+NaClO+H2O
遇火或强光会爆炸
(2)离子交换膜的作用:
a.防止H2和Cl2混合而引起爆炸;
b.避免Cl2和NaOH反应影响NaOH的产量。
一、电解饱和食盐水(氯碱工业)
-
+
Cl2
Cl2
Cl—
H2
Na+
H+
OH—
淡盐水
NaOH溶液
精制饱和NaCl溶液
H2O(含少量NaOH)
离子交换膜
阳极室
阴极室
a、防止氢气和氯气混合而引起爆炸;
b、避免氯气和氢氧化钠反应生成 ,而影响氢氧化钠的产量
一、电解饱和食盐水(氯碱工业)
粗盐的成分:
这些杂质会与碱性物质反应生成沉淀,损坏离子交换膜。
4.精制食盐水
除杂过程
一、电解饱和食盐水(氯碱工业)
5.氯碱工业产品及其应用
以氯碱工业为基础的化工生产
电解饱和食盐水
湿氢气
湿氯气
液碱
H2
Cl2
含氯漂白剂
NaOH
金属冶炼
有机合成
HCI
盐酸
有机合成
氯化物合成
农药
有机合成、造纸
玻璃、肥皂
纺织、印染
一、电解饱和食盐水(氯碱工业)
【思考】如果想在铁制品表面镀上铜,该如何设计实验?
铜片
CuSO4溶液
待镀铁制品
二、电镀
使金属增强抗腐蚀能力,增加美观和表面硬度。
+
镀件
镀层金属
-
含镀层金属离子的盐溶液
镀层金属通常是一些在空气中或溶液里不易起变化的金属和合金
3.电镀的特点
阳极本身参加电极反应;电解质溶液的浓度保持不变。
阳极:镀层金属
阴极:待镀金属制品(即镀件)
1.概念
应用电解原理在某些金属表面镀上一层其它金属或合金的过程。
2.主要目的
二、电镀
电镀摆件及电镀金杯
电镀车间
三、电解精炼
黄铜矿
粗铜(含有锌、铁、镍、银、金、铂等微量杂质)
如果用粗铜制电线会大大降低其导电能力
三、电解精炼
镍铁精炼炉
铜精炼阳极炉车间
三、电解精炼
精铜精炼:
CuSO4溶液
①电极式:
阳极:Cu - 2e- = Cu2+
阴极:Cu2+ + 2e- = Cu
②电镀液:
含Cu2+离子的电解质溶液
Fe - 2e- = Fe2+
Zn - 2e- = Zn2+
Ni - 2e- = Ni2+
三、电解精炼
1.粗铜作阳极,纯铜作阴极。
2.阳极放电的金属有锌、铁、镍和铜,而银、金、铂等金属
不放电形成阳极泥,同时阴极只有Cu2+放电,所以能够将杂质除去
3.Cu2+的浓度有所下降。
精铜精炼
四、电冶金
1.金属冶炼:
由于电解是最强有力的氧化还原手段,所以电解法是冶炼金属的一种重要方法。对于冶炼Na、Ca、Mg、Al这样的活泼金属,电解法几乎是唯一可行的工业方法。
2.原理
使矿石中的金属离子获得电子变成金属单质的过程。
Mn+ + ne- = M
四、电冶金
3.冶炼金属的方法
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
电解法
热还原法
加热法
物理提取法
四、电冶金
熔融NaCl
阴极
阳极
e-
e-
Na+
Cl-
总反应:2NaCl(熔融) === 2Na+Cl2↑
电解
4.电解熔融NaCl制金属钠
阳极:
2 Cl-- 2e- = Cl2↑
阴极:
2 Na++2e- = 2Na
四、电冶金
阴极:
阳极:
总反应:
4Al3+ + 12e- = 4Al
6O2- - 12e- = 3O2↑
2Al2O3(熔融) === 4Al + 3O2↑
电解
助熔剂:冰晶石(Na3AlF6 六氟合铝酸钠)
冰晶石
5.电解熔融Al2O3制金属铝
石墨
石墨
阴极
四、电冶金
电有机合成
四、电冶金
1.关于电解NaCl水溶液,下列叙述正确的是( )
A.电解时在阳极得到氯气,在阴极得到金属钠
B.若在阳极附近的溶液中滴入KI试液,溶液呈棕色
C.若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
B
课堂练习
四、电冶金
2.以硫酸铜溶液做电解液,对含有杂质Fe、Zn、Ag的粗铜进行电解精炼,下列叙述正确的是( )
①粗铜与直流电源负极相连
②阴极发生的反应为Cu2+ +2e-=Cu
④杂质Ag以Ag2SO4的形式沉入电解槽形成阳极泥
③电路中毎通过0.5mol电子,得到精铜质量为16g
A、 ① ③
D、 ② ③
C、 ③ ④
B、 ② ④
D
课堂练习
3.电解装置如图,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。已知:3I2+6OH-=IO3-+5I-+3H2O,下列说法正确的是( )
A.右侧发生的电极方程式:O2+4e-+2H2O=4OH-
B.电解槽内发生反应的总化学方程式是:
KI+3H2O=KIO3+3H2↑
C.电解结束后,右侧溶液中不可能含有IO3-
D.如果用阳离子交换膜代替阴离子交换膜,电解槽内反应的总化学方程式不变
四、电冶金
B
课堂练习
第四章
化学反应与电能
Electrolytic cell
感谢您的观看
THANK
