高二化学人教版(2019)选择性必修一 4.3.1 金属的腐蚀(29张ppt)
文档属性
| 名称 | 高二化学人教版(2019)选择性必修一 4.3.1 金属的腐蚀(29张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 17.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-14 13:04:45 | ||
图片预览







文档简介
(共29张PPT)
第四章
第1课时 金属的腐蚀
第三节
金属的腐蚀与防护
LESSON1
化学反应与电能
CORROSION OF METAL
化学平衡状态 化学平衡常数
核心素养
科学探究与创新意识:通过实验科学探究金属腐蚀的本质及其原因, 认识金属腐蚀的主要类型,能正确书写析氢腐蚀和吸氧腐蚀的电极反应式。
科学态度与社会责任:认识金属腐蚀产生的危害和影响。
——《青花瓷》方文山
【导入】
尽管铁链曾经承载着巨大的力量,但是经不住时间的考验和风雨的洗礼,如今面目全非不堪重负。今天我们从化学角度认识它腐蚀的原因。
【情景思考】
铜绿主要成分
Cu2(OH)2 CO3
铁锈主要成分
Fe2O3 xH2O
【思考】
1
什么是金属腐蚀?
2
金属腐蚀的实质是什么?
3
金属腐蚀的种类有哪些?
4
金属腐蚀有哪些危害?
【思考】
(1)概念:金属或合金与周围的气体或液体发生氧化还原反应而引起损耗的现象
(2)金属腐蚀的本质:金属原子失去电子,被氧化。
M - ne- = Mn+
(3)特征:金属腐蚀后,在外形,色泽及机械性能方面会发生变化。
1
金属腐蚀
由于与金属接触的气体或液体物质不同,发生腐蚀的情况也不同,一般金属腐蚀可分为化学腐蚀和电化学腐蚀。
(4)金属腐蚀的类型
金属腐蚀
化学腐蚀:
电化学腐蚀:
金属与其表面接触的一些物质(如O2、Cl2、SO2)直接反应而引起的腐蚀。
如:Fe与Cl2直接反应
特点:无电流产生,受温度影响大,温度升高而腐蚀速率加快。例如:钢材在高温下容易被氧化,表面生成由FeO、Fe2O3、Fe3O4组成的一层氧化物。
例如:钢铁制品在潮湿空气中的锈蚀就是电化学腐蚀。
特点:有微弱的电流产生,最为普遍,危害大,腐蚀速率快。
说明:金属腐蚀过程中,化学腐蚀和电化学腐蚀同时发生,只是电化学腐蚀比化学腐蚀更普遍,速率更大,危害更大。
当不纯的金属与电解质溶液接触时会发生原电池反应,比较活泼的金属发生氧化反应而被腐蚀。
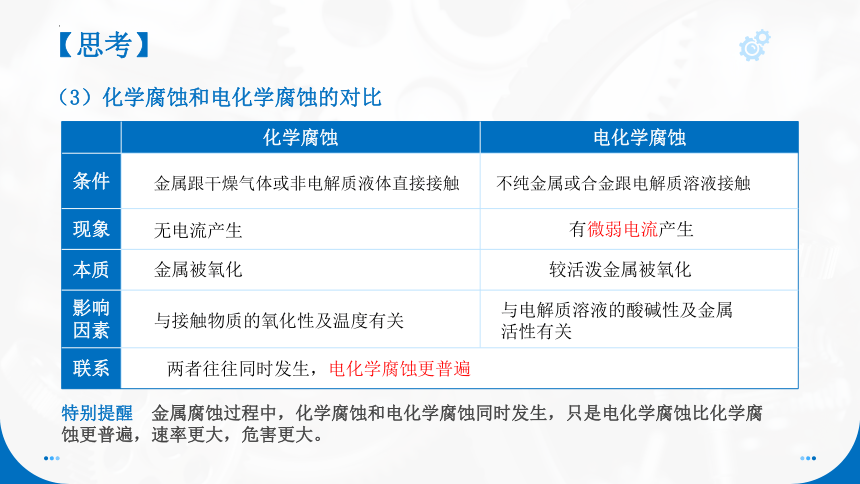
(3)化学腐蚀和电化学腐蚀的对比
化学腐蚀 电化学腐蚀
条件
现象
本质
影响 因素
联系 金属跟干燥气体或非电解质液体直接接触
不纯金属或合金跟电解质溶液接触
无电流产生
有微弱电流产生
金属被氧化
较活泼金属被氧化
与接触物质的氧化性及温度有关
与电解质溶液的酸碱性及金属活性有关
两者往往同时发生,电化学腐蚀更普遍
特别提醒 金属腐蚀过程中,化学腐蚀和电化学腐蚀同时发生,只是电化学腐蚀比化学腐蚀更普遍,速率更大,危害更大。
【思考】
【化学腐蚀】
家用燃气灶的中心部位很容易生锈
食品罐头放在南极80多年却很少生锈
温度升高会加快化学反应速率,温度对化学腐蚀的影响较为明显
【比较下列现象的差异】
铁与酸反应,铁被腐蚀腐蚀速率较慢
铁作负极,铁被腐蚀腐蚀速率较快
【思考】
1.在新疆吐鲁番和海南省两地,哪个地区铁生锈相对较慢?
新疆吐鲁番,因为该地区相对干燥,水分少,而海南地区潮湿多雨,温度高,易发生电化学腐蚀。
【思考】
2.钢铁在潮湿的空气里很快被腐蚀,这是为什么?
在潮湿的空气中,钢铁表面吸附了一薄层水膜。水膜中溶有O2、CO2、SO2等气体,这样在钢铁表面形成了一层电解质溶液的薄膜,它跟钢铁中的铁和少量的单质碳构成无数微小的原电池。
【思考】
3.生活中的钢铁发生的是化学腐蚀还是电化学腐蚀?如何证明?
食盐水浸泡过的纯铁
实验1
实验2
现象
导管中水柱液面上升
铁钉表面有铁锈生成
装置中Fe、C以及饱和食盐水构成了Fe—C —饱和食盐水原电池Fe作负极, C作正极,饱和食盐水作电解质溶液,由于NaCl溶液呈中性发生吸氧腐蚀
钢铁的电化学腐蚀
⑴类型:根据钢铁表面水膜的酸性强弱
钢铁腐蚀可分为析氢腐蚀和吸氧腐蚀两种类型
析氢腐蚀
吸氧腐蚀
钢铁腐蚀
类别 项目 析氢腐蚀 吸氧腐蚀
图形描述
条件 水膜酸性较强 水膜酸性很弱或呈中性
负极 _______________ Fe-2e-===Fe2+
钢铁的电化学腐蚀
正极
总反应
后续反应 最终生成铁锈(主要成分为Fe2O3·xH2O),反应如下: 2Fe(OH)3===Fe2O3·xH2O+(3-x)H2O 联系 通常两种腐蚀同时存在,但后者更普遍 2H++2e-===H2↑
O2+4e-+2H2O===4OH-
Fe+2H+===Fe2++H2↑
2Fe+O2+2H2O===2Fe(OH)2
4Fe(OH)2+O2+2H2O=4Fe(OH)3
实验操作 实验现象 实验解释
导管中________ 装置中铁、碳和饱和食盐水构成原电池,铁钉发生 腐蚀
(1)
液面上升
吸氧
3.实验探究:电化学腐蚀
实验操作 实验现象 实验解释
①试管中产生气泡的速率___ Zn与CuSO4反应生成Cu,Zn、Cu和稀盐酸构成_______,
形成 腐蚀,速率更___
(2)
快
原电池
电化学
快
取铁电极周围的溶液于试管中,加入K3[Fe(CN)6]
溶液,发现产生特征蓝色沉淀,证明负极有Fe2+生成。
金属表面的电解质溶液酸性较强
腐蚀过程中有H2放出,如右图所示。
钢铁的电化学腐蚀
⑵ 钢铁的析氢腐蚀(水膜酸性较强)
写出正、负极反应:
负极产物该如何检验?
钢铁的电化学腐蚀
钢铁表面吸附的水膜酸性很弱或呈中性时,溶解的氧气参加电极反应,发生吸氧腐蚀。如右图所示。
⑶ 钢铁的吸氧腐蚀(水膜酸性很弱或中性)
写出正、负极反应、总反应:
Fe(OH)2进一步被氧化:
Fe(OH)3失去部分水生成Fe2O3·xH2O:
电池工作一段时间后,取正极周围的溶液于试管中,加入酚酞溶液变红。
正极产物该如何检验?
析氢腐蚀和吸氧腐蚀都属于电化学腐蚀
说明
化学腐蚀和电化学腐蚀往往同时发生,只是电化学腐蚀比化学腐蚀更普遍速率更大,危害更大。
1
析氢腐蚀和吸氧腐蚀取决于金属表面电解质溶液的酸碱性
实际情况中以吸氧腐蚀为主。
2
钢铁发生析氢腐蚀或吸氧腐蚀时,负极都是铁,失电子生成Fe2+,而非Fe3+。
3
我国作为世界上钢铁产量最多的国家,每年被腐蚀的铁占到我国钢铁年产量的十分之一,因金属腐蚀而造成的损失占到国内生产总值的2%~4%;另据国外统计,金属腐蚀的年损失远远超过水灾、火灾、风灾和地震(平均值)损失的总和,在这里还不包括由于腐蚀导致的停工、减产和爆炸等造成的间接损失。
金属腐蚀的危害
金属腐蚀的主要害处,不仅在于金属本身的损失,更严重的是金属制品结构损坏所造成的损失比金属本身要大到无法估量。
腐蚀不仅造成经济损失,也经常对安全构成威胁。
国内外都曾发生过许多灾难性腐蚀事故,如飞机因某一零部件破裂而坠毁;桥梁因钢梁产生裂缝而塌陷;
油管因穿孔或裂缝而漏油,引起着火爆炸;
化工厂中储酸槽穿孔泄漏,造成重大环境污染;
管道和设备跑、冒、滴、漏,破坏生产环境,有毒气体如Cl2、H2S、HCN等的泄漏,更会危及工作人员和附近居民的生命安全。
金属腐蚀的危害
思考:连接铜板的铁制品更容易生锈?
铜板上的铁铆钉生锈
+
+
-
铁与铜及潮湿的空气构成了原电池,铁作负极,因此更容易被腐蚀而生锈。
1.如图装置中,小试管内为红墨水,具支试管内盛有pH=4的雨水和生铁片。观察到:开始导管内液面下降,一段时间后导管内液面回升,略高于小试管液面。以下有关解释合理的是( )
A.生铁片中的碳是原电池的负极,发生还原反应
B.雨水酸性较强,生铁片仅发生析氢腐蚀
C.墨水回升时,碳极反应式为O2+2H2O+4e-= 4OH-
D.具支试管中溶液pH逐渐减小
C
课堂练习
如图所示水槽中试管内有一枚铁钉放置数天观察:
(1)铁钉在逐渐生锈,则铁钉的腐蚀属于________腐蚀。
(2)若液面上升,溶液呈 性,发生_____腐蚀,电极反应式:负极: _____________________________,
正极:________________________________________。
(3)若试管内液面下降,则原溶液呈 性,发生 腐蚀。电极反应式:负极_______________________,
正极:_______________________。
电化学
弱酸或中或碱
吸氧
2Fe-4e-===2Fe2+
O2+2H2O+4e-===4OH-
较强的酸
析氢
Fe-2e-===Fe2+
2H++2e-===H2↑
练习
总结
感谢您的观看
THANK
第四章
第1课时 金属的腐蚀
第三节
金属的腐蚀与防护
LESSON1
化学反应与电能
CORROSION OF METAL
化学平衡状态 化学平衡常数
核心素养
科学探究与创新意识:通过实验科学探究金属腐蚀的本质及其原因, 认识金属腐蚀的主要类型,能正确书写析氢腐蚀和吸氧腐蚀的电极反应式。
科学态度与社会责任:认识金属腐蚀产生的危害和影响。
——《青花瓷》方文山
【导入】
尽管铁链曾经承载着巨大的力量,但是经不住时间的考验和风雨的洗礼,如今面目全非不堪重负。今天我们从化学角度认识它腐蚀的原因。
【情景思考】
铜绿主要成分
Cu2(OH)2 CO3
铁锈主要成分
Fe2O3 xH2O
【思考】
1
什么是金属腐蚀?
2
金属腐蚀的实质是什么?
3
金属腐蚀的种类有哪些?
4
金属腐蚀有哪些危害?
【思考】
(1)概念:金属或合金与周围的气体或液体发生氧化还原反应而引起损耗的现象
(2)金属腐蚀的本质:金属原子失去电子,被氧化。
M - ne- = Mn+
(3)特征:金属腐蚀后,在外形,色泽及机械性能方面会发生变化。
1
金属腐蚀
由于与金属接触的气体或液体物质不同,发生腐蚀的情况也不同,一般金属腐蚀可分为化学腐蚀和电化学腐蚀。
(4)金属腐蚀的类型
金属腐蚀
化学腐蚀:
电化学腐蚀:
金属与其表面接触的一些物质(如O2、Cl2、SO2)直接反应而引起的腐蚀。
如:Fe与Cl2直接反应
特点:无电流产生,受温度影响大,温度升高而腐蚀速率加快。例如:钢材在高温下容易被氧化,表面生成由FeO、Fe2O3、Fe3O4组成的一层氧化物。
例如:钢铁制品在潮湿空气中的锈蚀就是电化学腐蚀。
特点:有微弱的电流产生,最为普遍,危害大,腐蚀速率快。
说明:金属腐蚀过程中,化学腐蚀和电化学腐蚀同时发生,只是电化学腐蚀比化学腐蚀更普遍,速率更大,危害更大。
当不纯的金属与电解质溶液接触时会发生原电池反应,比较活泼的金属发生氧化反应而被腐蚀。
(3)化学腐蚀和电化学腐蚀的对比
化学腐蚀 电化学腐蚀
条件
现象
本质
影响 因素
联系 金属跟干燥气体或非电解质液体直接接触
不纯金属或合金跟电解质溶液接触
无电流产生
有微弱电流产生
金属被氧化
较活泼金属被氧化
与接触物质的氧化性及温度有关
与电解质溶液的酸碱性及金属活性有关
两者往往同时发生,电化学腐蚀更普遍
特别提醒 金属腐蚀过程中,化学腐蚀和电化学腐蚀同时发生,只是电化学腐蚀比化学腐蚀更普遍,速率更大,危害更大。
【思考】
【化学腐蚀】
家用燃气灶的中心部位很容易生锈
食品罐头放在南极80多年却很少生锈
温度升高会加快化学反应速率,温度对化学腐蚀的影响较为明显
【比较下列现象的差异】
铁与酸反应,铁被腐蚀腐蚀速率较慢
铁作负极,铁被腐蚀腐蚀速率较快
【思考】
1.在新疆吐鲁番和海南省两地,哪个地区铁生锈相对较慢?
新疆吐鲁番,因为该地区相对干燥,水分少,而海南地区潮湿多雨,温度高,易发生电化学腐蚀。
【思考】
2.钢铁在潮湿的空气里很快被腐蚀,这是为什么?
在潮湿的空气中,钢铁表面吸附了一薄层水膜。水膜中溶有O2、CO2、SO2等气体,这样在钢铁表面形成了一层电解质溶液的薄膜,它跟钢铁中的铁和少量的单质碳构成无数微小的原电池。
【思考】
3.生活中的钢铁发生的是化学腐蚀还是电化学腐蚀?如何证明?
食盐水浸泡过的纯铁
实验1
实验2
现象
导管中水柱液面上升
铁钉表面有铁锈生成
装置中Fe、C以及饱和食盐水构成了Fe—C —饱和食盐水原电池Fe作负极, C作正极,饱和食盐水作电解质溶液,由于NaCl溶液呈中性发生吸氧腐蚀
钢铁的电化学腐蚀
⑴类型:根据钢铁表面水膜的酸性强弱
钢铁腐蚀可分为析氢腐蚀和吸氧腐蚀两种类型
析氢腐蚀
吸氧腐蚀
钢铁腐蚀
类别 项目 析氢腐蚀 吸氧腐蚀
图形描述
条件 水膜酸性较强 水膜酸性很弱或呈中性
负极 _______________ Fe-2e-===Fe2+
钢铁的电化学腐蚀
正极
总反应
后续反应 最终生成铁锈(主要成分为Fe2O3·xH2O),反应如下: 2Fe(OH)3===Fe2O3·xH2O+(3-x)H2O 联系 通常两种腐蚀同时存在,但后者更普遍 2H++2e-===H2↑
O2+4e-+2H2O===4OH-
Fe+2H+===Fe2++H2↑
2Fe+O2+2H2O===2Fe(OH)2
4Fe(OH)2+O2+2H2O=4Fe(OH)3
实验操作 实验现象 实验解释
导管中________ 装置中铁、碳和饱和食盐水构成原电池,铁钉发生 腐蚀
(1)
液面上升
吸氧
3.实验探究:电化学腐蚀
实验操作 实验现象 实验解释
①试管中产生气泡的速率___ Zn与CuSO4反应生成Cu,Zn、Cu和稀盐酸构成_______,
形成 腐蚀,速率更___
(2)
快
原电池
电化学
快
取铁电极周围的溶液于试管中,加入K3[Fe(CN)6]
溶液,发现产生特征蓝色沉淀,证明负极有Fe2+生成。
金属表面的电解质溶液酸性较强
腐蚀过程中有H2放出,如右图所示。
钢铁的电化学腐蚀
⑵ 钢铁的析氢腐蚀(水膜酸性较强)
写出正、负极反应:
负极产物该如何检验?
钢铁的电化学腐蚀
钢铁表面吸附的水膜酸性很弱或呈中性时,溶解的氧气参加电极反应,发生吸氧腐蚀。如右图所示。
⑶ 钢铁的吸氧腐蚀(水膜酸性很弱或中性)
写出正、负极反应、总反应:
Fe(OH)2进一步被氧化:
Fe(OH)3失去部分水生成Fe2O3·xH2O:
电池工作一段时间后,取正极周围的溶液于试管中,加入酚酞溶液变红。
正极产物该如何检验?
析氢腐蚀和吸氧腐蚀都属于电化学腐蚀
说明
化学腐蚀和电化学腐蚀往往同时发生,只是电化学腐蚀比化学腐蚀更普遍速率更大,危害更大。
1
析氢腐蚀和吸氧腐蚀取决于金属表面电解质溶液的酸碱性
实际情况中以吸氧腐蚀为主。
2
钢铁发生析氢腐蚀或吸氧腐蚀时,负极都是铁,失电子生成Fe2+,而非Fe3+。
3
我国作为世界上钢铁产量最多的国家,每年被腐蚀的铁占到我国钢铁年产量的十分之一,因金属腐蚀而造成的损失占到国内生产总值的2%~4%;另据国外统计,金属腐蚀的年损失远远超过水灾、火灾、风灾和地震(平均值)损失的总和,在这里还不包括由于腐蚀导致的停工、减产和爆炸等造成的间接损失。
金属腐蚀的危害
金属腐蚀的主要害处,不仅在于金属本身的损失,更严重的是金属制品结构损坏所造成的损失比金属本身要大到无法估量。
腐蚀不仅造成经济损失,也经常对安全构成威胁。
国内外都曾发生过许多灾难性腐蚀事故,如飞机因某一零部件破裂而坠毁;桥梁因钢梁产生裂缝而塌陷;
油管因穿孔或裂缝而漏油,引起着火爆炸;
化工厂中储酸槽穿孔泄漏,造成重大环境污染;
管道和设备跑、冒、滴、漏,破坏生产环境,有毒气体如Cl2、H2S、HCN等的泄漏,更会危及工作人员和附近居民的生命安全。
金属腐蚀的危害
思考:连接铜板的铁制品更容易生锈?
铜板上的铁铆钉生锈
+
+
-
铁与铜及潮湿的空气构成了原电池,铁作负极,因此更容易被腐蚀而生锈。
1.如图装置中,小试管内为红墨水,具支试管内盛有pH=4的雨水和生铁片。观察到:开始导管内液面下降,一段时间后导管内液面回升,略高于小试管液面。以下有关解释合理的是( )
A.生铁片中的碳是原电池的负极,发生还原反应
B.雨水酸性较强,生铁片仅发生析氢腐蚀
C.墨水回升时,碳极反应式为O2+2H2O+4e-= 4OH-
D.具支试管中溶液pH逐渐减小
C
课堂练习
如图所示水槽中试管内有一枚铁钉放置数天观察:
(1)铁钉在逐渐生锈,则铁钉的腐蚀属于________腐蚀。
(2)若液面上升,溶液呈 性,发生_____腐蚀,电极反应式:负极: _____________________________,
正极:________________________________________。
(3)若试管内液面下降,则原溶液呈 性,发生 腐蚀。电极反应式:负极_______________________,
正极:_______________________。
电化学
弱酸或中或碱
吸氧
2Fe-4e-===2Fe2+
O2+2H2O+4e-===4OH-
较强的酸
析氢
Fe-2e-===Fe2+
2H++2e-===H2↑
练习
总结
感谢您的观看
THANK
