高二化学人教版(2019)选择性必修一 2.2.1化学平衡状态 化学平衡常数(38张)
文档属性
| 名称 | 高二化学人教版(2019)选择性必修一 2.2.1化学平衡状态 化学平衡常数(38张) |  | |
| 格式 | pptx | ||
| 文件大小 | 9.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-14 14:33:21 | ||
图片预览










文档简介
(共38张PPT)
化学平衡状态 化学平衡常数
第二章
化学反应速率与化学平衡
第二节 化学平衡
第2课时
第1课时
CHEMICAL EQUILIBRIUM STATE CHEMICAL EQUILIBRIUM CONSTANT
化学平衡状态 化学平衡常数
学习目标
1. 通过化学平衡状态的建立过程,知道化学平衡是一种动态平衡,理解并会判
断化学平衡状态的标志。
2. 认识化学平衡常数是表征反应限度的物理量,知道化学平衡常数的含义。
3. 了解浓度商和化学平衡常数的相对大小与反应方向间的联系。
一、化学平衡状态
一定条件下,可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
1. 化学平衡状态概念
适用对象:可逆反应;
内在本质:v(正)=v(逆)≠0
外在标志:反应混合物中各组分的浓度保持不变。
适用条件:一定条件;
一、化学平衡状态
2.化学平衡状态特征
逆:可逆反应(或可逆过程);
等: v正 = v逆 (不等于零);
动:正逆反应均未停止,只是速率相等,是动态平衡;
定:平衡时,各组分的浓度或含量保持不变;
变:条件改变,原平衡被破坏,在新的条件下建立新的平衡,平衡
移动。
一、化学平衡状态
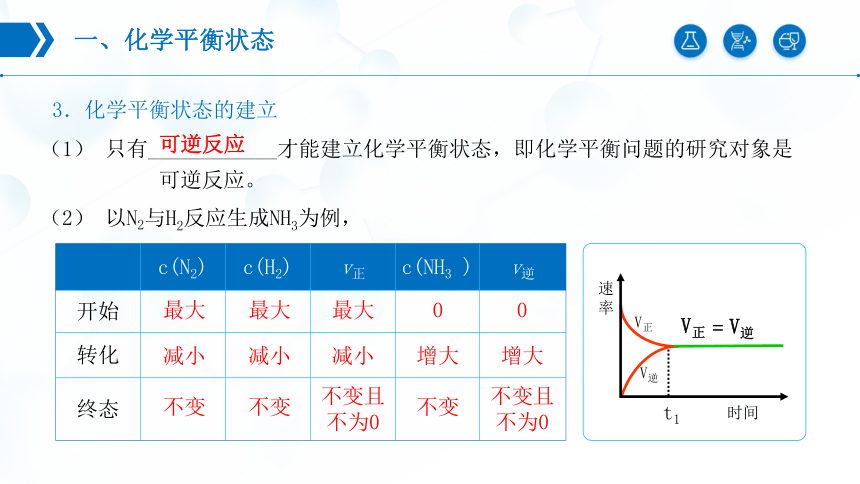
3.化学平衡状态的建立
(1) 只有____________才能建立化学平衡状态,即化学平衡问题的研究对象是
可逆反应。
可逆反应
(2) 以N2与H2反应生成NH3为例,
c(N2) c(H2) v正 c(NH3 ) v逆
开始
转化
终态
最大
0
0
减小
减小
减小
增大
增大
不变
不变
不变且不为0
不变
不变且不为0
最大
最大
t1
V逆
V正
=
V正
V逆
时间
速率
一、化学平衡状态
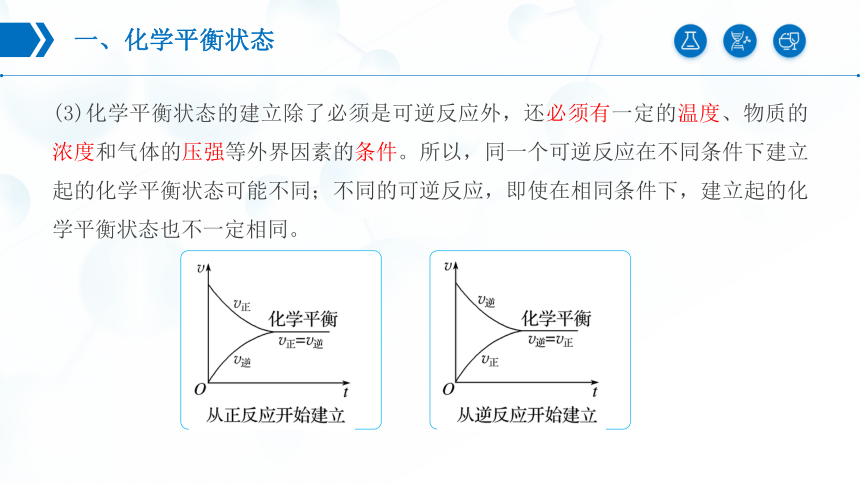
(3)化学平衡状态的建立除了必须是可逆反应外,还必须有一定的温度、物质的浓度和气体的压强等外界因素的条件。所以,同一个可逆反应在不同条件下建立起的化学平衡状态可能不同;不同的可逆反应,即使在相同条件下,建立起的化学平衡状态也不一定相同。
二、化学平衡状态的判断
v正=v逆≠0
(1)用同一种物质来表示反应速率时,该物质的生成速率与消耗速率相等。即单
位时间内生成与消耗某反应物(生成物)的量相等。
②速率之比化学方程式中相应的化学计量数之比。
①表示两个不同的方向。
(2)用不同种物质来表示反应速率时必须符合两方面
1. 等
直接判断法
二、化学平衡状态的判断
例如,一定条件下,可逆反应 N2+3H2 2NH3,对该
可逆反应,表示正、逆反应速率可以用N2或H2或NH3来表示:
(1)单位时间内,消耗1molN2,同时1molN2生成
(2)单位时间内,消耗3molH2,同时有2molNH3反应掉
(3)1个 N≡N 断裂的同时,有6个N—H 键断裂
二、化学平衡状态的判断
各组分的浓度保持不变
(注意不是相等,也不是成一定的比值)
2. 定
直接判断法
①各组分的物质的量或物质的量分数保持不变
②各气体的体积或体积分数保持不变
③各组分的质量或质量分数保持不变
④体系的颜色和温度不变
⑤转化率不变
二、化学平衡状态的判断
间接判断法
3. 气体的平均相对分子质量M
(1)若各物质均为气体
以mA(g) + nB(g) pC(g) + qD(g) 为例
若m+n≠p+q
若m+n=p+q
一 定
不一定
例如: 2SO2(g)+O2(g) 2SO3(g) ,
当平均相对分子质量不变时,一定是化学平衡状态;
H2(g)+I2(g) 2HI(g)
当平均相对分子质量不变时,不一定是化学平衡状态。
(变量不变即可判断平衡)
二、化学平衡状态的判断
间接判断法
(变量不变即可判断平衡)
(2)若有非气体参与,无论等计量数或非等计量数反应,M不变时一定是化学平衡状态。
例如: C(s)+O2(g) CO2(g)
当平均相对分子质量不变时,一定 是化学平衡状态
CO2(g)+C(s) 2CO(g)
当平均相对分子质量不变时,一定 是化学平衡状态
特例:单一气体的反应,气体平均相对分子质量一定时,不能作为判断平衡的标志
3. 气体的平均相对分子质量M
一 定
一定
二、化学平衡状态的判断
间接判断法
4. 气体密度
以mA(g) + nB(g) pC(g) + qD(g) 为例
若m+n≠p+q
若m+n=p+q
一 定
不一定
(1)若各物质均为气体
ρ
=
m总
V容器
恒压:
二、化学平衡状态的判断
间接判断法
4. 气体密度
ρ
=
m总
V容器
例如: 2SO2(g)+O2(g) 2SO3(g) ,
恒容条件下,当气体密度不变时, 是化学平衡状态
恒压条件下,当气体密度不变时, 是化学平衡状态
H2(g)+I2(g) 2HI(g)
恒容条件下,当气体密度不变时, 是化学平衡状态
恒压条件下,当气体密度不变时, 是化学平衡状态
一 定
不一定
不一定
不一定
二、化学平衡状态的判断
间接判断法
4. 气体密度
ρ
=
m总
V容器
(2)若有非气体参与,无论等计量数或非等计量数反应, 恒压或是恒容, ρ不变时一定
是化学平衡状态 。
例如: C(s) + O2(g) CO2(g)
恒容条件下,当气体密度不变时, 是化学平衡状态
恒压条件下,当气体密度不变时, 是化学平衡状态
CO2(g)+C(s) 2CO(g)
恒容条件下,当气体密度不变时, 是化学平衡状态
恒压条件下,当气体密度不变时, 是化学平衡状态
一 定
一 定
一 定
一 定
二、化学平衡状态的判断
间接判断法
5. 体系总压强
因为恒容、恒温条件下,n(g)越大则压强P就越大,则无论各成份是否均为气体,只需考虑Δn(g)。
当Δn(g)=0,则P为恒值,不一定是化学平衡状态。
当Δn(g)≠0,则P一定时,一定是化学平衡状态。
PV=nRT
二、化学平衡状态的判断
间接判断法
5. 体系总压强
PV=nRT
例如:恒容、恒温条件下 ,
C(s)+O2(g) CO2(g) 当体系总压强不变时, 是化学平衡状态
CO2(g)+C(s) 2CO(g) 当体系总压强不变时, 是化学平衡状态
2SO2(g)+O2(g) 2SO3(g) 当体系总压强不变时, 是化学平衡状态
H2(g)+I2(g) 2HI(g) 当体系总压强不变时, 是化学平衡状态
不一定
一定
一定
不一定
二、化学平衡状态的判断
间接判断法
5. 体系总压强
PV=nRT
例1.在一定温度下,将2 mol NO2气体通入恒容密闭容器中,发生如下反应:
2NO2(g)
N2O4(g)。下列不能说明反应达到平衡的是( )
A.N2O4浓度不再改变
B.NO2的消耗速率等于N2O4的生成速率
C.混合气体的颜色不变
D.混合气体中NO2百分含量不变
B
课堂练习
解析
N2O4浓度不再改变,反应达到平衡状态,A说法正确;NO2的消耗速率和N2O4的生成速率均为正反应速率,不能作为平衡标志,B说法错误;混合气体的颜色不变,NO2的浓度不再发生变化,反应达到平衡状态,C说法正确;混合气体中NO2百分含量不变,反应达到平衡状态,D说法正确。
答案:B
2SO2(g)+
O2(g),可用来确定该反应已达到平衡状态的是( )
A.容器内压强不随时间改变
B.SO3的消耗速率与SO2的生成速率相等
C.三种气体的分子数比为2∶2∶1
D.容器内混合气体的密度不随时间改变
二、化学平衡状态的判断
间接判断法
5. 体系总压强
PV=nRT
例2.在恒温下,固定容积的密闭容器中,有可逆反应2SO3(g)
A
课堂练习
解析
该反应为气体体积增大的反应,压强为变量,当容器内压强不随时间改变时,该反应达到平衡状态, A正确; SO3的消耗速率与SO2的生成速率相等,表示的都是正反应速率,无法判断平衡状态, B错误;三种气体的分子数比为2∶2∶1,无法判断各组分的浓度是否继续变化,则无法判断是否达到平衡状态, C错误;该反应中混合气体的密度为定值,无法根据容器内混合气体的密度判断平衡状态, D错误。
答案:A
根据下表数据计算平衡时 的值并分析其中规律:
【交流·研讨】
I2(g) + H2(g) 2HI(g)
起始时浓度mol/L 平衡时浓度mol/L 平衡时
c (H2) c(I2) c (HI) C(H2) C(I2) C(HI) 0.01197 0.006944 0 0.005617 0.0005936 0.01270 48.37
0.01228 0.009964 0 0.003841 0.001524 0.01687 48.62
0.01201 0.008403 0 0.004580 0.0009733 0.01486 49.54
0 0 0.01520 0.001696 0.001696 0.01181 48.49
0 0 0.01287 0.001433 0.001433 0.01000 48.70
0 0 0.03777 0.004213 0.0004213 0.02934 48.50
2
c (HI)
c(H2) · c(I2)
2
c (HI)
c(H2) · c(I2)
【交流·研讨】
在 457.6℃时反应体系H2(g)+I2(g) 2HI(g) 中各物质的浓度。 从中我们可以发现:
C2(HI)
C(H2).C(I2)
该反应在457.6℃达到平衡时,
是个常数。
三、化学平衡常数
对于一般的可逆反应:
mA(g) + nB(g) pC(g) + qD(g)
在任意时刻时,
称为浓度商
当该反应在一定温度下达到化学平衡时:
=K
K是常数,称为化学平衡常数,简称平衡常数。
三、化学平衡常数
1. 化学平衡常数的表达式
K=
mA(g) + nB(g) pC(g) + qD(g)
化学平衡常数:
浓度商:
c 为平衡浓度
c 为任一时刻浓度
三、化学平衡常数
2. 化学平衡常数的意义
化学平衡常数是表明化学反应限度的一个特征值,通常情况下,只受温度影响
当反应中有关物质的浓度商等于平衡常数时,表明反应达到限度,即达到化学平衡状态
三、化学平衡常数
2. 化学平衡常数的意义
K值越大,反应进行得越完全,反应物平衡转化率越高;
K值越小,反应进行越不完全,反应物平衡转化率越低。
一般来说,K>105时,反应就进行得基本完全
三、化学平衡常数
(1)平衡常数必须指明温度,反应必须达到平衡状态
(2)平衡常数表示反应进行的程度,不表示 反应的快慢,即速率大,K值不一
定大
(3)在进行K值的计算时,纯固体、纯液体不作考虑,表达式中不需表达
Fe3O4(s) + 4H2(g)
高温
3Fe(s) + 4H2O(g)
如:
一定温度下
易错提示
三、化学平衡常数
易错提示
(4)平衡常数的表达式与方程式的书写有关
N2+3H2 2NH3
2NH3 N2+3H2
某温度下
1/2N2+3/2H2 NH3
方程式的系数扩大n倍,K变为Kn;正反应与逆反应的K,互为倒数
三、化学平衡常数
Q<K ,反应向正方向进行
Q=K ,反应处于平衡状态
Q>K ,反应向逆方向进行
3. 化学平衡常数的应用
(1)判断平衡移动的方向
(2)判断反应的热效应
若升高温度,K值增大,则正反应为吸热反应
若升高温度,K值减小,则正反应为放热反应
三、化学平衡常数
H2(g) + I2(g) 2HI(g)
始始(mol/L) 0.010 0.010 0
变化(mol/L)
平衡(mol/L) 0.0080
0.0040
0.0020
0.0020
0.0040
0.0080
K=
C2(HI)
C(H2).C(I2)
=
(0.0040)2
(0.0080)2
=0.25
例3. 在某温度下,将H2和I2各0.01mol/L的气态混合物充入10L密闭容器中,充分反
应, 达到平衡后,测得c(H2)=0.008mol/L.
(1) 求反应的平衡常数.
(2) 在上述温度下,将H2和I2各0.20mol的气态混合物充入该密闭容器中, 试求达到
平衡时各物质的浓度.
三、化学平衡常数
(2) 根据题意:c(H2)=0.020mol/L, c(I2)=0.020mol/L
设H2的变化浓度为xmol L-1
H2 + I2 2HI
始 0.020 0.020 0
变
平
2x
x
x
2x
0.020-x
0.020-x
K只随温度发生变化,因此
K=
C2(HI)
C(H2).C(I2)
=
(2x)2
(0.020-x)2
=0.25
解得x=0.0040mol/L
C(H2)=C(I2)=0.016mol/L
C(HI)=0.0080mol/L
三、化学平衡常数
4. 平衡转化率
用平衡常数来表示反应的限度有时不够直观,常用平衡转化率α来表示反应限度。
对于可逆反应: mA(g)+nB (g) pC(g)+qD(g)
反应物A的平衡转化率(该条件最大转化率)可表示:
课堂练习
1. 一定条件下,在密闭容器中,能表示反应X(g)+2Y(g) 2Z(g)一定达到化学平
衡状态的是( )
①X、Y、Z的物质的量之比为1∶2∶2
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成 n mol Z,同时生成2n mol Y
A.①② B.①④
C.②③ D.③④
C
课堂练习
2.当把晶体N2O4放入密闭容器中汽化,并建立了N2O4(g)
2NO2(g)平衡后,保持温度不变,再通入若干N2O4气体,待反应达到新的平衡时,则新平衡与旧平衡相比,其 值( )
A.变大 B.不变
C.变小 D.无法确定
C
c2(NO2)
c2(N2O4)
课堂练习
3. 现有一定温度下的密闭容器中存在如下反应:
H2 (g) + I2 (g) 2HI (g)
已知c(H2)始=0.4mol/L,c(I2)始=1mol/L经测定该反应在该温度下的平衡常数K=64,试判断,达平衡状态时,H2的转化率应为多少?
课堂练习
解: 设氢气的转化浓度为xmol/L
H2 + I2 2HI
起始浓度/mol·L-1 0.4 1 0
转化浓度/mol·L-1 x x 2x
平衡浓度/mol·L-1 0.4-x 1-x 2x
解得 x=0.385 mol/L,则氢气的转化率为
课堂小结
CLASS SUMMARY
向奋斗在一线的老师致敬
感谢您的观看
第二章
化学反应速率与化学平衡
第一节 化学反应速率
THANKS FOR WATCHING
化学平衡状态 化学平衡常数
第二章
化学反应速率与化学平衡
第二节 化学平衡
第2课时
第1课时
CHEMICAL EQUILIBRIUM STATE CHEMICAL EQUILIBRIUM CONSTANT
化学平衡状态 化学平衡常数
学习目标
1. 通过化学平衡状态的建立过程,知道化学平衡是一种动态平衡,理解并会判
断化学平衡状态的标志。
2. 认识化学平衡常数是表征反应限度的物理量,知道化学平衡常数的含义。
3. 了解浓度商和化学平衡常数的相对大小与反应方向间的联系。
一、化学平衡状态
一定条件下,可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
1. 化学平衡状态概念
适用对象:可逆反应;
内在本质:v(正)=v(逆)≠0
外在标志:反应混合物中各组分的浓度保持不变。
适用条件:一定条件;
一、化学平衡状态
2.化学平衡状态特征
逆:可逆反应(或可逆过程);
等: v正 = v逆 (不等于零);
动:正逆反应均未停止,只是速率相等,是动态平衡;
定:平衡时,各组分的浓度或含量保持不变;
变:条件改变,原平衡被破坏,在新的条件下建立新的平衡,平衡
移动。
一、化学平衡状态
3.化学平衡状态的建立
(1) 只有____________才能建立化学平衡状态,即化学平衡问题的研究对象是
可逆反应。
可逆反应
(2) 以N2与H2反应生成NH3为例,
c(N2) c(H2) v正 c(NH3 ) v逆
开始
转化
终态
最大
0
0
减小
减小
减小
增大
增大
不变
不变
不变且不为0
不变
不变且不为0
最大
最大
t1
V逆
V正
=
V正
V逆
时间
速率
一、化学平衡状态
(3)化学平衡状态的建立除了必须是可逆反应外,还必须有一定的温度、物质的浓度和气体的压强等外界因素的条件。所以,同一个可逆反应在不同条件下建立起的化学平衡状态可能不同;不同的可逆反应,即使在相同条件下,建立起的化学平衡状态也不一定相同。
二、化学平衡状态的判断
v正=v逆≠0
(1)用同一种物质来表示反应速率时,该物质的生成速率与消耗速率相等。即单
位时间内生成与消耗某反应物(生成物)的量相等。
②速率之比化学方程式中相应的化学计量数之比。
①表示两个不同的方向。
(2)用不同种物质来表示反应速率时必须符合两方面
1. 等
直接判断法
二、化学平衡状态的判断
例如,一定条件下,可逆反应 N2+3H2 2NH3,对该
可逆反应,表示正、逆反应速率可以用N2或H2或NH3来表示:
(1)单位时间内,消耗1molN2,同时1molN2生成
(2)单位时间内,消耗3molH2,同时有2molNH3反应掉
(3)1个 N≡N 断裂的同时,有6个N—H 键断裂
二、化学平衡状态的判断
各组分的浓度保持不变
(注意不是相等,也不是成一定的比值)
2. 定
直接判断法
①各组分的物质的量或物质的量分数保持不变
②各气体的体积或体积分数保持不变
③各组分的质量或质量分数保持不变
④体系的颜色和温度不变
⑤转化率不变
二、化学平衡状态的判断
间接判断法
3. 气体的平均相对分子质量M
(1)若各物质均为气体
以mA(g) + nB(g) pC(g) + qD(g) 为例
若m+n≠p+q
若m+n=p+q
一 定
不一定
例如: 2SO2(g)+O2(g) 2SO3(g) ,
当平均相对分子质量不变时,一定是化学平衡状态;
H2(g)+I2(g) 2HI(g)
当平均相对分子质量不变时,不一定是化学平衡状态。
(变量不变即可判断平衡)
二、化学平衡状态的判断
间接判断法
(变量不变即可判断平衡)
(2)若有非气体参与,无论等计量数或非等计量数反应,M不变时一定是化学平衡状态。
例如: C(s)+O2(g) CO2(g)
当平均相对分子质量不变时,一定 是化学平衡状态
CO2(g)+C(s) 2CO(g)
当平均相对分子质量不变时,一定 是化学平衡状态
特例:单一气体的反应,气体平均相对分子质量一定时,不能作为判断平衡的标志
3. 气体的平均相对分子质量M
一 定
一定
二、化学平衡状态的判断
间接判断法
4. 气体密度
以mA(g) + nB(g) pC(g) + qD(g) 为例
若m+n≠p+q
若m+n=p+q
一 定
不一定
(1)若各物质均为气体
ρ
=
m总
V容器
恒压:
二、化学平衡状态的判断
间接判断法
4. 气体密度
ρ
=
m总
V容器
例如: 2SO2(g)+O2(g) 2SO3(g) ,
恒容条件下,当气体密度不变时, 是化学平衡状态
恒压条件下,当气体密度不变时, 是化学平衡状态
H2(g)+I2(g) 2HI(g)
恒容条件下,当气体密度不变时, 是化学平衡状态
恒压条件下,当气体密度不变时, 是化学平衡状态
一 定
不一定
不一定
不一定
二、化学平衡状态的判断
间接判断法
4. 气体密度
ρ
=
m总
V容器
(2)若有非气体参与,无论等计量数或非等计量数反应, 恒压或是恒容, ρ不变时一定
是化学平衡状态 。
例如: C(s) + O2(g) CO2(g)
恒容条件下,当气体密度不变时, 是化学平衡状态
恒压条件下,当气体密度不变时, 是化学平衡状态
CO2(g)+C(s) 2CO(g)
恒容条件下,当气体密度不变时, 是化学平衡状态
恒压条件下,当气体密度不变时, 是化学平衡状态
一 定
一 定
一 定
一 定
二、化学平衡状态的判断
间接判断法
5. 体系总压强
因为恒容、恒温条件下,n(g)越大则压强P就越大,则无论各成份是否均为气体,只需考虑Δn(g)。
当Δn(g)=0,则P为恒值,不一定是化学平衡状态。
当Δn(g)≠0,则P一定时,一定是化学平衡状态。
PV=nRT
二、化学平衡状态的判断
间接判断法
5. 体系总压强
PV=nRT
例如:恒容、恒温条件下 ,
C(s)+O2(g) CO2(g) 当体系总压强不变时, 是化学平衡状态
CO2(g)+C(s) 2CO(g) 当体系总压强不变时, 是化学平衡状态
2SO2(g)+O2(g) 2SO3(g) 当体系总压强不变时, 是化学平衡状态
H2(g)+I2(g) 2HI(g) 当体系总压强不变时, 是化学平衡状态
不一定
一定
一定
不一定
二、化学平衡状态的判断
间接判断法
5. 体系总压强
PV=nRT
例1.在一定温度下,将2 mol NO2气体通入恒容密闭容器中,发生如下反应:
2NO2(g)
N2O4(g)。下列不能说明反应达到平衡的是( )
A.N2O4浓度不再改变
B.NO2的消耗速率等于N2O4的生成速率
C.混合气体的颜色不变
D.混合气体中NO2百分含量不变
B
课堂练习
解析
N2O4浓度不再改变,反应达到平衡状态,A说法正确;NO2的消耗速率和N2O4的生成速率均为正反应速率,不能作为平衡标志,B说法错误;混合气体的颜色不变,NO2的浓度不再发生变化,反应达到平衡状态,C说法正确;混合气体中NO2百分含量不变,反应达到平衡状态,D说法正确。
答案:B
2SO2(g)+
O2(g),可用来确定该反应已达到平衡状态的是( )
A.容器内压强不随时间改变
B.SO3的消耗速率与SO2的生成速率相等
C.三种气体的分子数比为2∶2∶1
D.容器内混合气体的密度不随时间改变
二、化学平衡状态的判断
间接判断法
5. 体系总压强
PV=nRT
例2.在恒温下,固定容积的密闭容器中,有可逆反应2SO3(g)
A
课堂练习
解析
该反应为气体体积增大的反应,压强为变量,当容器内压强不随时间改变时,该反应达到平衡状态, A正确; SO3的消耗速率与SO2的生成速率相等,表示的都是正反应速率,无法判断平衡状态, B错误;三种气体的分子数比为2∶2∶1,无法判断各组分的浓度是否继续变化,则无法判断是否达到平衡状态, C错误;该反应中混合气体的密度为定值,无法根据容器内混合气体的密度判断平衡状态, D错误。
答案:A
根据下表数据计算平衡时 的值并分析其中规律:
【交流·研讨】
I2(g) + H2(g) 2HI(g)
起始时浓度mol/L 平衡时浓度mol/L 平衡时
c (H2) c(I2) c (HI) C(H2) C(I2) C(HI) 0.01197 0.006944 0 0.005617 0.0005936 0.01270 48.37
0.01228 0.009964 0 0.003841 0.001524 0.01687 48.62
0.01201 0.008403 0 0.004580 0.0009733 0.01486 49.54
0 0 0.01520 0.001696 0.001696 0.01181 48.49
0 0 0.01287 0.001433 0.001433 0.01000 48.70
0 0 0.03777 0.004213 0.0004213 0.02934 48.50
2
c (HI)
c(H2) · c(I2)
2
c (HI)
c(H2) · c(I2)
【交流·研讨】
在 457.6℃时反应体系H2(g)+I2(g) 2HI(g) 中各物质的浓度。 从中我们可以发现:
C2(HI)
C(H2).C(I2)
该反应在457.6℃达到平衡时,
是个常数。
三、化学平衡常数
对于一般的可逆反应:
mA(g) + nB(g) pC(g) + qD(g)
在任意时刻时,
称为浓度商
当该反应在一定温度下达到化学平衡时:
=K
K是常数,称为化学平衡常数,简称平衡常数。
三、化学平衡常数
1. 化学平衡常数的表达式
K=
mA(g) + nB(g) pC(g) + qD(g)
化学平衡常数:
浓度商:
c 为平衡浓度
c 为任一时刻浓度
三、化学平衡常数
2. 化学平衡常数的意义
化学平衡常数是表明化学反应限度的一个特征值,通常情况下,只受温度影响
当反应中有关物质的浓度商等于平衡常数时,表明反应达到限度,即达到化学平衡状态
三、化学平衡常数
2. 化学平衡常数的意义
K值越大,反应进行得越完全,反应物平衡转化率越高;
K值越小,反应进行越不完全,反应物平衡转化率越低。
一般来说,K>105时,反应就进行得基本完全
三、化学平衡常数
(1)平衡常数必须指明温度,反应必须达到平衡状态
(2)平衡常数表示反应进行的程度,不表示 反应的快慢,即速率大,K值不一
定大
(3)在进行K值的计算时,纯固体、纯液体不作考虑,表达式中不需表达
Fe3O4(s) + 4H2(g)
高温
3Fe(s) + 4H2O(g)
如:
一定温度下
易错提示
三、化学平衡常数
易错提示
(4)平衡常数的表达式与方程式的书写有关
N2+3H2 2NH3
2NH3 N2+3H2
某温度下
1/2N2+3/2H2 NH3
方程式的系数扩大n倍,K变为Kn;正反应与逆反应的K,互为倒数
三、化学平衡常数
Q<K ,反应向正方向进行
Q=K ,反应处于平衡状态
Q>K ,反应向逆方向进行
3. 化学平衡常数的应用
(1)判断平衡移动的方向
(2)判断反应的热效应
若升高温度,K值增大,则正反应为吸热反应
若升高温度,K值减小,则正反应为放热反应
三、化学平衡常数
H2(g) + I2(g) 2HI(g)
始始(mol/L) 0.010 0.010 0
变化(mol/L)
平衡(mol/L) 0.0080
0.0040
0.0020
0.0020
0.0040
0.0080
K=
C2(HI)
C(H2).C(I2)
=
(0.0040)2
(0.0080)2
=0.25
例3. 在某温度下,将H2和I2各0.01mol/L的气态混合物充入10L密闭容器中,充分反
应, 达到平衡后,测得c(H2)=0.008mol/L.
(1) 求反应的平衡常数.
(2) 在上述温度下,将H2和I2各0.20mol的气态混合物充入该密闭容器中, 试求达到
平衡时各物质的浓度.
三、化学平衡常数
(2) 根据题意:c(H2)=0.020mol/L, c(I2)=0.020mol/L
设H2的变化浓度为xmol L-1
H2 + I2 2HI
始 0.020 0.020 0
变
平
2x
x
x
2x
0.020-x
0.020-x
K只随温度发生变化,因此
K=
C2(HI)
C(H2).C(I2)
=
(2x)2
(0.020-x)2
=0.25
解得x=0.0040mol/L
C(H2)=C(I2)=0.016mol/L
C(HI)=0.0080mol/L
三、化学平衡常数
4. 平衡转化率
用平衡常数来表示反应的限度有时不够直观,常用平衡转化率α来表示反应限度。
对于可逆反应: mA(g)+nB (g) pC(g)+qD(g)
反应物A的平衡转化率(该条件最大转化率)可表示:
课堂练习
1. 一定条件下,在密闭容器中,能表示反应X(g)+2Y(g) 2Z(g)一定达到化学平
衡状态的是( )
①X、Y、Z的物质的量之比为1∶2∶2
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成 n mol Z,同时生成2n mol Y
A.①② B.①④
C.②③ D.③④
C
课堂练习
2.当把晶体N2O4放入密闭容器中汽化,并建立了N2O4(g)
2NO2(g)平衡后,保持温度不变,再通入若干N2O4气体,待反应达到新的平衡时,则新平衡与旧平衡相比,其 值( )
A.变大 B.不变
C.变小 D.无法确定
C
c2(NO2)
c2(N2O4)
课堂练习
3. 现有一定温度下的密闭容器中存在如下反应:
H2 (g) + I2 (g) 2HI (g)
已知c(H2)始=0.4mol/L,c(I2)始=1mol/L经测定该反应在该温度下的平衡常数K=64,试判断,达平衡状态时,H2的转化率应为多少?
课堂练习
解: 设氢气的转化浓度为xmol/L
H2 + I2 2HI
起始浓度/mol·L-1 0.4 1 0
转化浓度/mol·L-1 x x 2x
平衡浓度/mol·L-1 0.4-x 1-x 2x
解得 x=0.385 mol/L,则氢气的转化率为
课堂小结
CLASS SUMMARY
向奋斗在一线的老师致敬
感谢您的观看
第二章
化学反应速率与化学平衡
第一节 化学反应速率
THANKS FOR WATCHING
