高二化学人教版(2019)选择性必修一 3.3.1盐类的水解(28张ppt)
文档属性
| 名称 | 高二化学人教版(2019)选择性必修一 3.3.1盐类的水解(28张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-14 14:34:53 | ||
图片预览




文档简介
(共28张PPT)
第三章
盐类的水解
第三节 盐类的水解
第1课时
HYDROLYSIS OF SALTS
Na2CO3是日常生活中常用的盐,俗称纯碱
常在面点加工时用于中和酸并使食品松软或酥脆为什么 Na2CO3可被当作“碱”使用呢
你知道吗
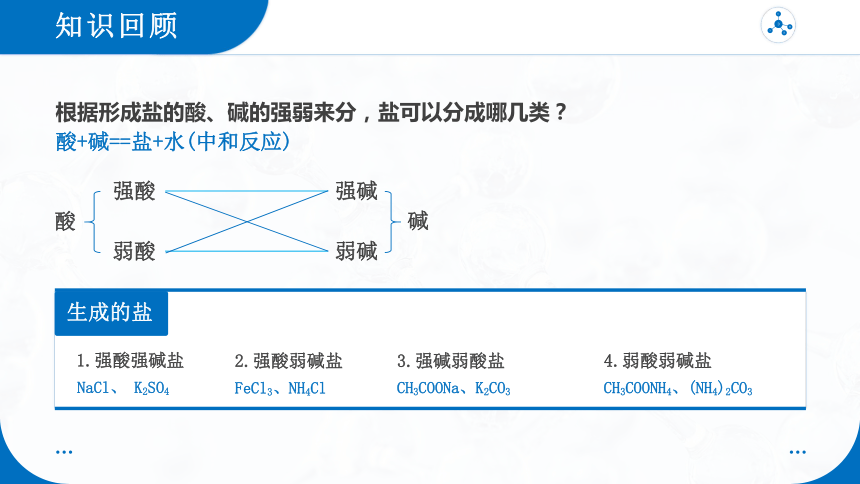
根据形成盐的酸、碱的强弱来分,盐可以分成哪几类?
酸+碱==盐+水(中和反应)
酸
强酸
弱酸
弱碱
强碱
碱
1.强酸强碱盐
2.强酸弱碱盐
3.强碱弱酸盐
4.弱酸弱碱盐
NaCl、 K2SO4
FeCl3、NH4Cl
CH3COONH4、(NH4)2CO3
CH3COONa、K2CO3
知识回顾
生成的盐
Na2CO3溶液+酚酞
如何验证Na2CO3溶液的酸碱性?
pH试纸
pH计
活动与探究
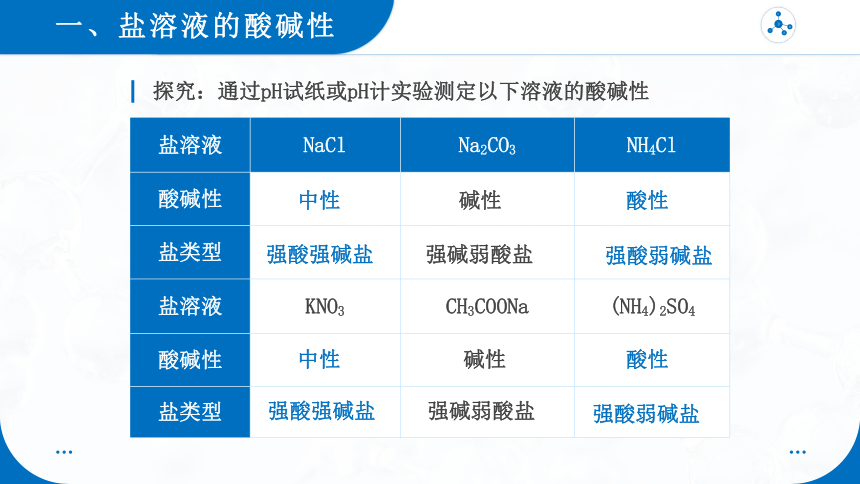
盐溶液 NaCl Na2CO3 NH4Cl
酸碱性
盐类型
盐溶液 KNO3 CH3COONa (NH4)2SO4
酸碱性
盐类型
探究:通过pH试纸或pH计实验测定以下溶液的酸碱性
中性
碱性
碱性
酸性
中性
酸性
强酸强碱盐
强碱弱酸盐
强碱弱酸盐
强酸弱碱盐
强酸强碱盐
强酸弱碱盐
一、盐溶液的酸碱性
结论
盐的类型 强酸强碱盐 强酸弱碱盐 强碱弱酸盐
盐溶液酸碱性
中性
酸性
碱性
规律:谁强显谁性,同强显中性
一、盐溶液的酸碱性
盐的类型与盐溶液酸碱性的关系
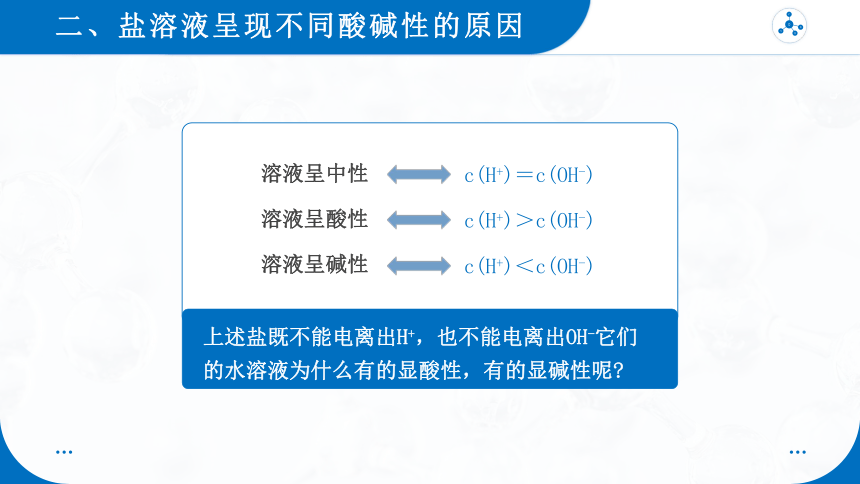
盐溶液有的显酸性,有的显碱性,还有的显中性。
溶液呈中性
c(H+)=c(OH-)
溶液呈酸性
c(H+)>c(OH-)
溶液呈碱性
c(H+)<c(OH-)
上述盐既不能电离出H+,也不能电离出OH-它们的水溶液为什么有的显酸性,有的显碱性呢
二、盐溶液呈现不同酸碱性的原因
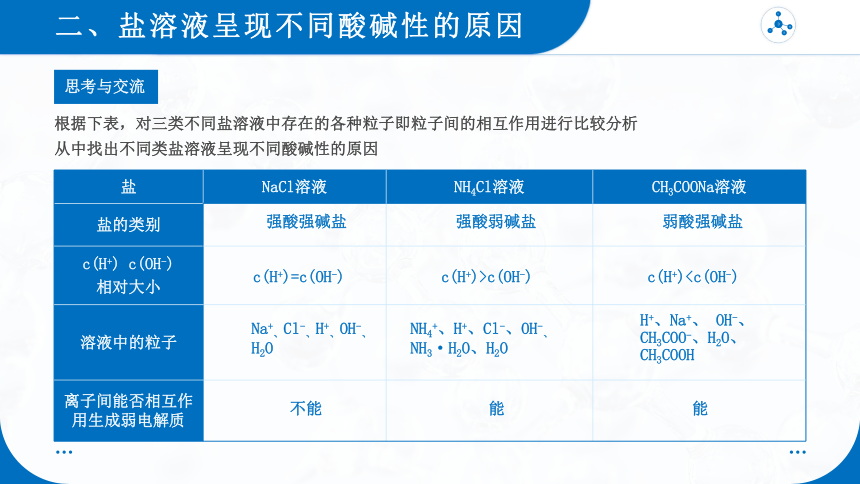
思考与交流
根据下表,对三类不同盐溶液中存在的各种粒子即粒子间的相互作用进行比较分析
从中找出不同类盐溶液呈现不同酸碱性的原因
盐 NaCl溶液 NH4Cl溶液 CH3COONa溶液
盐的类别
c(H+) c(OH-) 相对大小
溶液中的粒子
离子间能否相互作用生成弱电解质
强酸强碱盐
强酸弱碱盐
弱酸强碱盐
c(H+)=c(OH-)
c(H+)>c(OH-)
c(H+)Na+、Cl-、H+、OH-、H2O
NH4+、H+、Cl-、OH-、NH3·H2O、H2O
H+、Na+、 OH-、CH3COO-、H2O、 CH3COOH
不能
能
能
二、盐溶液呈现不同酸碱性的原因
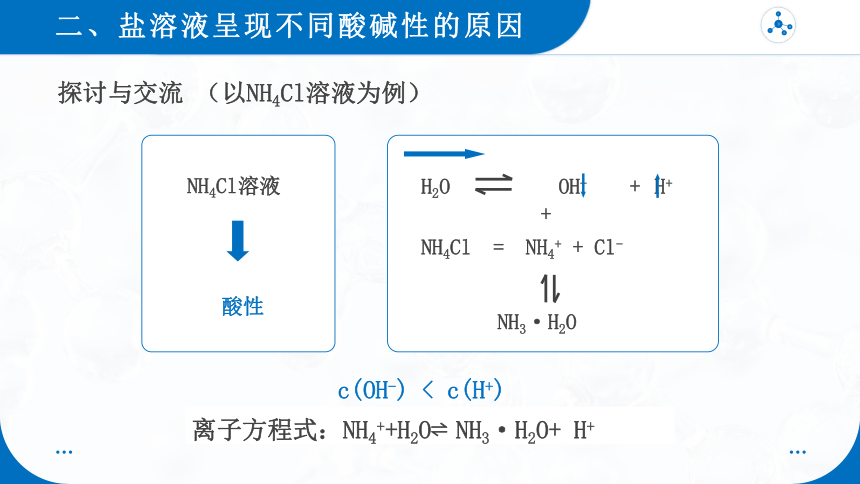
NH4Cl = NH4+ + Cl-
+
NH3·H2O
H2O OH- + H+
探讨与交流 (以NH4Cl溶液为例)
酸性
NH4Cl溶液
c(OH-) < c(H+)
离子方程式:NH4++H2O NH3·H2O+ H+
二、盐溶液呈现不同酸碱性的原因
NaCl = Na+ + Cl-
H2O OH- + H+
中性
Nacl溶液
二、盐溶液呈现不同酸碱性的原因
探讨与交流 (以NaCl溶液为例)
c(H+) = c(OH-)
CH3COONa = CH3COO- + Na+
+
CH3COOH
c(H+)碱性
CH3COONa溶液
H2O H+ + OH-
离子方程式:CH3COO-+H2O CH3COOH+ OH-
探讨与交流 (CH3COONa溶液)
二、盐溶液呈现不同酸碱性的原因
在溶液中盐电离出来的弱离子跟水所电离出来的H+ 或OH –结合生成弱电解质的反应,叫做盐类的水解。
(弱酸、弱碱)
盐 + 水 酸 + 碱
三、盐类的水解
概念
1
盐 + 水 酸 + 碱
促进水的电离。
使 c (H+) ≠ c (OH–)
生成弱电解质;
⑴ 可逆
⑵ 吸热
⑶ 一般很微弱
中和
水解
一般不用“↑”或“↓”;
一般不写“ ”,而写“ ”
,必有弱酸或弱碱生成
三、盐类的水解
水解的实质
3
水解的特点
4
盐易溶,有弱离子。
水解的条件
2
盐类 溶液酸碱性 规律
强酸强碱盐
强酸弱碱盐
强碱弱酸盐 弱酸弱碱盐 中性
酸性
碱性
无弱不水解,同强显中性
谁弱谁水解,谁强显谁性
都弱都水解,同弱显中性,谁强显谁性
有弱才水解,无弱不水解;越弱越水解,都弱都水解;谁强显谁性,同强显中性,规律要记清。
盐类水解的规律
5
三、盐类的水解
问题2
问题1
中性
越弱越水解,同弱的情况,水解产生的c(H+)=c(OH-),故显中性
查阅资料可知,CH3COOH和NH3·H2O的电离平衡常数几乎相等,请问CH3COONH4溶液显啥性?为什么?
不相同,CH3COONH4溶液中水的电离程度大
NaCl溶液与CH3COONH4溶液都显中性那么两溶液中水的电离程度相同么?
三、盐类的水解
第一步
HCO3-
H2O OH-+ H+
Na2CO3=2Na++CO32-
+
Na2CO3电离出来的CO32-与水电离出来的H+结合生成HCO3-,HCO3-又与H+结合生成H2CO3,促使水继续电离,使溶液中的c(OH-)增大,所以溶液呈碱性。
【思考】碳酸钠中的碳酸根也水解,碳酸根水解分几步进行 与碳酸的元数有何对应关系
CO32-+H2O OH-+HCO3-
总离子方程式
第二步
HCO3-+H2O
OH-+H2CO3
生成的HCO3-进一步发生水解
Na2CO3第二步水解的程度很小,平衡时溶液中H2CO3的浓度很小,不会放出CO2气体。
重点提示
三、盐类的水解
(1)盐类水解是可逆反应,反应方程式要写可逆符号 ;
(2)一般水解程度较小,水解产物很少,通常不生成气体和沉淀,不
写↑↓符号,不稳定的生成物如H2CO3、NH3·H2O也不写分解产物。
三、盐类的水解
水解方程式的书写
6
(4)多元弱碱盐分步水解但不分步书写方程式,一步书写到位。
HCO3 – + H2O H2CO3 + OH –
CO3 2– + H2O HCO3 – + OH –
(主)
(次)
(3)多元弱酸盐分步水解,第一步为主,水解方程式通常只写第一步
Al 3++3H2O Al(OH)3+3H+
如:AlCl3
三、盐类的水解
1
强酸弱碱盐水解的离子方程式(通式)
Mn+ +n H2O M(OH)n + n H+
1
强碱弱酸盐水解的离子方程式(通式)
Rn- + H2O HR(n-1) - + OH-
三、盐类的水解
①一般的双水解:程度不是很大,阴阳离子仍能在溶液中大量共存的
如NH4HCO3、(NH4)2CO3;
若不能同时产生沉淀和气体,水解不完全;
进行“一般双水解”用 。
三、盐类的水解
(5)弱酸弱碱盐水解
CH3COO– + NH4+ + H2O CH3COOH + NH3·H2O
若同时产生沉淀和气体,水解趋于完全;
“完全双水解”的,用“ =”、“↑”、“↓”
Al3+ 与 AlO2-、CO32-、HCO3- 、 HS-、S2-、SiO32-
Fe3+ 与 AlO2-、CO32-、HCO3-
NH4+ 与 SiO32-、AlO2-
三、盐类的水解
水解进行完全,阴阳离子不能在溶液中大量共存的
② 完全双水解
三、盐类的水解
2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑
2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑
Al3++3HCO3-=Al(OH)3↓+3CO2 ↑
例如.双水解的离子方程式的书写:
(1) Al3+与 CO32
(2) Al3+与 HCO3-
(3) Al3+与 S2-
三、盐类的水解
课堂练习
三、盐类的水解
三、盐类的水解
三、盐类的水解
三、盐类的水解
盐类的水解
0
盐类水解的概念
0
盐类水解的实质
0
水解的规律
0
水解方程式书写
0
盐类水解的特点
课堂小结
感谢您的观看
THANK
第三章
盐类的水解
第三节 盐类的水解
第1课时
HYDROLYSIS OF SALTS
Na2CO3是日常生活中常用的盐,俗称纯碱
常在面点加工时用于中和酸并使食品松软或酥脆为什么 Na2CO3可被当作“碱”使用呢
你知道吗
根据形成盐的酸、碱的强弱来分,盐可以分成哪几类?
酸+碱==盐+水(中和反应)
酸
强酸
弱酸
弱碱
强碱
碱
1.强酸强碱盐
2.强酸弱碱盐
3.强碱弱酸盐
4.弱酸弱碱盐
NaCl、 K2SO4
FeCl3、NH4Cl
CH3COONH4、(NH4)2CO3
CH3COONa、K2CO3
知识回顾
生成的盐
Na2CO3溶液+酚酞
如何验证Na2CO3溶液的酸碱性?
pH试纸
pH计
活动与探究
盐溶液 NaCl Na2CO3 NH4Cl
酸碱性
盐类型
盐溶液 KNO3 CH3COONa (NH4)2SO4
酸碱性
盐类型
探究:通过pH试纸或pH计实验测定以下溶液的酸碱性
中性
碱性
碱性
酸性
中性
酸性
强酸强碱盐
强碱弱酸盐
强碱弱酸盐
强酸弱碱盐
强酸强碱盐
强酸弱碱盐
一、盐溶液的酸碱性
结论
盐的类型 强酸强碱盐 强酸弱碱盐 强碱弱酸盐
盐溶液酸碱性
中性
酸性
碱性
规律:谁强显谁性,同强显中性
一、盐溶液的酸碱性
盐的类型与盐溶液酸碱性的关系
盐溶液有的显酸性,有的显碱性,还有的显中性。
溶液呈中性
c(H+)=c(OH-)
溶液呈酸性
c(H+)>c(OH-)
溶液呈碱性
c(H+)<c(OH-)
上述盐既不能电离出H+,也不能电离出OH-它们的水溶液为什么有的显酸性,有的显碱性呢
二、盐溶液呈现不同酸碱性的原因
思考与交流
根据下表,对三类不同盐溶液中存在的各种粒子即粒子间的相互作用进行比较分析
从中找出不同类盐溶液呈现不同酸碱性的原因
盐 NaCl溶液 NH4Cl溶液 CH3COONa溶液
盐的类别
c(H+) c(OH-) 相对大小
溶液中的粒子
离子间能否相互作用生成弱电解质
强酸强碱盐
强酸弱碱盐
弱酸强碱盐
c(H+)=c(OH-)
c(H+)>c(OH-)
c(H+)
NH4+、H+、Cl-、OH-、NH3·H2O、H2O
H+、Na+、 OH-、CH3COO-、H2O、 CH3COOH
不能
能
能
二、盐溶液呈现不同酸碱性的原因
NH4Cl = NH4+ + Cl-
+
NH3·H2O
H2O OH- + H+
探讨与交流 (以NH4Cl溶液为例)
酸性
NH4Cl溶液
c(OH-) < c(H+)
离子方程式:NH4++H2O NH3·H2O+ H+
二、盐溶液呈现不同酸碱性的原因
NaCl = Na+ + Cl-
H2O OH- + H+
中性
Nacl溶液
二、盐溶液呈现不同酸碱性的原因
探讨与交流 (以NaCl溶液为例)
c(H+) = c(OH-)
CH3COONa = CH3COO- + Na+
+
CH3COOH
c(H+)
CH3COONa溶液
H2O H+ + OH-
离子方程式:CH3COO-+H2O CH3COOH+ OH-
探讨与交流 (CH3COONa溶液)
二、盐溶液呈现不同酸碱性的原因
在溶液中盐电离出来的弱离子跟水所电离出来的H+ 或OH –结合生成弱电解质的反应,叫做盐类的水解。
(弱酸、弱碱)
盐 + 水 酸 + 碱
三、盐类的水解
概念
1
盐 + 水 酸 + 碱
促进水的电离。
使 c (H+) ≠ c (OH–)
生成弱电解质;
⑴ 可逆
⑵ 吸热
⑶ 一般很微弱
中和
水解
一般不用“↑”或“↓”;
一般不写“ ”,而写“ ”
,必有弱酸或弱碱生成
三、盐类的水解
水解的实质
3
水解的特点
4
盐易溶,有弱离子。
水解的条件
2
盐类 溶液酸碱性 规律
强酸强碱盐
强酸弱碱盐
强碱弱酸盐 弱酸弱碱盐 中性
酸性
碱性
无弱不水解,同强显中性
谁弱谁水解,谁强显谁性
都弱都水解,同弱显中性,谁强显谁性
有弱才水解,无弱不水解;越弱越水解,都弱都水解;谁强显谁性,同强显中性,规律要记清。
盐类水解的规律
5
三、盐类的水解
问题2
问题1
中性
越弱越水解,同弱的情况,水解产生的c(H+)=c(OH-),故显中性
查阅资料可知,CH3COOH和NH3·H2O的电离平衡常数几乎相等,请问CH3COONH4溶液显啥性?为什么?
不相同,CH3COONH4溶液中水的电离程度大
NaCl溶液与CH3COONH4溶液都显中性那么两溶液中水的电离程度相同么?
三、盐类的水解
第一步
HCO3-
H2O OH-+ H+
Na2CO3=2Na++CO32-
+
Na2CO3电离出来的CO32-与水电离出来的H+结合生成HCO3-,HCO3-又与H+结合生成H2CO3,促使水继续电离,使溶液中的c(OH-)增大,所以溶液呈碱性。
【思考】碳酸钠中的碳酸根也水解,碳酸根水解分几步进行 与碳酸的元数有何对应关系
CO32-+H2O OH-+HCO3-
总离子方程式
第二步
HCO3-+H2O
OH-+H2CO3
生成的HCO3-进一步发生水解
Na2CO3第二步水解的程度很小,平衡时溶液中H2CO3的浓度很小,不会放出CO2气体。
重点提示
三、盐类的水解
(1)盐类水解是可逆反应,反应方程式要写可逆符号 ;
(2)一般水解程度较小,水解产物很少,通常不生成气体和沉淀,不
写↑↓符号,不稳定的生成物如H2CO3、NH3·H2O也不写分解产物。
三、盐类的水解
水解方程式的书写
6
(4)多元弱碱盐分步水解但不分步书写方程式,一步书写到位。
HCO3 – + H2O H2CO3 + OH –
CO3 2– + H2O HCO3 – + OH –
(主)
(次)
(3)多元弱酸盐分步水解,第一步为主,水解方程式通常只写第一步
Al 3++3H2O Al(OH)3+3H+
如:AlCl3
三、盐类的水解
1
强酸弱碱盐水解的离子方程式(通式)
Mn+ +n H2O M(OH)n + n H+
1
强碱弱酸盐水解的离子方程式(通式)
Rn- + H2O HR(n-1) - + OH-
三、盐类的水解
①一般的双水解:程度不是很大,阴阳离子仍能在溶液中大量共存的
如NH4HCO3、(NH4)2CO3;
若不能同时产生沉淀和气体,水解不完全;
进行“一般双水解”用 。
三、盐类的水解
(5)弱酸弱碱盐水解
CH3COO– + NH4+ + H2O CH3COOH + NH3·H2O
若同时产生沉淀和气体,水解趋于完全;
“完全双水解”的,用“ =”、“↑”、“↓”
Al3+ 与 AlO2-、CO32-、HCO3- 、 HS-、S2-、SiO32-
Fe3+ 与 AlO2-、CO32-、HCO3-
NH4+ 与 SiO32-、AlO2-
三、盐类的水解
水解进行完全,阴阳离子不能在溶液中大量共存的
② 完全双水解
三、盐类的水解
2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑
2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑
Al3++3HCO3-=Al(OH)3↓+3CO2 ↑
例如.双水解的离子方程式的书写:
(1) Al3+与 CO32
(2) Al3+与 HCO3-
(3) Al3+与 S2-
三、盐类的水解
课堂练习
三、盐类的水解
三、盐类的水解
三、盐类的水解
三、盐类的水解
盐类的水解
0
盐类水解的概念
0
盐类水解的实质
0
水解的规律
0
水解方程式书写
0
盐类水解的特点
课堂小结
感谢您的观看
THANK
