高二化学人教版(2019)选择性必修一 3.4.1 难溶电解质的沉淀溶解平衡(36张ppt)
文档属性
| 名称 | 高二化学人教版(2019)选择性必修一 3.4.1 难溶电解质的沉淀溶解平衡(36张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 6.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-14 14:41:53 | ||
图片预览







文档简介
(共36张PPT)
第四节 沉淀溶解平衡
The precipitation dissolves in equilibrium
难溶电解质的沉淀溶解平衡
第
1
课
时
溶洞的形成
溶洞的形成
对“沉淀”认识的拨乱反正
AgNO3 + NaCl === AgCl ↓+ NaNO3
我们初中就知道:
将AgNO3溶液和NaCl溶液混合可以得到白色沉淀:
误区①:
误认为沉淀只能是AgCl 、Fe(OH)3…之类的不溶物,而NaCl之类的一定不会沉淀。
沉淀是相对的,只要达到溶解极限,即便如NaCl 之类的易溶盐也可沉淀,也会有沉淀溶解平衡,只是难以实现。
物质
20℃的溶解度 S g/100gH2O
AgCl
1.5Ⅹ10-4
Fe(OH)3
3.0Ⅹ10-9
物质
20℃的溶解度 S g/100gH2O
NaCl
36.0
NaNO3
88.0
对“沉淀”认识的拨乱反正
化学式 溶解度/g 化学式 溶解度/g
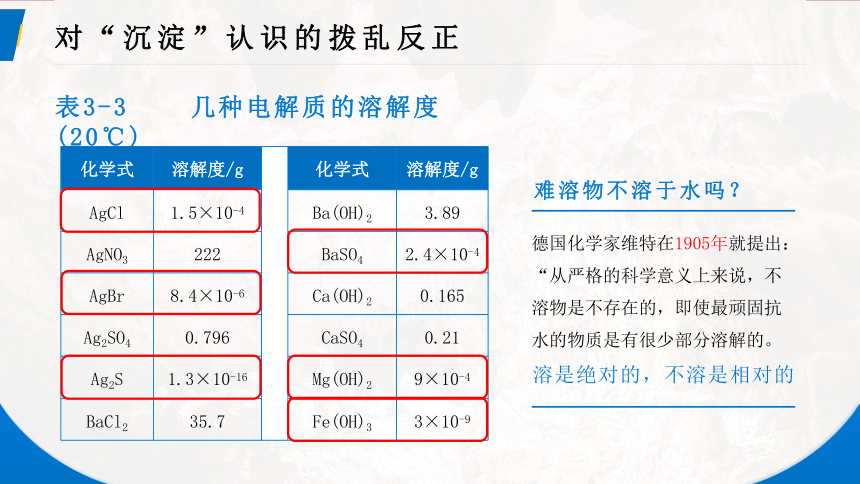
AgCl 1.5×10-4 Ba(OH)2 3.89
AgNO3 222 BaSO4 2.4×10-4
AgBr 8.4×10-6 Ca(OH)2 0.165
Ag2SO4 0.796 CaSO4 0.21
Ag2S 1.3×10-16 Mg(OH)2 9×10-4
BaCl2 35.7 Fe(OH)3 3×10-9
表3-3 几种电解质的溶解度(20℃)
难溶物不溶于水吗?
德国化学家维特在1905年就提出:“从严格的科学意义上来说,不溶物是不存在的,即使最顽固抗水的物质是有很少部分溶解的。
溶是绝对的,不溶是相对的
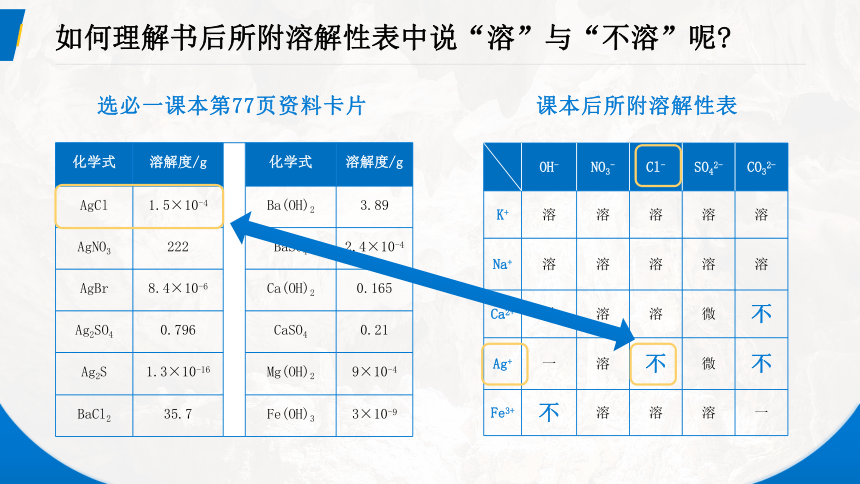
如何理解书后所附溶解性表中说“溶”与“不溶”呢
OH- NO3- Cl- SO42- CO32-
K+ 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶
Ca2+ 微 溶 溶 微 不
Ag+ 一 溶 不 微 不
Fe3+ 不 溶 溶 溶 一
课本后所附溶解性表
选必一课本第77页资料卡片
化学式 溶解度/g 化学式 溶解度/g
AgCl 1.5×10-4 Ba(OH)2 3.89
AgNO3 222 BaSO4 2.4×10-4
AgBr 8.4×10-6 Ca(OH)2 0.165
Ag2SO4 0.796 CaSO4 0.21
Ag2S 1.3×10-16 Mg(OH)2 9×10-4
BaCl2 35.7 Fe(OH)3 3×10-9
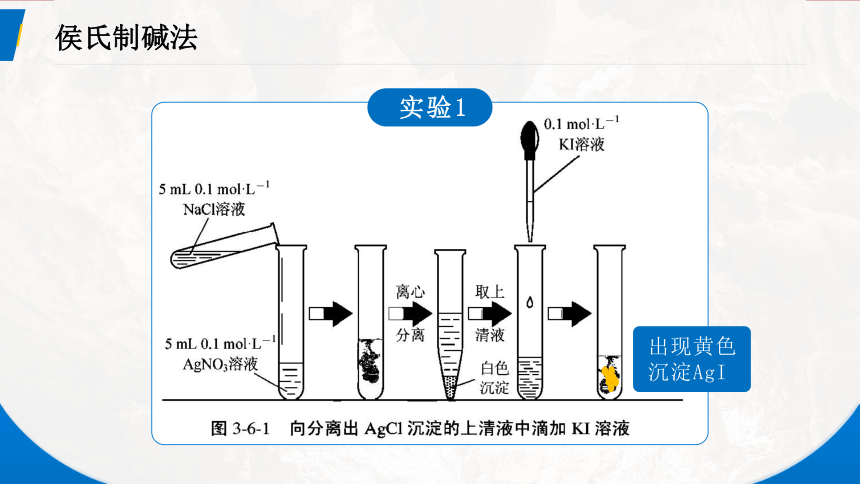
侯氏制碱法
室温NaHCO3的溶解度为9.6g,只要溶液中有足够多的 Na+和 HCO3-,也可沉淀
总反应
NaCl + CO2+ NH3+ H2O = NaHCO3 ↓ + NH4Cl
向饱和Na2CO3溶液中通入CO2气体,会析出NaHCO3固体。
侯氏制碱法
思考:
能否生成0.5mmol沉淀?
5mL 0.1mol/L AgNO3 溶液
5mL 0.1mol/L NaCl 溶液
将AgCl固体溶于少量水后,得到白色沉淀,请问最终上层液体是什么?是纯水?
混合
对于难容物质,在化学反应中很容易达到溶解极限(饱和溶液),所以本节我们重点介绍难溶物的沉淀溶解平衡。
误区②:误认为“沉淀”就是百分之百的“不容”。
通过上表我们知 道,物质的溶解度差异巨大,我们平常简单按如下分类:
侯氏制碱法
实验1
出现黄色沉淀AgI
侯氏制碱法
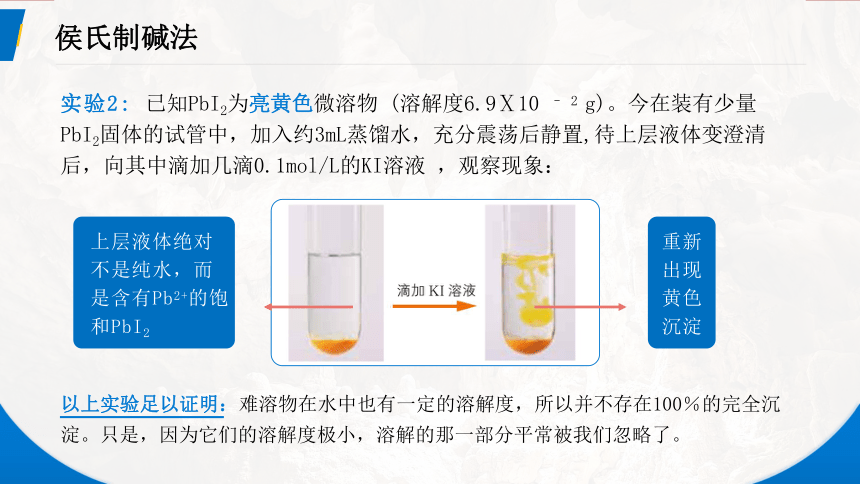
实验2: 已知PbI2为亮黄色微溶物 (溶解度6.9Ⅹ10 – 2 g)。今在装有少量PbI2固体的试管中,加入约3mL蒸馏水,充分震荡后静置,待上层液体变澄清后,向其中滴加几滴0.1mol/L的KI溶液 ,观察现象:
上层液体绝对不是纯水,而是含有Pb2+的饱和PbI2
重新
出现
黄色
沉淀
以上实验足以证明:难溶物在水中也有一定的溶解度,所以并不存在100%的完全沉淀。只是,因为它们的溶解度极小,溶解的那一部分平常被我们忽略了。
侯氏制碱法
溶
解
沉淀
其实在整个体系中一直存在着两个相反的过程
①溶解:在水分子作用下, Pb2+和I-脱离固体表面溶入水中
②沉淀:Pb2+和I- 结合回到固体表面,析出沉淀
最终溶解速率和沉淀速率相等,达到平衡状态,即我们将要学习的沉淀溶解平衡
PbI2 (s) Pb2+ (aq) + 2I- (aq)
沉淀
溶解
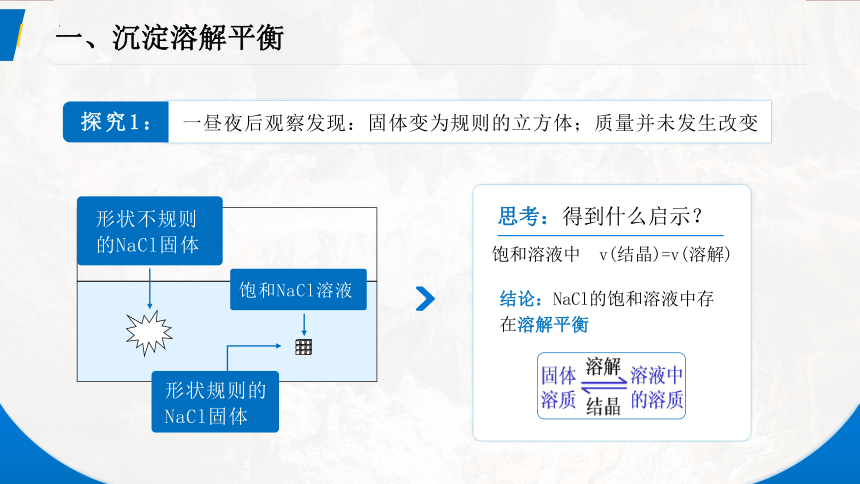
一、沉淀溶解平衡
形状不规则的NaCl固体
饱和NaCl溶液
形状规则的NaCl固体
思考:得到什么启示?
饱和溶液中 v(结晶)=v(溶解)
结论:NaCl的饱和溶液中存在溶解平衡
探究1:
一昼夜后观察发现:固体变为规则的立方体;质量并未发生改变
一、沉淀溶解平衡
加浓盐酸Cl- 的浓度增加,平衡向左移, NaCl析出
可溶的电解质溶液中存在溶解平衡,难溶的电解质在水中是否也存在溶解平衡呢?
在饱和NaCl溶液中加入浓盐酸
NaCl饱和溶液中析出固体
现象:
探究2:
在NaCl的饱和溶液中,存在溶解平衡
NaCl(s) Na+(aq)+Cl-(aq)
解释:
一、沉淀溶解平衡
例如,AgNO3溶液与NaCl溶液混合,生成白色沉淀AgCl:Ag++Cl-=AgCl↓,如果上述两种溶液是等物质的量浓度、等体积的,一般认为反应可以进行到底。
我们知道,溶液中有难溶于水的沉淀生成是离子反应发生的条件之一。
一、沉淀溶解平衡
200C时,溶解性与溶解度的大小关系
溶解性 易溶 可溶 微溶 难溶
溶解度 >10g 1g~10g 0.01g~1g <0.01g
1、溶解是绝对的,不溶是相对的。
2、没有绝对不溶的电解质,难溶电解质都会发生微量溶解
3、生成沉淀的离子反应能发生的原因:生成物的溶解度很小。
化学上通常认为残留在溶液中的离子浓度小于1×10-5 mol/L,沉淀就达完全。
一、沉淀溶解平衡
【探究实验】向盛有2 mL 0.1mol/LAgNO3溶液的试管中加入
2 mL 0.1 mol/L NaCl溶液。
讨论:
现象:有白色沉淀生成,说明溶液中依然有Ag+ Cl-存在,即Ag+和Cl-的反应不能进行到底。
(1)是否恰好反应?
(2)溶液中是否还含有Ag+和Cl-?
【继续试验】取上层清液,滴加NaCl溶液,有何现象?说明了什么?
沉淀是难溶物,但不是绝对不溶,只不过溶解度很小,难溶物在水中存在溶解平衡。
一、沉淀溶解平衡
宏观现象 溶液状态 微观过程
V(溶解)>V(结晶)
固体质量减少
不饱和
V(溶解)=V(结晶)
固体质量不变
饱和
饱和阶段
固体质量增加
结晶阶段
V(溶解)过饱和
思考:把AgCl固体加到水中都发生着怎样的过程?
开始阶段
一、沉淀溶解平衡
尽管AgCl固体难溶于水,但仍有部分Ag+和 Cl-离开固体表面进入溶液, 同时进入溶液的Ag+和 Cl-又会在固体表面沉淀下来,当这两个过程速率相等时,Ag+和 Cl-的沉淀与AgCl固体的溶解达到平衡状态即达到沉淀溶解平衡状态. AgCl固体在水中的沉淀溶解平衡可表示为:
AgCl在水中溶解平衡
溶解
AgCl(s) Ag+(aq) + 2Cl-(aq)
沉淀
Ag+
Cl-
二、难溶电解质的溶解平衡
一定温度下,当沉淀溶解的速率和沉淀生成的速率相等时,形成电解质的饱和溶液,达到平衡状态,我们把这种平衡称为沉淀溶解平衡 。
1
概念:
二、难溶电解质的溶解平衡
溶解速率
沉淀速率
时间
速率
沉淀溶解平衡
2
溶解平衡的建立
溶液中的溶质
固体溶质
溶解
结晶
v(溶解)> v(结晶) 固体溶解
v(溶解)= v(结晶) 溶解平衡
v(溶解)< v(结晶) 析出晶体
二、难溶电解质的溶解平衡
3
表达方法
标明物质状态和可逆符号
4
溶解平衡的特征
5
生成难溶电解质的离子反应的限度
逆、等、动、定、变
离子浓度小于1×10-5mol/L时,认为反应完全。
AgCl(s) Ag+(aq) + Cl-(aq)
二、难溶电解质的溶解平衡
①内因:电解质本身的性质。
只要是饱和溶液都存在溶解平衡
绝对不溶的物质是没有的
不同难溶物其溶解度差别也很大
0.01g
10g
难溶
微溶
易溶
可溶
1g
难溶的电解质更易建立溶解平衡
6
沉淀溶解平衡的影响因素
二、难溶电解质的溶解平衡
②外因
(气体,Ca(OH)2除外)
升温,多数平衡向溶解方向移动。
温度:
加水,平衡向溶解方向移动;
浓度:
加与难溶电解质相同离子,平衡向沉淀方向移动
同离子效应:
反应消耗难溶电解质的离子,平衡向溶解方向移动。
化学反应:
二、难溶电解质的溶解平衡
讨论:在AgCl饱和溶液中,尚有AgCl固体存在,当分别改变下列条件,将如何变化? AgCl(S) Ag+(aq) + Cl-(aq)
改变条件 平衡移动方向 C(Ag+ ) C(Cl-)
升 温
加 水
加AgCl(s)
加NaCl(s)
加NaI(s)
加AgNO3(s)
→
不变
不变
不移动
不变
不变
→
↑
↑
→
↑
↑
→
↑
↑
↑
↑
→
三、溶度积常数
固体浓度视为定值
思考:写出难溶物Ag2CrO4、 Fe(OH)3的溶度积表达式
Ksp=cm(An+)·cn(Bm-)
在一定温度下,沉淀达溶解平衡后的溶液为饱和溶液,其离子浓度不再发生变化,溶液中各离子浓度幂之积为常数,叫做溶度积常数(简称溶度积),用Ksp表示。
1
概念:
2
表达式:
AmBn(s) mAn+(aq)+nBm-(aq)
三、溶度积常数
Ksp的大小只与难溶电解质本身的性质和温度有关。T↑,Ksp↑ [ Ca(OH)2 相反]
相同类型(阴、阳离子个数比相同)的难溶电解质,溶度积小的电解质,其溶解能力小;不同类型的难溶电解质,应通过计算才能进行比较。
Ksp反映了难溶电解质在水中的溶解能力
3
影响Ksp的因素:
4
Ksp的意义:
三、溶度积常数
讨论:溶度积和溶解度都可以表示难溶电解质在水中的溶解能力,分析下表,你将如何看待溶度积和溶解度的关系?
类型 化学式 溶度积Ksp 溶解度/g
AB AgBr 5.0×10-13 8.4×10-6
AB AgCl 1.8×10-10 1.5×10-4
A2B Ag2CrO4 1.1×10-12 2.2×10-3
A2B Ag2S 6.3×10-50 1.3×10-16
结论:相同类型(阴、阳离子个数比相同)的难溶电解质的Ksp越小溶解度越小
一定条件下:
注意:只有在同种类型的电解质之间才能通过Ksp的大小来直接比较溶解度的大小。
三、溶度积常数
5
溶度积规则:
②溶度积规则
Qc>Ksp时,溶液过饱和,有沉淀析出,直至达到平衡
Qc=Ksp时,沉淀与饱和溶液的平衡
Qc①离子积
AnBm(s) nAm+(aq) + mBn-(aq)
Qc称为离子积,其表达式中离子浓度是任意的,为此瞬间溶液中的实际浓度
Qc= cn(Am+) · cm(Bn-)
三、溶度积常数
6
利用溶度积计算某种离子的浓度:
① 25℃时,Ksp (AgBr)= 5.0×10-10,求AgBr的饱和溶液中的c(Ag+)和c(Br-)。
② 25℃时,Ksp [Mg(OH)2]= 1.8×10-11,求Mg(OH)2的饱和溶液中的C(Mg2+)和c(OH-)
C(Mg2+)=1.65×10-4,c(OH-)=3.3×10-4
c(Ag+)=c(Br- )=2.2×10-5
随堂一练
三、溶度积常数
室温下,AgCl的溶解度是1.93×10-3g/L,求AgCl的溶度积。已知AgCl的摩尔质量为
143.3g/mol。
7
溶度积与溶解度的相互换算
饱和、平衡 1.35×10-5 1.35×10-5
②求Ksp
AgCl(s) Ag+ (aq) + Cl-(aq)
Ksp(AgCl)=c(Ag+).c(Cl-) =(1.35×10-5)2
=1.82×10-10
答:AgCl的Ksp为1.82×10-10
解:①把AgCl溶解度单位(g/L)换算成mol·L-1
s=1.93×10-3g/L÷143.3g/mol
=1.35×10-5mol·L-1
三、溶度积常数
25℃时,在1.00 L 0.03 mol/L AgNO3溶液中加入0.50 L 0.06 mol/L的CaCl2溶液,能否生成AgCl沉淀?
已知:AgCl的Ksp=1.8×10-10
c(Ag+)=(0.03 mol/L×1.00 L)÷(1.00 L+0.50 L)
=0.020 mol/L
c(Cl-)=(0.06 mol/L×2×0.50 L)÷(1.00 L+0.50 L)
=0.040 mol/L
Qc=c(Ag+)·c(Cl-)=0.020 mol/L×0.040 mol/L=8.0×10-4
8
判断能否生成沉淀
由于Qc>Ksp,所以有AgCl沉淀生成。
三、溶度积常数
9
计算某离子开始沉淀的pH值
实验测得某水样中的铁离子的浓度为6×10-6mol·L-1若要使水中的铁离子转化为沉淀,则溶液的pH值至少要控制在多少以上?[已知Fe(OH)3的Ksp为2.6×10-39]
解:设溶液中的OH-离子的浓度最少为X才能使水中的铁离子转化为沉淀。
Ksp=c(Fe3+) ·c3(OH-)=2.6×10-39 =6×10-6×X3
求得X=7.57×10-12mol·L-1=c(OH-)
c(H+)=1.32×10-3mol·L-1
pH=2.88
答:pH至少要控制在2.88以上。
课堂练习
1.下列有关AgCl沉淀的溶解平衡状态的说法中,正确的是( )
A.AgCl沉淀的生成和溶解不断进行,但速率相等
B.AgCl难溶于水,溶液中没有Ag+和Cl-
C.升高温度,AgCl的溶解度不变
D.向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解度不变
A [AgCl固体在溶液中存在溶解平衡,所以溶液中有Ag+和Cl-,B错;升高温度,AgCl溶解度增大,C错;向平衡体系中加入NaCl固体,增大了c(Cl-),溶解平衡左移,AgCl溶解度减小,D错
课堂练习
2.在0.10 mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=________ mol·L-1(Ksp[Cu(OH)2]=2.2×10-20)。若在0.1 mol·L-1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是________ mol·L-1。
课堂练习
[解析] pH=8时,c(OH-)=10-6 mol·L-1,由硫酸铜的溶度积常数可知:Ksp=2.2×10-20=10-12×c(Cu2+),得c(Cu2+)=2.2×10-8 mol·L-1;使Cu2+沉淀完全,已知c(Cu2+)=0.1 mol·L-1,根据反应关系式:Cu2+~2H+得c(H+)=0.2 mol·L-1。
[答案] 2.2×10-8 0.2
课堂总结
1、定义
2、表达式
3、特征
4、影响难溶电解质溶解平衡的因素
一
沉淀溶解平衡
二
溶度积常数
1、定义
2、影响Ksp的因素
3、Ksp的意义
感谢探究
Thanks for the inquiry
难溶电解质的沉淀溶解平衡
第
1
课
时
第四节 沉淀溶解平衡
The precipitation dissolves in equilibrium
难溶电解质的沉淀溶解平衡
第
1
课
时
溶洞的形成
溶洞的形成
对“沉淀”认识的拨乱反正
AgNO3 + NaCl === AgCl ↓+ NaNO3
我们初中就知道:
将AgNO3溶液和NaCl溶液混合可以得到白色沉淀:
误区①:
误认为沉淀只能是AgCl 、Fe(OH)3…之类的不溶物,而NaCl之类的一定不会沉淀。
沉淀是相对的,只要达到溶解极限,即便如NaCl 之类的易溶盐也可沉淀,也会有沉淀溶解平衡,只是难以实现。
物质
20℃的溶解度 S g/100gH2O
AgCl
1.5Ⅹ10-4
Fe(OH)3
3.0Ⅹ10-9
物质
20℃的溶解度 S g/100gH2O
NaCl
36.0
NaNO3
88.0
对“沉淀”认识的拨乱反正
化学式 溶解度/g 化学式 溶解度/g
AgCl 1.5×10-4 Ba(OH)2 3.89
AgNO3 222 BaSO4 2.4×10-4
AgBr 8.4×10-6 Ca(OH)2 0.165
Ag2SO4 0.796 CaSO4 0.21
Ag2S 1.3×10-16 Mg(OH)2 9×10-4
BaCl2 35.7 Fe(OH)3 3×10-9
表3-3 几种电解质的溶解度(20℃)
难溶物不溶于水吗?
德国化学家维特在1905年就提出:“从严格的科学意义上来说,不溶物是不存在的,即使最顽固抗水的物质是有很少部分溶解的。
溶是绝对的,不溶是相对的
如何理解书后所附溶解性表中说“溶”与“不溶”呢
OH- NO3- Cl- SO42- CO32-
K+ 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶
Ca2+ 微 溶 溶 微 不
Ag+ 一 溶 不 微 不
Fe3+ 不 溶 溶 溶 一
课本后所附溶解性表
选必一课本第77页资料卡片
化学式 溶解度/g 化学式 溶解度/g
AgCl 1.5×10-4 Ba(OH)2 3.89
AgNO3 222 BaSO4 2.4×10-4
AgBr 8.4×10-6 Ca(OH)2 0.165
Ag2SO4 0.796 CaSO4 0.21
Ag2S 1.3×10-16 Mg(OH)2 9×10-4
BaCl2 35.7 Fe(OH)3 3×10-9
侯氏制碱法
室温NaHCO3的溶解度为9.6g,只要溶液中有足够多的 Na+和 HCO3-,也可沉淀
总反应
NaCl + CO2+ NH3+ H2O = NaHCO3 ↓ + NH4Cl
向饱和Na2CO3溶液中通入CO2气体,会析出NaHCO3固体。
侯氏制碱法
思考:
能否生成0.5mmol沉淀?
5mL 0.1mol/L AgNO3 溶液
5mL 0.1mol/L NaCl 溶液
将AgCl固体溶于少量水后,得到白色沉淀,请问最终上层液体是什么?是纯水?
混合
对于难容物质,在化学反应中很容易达到溶解极限(饱和溶液),所以本节我们重点介绍难溶物的沉淀溶解平衡。
误区②:误认为“沉淀”就是百分之百的“不容”。
通过上表我们知 道,物质的溶解度差异巨大,我们平常简单按如下分类:
侯氏制碱法
实验1
出现黄色沉淀AgI
侯氏制碱法
实验2: 已知PbI2为亮黄色微溶物 (溶解度6.9Ⅹ10 – 2 g)。今在装有少量PbI2固体的试管中,加入约3mL蒸馏水,充分震荡后静置,待上层液体变澄清后,向其中滴加几滴0.1mol/L的KI溶液 ,观察现象:
上层液体绝对不是纯水,而是含有Pb2+的饱和PbI2
重新
出现
黄色
沉淀
以上实验足以证明:难溶物在水中也有一定的溶解度,所以并不存在100%的完全沉淀。只是,因为它们的溶解度极小,溶解的那一部分平常被我们忽略了。
侯氏制碱法
溶
解
沉淀
其实在整个体系中一直存在着两个相反的过程
①溶解:在水分子作用下, Pb2+和I-脱离固体表面溶入水中
②沉淀:Pb2+和I- 结合回到固体表面,析出沉淀
最终溶解速率和沉淀速率相等,达到平衡状态,即我们将要学习的沉淀溶解平衡
PbI2 (s) Pb2+ (aq) + 2I- (aq)
沉淀
溶解
一、沉淀溶解平衡
形状不规则的NaCl固体
饱和NaCl溶液
形状规则的NaCl固体
思考:得到什么启示?
饱和溶液中 v(结晶)=v(溶解)
结论:NaCl的饱和溶液中存在溶解平衡
探究1:
一昼夜后观察发现:固体变为规则的立方体;质量并未发生改变
一、沉淀溶解平衡
加浓盐酸Cl- 的浓度增加,平衡向左移, NaCl析出
可溶的电解质溶液中存在溶解平衡,难溶的电解质在水中是否也存在溶解平衡呢?
在饱和NaCl溶液中加入浓盐酸
NaCl饱和溶液中析出固体
现象:
探究2:
在NaCl的饱和溶液中,存在溶解平衡
NaCl(s) Na+(aq)+Cl-(aq)
解释:
一、沉淀溶解平衡
例如,AgNO3溶液与NaCl溶液混合,生成白色沉淀AgCl:Ag++Cl-=AgCl↓,如果上述两种溶液是等物质的量浓度、等体积的,一般认为反应可以进行到底。
我们知道,溶液中有难溶于水的沉淀生成是离子反应发生的条件之一。
一、沉淀溶解平衡
200C时,溶解性与溶解度的大小关系
溶解性 易溶 可溶 微溶 难溶
溶解度 >10g 1g~10g 0.01g~1g <0.01g
1、溶解是绝对的,不溶是相对的。
2、没有绝对不溶的电解质,难溶电解质都会发生微量溶解
3、生成沉淀的离子反应能发生的原因:生成物的溶解度很小。
化学上通常认为残留在溶液中的离子浓度小于1×10-5 mol/L,沉淀就达完全。
一、沉淀溶解平衡
【探究实验】向盛有2 mL 0.1mol/LAgNO3溶液的试管中加入
2 mL 0.1 mol/L NaCl溶液。
讨论:
现象:有白色沉淀生成,说明溶液中依然有Ag+ Cl-存在,即Ag+和Cl-的反应不能进行到底。
(1)是否恰好反应?
(2)溶液中是否还含有Ag+和Cl-?
【继续试验】取上层清液,滴加NaCl溶液,有何现象?说明了什么?
沉淀是难溶物,但不是绝对不溶,只不过溶解度很小,难溶物在水中存在溶解平衡。
一、沉淀溶解平衡
宏观现象 溶液状态 微观过程
V(溶解)>V(结晶)
固体质量减少
不饱和
V(溶解)=V(结晶)
固体质量不变
饱和
饱和阶段
固体质量增加
结晶阶段
V(溶解)
思考:把AgCl固体加到水中都发生着怎样的过程?
开始阶段
一、沉淀溶解平衡
尽管AgCl固体难溶于水,但仍有部分Ag+和 Cl-离开固体表面进入溶液, 同时进入溶液的Ag+和 Cl-又会在固体表面沉淀下来,当这两个过程速率相等时,Ag+和 Cl-的沉淀与AgCl固体的溶解达到平衡状态即达到沉淀溶解平衡状态. AgCl固体在水中的沉淀溶解平衡可表示为:
AgCl在水中溶解平衡
溶解
AgCl(s) Ag+(aq) + 2Cl-(aq)
沉淀
Ag+
Cl-
二、难溶电解质的溶解平衡
一定温度下,当沉淀溶解的速率和沉淀生成的速率相等时,形成电解质的饱和溶液,达到平衡状态,我们把这种平衡称为沉淀溶解平衡 。
1
概念:
二、难溶电解质的溶解平衡
溶解速率
沉淀速率
时间
速率
沉淀溶解平衡
2
溶解平衡的建立
溶液中的溶质
固体溶质
溶解
结晶
v(溶解)> v(结晶) 固体溶解
v(溶解)= v(结晶) 溶解平衡
v(溶解)< v(结晶) 析出晶体
二、难溶电解质的溶解平衡
3
表达方法
标明物质状态和可逆符号
4
溶解平衡的特征
5
生成难溶电解质的离子反应的限度
逆、等、动、定、变
离子浓度小于1×10-5mol/L时,认为反应完全。
AgCl(s) Ag+(aq) + Cl-(aq)
二、难溶电解质的溶解平衡
①内因:电解质本身的性质。
只要是饱和溶液都存在溶解平衡
绝对不溶的物质是没有的
不同难溶物其溶解度差别也很大
0.01g
10g
难溶
微溶
易溶
可溶
1g
难溶的电解质更易建立溶解平衡
6
沉淀溶解平衡的影响因素
二、难溶电解质的溶解平衡
②外因
(气体,Ca(OH)2除外)
升温,多数平衡向溶解方向移动。
温度:
加水,平衡向溶解方向移动;
浓度:
加与难溶电解质相同离子,平衡向沉淀方向移动
同离子效应:
反应消耗难溶电解质的离子,平衡向溶解方向移动。
化学反应:
二、难溶电解质的溶解平衡
讨论:在AgCl饱和溶液中,尚有AgCl固体存在,当分别改变下列条件,将如何变化? AgCl(S) Ag+(aq) + Cl-(aq)
改变条件 平衡移动方向 C(Ag+ ) C(Cl-)
升 温
加 水
加AgCl(s)
加NaCl(s)
加NaI(s)
加AgNO3(s)
→
不变
不变
不移动
不变
不变
→
↑
↑
→
↑
↑
→
↑
↑
↑
↑
→
三、溶度积常数
固体浓度视为定值
思考:写出难溶物Ag2CrO4、 Fe(OH)3的溶度积表达式
Ksp=cm(An+)·cn(Bm-)
在一定温度下,沉淀达溶解平衡后的溶液为饱和溶液,其离子浓度不再发生变化,溶液中各离子浓度幂之积为常数,叫做溶度积常数(简称溶度积),用Ksp表示。
1
概念:
2
表达式:
AmBn(s) mAn+(aq)+nBm-(aq)
三、溶度积常数
Ksp的大小只与难溶电解质本身的性质和温度有关。T↑,Ksp↑ [ Ca(OH)2 相反]
相同类型(阴、阳离子个数比相同)的难溶电解质,溶度积小的电解质,其溶解能力小;不同类型的难溶电解质,应通过计算才能进行比较。
Ksp反映了难溶电解质在水中的溶解能力
3
影响Ksp的因素:
4
Ksp的意义:
三、溶度积常数
讨论:溶度积和溶解度都可以表示难溶电解质在水中的溶解能力,分析下表,你将如何看待溶度积和溶解度的关系?
类型 化学式 溶度积Ksp 溶解度/g
AB AgBr 5.0×10-13 8.4×10-6
AB AgCl 1.8×10-10 1.5×10-4
A2B Ag2CrO4 1.1×10-12 2.2×10-3
A2B Ag2S 6.3×10-50 1.3×10-16
结论:相同类型(阴、阳离子个数比相同)的难溶电解质的Ksp越小溶解度越小
一定条件下:
注意:只有在同种类型的电解质之间才能通过Ksp的大小来直接比较溶解度的大小。
三、溶度积常数
5
溶度积规则:
②溶度积规则
Qc>Ksp时,溶液过饱和,有沉淀析出,直至达到平衡
Qc=Ksp时,沉淀与饱和溶液的平衡
Qc
AnBm(s) nAm+(aq) + mBn-(aq)
Qc称为离子积,其表达式中离子浓度是任意的,为此瞬间溶液中的实际浓度
Qc= cn(Am+) · cm(Bn-)
三、溶度积常数
6
利用溶度积计算某种离子的浓度:
① 25℃时,Ksp (AgBr)= 5.0×10-10,求AgBr的饱和溶液中的c(Ag+)和c(Br-)。
② 25℃时,Ksp [Mg(OH)2]= 1.8×10-11,求Mg(OH)2的饱和溶液中的C(Mg2+)和c(OH-)
C(Mg2+)=1.65×10-4,c(OH-)=3.3×10-4
c(Ag+)=c(Br- )=2.2×10-5
随堂一练
三、溶度积常数
室温下,AgCl的溶解度是1.93×10-3g/L,求AgCl的溶度积。已知AgCl的摩尔质量为
143.3g/mol。
7
溶度积与溶解度的相互换算
饱和、平衡 1.35×10-5 1.35×10-5
②求Ksp
AgCl(s) Ag+ (aq) + Cl-(aq)
Ksp(AgCl)=c(Ag+).c(Cl-) =(1.35×10-5)2
=1.82×10-10
答:AgCl的Ksp为1.82×10-10
解:①把AgCl溶解度单位(g/L)换算成mol·L-1
s=1.93×10-3g/L÷143.3g/mol
=1.35×10-5mol·L-1
三、溶度积常数
25℃时,在1.00 L 0.03 mol/L AgNO3溶液中加入0.50 L 0.06 mol/L的CaCl2溶液,能否生成AgCl沉淀?
已知:AgCl的Ksp=1.8×10-10
c(Ag+)=(0.03 mol/L×1.00 L)÷(1.00 L+0.50 L)
=0.020 mol/L
c(Cl-)=(0.06 mol/L×2×0.50 L)÷(1.00 L+0.50 L)
=0.040 mol/L
Qc=c(Ag+)·c(Cl-)=0.020 mol/L×0.040 mol/L=8.0×10-4
8
判断能否生成沉淀
由于Qc>Ksp,所以有AgCl沉淀生成。
三、溶度积常数
9
计算某离子开始沉淀的pH值
实验测得某水样中的铁离子的浓度为6×10-6mol·L-1若要使水中的铁离子转化为沉淀,则溶液的pH值至少要控制在多少以上?[已知Fe(OH)3的Ksp为2.6×10-39]
解:设溶液中的OH-离子的浓度最少为X才能使水中的铁离子转化为沉淀。
Ksp=c(Fe3+) ·c3(OH-)=2.6×10-39 =6×10-6×X3
求得X=7.57×10-12mol·L-1=c(OH-)
c(H+)=1.32×10-3mol·L-1
pH=2.88
答:pH至少要控制在2.88以上。
课堂练习
1.下列有关AgCl沉淀的溶解平衡状态的说法中,正确的是( )
A.AgCl沉淀的生成和溶解不断进行,但速率相等
B.AgCl难溶于水,溶液中没有Ag+和Cl-
C.升高温度,AgCl的溶解度不变
D.向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解度不变
A [AgCl固体在溶液中存在溶解平衡,所以溶液中有Ag+和Cl-,B错;升高温度,AgCl溶解度增大,C错;向平衡体系中加入NaCl固体,增大了c(Cl-),溶解平衡左移,AgCl溶解度减小,D错
课堂练习
2.在0.10 mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=________ mol·L-1(Ksp[Cu(OH)2]=2.2×10-20)。若在0.1 mol·L-1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是________ mol·L-1。
课堂练习
[解析] pH=8时,c(OH-)=10-6 mol·L-1,由硫酸铜的溶度积常数可知:Ksp=2.2×10-20=10-12×c(Cu2+),得c(Cu2+)=2.2×10-8 mol·L-1;使Cu2+沉淀完全,已知c(Cu2+)=0.1 mol·L-1,根据反应关系式:Cu2+~2H+得c(H+)=0.2 mol·L-1。
[答案] 2.2×10-8 0.2
课堂总结
1、定义
2、表达式
3、特征
4、影响难溶电解质溶解平衡的因素
一
沉淀溶解平衡
二
溶度积常数
1、定义
2、影响Ksp的因素
3、Ksp的意义
感谢探究
Thanks for the inquiry
难溶电解质的沉淀溶解平衡
第
1
课
时
