高二化学人教版(2019)选择性必修一 4.1.2电解原理(28张ppt)
文档属性
| 名称 | 高二化学人教版(2019)选择性必修一 4.1.2电解原理(28张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-14 00:00:00 | ||
图片预览




文档简介
(共28张PPT)
电解原理
第四章
化学反应与电能
第一节 电解池
第2课时
Principle of electrolysis
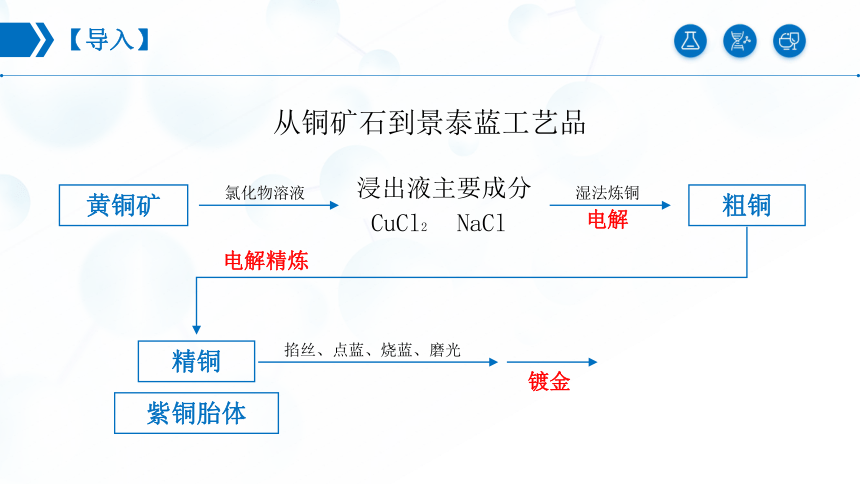
【导入】
黄铜矿
紫铜胎体
景泰蓝工艺品
从铜矿石到景泰蓝工艺品
【导入】
从铜矿石到景泰蓝工艺品
CuCl2 NaCl
黄铜矿
氯化物溶液
浸出液主要成分
湿法炼铜
电解
粗铜
电解精炼
精铜
紫铜胎体
掐丝、点蓝、烧蓝、磨光
镀金
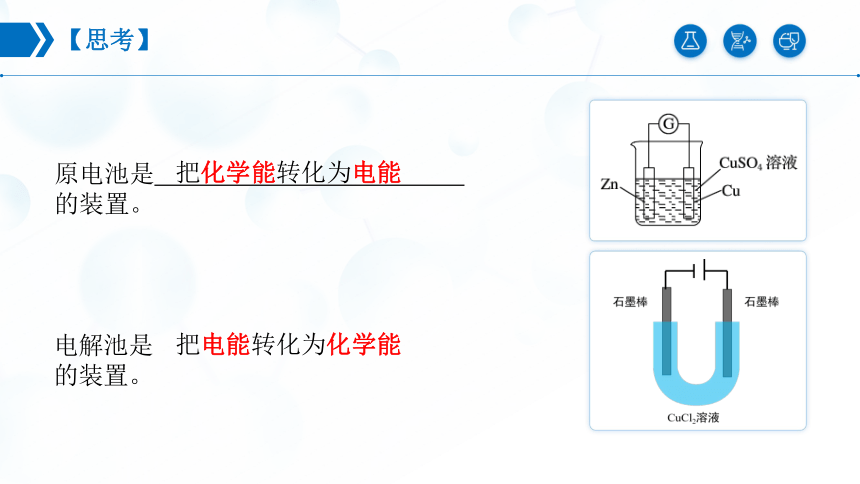
【思考】
原电池是 的装置。
把化学能转化为电能
电解池是 的装置。
把电能转化为化学能
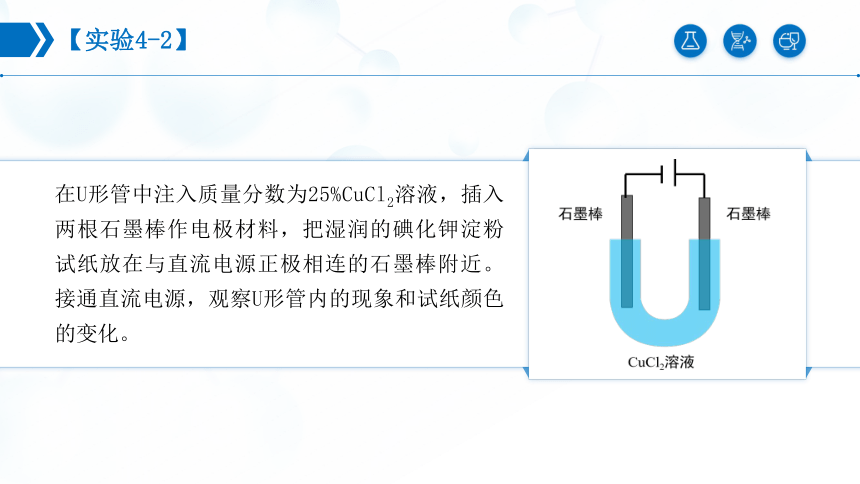
【实验4-2】
在U形管中注入质量分数为25%CuCl2溶液,插入两根石墨棒作电极材料,把湿润的碘化钾淀粉试纸放在与直流电源正极相连的石墨棒附近。接通直流电源,观察U形管内的现象和试纸颜色的变化。
【实验4-2】
通电前:分析电解质溶液中的离子情况
阳离子:H+、Cu2+
阴离子:OH-、Cl-
做无规则运动
通电后:(必须直流电)
(1)确定电极名称:
阳极(接电源正极)
阴极(接电源负极)
与电极材料无关
Ⅰ通电前
实验分析
实践探究
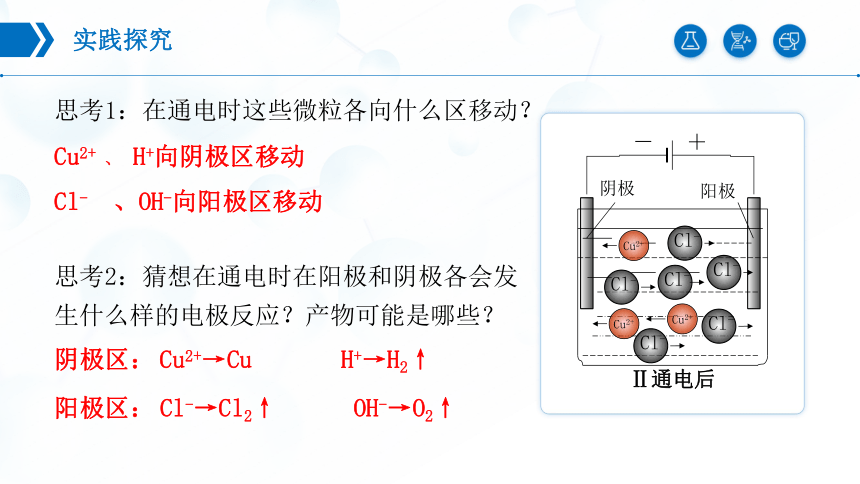
思考1:在通电时这些微粒各向什么区移动?
Cu2+ 、 H+向阴极区移动
Cl- 、OH-向阳极区移动
Cl-→Cl2↑ OH-→O2↑
阴极区:
Cu2+→Cu H+→H2↑
阳极区:
思考2:猜想在通电时在阳极和阴极各会发生什么样的电极反应?产物可能是哪些?
- +
阴极
阳极
Ⅱ通电后
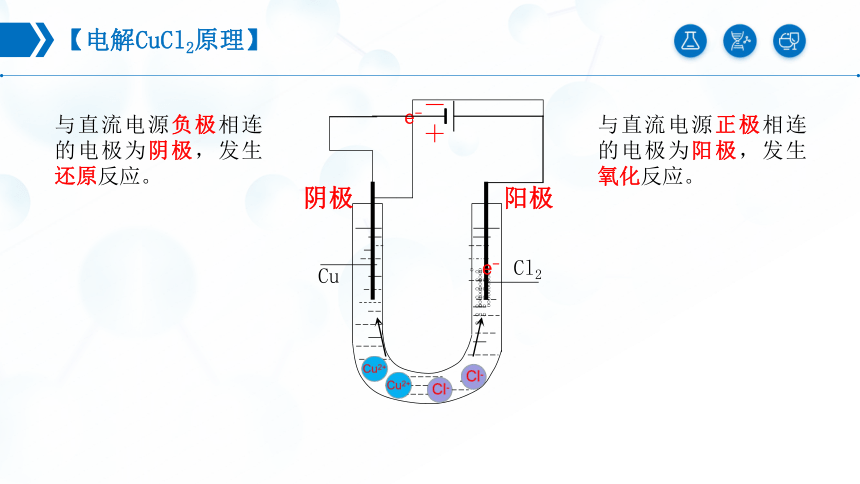
【电解CuCl2原理】
oooooooooooooooooooo
- +
阴极
阳极
Cu
Cl2
ooooooooooooooooooooooo
e-
e-
与直流电源负极相连的电极为阴极,发生还原反应。
与直流电源正极相连的电极为阳极,发生氧化反应。
Cu2+ + 2e- = Cu
(还原反应)
【电解CuCl2原理】
与直流电源负极相连的电极为阴极,发生还原反应。
与直流电源正极相连的电极为阳极,发生氧化反应。
oooooooooooooooooooo
- +
阴极
阳极
Cu
Cl2
ooooooooooooooooooooooo
e-
e-
阳离子Cu2+和H+ 向阴极移动
阴离子OH-和Cl- 向阳极移动
Cu2+在阴极放电:
总反应式:CuCl2 Cu + Cl2↑
电解
Cl- 在阳极放电:
2Cl--2e-=Cl2↑
(氧化反应)
一、电解和电解池
注意:①电流应是直流电 ②熔融态的电解质也能被电解
③电解质溶液或熔融的电解质;
④形成闭合回路。
与负极相连的为阴极,发生还原反应
与正极相连的为阳极,发生氧化反应
②阴、阳两极:
使电流通过电解质溶液(或熔融电解质)而在阳极、阴极引起氧化还原反应的过程。
1. 电 解
将电能转化为化学能的装置(也称电解槽)。
2.电解池
①外加直流电源
3.电解池的构成
一、电解和电解池
电极名称_________
反应类型_________
电极反应_________
实验现象_________
电极名称_________
反应类型_________
电极反应_________
实验现象_________
阴极
阳极
氧化
还原
氯化铜溶液
C
C
Cu2++2e-=Cu
红色固体
2Cl--2e-=Cl2↑
黄绿气体
一、电解和电解池
判断电解池的阴、阳极?
与电源正极相连
发生氧化反应
阴离子移向阳极
电子从阳极出来,流向正极
电极溶解或有O2、Cl2放出
阴极
与电源负极相连
发生还原反应
阳离子移向阴极
电子从负极出来,流向阴极
析出金属或有H2放出
思考
阳极
一、电解和电解池
电离和电解有何区别?
思考
1. 电解质溶液的导电过程,就是电解质溶液的电解过程。
2. 电解是最强的氧化还原反应手段,是不可逆的。
电解是电流通过电解质溶液在阴、阳两极引起氧化还原反应的过程。(需要通电)
电离是电解质在水中或熔融状态下,解离成自由移动离子的过程。(不需通电)
注意
随堂练习
Fe
Cu
氯化铜溶液
氯化铜溶液
C
C
A
B
Fe
Cu
盐酸溶液
分析下图,属于电解池的是( )
C
Cu
氯化铜溶液
D
C
D
二、电极材料的分类
根据电极本身是否参与反应, 分为惰性电极和活性电极:
惰性电极(C、Pt、Au):
阴极:不管是活性电极还是惰性电极都只起导电作
用,不参与反应。都是溶液中阳离子得电子。
阳极
只起导电作用,不参与反应;溶液中阴离子失电子。
活性电极(除Pt、Au外的其余金属):
活泼金属作阳极,金属失电子被氧化,
如Fe、Cu、Ag
随堂练习
下图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是( )
A、a为负极、b为正极
B、a为阳极、b为阴极
C、电解过程中,d电极质量增加
D、电解过程中,氯离子浓度不变
C
阳极 阴极
+ -
三、放电顺序
离子在电极表面得到或失去电子的过程。
离子放电顺序与哪些因素有关?
放电
在电解CuCl2溶液时,为什么是Cu2+在阴极放电,而不是H+?
为什么是Cl-在阳极放电,而不是OH-?
思考
三、放电顺序
离子放电顺序取决于离子本身性质(得失电子能力),另外也与离子的浓度及电极材料有关。
Cu2+ H+
>
Cl- OH-
>
失电子能力:(还原性)
得电子能力:(氧化性)
当溶液中有多种离子时,哪种离子先放电?
离子得失电子的能力强的先放电
三、放电顺序
1. 阴极放电顺序(阳离子得电子能力)
Al3+~ K+水溶液中不放电,熔融状态放电
Ag+>Hg2+> Fe3+> Cu2+>H+(浓度大)>Pb2+>Sn2+>Fe2+>Zn2+>
H+(浓度小) >Al3+>Mg2+>Na+ >Ca2+>K+
上述顺序基本上与金属活动顺序一致,即越活泼的金属,其阳离子越难结合电子,但Fe3+氧化性较强,排在Cu2+之前。
三、放电顺序
S2->SO32->I->Br->Cl->OH- >(含氧酸根)>F-
(1)用活性电极:金属失电子。
(2)用惰性电极:阴离子放电顺序:
2. 阳极放电顺序:
看电极材料是否参与反应:
惰性电极(只传递电子本身不失电子): 铂Pt、金Au、石墨C等
活性电极:除铂、金外的金属,如Cu、Ag、Fe等
含氧酸根、 F- 在水溶液中不放电。
四、电解池中电极反应的书写
1. 先判断电极材料
2. 找全阴、阳离子
3. 根据放电顺序写出电极反应式
4. 阴、阳两极相加得总反应式,
条件写电解
(弱电解质写化学式)
C
C
H+
OH-
四、电解池中电极反应的书写
2. 电极反应式要注意溶液的酸碱性对书写的影响;要注意两边的电荷要守恒
(电子看作负电荷)。
标明条件:通电或电解。 若电解的H+ 或OH- 来自于H2O,在方程式中要
以H2O形式存在,不能书写H+或OH-作为反应物。
电解反应是一个氧化还原反应,是被外界强迫发生的反应,所以:弱氧化剂
+弱还原剂 = 强氧化剂+强还原剂的反应形式也很常见。
首先看阳极材料,若阳极是活性电极阳极本身失去电子被氧化,若阳极是惰性电极,阴离子在阳极放电。
小结
(包括水的电离,并分成 阳离子组和阴离子组)
②明确溶液中存在哪些离子
③判断阴阳离子的放电顺序
④根据阳极氧化,阴极还原完成电极反应式
书写电极反应式及总方程式的方法
①判断电极材料
(注意得失 电子守恒)
⑤由阴阳两电极反应式,合并得总反应式
(弱电解质的须保持分子形式)
【练一练】
1. 判断正误
(1) 电解是把化学能转化为电能( )
(2) 电解质溶液导电一定发生化学反应( )
(3) 某些不能自发进行的氧化还原反应,通过电解可以实现( )
(4) 任何溶液被电解时,必须导致氧化还原反应的发生( )
(5) 电解、电离均需要通电才能实现( )
(6) 电解质溶液的导电过程就是该溶液的电解过程( )
×
√
√
√
×
√
【练一练】
2. 如图是电解熔融NaCl制备金属钠的装置示意图,下列有关判断正
确的是( )
A. 通过该装置可以将化学能转化为电能
B. 石墨电极为正极
C. Na+在铁电极上得到电子被还原为钠单质
D. 电流从负极流出,流入铁电极
C
【练一练】
3. 工业制镁是采用电解熔融氯化镁的方法。试分析电解熔融MgCl2
的原理,写出有关的电极反应式及总反应方程式。
电极反应式
阳极: ;
阴极: 。
2Cl--2e-===Cl2↑
Mg2++2e-===Mg
电解方程式: 。
MgCl2(熔融) Mg+Cl2↑
电解
课堂总结
CLASS SUMMARY
1. 电解
4. 电极反应式的书写
2. 电解池(电解槽)
3. 电解池构成条件
第四章
化学反应与电能
第一节 原电池
第2课时
感谢您的观看
THANKS FOR WATCHING
电解原理
第四章
化学反应与电能
第一节 电解池
第2课时
Principle of electrolysis
【导入】
黄铜矿
紫铜胎体
景泰蓝工艺品
从铜矿石到景泰蓝工艺品
【导入】
从铜矿石到景泰蓝工艺品
CuCl2 NaCl
黄铜矿
氯化物溶液
浸出液主要成分
湿法炼铜
电解
粗铜
电解精炼
精铜
紫铜胎体
掐丝、点蓝、烧蓝、磨光
镀金
【思考】
原电池是 的装置。
把化学能转化为电能
电解池是 的装置。
把电能转化为化学能
【实验4-2】
在U形管中注入质量分数为25%CuCl2溶液,插入两根石墨棒作电极材料,把湿润的碘化钾淀粉试纸放在与直流电源正极相连的石墨棒附近。接通直流电源,观察U形管内的现象和试纸颜色的变化。
【实验4-2】
通电前:分析电解质溶液中的离子情况
阳离子:H+、Cu2+
阴离子:OH-、Cl-
做无规则运动
通电后:(必须直流电)
(1)确定电极名称:
阳极(接电源正极)
阴极(接电源负极)
与电极材料无关
Ⅰ通电前
实验分析
实践探究
思考1:在通电时这些微粒各向什么区移动?
Cu2+ 、 H+向阴极区移动
Cl- 、OH-向阳极区移动
Cl-→Cl2↑ OH-→O2↑
阴极区:
Cu2+→Cu H+→H2↑
阳极区:
思考2:猜想在通电时在阳极和阴极各会发生什么样的电极反应?产物可能是哪些?
- +
阴极
阳极
Ⅱ通电后
【电解CuCl2原理】
oooooooooooooooooooo
- +
阴极
阳极
Cu
Cl2
ooooooooooooooooooooooo
e-
e-
与直流电源负极相连的电极为阴极,发生还原反应。
与直流电源正极相连的电极为阳极,发生氧化反应。
Cu2+ + 2e- = Cu
(还原反应)
【电解CuCl2原理】
与直流电源负极相连的电极为阴极,发生还原反应。
与直流电源正极相连的电极为阳极,发生氧化反应。
oooooooooooooooooooo
- +
阴极
阳极
Cu
Cl2
ooooooooooooooooooooooo
e-
e-
阳离子Cu2+和H+ 向阴极移动
阴离子OH-和Cl- 向阳极移动
Cu2+在阴极放电:
总反应式:CuCl2 Cu + Cl2↑
电解
Cl- 在阳极放电:
2Cl--2e-=Cl2↑
(氧化反应)
一、电解和电解池
注意:①电流应是直流电 ②熔融态的电解质也能被电解
③电解质溶液或熔融的电解质;
④形成闭合回路。
与负极相连的为阴极,发生还原反应
与正极相连的为阳极,发生氧化反应
②阴、阳两极:
使电流通过电解质溶液(或熔融电解质)而在阳极、阴极引起氧化还原反应的过程。
1. 电 解
将电能转化为化学能的装置(也称电解槽)。
2.电解池
①外加直流电源
3.电解池的构成
一、电解和电解池
电极名称_________
反应类型_________
电极反应_________
实验现象_________
电极名称_________
反应类型_________
电极反应_________
实验现象_________
阴极
阳极
氧化
还原
氯化铜溶液
C
C
Cu2++2e-=Cu
红色固体
2Cl--2e-=Cl2↑
黄绿气体
一、电解和电解池
判断电解池的阴、阳极?
与电源正极相连
发生氧化反应
阴离子移向阳极
电子从阳极出来,流向正极
电极溶解或有O2、Cl2放出
阴极
与电源负极相连
发生还原反应
阳离子移向阴极
电子从负极出来,流向阴极
析出金属或有H2放出
思考
阳极
一、电解和电解池
电离和电解有何区别?
思考
1. 电解质溶液的导电过程,就是电解质溶液的电解过程。
2. 电解是最强的氧化还原反应手段,是不可逆的。
电解是电流通过电解质溶液在阴、阳两极引起氧化还原反应的过程。(需要通电)
电离是电解质在水中或熔融状态下,解离成自由移动离子的过程。(不需通电)
注意
随堂练习
Fe
Cu
氯化铜溶液
氯化铜溶液
C
C
A
B
Fe
Cu
盐酸溶液
分析下图,属于电解池的是( )
C
Cu
氯化铜溶液
D
C
D
二、电极材料的分类
根据电极本身是否参与反应, 分为惰性电极和活性电极:
惰性电极(C、Pt、Au):
阴极:不管是活性电极还是惰性电极都只起导电作
用,不参与反应。都是溶液中阳离子得电子。
阳极
只起导电作用,不参与反应;溶液中阴离子失电子。
活性电极(除Pt、Au外的其余金属):
活泼金属作阳极,金属失电子被氧化,
如Fe、Cu、Ag
随堂练习
下图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是( )
A、a为负极、b为正极
B、a为阳极、b为阴极
C、电解过程中,d电极质量增加
D、电解过程中,氯离子浓度不变
C
阳极 阴极
+ -
三、放电顺序
离子在电极表面得到或失去电子的过程。
离子放电顺序与哪些因素有关?
放电
在电解CuCl2溶液时,为什么是Cu2+在阴极放电,而不是H+?
为什么是Cl-在阳极放电,而不是OH-?
思考
三、放电顺序
离子放电顺序取决于离子本身性质(得失电子能力),另外也与离子的浓度及电极材料有关。
Cu2+ H+
>
Cl- OH-
>
失电子能力:(还原性)
得电子能力:(氧化性)
当溶液中有多种离子时,哪种离子先放电?
离子得失电子的能力强的先放电
三、放电顺序
1. 阴极放电顺序(阳离子得电子能力)
Al3+~ K+水溶液中不放电,熔融状态放电
Ag+>Hg2+> Fe3+> Cu2+>H+(浓度大)>Pb2+>Sn2+>Fe2+>Zn2+>
H+(浓度小) >Al3+>Mg2+>Na+ >Ca2+>K+
上述顺序基本上与金属活动顺序一致,即越活泼的金属,其阳离子越难结合电子,但Fe3+氧化性较强,排在Cu2+之前。
三、放电顺序
S2->SO32->I->Br->Cl->OH- >(含氧酸根)>F-
(1)用活性电极:金属失电子。
(2)用惰性电极:阴离子放电顺序:
2. 阳极放电顺序:
看电极材料是否参与反应:
惰性电极(只传递电子本身不失电子): 铂Pt、金Au、石墨C等
活性电极:除铂、金外的金属,如Cu、Ag、Fe等
含氧酸根、 F- 在水溶液中不放电。
四、电解池中电极反应的书写
1. 先判断电极材料
2. 找全阴、阳离子
3. 根据放电顺序写出电极反应式
4. 阴、阳两极相加得总反应式,
条件写电解
(弱电解质写化学式)
C
C
H+
OH-
四、电解池中电极反应的书写
2. 电极反应式要注意溶液的酸碱性对书写的影响;要注意两边的电荷要守恒
(电子看作负电荷)。
标明条件:通电或电解。 若电解的H+ 或OH- 来自于H2O,在方程式中要
以H2O形式存在,不能书写H+或OH-作为反应物。
电解反应是一个氧化还原反应,是被外界强迫发生的反应,所以:弱氧化剂
+弱还原剂 = 强氧化剂+强还原剂的反应形式也很常见。
首先看阳极材料,若阳极是活性电极阳极本身失去电子被氧化,若阳极是惰性电极,阴离子在阳极放电。
小结
(包括水的电离,并分成 阳离子组和阴离子组)
②明确溶液中存在哪些离子
③判断阴阳离子的放电顺序
④根据阳极氧化,阴极还原完成电极反应式
书写电极反应式及总方程式的方法
①判断电极材料
(注意得失 电子守恒)
⑤由阴阳两电极反应式,合并得总反应式
(弱电解质的须保持分子形式)
【练一练】
1. 判断正误
(1) 电解是把化学能转化为电能( )
(2) 电解质溶液导电一定发生化学反应( )
(3) 某些不能自发进行的氧化还原反应,通过电解可以实现( )
(4) 任何溶液被电解时,必须导致氧化还原反应的发生( )
(5) 电解、电离均需要通电才能实现( )
(6) 电解质溶液的导电过程就是该溶液的电解过程( )
×
√
√
√
×
√
【练一练】
2. 如图是电解熔融NaCl制备金属钠的装置示意图,下列有关判断正
确的是( )
A. 通过该装置可以将化学能转化为电能
B. 石墨电极为正极
C. Na+在铁电极上得到电子被还原为钠单质
D. 电流从负极流出,流入铁电极
C
【练一练】
3. 工业制镁是采用电解熔融氯化镁的方法。试分析电解熔融MgCl2
的原理,写出有关的电极反应式及总反应方程式。
电极反应式
阳极: ;
阴极: 。
2Cl--2e-===Cl2↑
Mg2++2e-===Mg
电解方程式: 。
MgCl2(熔融) Mg+Cl2↑
电解
课堂总结
CLASS SUMMARY
1. 电解
4. 电极反应式的书写
2. 电解池(电解槽)
3. 电解池构成条件
第四章
化学反应与电能
第一节 原电池
第2课时
感谢您的观看
THANKS FOR WATCHING
