高一化学人教版(2019)选择性必修一 2.4化学反应的调控(34张)
文档属性
| 名称 | 高一化学人教版(2019)选择性必修一 2.4化学反应的调控(34张) |  | |
| 格式 | pptx | ||
| 文件大小 | 55.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-15 10:23:23 | ||
图片预览










文档简介
(共34张PPT)
化学反应的调控
第二章
化学反应速率与化学平衡
第四节
Regulation of chemical reactions
选择性必修一
引入
18世纪末,英国化学家克鲁克斯“先天下之忧而忧”,率先发出为了使子孙后代免于饥饿“向空气要氮肥”的号召。
化学创造了第二个大自然!
引入
工业合成氨是人类科学技术的一项重大突破,其反应如下:
N2(g)+3H2(g) 2NH3(g) ΔH= 92.4 kJ mol 1
化学反应的调控
核心素养发展目标
变化观念与平衡思想:知道如何应用化学反应速率和化学平衡分析合成氨的适宜条件,体会应用化学原理分析化工生产条件的思路和方法。
科学态度与社会责任:认识化学反应速率和化学平衡的调控在工业生产中的
重要应用,探索最适宜的化工生产条件。
一、工业合成氨
1. 合成氨反应及其特点
N2(g)+3H2(g) 2NH3(g) ΔH= 92.4 kJ mol 1
正反应是气体分子数减小的反应。
根据ΔH= 92.4 kJ mol 1可知,正反应是放热反应。
合成氨反应是可逆反应。
反应
特点
1
2
3
对合成氨反应
的影响
增大合成氨的
反应速率
提高平衡混合物中氨的含量
影响因素
浓度
温度
压强
催化剂
一、工业合成氨
增大
升高
增大
降低
增大
增大
使用
无影响
2. 工业合成氨生成条件的选择
思考与讨论
(1) 原理分析
根据合成氨反应的特点,应如何先择反应条件,以增大合成氨的反应速率、提高平衡混合物中氨的含量?请填入下表。
一、工业合成氨
2. 工业合成氨生成条件的选择
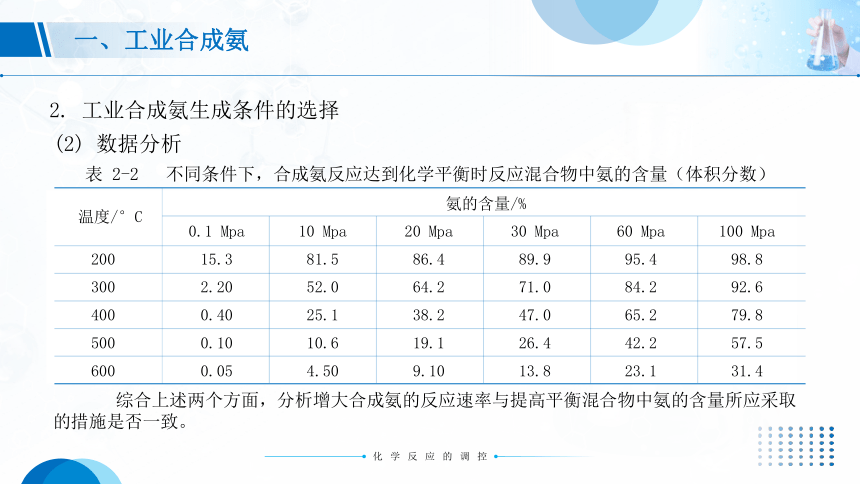
(2) 数据分析
温度/°C
表 2-2 不同条件下,合成氨反应达到化学平衡时反应混合物中氨的含量(体积分数)
综合上述两个方面,分析增大合成氨的反应速率与提高平衡混合物中氨的含量所应采取的措施是否一致。
氨的含量/%
0.1 Mpa
10 Mpa
20 Mpa
30 Mpa
60 Mpa
100 Mpa
15.3
81.5
86.4
89.9
95.4
98.8
2.20
52.0
64.2
71.0
84.2
92.6
0.40
25.1
38.2
47.0
65.2
79.8
0.10
10.6
19.1
26.4
42.2
57.5
0.05
4.50
9.10
13.8
23.1
31.4
200
300
400
500
600
一、工业合成氨
①升高温度,氨的含量降低。这与反应速率是矛盾的;
②增大压强,氨的含量增大。这与反应速率是一致的。
那么实际生成中到底选择哪些适宜的条件呢?
结论分析
一、工业合成氨
【交流·研讨】
工业合成氨时主要考虑的因素?
(3)便宜
(4)绿色
(2)快
(1)多
即提高平衡混合物里氨的含量。
——化学平衡问题
即提高单位时间里氨的产量。
——化学反应速率问题
降低成本,提高原料利用率。
保护环境,对设备的要求。
一、工业合成氨
(3)合成氨实际生成选择
压强
原理分析表明,合成氨时压强越大越好;但压强大,对材料的强度和设备的制造要求就越高,需要的动力也越大,这将会大大增加生产投资,并可能降低综合经济效益。
目前,一般采用的压强为10 MPa~30 MPa。
2. 工业合成氨生成条件的选择
0
20
40
60
80
20
40
60
80
100
压强/Mpa
图2-11 400°C下平衡时氨的体积分数随压强的变化示意图
NH3的体积分数/%
一、工业合成氨
(3)合成氨实际生成选择
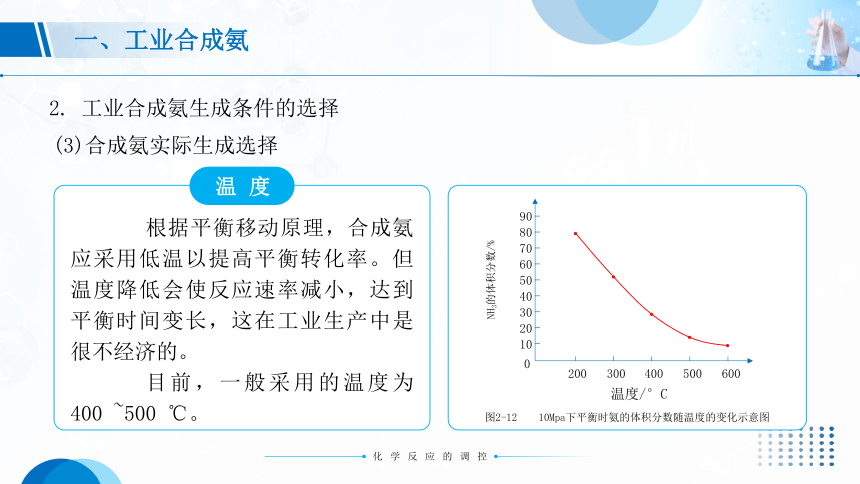
温度
根据平衡移动原理,合成氨应采用低温以提高平衡转化率。但温度降低会使反应速率减小,达到平衡时间变长,这在工业生产中是很不经济的。
目前,一般采用的温度为400 ~500 ℃。
2. 工业合成氨生成条件的选择
0
10
20
60
80
200
300
400
500
600
温度/°C
图2-12 10Mpa下平衡时氨的体积分数随温度的变化示意图
NH3的体积分数/%
30
40
50
70
90
一、工业合成氨
(3)合成氨实际生成选择
催化剂
使用催化剂能改变反应历程,降低反应活化能,使反应物在较低温度时能较快地进行反应。目前合成氨工业中普遍使用的是铁触媒。铁触媒在500℃左右时活性最大,这也是合成氨一般选择400 ~500 ℃进行的重要原因。
2. 工业合成氨生成条件的选择
一、工业合成氨
(3)合成氨实际生成选择
浓度
为提高平衡转化率,工业上采取迅速冷却的方法,使氨气变成液氨并及时分离,分离后的原料气N2和H2,并及时补充循环使用,使反应物保持一定的浓度。
2. 工业合成氨生成条件的选择
一、工业合成氨
2. 工业合成氨生成条件的选择
外界 条件 有利于增大反应速率 的条件控制 有利于平衡正向移动 的条件控制 综合分析结果
浓度 增大反应物的浓度 增大反应物的浓度、减小生成物的浓度 不断地补充反应物、及时地分离出生成物
催化剂 加合适的催化剂 不需要 加合适的催化剂
一、工业合成氨
2. 工业合成氨生成条件的选择
外界 条件 有利于增大反应 速率的条件控制 有利于平衡正向 移动的条件控制 综合分析结果
温度 高温 ΔH<0 低温 兼顾速率和平衡,考虑催化剂的
适宜温度
ΔH>0 高温 在设备条件允许的前提下,尽量
采取高温并考虑催化剂的活性
压强 高压(有气体参加) 反应后气体体积减小的反应 高压 在设备条件允许的前提下,尽量
采取高压
反应后气体体积增大的反应 低压 兼顾速率和平衡,选取适宜的压强
一、工业合成氨
综上可知, 要使合成氨的化学反应具有理想的反应速率和反应物的平衡转化率, 应掌握合成氨化学反应本身的特点, 运用化学反应速率和化学平衡原理, 同时考虑合成氨生产中的动力、材料、设备等因素, 综合确定合成氨的条件。
当前, 从所用催化剂的活性对温度的要求、工业生产对化学反应的速率与限度的要求、制作生产设备的材料性能和技术水平、追求生产投入与产品的最大正效益等实际情况来看,400~500 ℃的温度、10~30 MPa的压强和铁触媒的组合是合成氨的最佳条件。
一、工业合成氨
工业合成氨适宜条件
外部条件 工业合成氨的适宜条件
压强 根据反应器可使用的钢材质量及综合指标来选择压强(10~30 MPa)
温度 适宜温度,400~500 ℃
催化剂 使用铁触媒做催化剂
浓度 N2和H2的物质的量之比为1∶2.8的投料比,氨及时从混合气中分离出去
一、工业合成氨
工业上利用某可逆反应生产产品:
一般要使用催化剂:这样可以大大加快化学反应速率,提高生产效率,也提高了经济效益;
选择合适的温度:该温度是催化剂活性最大的温度;
选择合适的压强:既要考虑化学反应速率和化学平衡,还要考虑动力、材料、设备等。
【小结·反思】
二、工业合成氨的生产流程
1. 生产流程
二、工业合成氨的生产流程
2. 合成氨流程简图
合 成 塔
氨 分 离 器
液氨
水 冷 器
循环气体
压缩机
循环压缩机
氢氮混合气
(1)原料气干燥、净化:除去原料气中的水蒸气及其他气体杂质,防止
与催化剂接触时,导致催化剂“中毒”而降低或丧失催化活性
(2)压缩机加压:增大压强
(3)热交换:合成氨反应为放热反应,反应体系温度逐渐升高,为原料
气反应提供热量,故热交换可充分利用能源,提高经济效益。
3. 合成氨流程分析
二、工业合成氨的生产流程
3. 合成氨流程分析
(4)冷却:生成物NH3的液化需较低温度采取迅速冷却的方法,可使气
态氨变成液氨后及时从平衡混合物中分离出来,以促使平衡向生成
NH3的方向移动。
(5)循环使用原料气:因合成氨反应为可逆反应,平衡混合物中含有原
料气,将NH3分离后的原料气循环利用,并及时补充N2和H2,使反
应物保持一定的浓度,以利于合成氨反应,提高经济效益。
二、工业合成氨的生产流程
三、化学反应的调控
含义
通过改变反应条件使一个可能发生的反应按照某一方向进行。
考虑实际因素
结合设备条件、安全操作、经济成本等情况,综合考虑影响化学反应速率和
化学平衡的因素,寻找合适的生产条件。
根据环境保护及社会效益等方面的规定和要求做出分析,权衡利弊,才能实
施生产。
三、化学反应的调控
小结
化学反应的调控
明确目的
可行性
确定
反应
原理分析
实验摸索
找条件
化学平衡
设备可行
成本核算
如何为一个化学反应选择适宜的生产条件?
反应速率
课堂练习
在合成氨时,要使氨的产率增大,又要使化学反应速率增大,可
以采取的措施有( )
①增大体积使压强减小 ②减小体积使压强增大 ③升高温度 ④降低温度 ⑤恒温恒容,再充入N2和H2 ⑥恒温恒压,再充入N2和H2 ⑦及时分离产生的NH3 ⑧使用催化剂
A. ②④⑤⑦
B. ②③④⑤⑦⑧
C. ②⑤
D. ②③⑤⑧
C
课堂练习
在合成氨工业中,为增加NH3的日产量,实施下列措施的变化过
程中与平衡移动无关的是( )
A.不断将氨分离出来
B.使用催化剂
C.采用700 K左右的高温而不是900 K的高温
D.采用2×107 Pa~5×107 Pa的压强
B
课堂练习
D
3. 下列事实能用勒夏特列原理解释的是( )
A.使用铁触媒,使N2和H2混合气体有利于合成氨
B.由H2(g)、I2(g)和HI(g)组成的平衡体系加压后颜色变深
C.500 ℃左右比室温更有利于合成氨的反应
D.将混合气体中的氨液化有利于合成氨反应
解析 A、B两项,改变条件平衡均不移动,不能用勒夏特列原理解释;C项,根据勒夏特列原理,温度越低,NH3的转化率越高,采取500 ℃左右,主要考虑催化剂的活性和反应速率问题;D项,将混合气体中的氨液化,相当于减小了生成物的浓度,平衡正向移动,有利于合成氨反应。
课堂练习
4. 合成氨工业的原料气中含有少量CO,CO会使催化剂失去催化能力(催化剂中
毒),因此,在进入合成塔前必须将其除去。一般用醋酸二氨合铜溶液来吸收
原料气中的CO,其反应为:
Cu(NH3)2Ac(aq)+CO(g)+NH3(g) [Cu(NH3)3CO]Ac(aq)
(正反应为放热反应)。
(1)醋酸二氨合铜吸收CO的生产适宜条件是 。
(2)吸收CO后的醋酸铜氨溶液经过处理后可再生,恢复其吸收CO的能力以供
循环使用,醋酸铜氨溶液再生的生产适宜条件是 。
课堂练习
解析:(1)醋酸二氨合铜吸收CO的反应为气体体积减小的放热反应,降低温度或增大压强,平衡向吸收CO的方向移动,故应采用低温、高压作为生产条件。
(2)放出CO的反应正好和吸收CO的反应相反,应采用高温、低压作为生产条件。
答案:(1)低温、高压 (2)高温、低压
课堂练习
5. 在硫酸工业中,通过下列反应使SO2 氧化为SO3:
2SO2(g)+O2(g) 2SO3(g) ΔH<0。下表列出了在不同温度和
压强下,反应达到平衡时SO2转化率的统计数据:
温度 不同压强下SO2的转化率/% 0.1 MPa 0.5 MPa 1 MPa 5 MPa 10 MPa
450 ℃ 97.5 98.9 99.2 99.6 99.7
550 ℃ 85.6 92.9 94.9 97.7 98.3
课堂练习
从理论上分析,使SO2尽可能多、尽可能快地转化为SO3,应选择的
条件是什么?
(2) 在实际生产中,选定450 ℃,其原因是什么?
(3) 在实际生产中,采用的压强为常压,其原因是什么?
(4) 在实际生产中,通入过量的空气,其原因是什么?
(5) 尾气中的SO2必须回收,其原因是什么?
课堂练习
提示:
(1)低温、高压。
(2) 该反应是放热反应,升高温度,转化率降低;此温度下催化剂的活性
最高。
(3)0.1 MPa(常压)下SO2的转化率已经很高,若采用较大的压强,不仅SO2的转化率提高很少,且需要更大动力,对设备的要求更高,增加成本。
(4)增大O2浓度,提高SO2的转化率。
(5)SO2有毒,防止污染环境。
课堂小结
CLASS SUMMARY
第二章
化学反应速率与化学平衡
选择性必修一
感谢您的观看
THANKS FOR WATCHING
化学反应的调控
第二章
化学反应速率与化学平衡
第四节
Regulation of chemical reactions
选择性必修一
引入
18世纪末,英国化学家克鲁克斯“先天下之忧而忧”,率先发出为了使子孙后代免于饥饿“向空气要氮肥”的号召。
化学创造了第二个大自然!
引入
工业合成氨是人类科学技术的一项重大突破,其反应如下:
N2(g)+3H2(g) 2NH3(g) ΔH= 92.4 kJ mol 1
化学反应的调控
核心素养发展目标
变化观念与平衡思想:知道如何应用化学反应速率和化学平衡分析合成氨的适宜条件,体会应用化学原理分析化工生产条件的思路和方法。
科学态度与社会责任:认识化学反应速率和化学平衡的调控在工业生产中的
重要应用,探索最适宜的化工生产条件。
一、工业合成氨
1. 合成氨反应及其特点
N2(g)+3H2(g) 2NH3(g) ΔH= 92.4 kJ mol 1
正反应是气体分子数减小的反应。
根据ΔH= 92.4 kJ mol 1可知,正反应是放热反应。
合成氨反应是可逆反应。
反应
特点
1
2
3
对合成氨反应
的影响
增大合成氨的
反应速率
提高平衡混合物中氨的含量
影响因素
浓度
温度
压强
催化剂
一、工业合成氨
增大
升高
增大
降低
增大
增大
使用
无影响
2. 工业合成氨生成条件的选择
思考与讨论
(1) 原理分析
根据合成氨反应的特点,应如何先择反应条件,以增大合成氨的反应速率、提高平衡混合物中氨的含量?请填入下表。
一、工业合成氨
2. 工业合成氨生成条件的选择
(2) 数据分析
温度/°C
表 2-2 不同条件下,合成氨反应达到化学平衡时反应混合物中氨的含量(体积分数)
综合上述两个方面,分析增大合成氨的反应速率与提高平衡混合物中氨的含量所应采取的措施是否一致。
氨的含量/%
0.1 Mpa
10 Mpa
20 Mpa
30 Mpa
60 Mpa
100 Mpa
15.3
81.5
86.4
89.9
95.4
98.8
2.20
52.0
64.2
71.0
84.2
92.6
0.40
25.1
38.2
47.0
65.2
79.8
0.10
10.6
19.1
26.4
42.2
57.5
0.05
4.50
9.10
13.8
23.1
31.4
200
300
400
500
600
一、工业合成氨
①升高温度,氨的含量降低。这与反应速率是矛盾的;
②增大压强,氨的含量增大。这与反应速率是一致的。
那么实际生成中到底选择哪些适宜的条件呢?
结论分析
一、工业合成氨
【交流·研讨】
工业合成氨时主要考虑的因素?
(3)便宜
(4)绿色
(2)快
(1)多
即提高平衡混合物里氨的含量。
——化学平衡问题
即提高单位时间里氨的产量。
——化学反应速率问题
降低成本,提高原料利用率。
保护环境,对设备的要求。
一、工业合成氨
(3)合成氨实际生成选择
压强
原理分析表明,合成氨时压强越大越好;但压强大,对材料的强度和设备的制造要求就越高,需要的动力也越大,这将会大大增加生产投资,并可能降低综合经济效益。
目前,一般采用的压强为10 MPa~30 MPa。
2. 工业合成氨生成条件的选择
0
20
40
60
80
20
40
60
80
100
压强/Mpa
图2-11 400°C下平衡时氨的体积分数随压强的变化示意图
NH3的体积分数/%
一、工业合成氨
(3)合成氨实际生成选择
温度
根据平衡移动原理,合成氨应采用低温以提高平衡转化率。但温度降低会使反应速率减小,达到平衡时间变长,这在工业生产中是很不经济的。
目前,一般采用的温度为400 ~500 ℃。
2. 工业合成氨生成条件的选择
0
10
20
60
80
200
300
400
500
600
温度/°C
图2-12 10Mpa下平衡时氨的体积分数随温度的变化示意图
NH3的体积分数/%
30
40
50
70
90
一、工业合成氨
(3)合成氨实际生成选择
催化剂
使用催化剂能改变反应历程,降低反应活化能,使反应物在较低温度时能较快地进行反应。目前合成氨工业中普遍使用的是铁触媒。铁触媒在500℃左右时活性最大,这也是合成氨一般选择400 ~500 ℃进行的重要原因。
2. 工业合成氨生成条件的选择
一、工业合成氨
(3)合成氨实际生成选择
浓度
为提高平衡转化率,工业上采取迅速冷却的方法,使氨气变成液氨并及时分离,分离后的原料气N2和H2,并及时补充循环使用,使反应物保持一定的浓度。
2. 工业合成氨生成条件的选择
一、工业合成氨
2. 工业合成氨生成条件的选择
外界 条件 有利于增大反应速率 的条件控制 有利于平衡正向移动 的条件控制 综合分析结果
浓度 增大反应物的浓度 增大反应物的浓度、减小生成物的浓度 不断地补充反应物、及时地分离出生成物
催化剂 加合适的催化剂 不需要 加合适的催化剂
一、工业合成氨
2. 工业合成氨生成条件的选择
外界 条件 有利于增大反应 速率的条件控制 有利于平衡正向 移动的条件控制 综合分析结果
温度 高温 ΔH<0 低温 兼顾速率和平衡,考虑催化剂的
适宜温度
ΔH>0 高温 在设备条件允许的前提下,尽量
采取高温并考虑催化剂的活性
压强 高压(有气体参加) 反应后气体体积减小的反应 高压 在设备条件允许的前提下,尽量
采取高压
反应后气体体积增大的反应 低压 兼顾速率和平衡,选取适宜的压强
一、工业合成氨
综上可知, 要使合成氨的化学反应具有理想的反应速率和反应物的平衡转化率, 应掌握合成氨化学反应本身的特点, 运用化学反应速率和化学平衡原理, 同时考虑合成氨生产中的动力、材料、设备等因素, 综合确定合成氨的条件。
当前, 从所用催化剂的活性对温度的要求、工业生产对化学反应的速率与限度的要求、制作生产设备的材料性能和技术水平、追求生产投入与产品的最大正效益等实际情况来看,400~500 ℃的温度、10~30 MPa的压强和铁触媒的组合是合成氨的最佳条件。
一、工业合成氨
工业合成氨适宜条件
外部条件 工业合成氨的适宜条件
压强 根据反应器可使用的钢材质量及综合指标来选择压强(10~30 MPa)
温度 适宜温度,400~500 ℃
催化剂 使用铁触媒做催化剂
浓度 N2和H2的物质的量之比为1∶2.8的投料比,氨及时从混合气中分离出去
一、工业合成氨
工业上利用某可逆反应生产产品:
一般要使用催化剂:这样可以大大加快化学反应速率,提高生产效率,也提高了经济效益;
选择合适的温度:该温度是催化剂活性最大的温度;
选择合适的压强:既要考虑化学反应速率和化学平衡,还要考虑动力、材料、设备等。
【小结·反思】
二、工业合成氨的生产流程
1. 生产流程
二、工业合成氨的生产流程
2. 合成氨流程简图
合 成 塔
氨 分 离 器
液氨
水 冷 器
循环气体
压缩机
循环压缩机
氢氮混合气
(1)原料气干燥、净化:除去原料气中的水蒸气及其他气体杂质,防止
与催化剂接触时,导致催化剂“中毒”而降低或丧失催化活性
(2)压缩机加压:增大压强
(3)热交换:合成氨反应为放热反应,反应体系温度逐渐升高,为原料
气反应提供热量,故热交换可充分利用能源,提高经济效益。
3. 合成氨流程分析
二、工业合成氨的生产流程
3. 合成氨流程分析
(4)冷却:生成物NH3的液化需较低温度采取迅速冷却的方法,可使气
态氨变成液氨后及时从平衡混合物中分离出来,以促使平衡向生成
NH3的方向移动。
(5)循环使用原料气:因合成氨反应为可逆反应,平衡混合物中含有原
料气,将NH3分离后的原料气循环利用,并及时补充N2和H2,使反
应物保持一定的浓度,以利于合成氨反应,提高经济效益。
二、工业合成氨的生产流程
三、化学反应的调控
含义
通过改变反应条件使一个可能发生的反应按照某一方向进行。
考虑实际因素
结合设备条件、安全操作、经济成本等情况,综合考虑影响化学反应速率和
化学平衡的因素,寻找合适的生产条件。
根据环境保护及社会效益等方面的规定和要求做出分析,权衡利弊,才能实
施生产。
三、化学反应的调控
小结
化学反应的调控
明确目的
可行性
确定
反应
原理分析
实验摸索
找条件
化学平衡
设备可行
成本核算
如何为一个化学反应选择适宜的生产条件?
反应速率
课堂练习
在合成氨时,要使氨的产率增大,又要使化学反应速率增大,可
以采取的措施有( )
①增大体积使压强减小 ②减小体积使压强增大 ③升高温度 ④降低温度 ⑤恒温恒容,再充入N2和H2 ⑥恒温恒压,再充入N2和H2 ⑦及时分离产生的NH3 ⑧使用催化剂
A. ②④⑤⑦
B. ②③④⑤⑦⑧
C. ②⑤
D. ②③⑤⑧
C
课堂练习
在合成氨工业中,为增加NH3的日产量,实施下列措施的变化过
程中与平衡移动无关的是( )
A.不断将氨分离出来
B.使用催化剂
C.采用700 K左右的高温而不是900 K的高温
D.采用2×107 Pa~5×107 Pa的压强
B
课堂练习
D
3. 下列事实能用勒夏特列原理解释的是( )
A.使用铁触媒,使N2和H2混合气体有利于合成氨
B.由H2(g)、I2(g)和HI(g)组成的平衡体系加压后颜色变深
C.500 ℃左右比室温更有利于合成氨的反应
D.将混合气体中的氨液化有利于合成氨反应
解析 A、B两项,改变条件平衡均不移动,不能用勒夏特列原理解释;C项,根据勒夏特列原理,温度越低,NH3的转化率越高,采取500 ℃左右,主要考虑催化剂的活性和反应速率问题;D项,将混合气体中的氨液化,相当于减小了生成物的浓度,平衡正向移动,有利于合成氨反应。
课堂练习
4. 合成氨工业的原料气中含有少量CO,CO会使催化剂失去催化能力(催化剂中
毒),因此,在进入合成塔前必须将其除去。一般用醋酸二氨合铜溶液来吸收
原料气中的CO,其反应为:
Cu(NH3)2Ac(aq)+CO(g)+NH3(g) [Cu(NH3)3CO]Ac(aq)
(正反应为放热反应)。
(1)醋酸二氨合铜吸收CO的生产适宜条件是 。
(2)吸收CO后的醋酸铜氨溶液经过处理后可再生,恢复其吸收CO的能力以供
循环使用,醋酸铜氨溶液再生的生产适宜条件是 。
课堂练习
解析:(1)醋酸二氨合铜吸收CO的反应为气体体积减小的放热反应,降低温度或增大压强,平衡向吸收CO的方向移动,故应采用低温、高压作为生产条件。
(2)放出CO的反应正好和吸收CO的反应相反,应采用高温、低压作为生产条件。
答案:(1)低温、高压 (2)高温、低压
课堂练习
5. 在硫酸工业中,通过下列反应使SO2 氧化为SO3:
2SO2(g)+O2(g) 2SO3(g) ΔH<0。下表列出了在不同温度和
压强下,反应达到平衡时SO2转化率的统计数据:
温度 不同压强下SO2的转化率/% 0.1 MPa 0.5 MPa 1 MPa 5 MPa 10 MPa
450 ℃ 97.5 98.9 99.2 99.6 99.7
550 ℃ 85.6 92.9 94.9 97.7 98.3
课堂练习
从理论上分析,使SO2尽可能多、尽可能快地转化为SO3,应选择的
条件是什么?
(2) 在实际生产中,选定450 ℃,其原因是什么?
(3) 在实际生产中,采用的压强为常压,其原因是什么?
(4) 在实际生产中,通入过量的空气,其原因是什么?
(5) 尾气中的SO2必须回收,其原因是什么?
课堂练习
提示:
(1)低温、高压。
(2) 该反应是放热反应,升高温度,转化率降低;此温度下催化剂的活性
最高。
(3)0.1 MPa(常压)下SO2的转化率已经很高,若采用较大的压强,不仅SO2的转化率提高很少,且需要更大动力,对设备的要求更高,增加成本。
(4)增大O2浓度,提高SO2的转化率。
(5)SO2有毒,防止污染环境。
课堂小结
CLASS SUMMARY
第二章
化学反应速率与化学平衡
选择性必修一
感谢您的观看
THANKS FOR WATCHING
