高一化学人教版(2019)选择性必修一 4.1.3化学电源(32张)
文档属性
| 名称 | 高一化学人教版(2019)选择性必修一 4.1.3化学电源(32张) |

|
|
| 格式 | pptx | ||
| 文件大小 | 5.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-15 00:00:00 | ||
图片预览









文档简介
(共32张PPT)
化学电源
第四章
化学反应与电能
第二节 原电池
第2课时
Principle of electrolysis
学习目标
了解常见的化学电源,能运用原电池思维模型分析其工作原理,能用电极反应表示其中发生的化学反应,体会变化与守恒思想。
了解化学电源的发展史,能列举常见的化学电源;能从物质变化和能量变化的角度分析新型电池的研发和利用,培养责任意识和创新精神。
化学史:发明电池的故事
伏特是意大利帕维亚大学的研究电学的物理学家.有一天,伏特看了一位名叫加伐尼的解剖学家的一篇论文,说动物肌肉里贮存着电,可以用金属接触肌肉把电引出来.看了这篇论文,伏特非常兴奋,便决定亲自来做这个实验.他用许多只活青蛙反复实验,终于发现,实际情况并不像加伐尼所说的那样,而是两种不同的金属接触产生的电流,才使蛙腿的肌肉充电而收缩。
为了证明自己的发现是正确的,伏特决定更深入地了解电的来源。
为了纪念他的贡献,人们把电压的计量单位叫做伏特,简称伏,符号V。比如我们手电筒里的电池的电压是1.5伏特,我们家里的电灯的电压是220伏特。
用途广泛的电池
用于汽车的铅蓄电池和燃料电池
用途广泛的电池
用于“神六”的太阳能电池
笔记本电脑专用电池
手机专用电池
摄像机专用电池
各式各样的纽扣电池
用途广泛的电池
(一)化学电池
将化学能变成电能的装置
①能量转换效率高,供能稳定可靠
②可以制成各种形状和大小、不同容量和电压的电
池和电池组,使用方便
③易维护,可在各种环境下工作。
概念
2. 优点
用途广泛的电池
3. 电池优劣的判断标准
① 比能量
[单位:(w·h/kg),(w·h/L)]
指电池单位质量或单位体积所能输出电能的多少
② 比功率
[单位:(W/kg,W/L)]
指电池单位质量或单位体积所能输出功率的大小
③ 电池的可储存时间的长短
除特殊情况外,质量轻、体积小而输出电能多、功率大、储存时间长的电池,其质量好。
用途广泛的电池
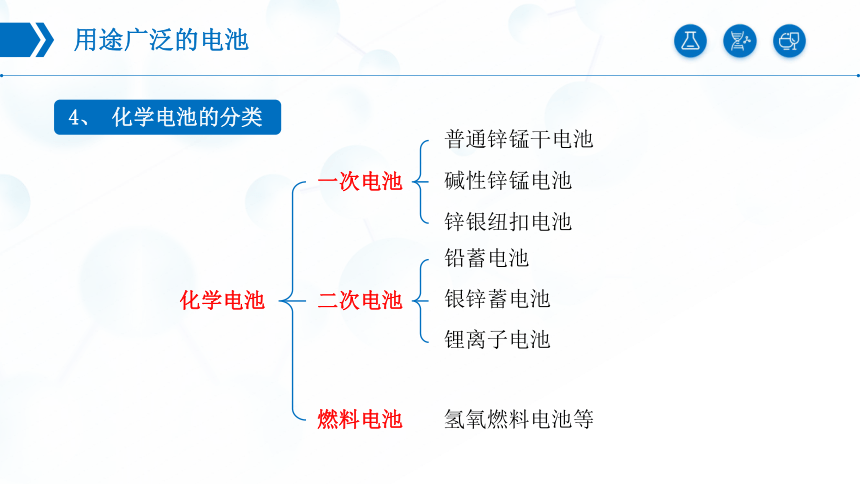
4、 化学电池的分类
化学电池
一次电池
二次电池
燃料电池
碱性锌锰电池
铅蓄电池
氢氧燃料电池等
锂离子电池
银锌蓄电池
普通锌锰干电池
锌银纽扣电池
用途广泛的电池
(二)一次电池
普通电池
电池中的反应物质进行一次氧化还原反应并放电之后,就不能再次利用。
锌筒
石墨棒
MnO2和C
普通锌-锰干电池的结构
NH4Cl、ZnCl2 和 H2O等
总反应:Zn+2MnO2+2NH4+=Zn2++Mn2O3+2NH3+H2O
负极: Zn - 2e- = Zn2+
正极:2MnO2+2NH4++2e- =Mn2O3+ 2NH3+H2O
优点:制作简单、价格便宜。缺点:放电时间短,电压下降快。
负极材料是什么?
正极材料是什么?
电解质溶液是什么?
电极反应式如何书写?
用途广泛的电池
2. 碱性锌锰电池
正极:MnO2
负极:Zn
负极:
Zn + 2OH- -2e- =Zn(OH)2
正极:
2MnO2 + 2H2O+2e-=2MnOOH+2OH-
氢氧化氧锰
电解质:KOH
负极材料是什么?
正极材料是什么?
电解质溶液是什么?
电极反应式如何书写?
优点:比能量和储存时间有所提高,适用于大电流和连续放电(电流稳定,放电容量、时间增大
几倍,不会气涨或漏液)
缺点:多数只能一次使用,不能充电;价格较贵
碱性锌锰电池构造示意图
用途广泛的电池
3. 银锌电池
Zn为______,Ag2O为______
电解液:
电极反应式:
负极:
正极:
总反应式:
优点:比能量大、电压稳定,储存时间长,适宜小电流连续放电。广泛用于电子
手表、照相机、计算器和其他微型电子仪器。
Zn+2OH--2e-=Zn(OH)2
Ag2O+H2O+2e-=2Ag+2OH-
负极
正极
Zn+Ag2O+H2O=2Ag+Zn(OH)2
KOH溶液
随堂小练
电子表和电子计算器的电源通常用微型银—锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,总反应式为Ag2O+H2O+Zn===Zn(OH)2+2Ag。下列说法正确的是( )
A. Ag2O是正极,Zn是负极
B. Zn是正极,Ag2O是负极
C. 工作时,电池负极区溶液pH增大
D. 工作时,电子由Ag2O极经外电路流向Zn极
A
随堂小练
解析 根据总反应式可知,金属锌失去电子发生氧化反应,作该电池的负极,氧化银得到电子发生还原反应,作该电池的正极,A项正确,B项错误;负极区锌离子与氢氧根离子结合,溶液中氢氧根离子浓度减小,则其pH减小,C项错误;该电池工作时,电子由锌极经外电路流向氧化银极,D项错误。
答案:A
用途广泛的电池
(二)二次电池(充电电池或蓄电池)
(1)正负极材料
正极:PbO2
负极:Pb
电解质溶液:H2SO4(aq)
化学能
电能
放电
充电
(2)工作机制
充电电池中能量的转化关系:
放电后可以再充电使活性物质获得再生;铅蓄电池、锂离子电池……
其电池反应可以正向和逆向进行.蓄电池放电时为自发电池,充电时为电解池.充电后电池容量得到恢复,充放电次数可达千百次。
铅蓄电池
用途广泛的电池
(3)放电时电极反应式:
优点:电压稳定、使用方便、安全可靠、价格低廉。
缺点:比能量低、笨重、废弃电池污染环境。
Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(l)
放电
充电
用途:电动自行车、汽车、发电站等都要用到它
总反应:Pb + PbO2 + 2H2SO4=2PbSO4 + 2H2O
负极: Pb + SO42- -2e-=PbSO4
正极:PbO2 + 4H+ + SO42- + 2e-=PbSO4 + 2H2O
(4)(充放电)可逆反应式: 充电时电极反应式与放电时电极反应式相反,所以可以把上述反应写成一个可逆反应式:
(1) 放电时Li+由 极向 极移动。
(2) 电极反应式:
①负极:________________________;
②正极:_________________________;
③放电电池总反应为_______________________。
(3) 电解液a能否是氯化锂溶液? (填“能”或“否”),原因是:金属锂能
,电解质中 。
随堂小练
锂空气电池放电时的工作原理如图所示。根据图示解答下列问题:
A
B
4Li+4OH--4e-===4LiOH
O2+
2H2O+4e-===4OH-
4Li+O2+2H2O===4LiOH
否
与水反应
不能含有水
随堂小练
负极: ;
正极: 。
。
用途:便携式电子设备(智能手机、笔记本电脑等)和交通工具(电动汽车、电动自行车等;大型储能电站等)
LixCy-xe-=xLi++Cy
Li1-xCoO2 +xLi+ + xe-= LiCoO2
负极: Li(嵌锂石墨), 正极:LiCoO2(钴酸锂); 电解质溶液为LiPF6(六氟磷酸锂)的碳酸酯溶液
LixCy+ Li1-xCoO2 = LiCoO2+Cy
优点:质量小、体积小、储存和输出能量大
2. 锂电池——电解液为有机溶剂(无水)
方法指导
电极反应式的书写类型及书写方法
(1)根据装置书写电极反应式
首先判断该电池所依据的化学反应,从而确定两个半反应即电极反应。注意电解质溶液是否参与电极反应。
(2)给出总反应式,写电极反应式
电极反应式的书写步骤一般为:列出物质、标电子的得失→选离子、配电荷→配个数、巧用水→两式加、验总式。
方法指导
如以2H2+O2
2H2O为例, 当电解质溶液为KOH溶液时的电极反应式的书写
步骤如下:
4H2O
列出物质、标电子的得失: 根据总反应式找出还原剂(H2)和氧化产物(H2O), 根据化合价变化标出转移电子数,得到2H2-4e- —— 2H2O
①负极反应式的书写
配个数、巧用水: 根据原子守恒, 右边加上2H2O, 得到
2H2 + 4OH- - 4e-
b. 选离子、配电荷: 根据电荷守恒和电解质溶液的酸碱性, 用OH-配平, 使两边电
荷总数相等, 得到2H2 + 4OH- - 4e- —— 2H2O
方法指导
②正极反应式的书写
把正极反应式和负极反应式相加, 与总反应式对比
列出物质、标电子的得失: 根据总反应式找出氧化剂(O2)和还原产物(H2O), 根
据化合价变化标出转移电子数, 得到O2+4e- —— 2H2O
选离子、配电荷: 根据电荷守恒和电解质溶液的酸碱性, 用OH-配平, 使两边电
荷总数相等,得到O2+4e-——2H2O+4OH-
配个数、巧用水: 根据原子守恒, 把左边加上4H2O才符合,整理得到
O2+2H2O+4e-
4OH-
③两式加、验总式
发展中的燃料电池
燃料电池是一种将燃料(如氢气、甲烷、乙醇)和氧化剂(如氧气)的化学能直接转化为电能的电化学反应装置,具有清洁、安全、高效等特点。燃料电池的能量转化率可以达到80%以上。当以氢气为燃料时,产物为水;以甲烷为燃料时,产物为水和二氧化碳。与常规发电厂相比,其二氧化碳排放量明显降低。燃料电池与干电池或蓄电池的主要差别在于反应物不是储存在电池内部,而是从外部提供,这时电池起着类似试管、烧杯等反应器的作用。
燃料电池的供电量易于调节,能适应用电器负载的变化,而且不需要很长的充电时间,在航天、军事和交通等领城有广阔的应用前景。
发展中的燃料电池
(三)燃料电池
一种连续将燃料和氧化剂的化学能直接转换成电能的化学电池。
电池的电极本身不包含活性物质, 只是一个催化转化元件。
工作时, 燃料和氧化剂连续地由外部供给, 在电极上不断地进行反应, 生成物不断地被排除, 于是电池就连续不断地提供电能。
清洁、能量转换率高的特点。
可供选择的燃料很多,如: 氢气、烃类、肼、甲醇、氨、煤气等液态或气态的燃料。
发展中的燃料电池
一种高效低污染的新型电池
正极: O2 + 4H+ + 4e-=2H2O
正极: O2 + 2H2O +4e-=4OH-
负极: 2H2+4OH- -4e-=4H2O
负极: 2H2 - 4e-=4H+
总(电池)反应:2H2 + O2=2H2O
B. 碱性条件下工作原理:
总(电池)反应:2H2 + O2=2H2O
1. 氢氧燃料电池
A.酸性条件下工作原理:
发展中的燃料电池
2. 固体燃料电池
介质 电池反应: 2H2 +O2 = 2H2O 负极
正极
负极
正极
2H2 - 4e- +2O2-= 2H2O
O2 + 4e-= 2O2-
2H2 - 4e- = 4H+
O2 + 4H+ + 4e-= 2H2O
发展中的燃料电池
3. 燃料电池的规律
①燃料做负极,助燃剂氧气为正极
②电极材料一般不参加化学反应,只起传导电子的作用。
③能量转化率高(超过80%),普通的只有30%,有利于节约能源。
燃料电池与前几种电池的差别:
①氧化剂与还原剂在工作时不断补充;
②反应产物不断排出
方法指导
书写步骤
(1)写出燃烧反应的化学方程式;
(2)根据电解液改写燃料电池总反应;
(3)写出正极的电极反应式(一般较简单);
(4)由燃料电池总反应式减去正极的电极反应式得到负极的电极反应式。
怎样书写燃料电池的电极反应式和总反应式?
方法指导
是用金属铂片插入KOH溶液作电极,又在两极上分别通甲烷(或其它烃燃料)和氧气(氧化剂)。电极反应式为:
其它燃料电池
CH4+10OH--8e =CO32-+7H2O
负极
4H2O+2O2+8e =8OH
正极
CH4+2O2+2KOH=K2CO3+3H2O
电池反应为
随堂小练
一种新型熔融盐燃料电池具有高发电效率。现用Li2CO3和Na2CO3的熔融混合物作电解质,一极通CO气体,另一极通O2和CO2混合气体,其总反应为2CO+O2 2CO2。下列说法中正确的是( )
通CO的一极是电池的正极
负极发生的电极反应是O2+2CO2+4e- 2CO2-
负极发生的电极反应是2CO+2CO3 - 4e- 4CO2
正极发生氧化反应
2-
3
C
随堂小练
解析 由电池总反应
2CO+O2
2CO2可知, 通CO的一极为电池负极,
4CO2,
- 4e-
正极的电极反应为O2+2CO2+4e-
2CO3
2-
答案:C
2-
3
通O2和CO2混合气体的一极为电池正极, 负极失电子, 发生氧化反应, 正极得电子, 发生还原反应, 负极的电极反应为2CO+2CO
化学与职业
电池研发人员
电池研发与生产、生活和军事等领域的发展密切相关。电池研发人员的工作包括电池构成材料的研制、电池性能的改进和应用的拓展等。以燃料电池为例, 研发中需要研究电极、 电解质等电池基本构成材料的性质和材料之间的相容性;研究不同类型的电池构成材料在不同用途时对温度、 湿度等环境因素的适应性; 还要研究使用什么
的电池材料使电池的容量更大;等等。这些研究工作关系着电池的效率、寿命、安全性、适用性和制造成本。在许多科研机构和生产企业中,都有具备着扎实的化学基础的研究人员从事电池研发工作。
课堂小结
CLASS SUMMARY
化学电源
一次电池
二次电池
燃料电池
酸性锌锰电池
碱性锌锰电池
铅蓄电池
氢氧燃料电池
锂电池
第四章
化学反应与电能
第一节 原电池
第2课时
感谢您的观看
THANKS FOR WATCHING
化学电源
第四章
化学反应与电能
第二节 原电池
第2课时
Principle of electrolysis
学习目标
了解常见的化学电源,能运用原电池思维模型分析其工作原理,能用电极反应表示其中发生的化学反应,体会变化与守恒思想。
了解化学电源的发展史,能列举常见的化学电源;能从物质变化和能量变化的角度分析新型电池的研发和利用,培养责任意识和创新精神。
化学史:发明电池的故事
伏特是意大利帕维亚大学的研究电学的物理学家.有一天,伏特看了一位名叫加伐尼的解剖学家的一篇论文,说动物肌肉里贮存着电,可以用金属接触肌肉把电引出来.看了这篇论文,伏特非常兴奋,便决定亲自来做这个实验.他用许多只活青蛙反复实验,终于发现,实际情况并不像加伐尼所说的那样,而是两种不同的金属接触产生的电流,才使蛙腿的肌肉充电而收缩。
为了证明自己的发现是正确的,伏特决定更深入地了解电的来源。
为了纪念他的贡献,人们把电压的计量单位叫做伏特,简称伏,符号V。比如我们手电筒里的电池的电压是1.5伏特,我们家里的电灯的电压是220伏特。
用途广泛的电池
用于汽车的铅蓄电池和燃料电池
用途广泛的电池
用于“神六”的太阳能电池
笔记本电脑专用电池
手机专用电池
摄像机专用电池
各式各样的纽扣电池
用途广泛的电池
(一)化学电池
将化学能变成电能的装置
①能量转换效率高,供能稳定可靠
②可以制成各种形状和大小、不同容量和电压的电
池和电池组,使用方便
③易维护,可在各种环境下工作。
概念
2. 优点
用途广泛的电池
3. 电池优劣的判断标准
① 比能量
[单位:(w·h/kg),(w·h/L)]
指电池单位质量或单位体积所能输出电能的多少
② 比功率
[单位:(W/kg,W/L)]
指电池单位质量或单位体积所能输出功率的大小
③ 电池的可储存时间的长短
除特殊情况外,质量轻、体积小而输出电能多、功率大、储存时间长的电池,其质量好。
用途广泛的电池
4、 化学电池的分类
化学电池
一次电池
二次电池
燃料电池
碱性锌锰电池
铅蓄电池
氢氧燃料电池等
锂离子电池
银锌蓄电池
普通锌锰干电池
锌银纽扣电池
用途广泛的电池
(二)一次电池
普通电池
电池中的反应物质进行一次氧化还原反应并放电之后,就不能再次利用。
锌筒
石墨棒
MnO2和C
普通锌-锰干电池的结构
NH4Cl、ZnCl2 和 H2O等
总反应:Zn+2MnO2+2NH4+=Zn2++Mn2O3+2NH3+H2O
负极: Zn - 2e- = Zn2+
正极:2MnO2+2NH4++2e- =Mn2O3+ 2NH3+H2O
优点:制作简单、价格便宜。缺点:放电时间短,电压下降快。
负极材料是什么?
正极材料是什么?
电解质溶液是什么?
电极反应式如何书写?
用途广泛的电池
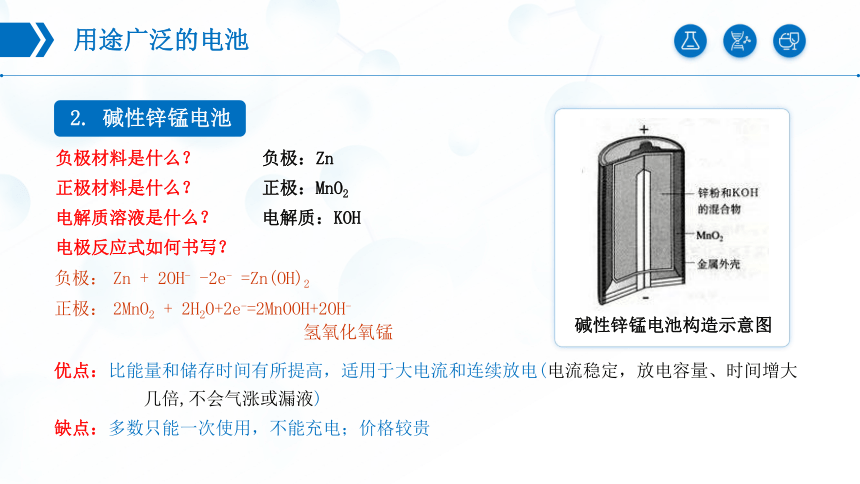
2. 碱性锌锰电池
正极:MnO2
负极:Zn
负极:
Zn + 2OH- -2e- =Zn(OH)2
正极:
2MnO2 + 2H2O+2e-=2MnOOH+2OH-
氢氧化氧锰
电解质:KOH
负极材料是什么?
正极材料是什么?
电解质溶液是什么?
电极反应式如何书写?
优点:比能量和储存时间有所提高,适用于大电流和连续放电(电流稳定,放电容量、时间增大
几倍,不会气涨或漏液)
缺点:多数只能一次使用,不能充电;价格较贵
碱性锌锰电池构造示意图
用途广泛的电池
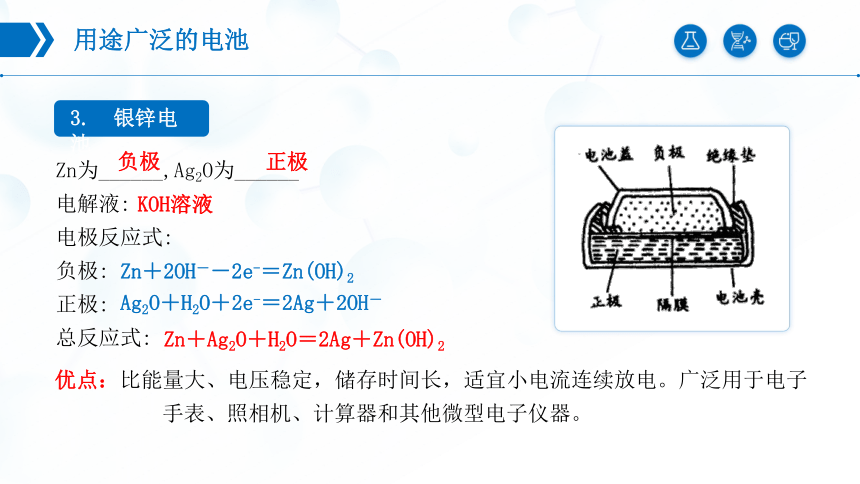
3. 银锌电池
Zn为______,Ag2O为______
电解液:
电极反应式:
负极:
正极:
总反应式:
优点:比能量大、电压稳定,储存时间长,适宜小电流连续放电。广泛用于电子
手表、照相机、计算器和其他微型电子仪器。
Zn+2OH--2e-=Zn(OH)2
Ag2O+H2O+2e-=2Ag+2OH-
负极
正极
Zn+Ag2O+H2O=2Ag+Zn(OH)2
KOH溶液
随堂小练
电子表和电子计算器的电源通常用微型银—锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,总反应式为Ag2O+H2O+Zn===Zn(OH)2+2Ag。下列说法正确的是( )
A. Ag2O是正极,Zn是负极
B. Zn是正极,Ag2O是负极
C. 工作时,电池负极区溶液pH增大
D. 工作时,电子由Ag2O极经外电路流向Zn极
A
随堂小练
解析 根据总反应式可知,金属锌失去电子发生氧化反应,作该电池的负极,氧化银得到电子发生还原反应,作该电池的正极,A项正确,B项错误;负极区锌离子与氢氧根离子结合,溶液中氢氧根离子浓度减小,则其pH减小,C项错误;该电池工作时,电子由锌极经外电路流向氧化银极,D项错误。
答案:A
用途广泛的电池
(二)二次电池(充电电池或蓄电池)
(1)正负极材料
正极:PbO2
负极:Pb
电解质溶液:H2SO4(aq)
化学能
电能
放电
充电
(2)工作机制
充电电池中能量的转化关系:
放电后可以再充电使活性物质获得再生;铅蓄电池、锂离子电池……
其电池反应可以正向和逆向进行.蓄电池放电时为自发电池,充电时为电解池.充电后电池容量得到恢复,充放电次数可达千百次。
铅蓄电池
用途广泛的电池
(3)放电时电极反应式:
优点:电压稳定、使用方便、安全可靠、价格低廉。
缺点:比能量低、笨重、废弃电池污染环境。
Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(l)
放电
充电
用途:电动自行车、汽车、发电站等都要用到它
总反应:Pb + PbO2 + 2H2SO4=2PbSO4 + 2H2O
负极: Pb + SO42- -2e-=PbSO4
正极:PbO2 + 4H+ + SO42- + 2e-=PbSO4 + 2H2O
(4)(充放电)可逆反应式: 充电时电极反应式与放电时电极反应式相反,所以可以把上述反应写成一个可逆反应式:
(1) 放电时Li+由 极向 极移动。
(2) 电极反应式:
①负极:________________________;
②正极:_________________________;
③放电电池总反应为_______________________。
(3) 电解液a能否是氯化锂溶液? (填“能”或“否”),原因是:金属锂能
,电解质中 。
随堂小练
锂空气电池放电时的工作原理如图所示。根据图示解答下列问题:
A
B
4Li+4OH--4e-===4LiOH
O2+
2H2O+4e-===4OH-
4Li+O2+2H2O===4LiOH
否
与水反应
不能含有水
随堂小练
负极: ;
正极: 。
。
用途:便携式电子设备(智能手机、笔记本电脑等)和交通工具(电动汽车、电动自行车等;大型储能电站等)
LixCy-xe-=xLi++Cy
Li1-xCoO2 +xLi+ + xe-= LiCoO2
负极: Li(嵌锂石墨), 正极:LiCoO2(钴酸锂); 电解质溶液为LiPF6(六氟磷酸锂)的碳酸酯溶液
LixCy+ Li1-xCoO2 = LiCoO2+Cy
优点:质量小、体积小、储存和输出能量大
2. 锂电池——电解液为有机溶剂(无水)
方法指导
电极反应式的书写类型及书写方法
(1)根据装置书写电极反应式
首先判断该电池所依据的化学反应,从而确定两个半反应即电极反应。注意电解质溶液是否参与电极反应。
(2)给出总反应式,写电极反应式
电极反应式的书写步骤一般为:列出物质、标电子的得失→选离子、配电荷→配个数、巧用水→两式加、验总式。
方法指导
如以2H2+O2
2H2O为例, 当电解质溶液为KOH溶液时的电极反应式的书写
步骤如下:
4H2O
列出物质、标电子的得失: 根据总反应式找出还原剂(H2)和氧化产物(H2O), 根据化合价变化标出转移电子数,得到2H2-4e- —— 2H2O
①负极反应式的书写
配个数、巧用水: 根据原子守恒, 右边加上2H2O, 得到
2H2 + 4OH- - 4e-
b. 选离子、配电荷: 根据电荷守恒和电解质溶液的酸碱性, 用OH-配平, 使两边电
荷总数相等, 得到2H2 + 4OH- - 4e- —— 2H2O
方法指导
②正极反应式的书写
把正极反应式和负极反应式相加, 与总反应式对比
列出物质、标电子的得失: 根据总反应式找出氧化剂(O2)和还原产物(H2O), 根
据化合价变化标出转移电子数, 得到O2+4e- —— 2H2O
选离子、配电荷: 根据电荷守恒和电解质溶液的酸碱性, 用OH-配平, 使两边电
荷总数相等,得到O2+4e-——2H2O+4OH-
配个数、巧用水: 根据原子守恒, 把左边加上4H2O才符合,整理得到
O2+2H2O+4e-
4OH-
③两式加、验总式
发展中的燃料电池
燃料电池是一种将燃料(如氢气、甲烷、乙醇)和氧化剂(如氧气)的化学能直接转化为电能的电化学反应装置,具有清洁、安全、高效等特点。燃料电池的能量转化率可以达到80%以上。当以氢气为燃料时,产物为水;以甲烷为燃料时,产物为水和二氧化碳。与常规发电厂相比,其二氧化碳排放量明显降低。燃料电池与干电池或蓄电池的主要差别在于反应物不是储存在电池内部,而是从外部提供,这时电池起着类似试管、烧杯等反应器的作用。
燃料电池的供电量易于调节,能适应用电器负载的变化,而且不需要很长的充电时间,在航天、军事和交通等领城有广阔的应用前景。
发展中的燃料电池
(三)燃料电池
一种连续将燃料和氧化剂的化学能直接转换成电能的化学电池。
电池的电极本身不包含活性物质, 只是一个催化转化元件。
工作时, 燃料和氧化剂连续地由外部供给, 在电极上不断地进行反应, 生成物不断地被排除, 于是电池就连续不断地提供电能。
清洁、能量转换率高的特点。
可供选择的燃料很多,如: 氢气、烃类、肼、甲醇、氨、煤气等液态或气态的燃料。
发展中的燃料电池
一种高效低污染的新型电池
正极: O2 + 4H+ + 4e-=2H2O
正极: O2 + 2H2O +4e-=4OH-
负极: 2H2+4OH- -4e-=4H2O
负极: 2H2 - 4e-=4H+
总(电池)反应:2H2 + O2=2H2O
B. 碱性条件下工作原理:
总(电池)反应:2H2 + O2=2H2O
1. 氢氧燃料电池
A.酸性条件下工作原理:
发展中的燃料电池
2. 固体燃料电池
介质 电池反应: 2H2 +O2 = 2H2O 负极
正极
负极
正极
2H2 - 4e- +2O2-= 2H2O
O2 + 4e-= 2O2-
2H2 - 4e- = 4H+
O2 + 4H+ + 4e-= 2H2O
发展中的燃料电池
3. 燃料电池的规律
①燃料做负极,助燃剂氧气为正极
②电极材料一般不参加化学反应,只起传导电子的作用。
③能量转化率高(超过80%),普通的只有30%,有利于节约能源。
燃料电池与前几种电池的差别:
①氧化剂与还原剂在工作时不断补充;
②反应产物不断排出
方法指导
书写步骤
(1)写出燃烧反应的化学方程式;
(2)根据电解液改写燃料电池总反应;
(3)写出正极的电极反应式(一般较简单);
(4)由燃料电池总反应式减去正极的电极反应式得到负极的电极反应式。
怎样书写燃料电池的电极反应式和总反应式?
方法指导
是用金属铂片插入KOH溶液作电极,又在两极上分别通甲烷(或其它烃燃料)和氧气(氧化剂)。电极反应式为:
其它燃料电池
CH4+10OH--8e =CO32-+7H2O
负极
4H2O+2O2+8e =8OH
正极
CH4+2O2+2KOH=K2CO3+3H2O
电池反应为
随堂小练
一种新型熔融盐燃料电池具有高发电效率。现用Li2CO3和Na2CO3的熔融混合物作电解质,一极通CO气体,另一极通O2和CO2混合气体,其总反应为2CO+O2 2CO2。下列说法中正确的是( )
通CO的一极是电池的正极
负极发生的电极反应是O2+2CO2+4e- 2CO2-
负极发生的电极反应是2CO+2CO3 - 4e- 4CO2
正极发生氧化反应
2-
3
C
随堂小练
解析 由电池总反应
2CO+O2
2CO2可知, 通CO的一极为电池负极,
4CO2,
- 4e-
正极的电极反应为O2+2CO2+4e-
2CO3
2-
答案:C
2-
3
通O2和CO2混合气体的一极为电池正极, 负极失电子, 发生氧化反应, 正极得电子, 发生还原反应, 负极的电极反应为2CO+2CO
化学与职业
电池研发人员
电池研发与生产、生活和军事等领域的发展密切相关。电池研发人员的工作包括电池构成材料的研制、电池性能的改进和应用的拓展等。以燃料电池为例, 研发中需要研究电极、 电解质等电池基本构成材料的性质和材料之间的相容性;研究不同类型的电池构成材料在不同用途时对温度、 湿度等环境因素的适应性; 还要研究使用什么
的电池材料使电池的容量更大;等等。这些研究工作关系着电池的效率、寿命、安全性、适用性和制造成本。在许多科研机构和生产企业中,都有具备着扎实的化学基础的研究人员从事电池研发工作。
课堂小结
CLASS SUMMARY
化学电源
一次电池
二次电池
燃料电池
酸性锌锰电池
碱性锌锰电池
铅蓄电池
氢氧燃料电池
锂电池
第四章
化学反应与电能
第一节 原电池
第2课时
感谢您的观看
THANKS FOR WATCHING
