人教版化学九下:10.2.1 中和反应 课件(共22张PPT)
文档属性
| 名称 | 人教版化学九下:10.2.1 中和反应 课件(共22张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-13 15:37:14 | ||
图片预览




文档简介
(共22张PPT)
第十单元 酸和碱
课题2 酸和碱的中和反应
第1课时 中和反应
学习目标-新课导入-新知探究-课堂小结-课堂训练
人教版-化学-九年级下册
1.掌握中和反应的定义。
3.了解中和反应在实际生活中的应用。
学习目标
2.理解酸和碱发生中和反应的本质。
新课导入
思考:
为什么被蚊虫叮咬过之后会觉得痛痒?有什么办法会消除肿痛?
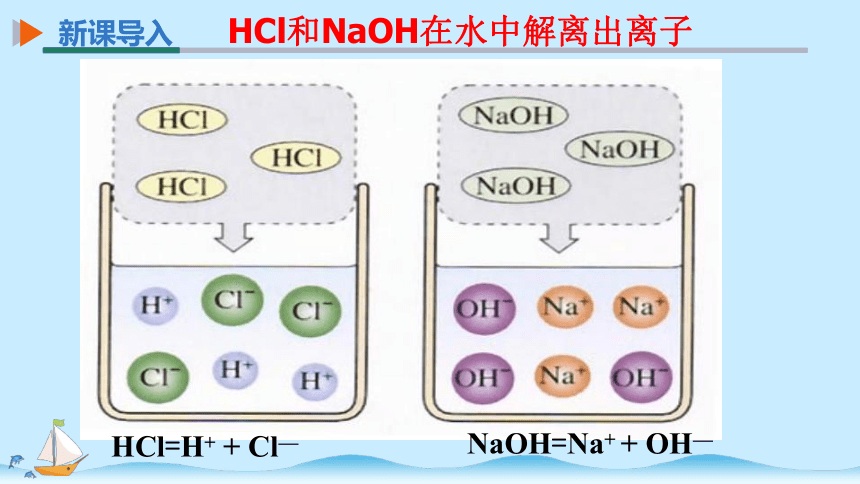
HCl=H+ + Cl—
NaOH=Na+ + OH—
HCl和NaOH在水中解离出离子
新课导入
新课导入
H+
OH-
酸溶液中都含有大量的H+,表现出酸性;碱溶液中都含有大量的OH-,表现出碱性。那么,酸与碱能发生反应吗?
酸
H+ + 酸根离子
碱
金属离子 + OH-
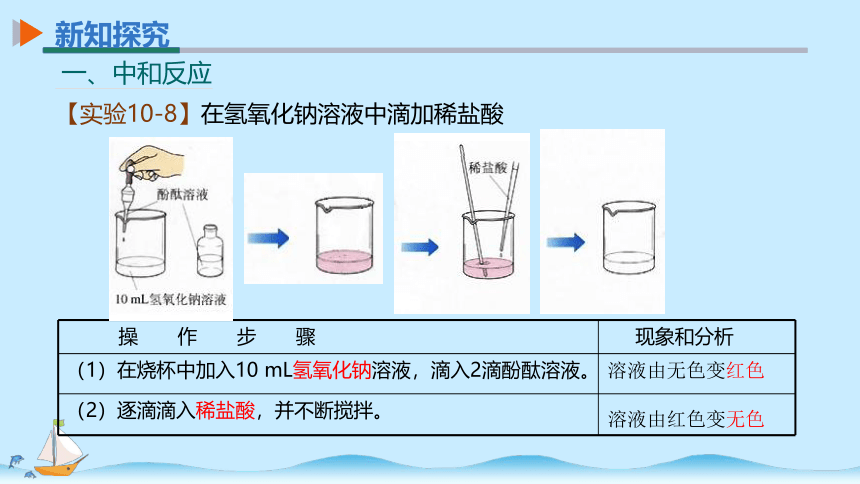
【实验10-8】在氢氧化钠溶液中滴加稀盐酸
一、中和反应
新知探究
操 作 步 骤 现象和分析
(1)在烧杯中加入10 mL氢氧化钠溶液,滴入2滴酚酞溶液。
(2)逐滴滴入稀盐酸,并不断搅拌。
溶液由无色变红色
溶液由红色变无色
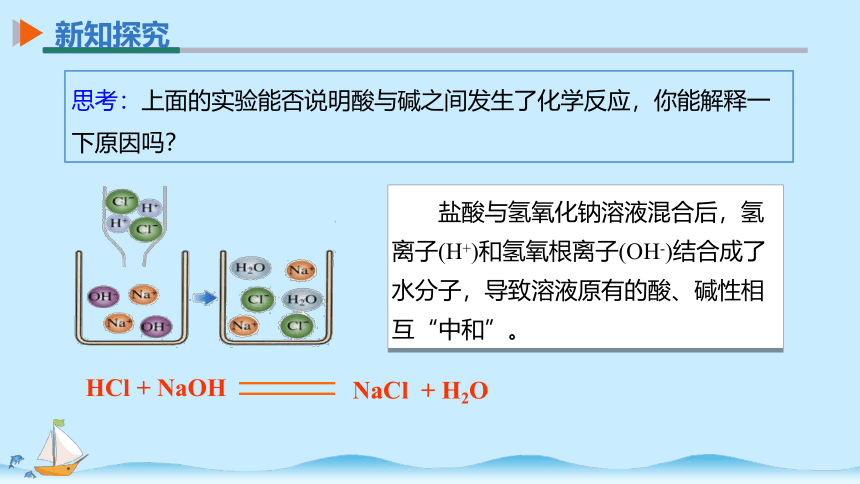
思考:上面的实验能否说明酸与碱之间发生了化学反应,你能解释一下原因吗?
盐酸与氢氧化钠溶液混合后,氢离子(H+)和氢氧根离子(OH-)结合成了水分子,导致溶液原有的酸、碱性相互“中和”。
新知探究
HCl + NaOH
NaCl + H2O
新知探究
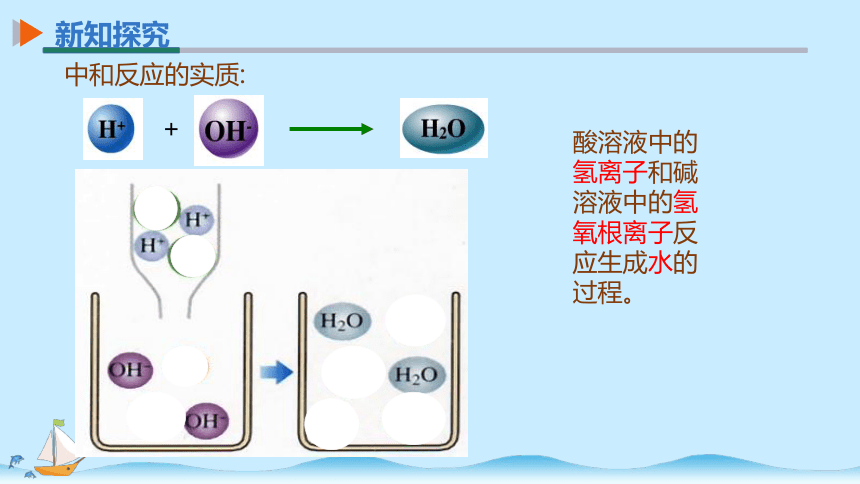
中和反应的实质:
+
酸溶液中的氢离子和碱溶液中的氢氧根离子反应生成水的过程。
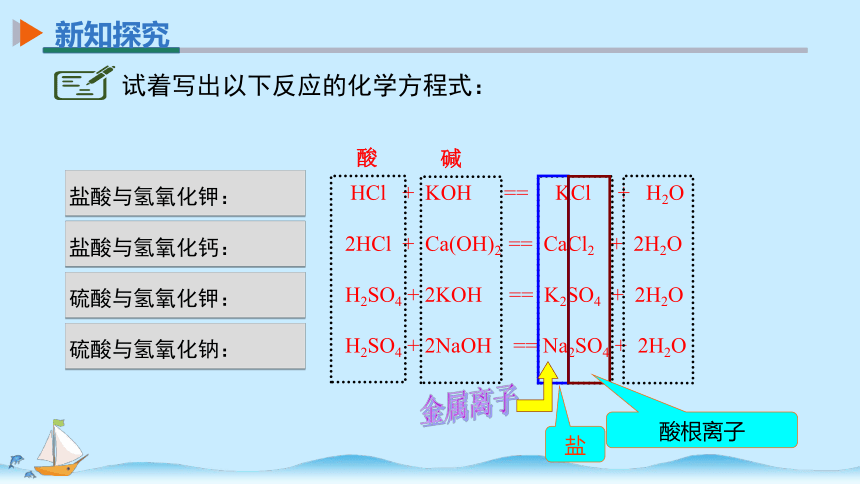
盐酸与氢氧化钾:
盐酸与氢氧化钙:
硫酸与氢氧化钾:
硫酸与氢氧化钠:
HCl + KOH == KCl + H2O
2HCl + Ca(OH)2 == CaCl2 + 2H2O
H2SO4 + 2KOH == K2SO4 + 2H2O
H2SO4 + 2NaOH == Na2SO4 + 2H2O
试着写出以下反应的化学方程式:
新知探究
金属离子
酸根离子
盐
酸
碱
我们化学上所说的“盐”,是否就是我们日常生活中所说的“盐”?
HCl+NaOH == NaCl+H2O
酸 + 碱 → 盐 + 水
盐:由金属离子(或铵根离子)和酸根离子构成的化合物。
例如:Na2SO4,K2CO3,NH4NO3, FeCl3等等。
新知探究
中和反应:酸和碱作用生成盐和水的反应叫做中和反应
有人说:凡是生成盐和水的反应就是中和反应,对不对?
答:不正确。因为能生成盐和水的反应有3种
酸 + 金属氧化物 = 盐 + 水
如:2HCl+CuO=CuCl2+H2O
酸 + 碱 = 盐 + 水
如:HCl+NaOH=NaCl+H2O
碱 + 非金属氧化物 = 盐 + 水
如:2NaOH+CO2=Na2CO3+H2O
新知探究
想一想
新知探究
二:中和反应的应用
用于医药
处理工业废水
改良土壤的酸碱性
用于医药
1.改变土壤的酸碱性
二、中和反应在实际中的应用
新知探究
加入酸 性物质
中性土壤
酸性土壤
熟石灰
Ca(OH)2
盐碱地
碱性土壤
利用中和反应原理,向土壤中加入酸性或碱性物质,将土壤pH控制在最适宜农作物生长的范围之内。如撒熟石灰中和酸性土壤。
⑵为什么向酸性土壤中加入熟石灰,而不可以加入
氢氧化钠粉末?
答:因为氢氧化钠的腐蚀性太强。
答:是酸雨或化肥。
⑴导致土壤显酸性的主要原因是什么?
新知探究
交流与反思
酸性或碱性废水必须先进行处理,达标后才可以排放,否则会造成水体污染。
思考:化学实验产生的酸性或碱性废液能否直接倒入下水道中?应如何处理?
2.处理工业废水
新知探究
胃酸过多导致胃部不适或疼痛时可口服碱性药物,以降低胃酸的含量。如“胃舒平”(主要成分为Al(OH)3)或小苏打片(主要成分是NaHCO3)
属于
利用
中和
反应
吗?
新知探究
3.用于医药卫生
⑴ 中和胃酸过多(胃液中含有盐酸)
中和反应的化学方程式:
Al(OH)3 + 3HCl=AlCl3 + 3H2O
中和蚊虫叮咬时“注射”的蚁酸可以用含碱性物质的溶液,如肥皂水、稀氨水,中和蚁酸,就可以减轻痛痒。
新知探究
⑵ 治疗蚊虫叮咬
科学实验需将溶液的pH控制在一定范围内。若溶液酸碱性太强或太弱,都可用适当的碱或酸调节溶液pH。
4.调节溶液的酸碱性
新知探究
1.中和反应:酸与碱作用生成盐和水的反应。
实质: H+ + OH- = H2O
2.盐:由金属离子(或氨根离子)和酸根离子构成的化合物。
3.中和反应在日常生活和工农业生产中有广泛的应用:
改良酸性土壤;处理酸性废水;
治疗胃酸;处理蚊虫叮咬。
课堂小结
课堂训练
1.下列物质中,能与稀盐酸发生中和反应的是( )
A.Mg B.MgO
C.Mg(OH)2 D.MgCO3
2.向盛有酚酞和烧碱溶液的烧杯中滴加稀盐酸,直至液体呈无色,为探究反应后所得溶液中溶质的成分,所选试剂不正确的是( )
A.稀硫酸溶液 B.锌粒
C.紫色石蕊溶液 D.碳酸钠溶液
C
A
课堂训练
3.下列反应属于中和反应的是( )
A.Mg+2HCl===MgCl2+H2↑
B.CuO+2HCl===CuCl2+H2O
C.K2CO3+H2SO4===K2SO4+H2O+CO2↑
D.KOH+HNO3===KNO3+H2O
4.某实验室废水中含有较多的盐酸,排放前应加入某种试剂将废水调至中性,下列试剂中最合适的是( )
A.AgNO3溶液 B.NaOH溶液 C.稀醋酸 D.KNO3溶液
B
D
课堂训练
5.下列应用与中和反应原理无关的是( )
A.配制农药波尔多液
B.用氢氧化钠溶液洗涤石油产品中残留的硫酸
C.用熟石灰改良酸性土壤
D.服用含氢氧化镁的药物治疗胃酸过多症
6.如图是氢氧化钠与盐酸反应的示意图。
(1)反应前后没有发生变化的离子有哪些?
(2)用实际参加反应的离子符号来表示反应的式子叫做离子方程式。请写出氢氧化钠与盐酸反应的离子方程式。
H++OH-===H2O。
A
Na+、Cl- 。
第十单元 酸和碱
课题2 酸和碱的中和反应
第1课时 中和反应
学习目标-新课导入-新知探究-课堂小结-课堂训练
人教版-化学-九年级下册
1.掌握中和反应的定义。
3.了解中和反应在实际生活中的应用。
学习目标
2.理解酸和碱发生中和反应的本质。
新课导入
思考:
为什么被蚊虫叮咬过之后会觉得痛痒?有什么办法会消除肿痛?
HCl=H+ + Cl—
NaOH=Na+ + OH—
HCl和NaOH在水中解离出离子
新课导入
新课导入
H+
OH-
酸溶液中都含有大量的H+,表现出酸性;碱溶液中都含有大量的OH-,表现出碱性。那么,酸与碱能发生反应吗?
酸
H+ + 酸根离子
碱
金属离子 + OH-
【实验10-8】在氢氧化钠溶液中滴加稀盐酸
一、中和反应
新知探究
操 作 步 骤 现象和分析
(1)在烧杯中加入10 mL氢氧化钠溶液,滴入2滴酚酞溶液。
(2)逐滴滴入稀盐酸,并不断搅拌。
溶液由无色变红色
溶液由红色变无色
思考:上面的实验能否说明酸与碱之间发生了化学反应,你能解释一下原因吗?
盐酸与氢氧化钠溶液混合后,氢离子(H+)和氢氧根离子(OH-)结合成了水分子,导致溶液原有的酸、碱性相互“中和”。
新知探究
HCl + NaOH
NaCl + H2O
新知探究
中和反应的实质:
+
酸溶液中的氢离子和碱溶液中的氢氧根离子反应生成水的过程。
盐酸与氢氧化钾:
盐酸与氢氧化钙:
硫酸与氢氧化钾:
硫酸与氢氧化钠:
HCl + KOH == KCl + H2O
2HCl + Ca(OH)2 == CaCl2 + 2H2O
H2SO4 + 2KOH == K2SO4 + 2H2O
H2SO4 + 2NaOH == Na2SO4 + 2H2O
试着写出以下反应的化学方程式:
新知探究
金属离子
酸根离子
盐
酸
碱
我们化学上所说的“盐”,是否就是我们日常生活中所说的“盐”?
HCl+NaOH == NaCl+H2O
酸 + 碱 → 盐 + 水
盐:由金属离子(或铵根离子)和酸根离子构成的化合物。
例如:Na2SO4,K2CO3,NH4NO3, FeCl3等等。
新知探究
中和反应:酸和碱作用生成盐和水的反应叫做中和反应
有人说:凡是生成盐和水的反应就是中和反应,对不对?
答:不正确。因为能生成盐和水的反应有3种
酸 + 金属氧化物 = 盐 + 水
如:2HCl+CuO=CuCl2+H2O
酸 + 碱 = 盐 + 水
如:HCl+NaOH=NaCl+H2O
碱 + 非金属氧化物 = 盐 + 水
如:2NaOH+CO2=Na2CO3+H2O
新知探究
想一想
新知探究
二:中和反应的应用
用于医药
处理工业废水
改良土壤的酸碱性
用于医药
1.改变土壤的酸碱性
二、中和反应在实际中的应用
新知探究
加入酸 性物质
中性土壤
酸性土壤
熟石灰
Ca(OH)2
盐碱地
碱性土壤
利用中和反应原理,向土壤中加入酸性或碱性物质,将土壤pH控制在最适宜农作物生长的范围之内。如撒熟石灰中和酸性土壤。
⑵为什么向酸性土壤中加入熟石灰,而不可以加入
氢氧化钠粉末?
答:因为氢氧化钠的腐蚀性太强。
答:是酸雨或化肥。
⑴导致土壤显酸性的主要原因是什么?
新知探究
交流与反思
酸性或碱性废水必须先进行处理,达标后才可以排放,否则会造成水体污染。
思考:化学实验产生的酸性或碱性废液能否直接倒入下水道中?应如何处理?
2.处理工业废水
新知探究
胃酸过多导致胃部不适或疼痛时可口服碱性药物,以降低胃酸的含量。如“胃舒平”(主要成分为Al(OH)3)或小苏打片(主要成分是NaHCO3)
属于
利用
中和
反应
吗?
新知探究
3.用于医药卫生
⑴ 中和胃酸过多(胃液中含有盐酸)
中和反应的化学方程式:
Al(OH)3 + 3HCl=AlCl3 + 3H2O
中和蚊虫叮咬时“注射”的蚁酸可以用含碱性物质的溶液,如肥皂水、稀氨水,中和蚁酸,就可以减轻痛痒。
新知探究
⑵ 治疗蚊虫叮咬
科学实验需将溶液的pH控制在一定范围内。若溶液酸碱性太强或太弱,都可用适当的碱或酸调节溶液pH。
4.调节溶液的酸碱性
新知探究
1.中和反应:酸与碱作用生成盐和水的反应。
实质: H+ + OH- = H2O
2.盐:由金属离子(或氨根离子)和酸根离子构成的化合物。
3.中和反应在日常生活和工农业生产中有广泛的应用:
改良酸性土壤;处理酸性废水;
治疗胃酸;处理蚊虫叮咬。
课堂小结
课堂训练
1.下列物质中,能与稀盐酸发生中和反应的是( )
A.Mg B.MgO
C.Mg(OH)2 D.MgCO3
2.向盛有酚酞和烧碱溶液的烧杯中滴加稀盐酸,直至液体呈无色,为探究反应后所得溶液中溶质的成分,所选试剂不正确的是( )
A.稀硫酸溶液 B.锌粒
C.紫色石蕊溶液 D.碳酸钠溶液
C
A
课堂训练
3.下列反应属于中和反应的是( )
A.Mg+2HCl===MgCl2+H2↑
B.CuO+2HCl===CuCl2+H2O
C.K2CO3+H2SO4===K2SO4+H2O+CO2↑
D.KOH+HNO3===KNO3+H2O
4.某实验室废水中含有较多的盐酸,排放前应加入某种试剂将废水调至中性,下列试剂中最合适的是( )
A.AgNO3溶液 B.NaOH溶液 C.稀醋酸 D.KNO3溶液
B
D
课堂训练
5.下列应用与中和反应原理无关的是( )
A.配制农药波尔多液
B.用氢氧化钠溶液洗涤石油产品中残留的硫酸
C.用熟石灰改良酸性土壤
D.服用含氢氧化镁的药物治疗胃酸过多症
6.如图是氢氧化钠与盐酸反应的示意图。
(1)反应前后没有发生变化的离子有哪些?
(2)用实际参加反应的离子符号来表示反应的式子叫做离子方程式。请写出氢氧化钠与盐酸反应的离子方程式。
H++OH-===H2O。
A
Na+、Cl- 。
同课章节目录
