2022-2023学年鲁教版高中化学选择性必修2 2.3.2 配位键 (共23张PPT)
文档属性
| 名称 | 2022-2023学年鲁教版高中化学选择性必修2 2.3.2 配位键 (共23张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-15 00:00:00 | ||
图片预览





文档简介
(共23张PPT)
第2章 第3节 第2课时 《配位键》
鲁科版 选择性必修2
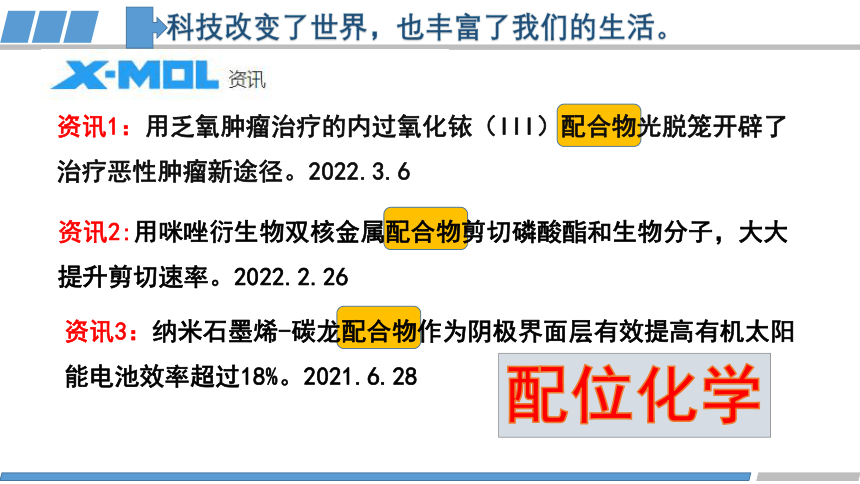
科技改变了世界,也丰富了我们的生活。
资讯1:用乏氧肿瘤治疗的内过氧化铱(III)配合物光脱笼开辟了治疗恶性肿瘤新途径。2022.3.6
资讯3:纳米石墨烯-碳龙配合物作为阴极界面层有效提高有机太阳
能电池效率超过18%。2021.6.28
资讯2:用咪唑衍生物双核金属配合物剪切磷酸酯和生物分子,大大提升剪切速率。2022.2.26
配位化学
"中国量子化学之父"
-----唐敖庆
配
位
场
理
论
方
法
"中国稀土之父"、
"稀土界的袁隆平"---徐光宪
配合物萃取稀土元素
配位化学--领先人物
配位键
课标要点 核心素养
1.知道配位键的特点、认识简单配位化合物的成键特征。 2.了解配位化合物的存在与应用。通过探究配合物的制备,了解外界条件对配合物的影响。
发展宏观辨识与微观探析
落实变化观念与平衡思想
培养实验探究与创新意识
配位键
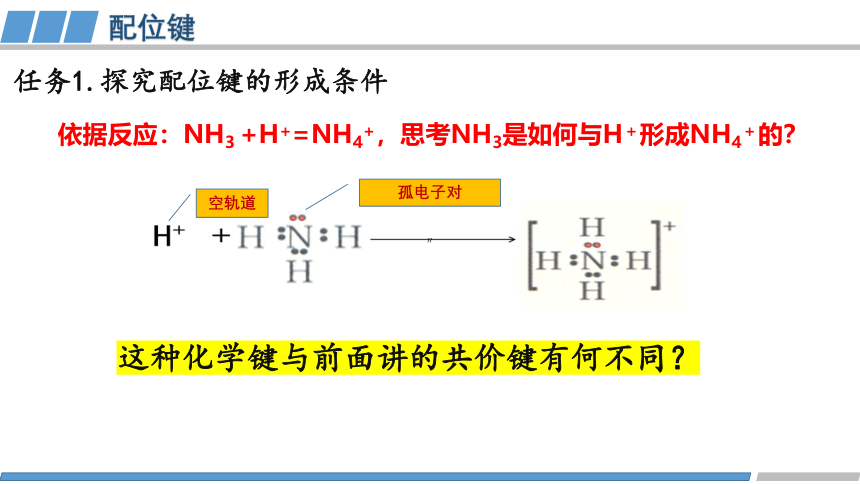
任务1.探究配位键的形成条件
依据反应:NH3 +H+=NH4+,思考NH3是如何与H+形成NH4+的?
这种化学键与前面讲的共价键有何不同?
孤电子对
空轨道
配位键
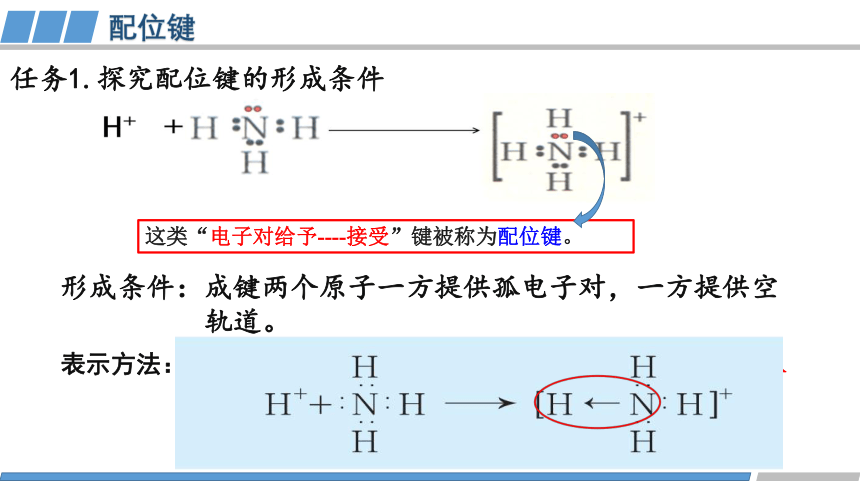
任务1.探究配位键的形成条件
形成条件:成键两个原子一方提供孤电子对,一方提供空
轨道。
这类“电子对给予----接受”键被称为配位键。
表示方法:
A→B(A为提供孤电子对的原子,称为配体;B为接受孤
电子对的原子,称为中心原子或中心离子。)
配位键
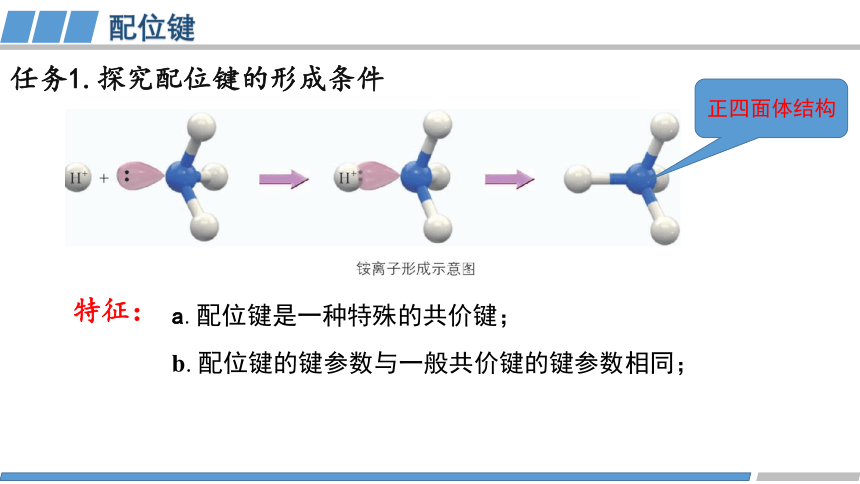
a.配位键是一种特殊的共价键;
任务1.探究配位键的形成条件
特征:
b. 配位键的键参数与一般共价键的键参数相同;
正四面体结构
配位键
任务2.探究配位化合物的结构
配位化合物(配合物):
交流研讨
物质 是否含有配位键 提供空轨道 提供孤电子对
KCl
NaOH
[Ag(NH3)2]+
下列物质中哪些含有配位键?提供空轨道和提供孤电子对的微粒是?
否
否
有
Ag+
N
金属离子或原子(称为中心离子或原子)与某些分子或离子(称为配体或配位体)以配位键结合形成的化合物。
思考:NH4Cl是配合物吗?
配位键
任务2.探究配位化合物的结构
观察 思考
观察下列物质的颜色。
CuSO4
溶液
无水CuSO4
CuSO4
5H2O
蓝色是Cu2+的颜色吗?
【结论】Cu2+与H2O结合显蓝色,从成键角度分析Cu2+与H2O是
怎样结合的?
【信 息】Cu2+ + 4H2O = [Cu(H2O)4]2+(蓝色)。
(电子对接受体)空轨道 孤电子对(电子对给予体)
配位键
类比NH4+的形成,推测[Cu(H2O)4]2+的形成。
配位键
任务2.探究配位化合物的结构
[Cu(H2O)4 ] S O 4
外界(离子)
配
位
数
中
心
离
子
配
位
体
[Cu(H2O)4]SO4
= [Cu(H2O)4]2+ + SO42-
配
位
原
子
配位键
配合物的表示方法:
任务2.探究配位化合物的结构
提供孤电子对
提供空轨道
内界(配离子)
配位键
形成条件
一方能给予孤电子对
另一方能接受电子对
(有空轨道)
NH3、H2O、Cl-、SCN-等。
Ag+、Fe3+、Cu2+、Zn2+、Mg2+、Al3+等
大多为过渡金属的原子或离子。
任务2.探究配位化合物的结构
[CuCl4]2- [Cu(NH3)4]2+ [Fe(H2O)6]3+ [Fe(H2O)6-n(OH)n]3-n [FeCl4]-
黄绿色 深蓝色 无色 黄色 黄色
配位键
任务3.探究配位化合物制备及应用
活动1.向试管中加入少量氯化铜粉末,然后加水溶解,再逐渐加水稀释,边加边振荡,观察现象。
活动2.探究Cu2+与氨水和OH-反应的差异。
活动3.分别以氯化铁和硝酸铁为原料,探究Fe3+溶液显色的原因
活动4.制备[Ag(NH3)2]+并用于与葡萄糖反应制备银镜
配位键
任务3.探究配位化合物制备及应用
活动2.探究Cu2+与氨水和OH-反应的差异。
活动3.分别以氯化铁和硝酸铁为原料,探究Fe3+溶液显色的原因
活动4.制备[Ag(NH3)2]+并用于与葡萄糖反应制备银镜
操作:取少量0.1mol/LCuSO4溶液于试管①和②中,分别滴加浓氨水和NaOH溶液至过量。
操作:(1)取少量硝酸铁和氯化铁于试管①和②中,加少量水观察颜色。
(2)取2ml①溶液于试管,加几滴HNO3观察颜色。
(3)取(2)中溶液于试管,加少量氯化钠观察颜色。
(4)取2ml②溶液于试管,加几滴HNO3观察颜色。
操作:向1ml0.1 mol·L-1 的AgNO3溶液中逐滴加入浓氨水,直至沉淀恰好溶解,再加入1ml10%葡萄糖溶液振荡,水浴加热。
如何设计实验操作?
配位键
任务3.探究配位化合物制备及应用
活动1.向试管中加入少量氯化铜粉末,然后加水溶解,再逐渐加水稀释,边加边振荡,观察现象。
现象:CuCl2(s) 黄绿色溶液
水
水
蓝色溶液
结论:
[CuCl4]2-+4H2O [Cu(H2O)4]2++4Cl-
黄绿 蓝色
思考:溶液呈现黄绿色和蓝色,说明溶液中分别存在了什么微粒?
由于溶液浓度的改变,引起平衡移动,导致配离子发生转变,从而使溶液颜色发生变化。
配合物存在形式受浓度的影响
配位键
任务3.探究配位化合物制备及应用
活动2.探究Cu2+与氨水和OH-反应的差异。
结论:
如何设计实验操作?
现象:CuSO4(aq) 蓝色沉淀
氨水
氨水
深蓝色溶液
现象:CuSO4(aq) 蓝色沉淀
氢氧化钠
氢氧化钠
蓝色溶液
①Cu2++2NH3·H2O ==Cu(OH)2↓+2NH4+
②Cu(OH)2+ 4NH3·H2O == [Cu(NH3)4]2++2OH-+4H2O
①Cu2++2OH-==Cu(OH)2↓
②Cu(OH)2+2OH-== [Cu(OH)4]2-
配合物存在形式受配体的影响。
配位键
任务3.探究配位化合物制备及应用
活动3.分别以氯化铁和硝酸铁为原料,探究Fe3+溶液显色的原因
结论:
不同的配合物耐酸程度不同,从而影响其存在形式。
如何设计实验操作?
① Fe3+水解并与OH-配位 [Fe(H2O)6-n(OH)n]3-n,使溶液显示黄色。
加入硝酸,氢离子浓度增加,平衡左移,溶液主要以[Fe(H2O)6]3+存在,退为无色。
[Fe(H2O)6]3++nH2O [Fe(H2O)6-n(OH)n]3-n+nH3O+
现象:FeCl3(s) 黄色溶液
硝酸
水
黄色溶液
结论:
② 氯化铁溶液中形成黄色配离子[FeCl4]-。加酸酸化也不分解。
现象:Fe(NO3)3(s) 黄色溶液
硝酸
水
黄色退去
氯化钠
黄色溶液
配位键
任务3.探究配位化合物制备及应用
活动4.制备[Ag(NH3)2]+并用于与葡萄糖反应制备银镜
配合物可用于制备物质。
结论:
Ag++NH3·H2O = AgOH↓+NH4+
AgOH+2NH3·H2O = [Ag(NH3)2]++ OH- + 2H2O
[Ag(NH3)2]OH与葡萄糖反应产生银镜。
现象:AgNO3(aq) 白色沉淀
浓氨水
浓氨水
沉淀溶解
葡萄糖
水浴加热
银镜
配位键
任务3.探究配位化合物制备及应用
活动5.归纳配合物的应用
(1)物质检验
Fe3+的检验
Fe3+ + nSCN- → [Fe(SCN)n]3-n (n=1 ~ 6)
(2)物质制备
制备银氨溶液用于制镜工业
(3)参与生命活动
生命体中,许多酶与金属离子的配合物有关
(4)用于尖端技术、医药科学、催化反应和材料化学等领域
课堂练习
1.下列分子或离子中,能提供孤电子对与某些金属离子形成配位键的是( )
①H2O ②NH3 ③F- ④CN- ⑤CO
A.①② B.①②③ C.①②④ D.①②③④⑤
D
C
2.下列化合物属于配合物的是( )
A.Cu2(OH)2SO4 B.NH3
C.[Zn(NH3)4]SO4 D.KAl(SO4)2
课堂练习
3.某物质A的实验式为CoCl3·4NH3,1molA中加入足量的AgNO3溶液中能生成1mol白色沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法中正确的是( )
A.Co3+只与NH3形成配位键
B.配合物配位数为3
C.该配合物可能是平面正方形结构
D.此配合物可写成[Co(NH3)4Cl2] Cl
D
课堂小结:
→ 配合物
概 念
形成条件
表示方法
配位键
物质检验
物质制备
参与生命活动
医药、催化和材料化学等领域
用于科学研究和生产实践
配位键
谢谢!
第2章 第3节 第2课时 《配位键》
鲁科版 选择性必修2
科技改变了世界,也丰富了我们的生活。
资讯1:用乏氧肿瘤治疗的内过氧化铱(III)配合物光脱笼开辟了治疗恶性肿瘤新途径。2022.3.6
资讯3:纳米石墨烯-碳龙配合物作为阴极界面层有效提高有机太阳
能电池效率超过18%。2021.6.28
资讯2:用咪唑衍生物双核金属配合物剪切磷酸酯和生物分子,大大提升剪切速率。2022.2.26
配位化学
"中国量子化学之父"
-----唐敖庆
配
位
场
理
论
方
法
"中国稀土之父"、
"稀土界的袁隆平"---徐光宪
配合物萃取稀土元素
配位化学--领先人物
配位键
课标要点 核心素养
1.知道配位键的特点、认识简单配位化合物的成键特征。 2.了解配位化合物的存在与应用。通过探究配合物的制备,了解外界条件对配合物的影响。
发展宏观辨识与微观探析
落实变化观念与平衡思想
培养实验探究与创新意识
配位键
任务1.探究配位键的形成条件
依据反应:NH3 +H+=NH4+,思考NH3是如何与H+形成NH4+的?
这种化学键与前面讲的共价键有何不同?
孤电子对
空轨道
配位键
任务1.探究配位键的形成条件
形成条件:成键两个原子一方提供孤电子对,一方提供空
轨道。
这类“电子对给予----接受”键被称为配位键。
表示方法:
A→B(A为提供孤电子对的原子,称为配体;B为接受孤
电子对的原子,称为中心原子或中心离子。)
配位键
a.配位键是一种特殊的共价键;
任务1.探究配位键的形成条件
特征:
b. 配位键的键参数与一般共价键的键参数相同;
正四面体结构
配位键
任务2.探究配位化合物的结构
配位化合物(配合物):
交流研讨
物质 是否含有配位键 提供空轨道 提供孤电子对
KCl
NaOH
[Ag(NH3)2]+
下列物质中哪些含有配位键?提供空轨道和提供孤电子对的微粒是?
否
否
有
Ag+
N
金属离子或原子(称为中心离子或原子)与某些分子或离子(称为配体或配位体)以配位键结合形成的化合物。
思考:NH4Cl是配合物吗?
配位键
任务2.探究配位化合物的结构
观察 思考
观察下列物质的颜色。
CuSO4
溶液
无水CuSO4
CuSO4
5H2O
蓝色是Cu2+的颜色吗?
【结论】Cu2+与H2O结合显蓝色,从成键角度分析Cu2+与H2O是
怎样结合的?
【信 息】Cu2+ + 4H2O = [Cu(H2O)4]2+(蓝色)。
(电子对接受体)空轨道 孤电子对(电子对给予体)
配位键
类比NH4+的形成,推测[Cu(H2O)4]2+的形成。
配位键
任务2.探究配位化合物的结构
[Cu(H2O)4 ] S O 4
外界(离子)
配
位
数
中
心
离
子
配
位
体
[Cu(H2O)4]SO4
= [Cu(H2O)4]2+ + SO42-
配
位
原
子
配位键
配合物的表示方法:
任务2.探究配位化合物的结构
提供孤电子对
提供空轨道
内界(配离子)
配位键
形成条件
一方能给予孤电子对
另一方能接受电子对
(有空轨道)
NH3、H2O、Cl-、SCN-等。
Ag+、Fe3+、Cu2+、Zn2+、Mg2+、Al3+等
大多为过渡金属的原子或离子。
任务2.探究配位化合物的结构
[CuCl4]2- [Cu(NH3)4]2+ [Fe(H2O)6]3+ [Fe(H2O)6-n(OH)n]3-n [FeCl4]-
黄绿色 深蓝色 无色 黄色 黄色
配位键
任务3.探究配位化合物制备及应用
活动1.向试管中加入少量氯化铜粉末,然后加水溶解,再逐渐加水稀释,边加边振荡,观察现象。
活动2.探究Cu2+与氨水和OH-反应的差异。
活动3.分别以氯化铁和硝酸铁为原料,探究Fe3+溶液显色的原因
活动4.制备[Ag(NH3)2]+并用于与葡萄糖反应制备银镜
配位键
任务3.探究配位化合物制备及应用
活动2.探究Cu2+与氨水和OH-反应的差异。
活动3.分别以氯化铁和硝酸铁为原料,探究Fe3+溶液显色的原因
活动4.制备[Ag(NH3)2]+并用于与葡萄糖反应制备银镜
操作:取少量0.1mol/LCuSO4溶液于试管①和②中,分别滴加浓氨水和NaOH溶液至过量。
操作:(1)取少量硝酸铁和氯化铁于试管①和②中,加少量水观察颜色。
(2)取2ml①溶液于试管,加几滴HNO3观察颜色。
(3)取(2)中溶液于试管,加少量氯化钠观察颜色。
(4)取2ml②溶液于试管,加几滴HNO3观察颜色。
操作:向1ml0.1 mol·L-1 的AgNO3溶液中逐滴加入浓氨水,直至沉淀恰好溶解,再加入1ml10%葡萄糖溶液振荡,水浴加热。
如何设计实验操作?
配位键
任务3.探究配位化合物制备及应用
活动1.向试管中加入少量氯化铜粉末,然后加水溶解,再逐渐加水稀释,边加边振荡,观察现象。
现象:CuCl2(s) 黄绿色溶液
水
水
蓝色溶液
结论:
[CuCl4]2-+4H2O [Cu(H2O)4]2++4Cl-
黄绿 蓝色
思考:溶液呈现黄绿色和蓝色,说明溶液中分别存在了什么微粒?
由于溶液浓度的改变,引起平衡移动,导致配离子发生转变,从而使溶液颜色发生变化。
配合物存在形式受浓度的影响
配位键
任务3.探究配位化合物制备及应用
活动2.探究Cu2+与氨水和OH-反应的差异。
结论:
如何设计实验操作?
现象:CuSO4(aq) 蓝色沉淀
氨水
氨水
深蓝色溶液
现象:CuSO4(aq) 蓝色沉淀
氢氧化钠
氢氧化钠
蓝色溶液
①Cu2++2NH3·H2O ==Cu(OH)2↓+2NH4+
②Cu(OH)2+ 4NH3·H2O == [Cu(NH3)4]2++2OH-+4H2O
①Cu2++2OH-==Cu(OH)2↓
②Cu(OH)2+2OH-== [Cu(OH)4]2-
配合物存在形式受配体的影响。
配位键
任务3.探究配位化合物制备及应用
活动3.分别以氯化铁和硝酸铁为原料,探究Fe3+溶液显色的原因
结论:
不同的配合物耐酸程度不同,从而影响其存在形式。
如何设计实验操作?
① Fe3+水解并与OH-配位 [Fe(H2O)6-n(OH)n]3-n,使溶液显示黄色。
加入硝酸,氢离子浓度增加,平衡左移,溶液主要以[Fe(H2O)6]3+存在,退为无色。
[Fe(H2O)6]3++nH2O [Fe(H2O)6-n(OH)n]3-n+nH3O+
现象:FeCl3(s) 黄色溶液
硝酸
水
黄色溶液
结论:
② 氯化铁溶液中形成黄色配离子[FeCl4]-。加酸酸化也不分解。
现象:Fe(NO3)3(s) 黄色溶液
硝酸
水
黄色退去
氯化钠
黄色溶液
配位键
任务3.探究配位化合物制备及应用
活动4.制备[Ag(NH3)2]+并用于与葡萄糖反应制备银镜
配合物可用于制备物质。
结论:
Ag++NH3·H2O = AgOH↓+NH4+
AgOH+2NH3·H2O = [Ag(NH3)2]++ OH- + 2H2O
[Ag(NH3)2]OH与葡萄糖反应产生银镜。
现象:AgNO3(aq) 白色沉淀
浓氨水
浓氨水
沉淀溶解
葡萄糖
水浴加热
银镜
配位键
任务3.探究配位化合物制备及应用
活动5.归纳配合物的应用
(1)物质检验
Fe3+的检验
Fe3+ + nSCN- → [Fe(SCN)n]3-n (n=1 ~ 6)
(2)物质制备
制备银氨溶液用于制镜工业
(3)参与生命活动
生命体中,许多酶与金属离子的配合物有关
(4)用于尖端技术、医药科学、催化反应和材料化学等领域
课堂练习
1.下列分子或离子中,能提供孤电子对与某些金属离子形成配位键的是( )
①H2O ②NH3 ③F- ④CN- ⑤CO
A.①② B.①②③ C.①②④ D.①②③④⑤
D
C
2.下列化合物属于配合物的是( )
A.Cu2(OH)2SO4 B.NH3
C.[Zn(NH3)4]SO4 D.KAl(SO4)2
课堂练习
3.某物质A的实验式为CoCl3·4NH3,1molA中加入足量的AgNO3溶液中能生成1mol白色沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法中正确的是( )
A.Co3+只与NH3形成配位键
B.配合物配位数为3
C.该配合物可能是平面正方形结构
D.此配合物可写成[Co(NH3)4Cl2] Cl
D
课堂小结:
→ 配合物
概 念
形成条件
表示方法
配位键
物质检验
物质制备
参与生命活动
医药、催化和材料化学等领域
用于科学研究和生产实践
配位键
谢谢!
