2022-2023学年人教高中化学选择性必修2 3.4.1配合物(共26张PPT)
文档属性
| 名称 | 2022-2023学年人教高中化学选择性必修2 3.4.1配合物(共26张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-15 19:37:01 | ||
图片预览






文档简介
(共26张PPT)
情境导入
资料:据新华网统计,我国每年死于煤气中毒的人数近3000人,排在交通事故和生产事故的后面第三位。
第三章 第四节 配合物与超分子
第一课时 配合物
学习目标
素养目标
一、发展宏观辨识与微观探析化学学科核心素养;
二、培养实验探究与创新意识的化学学科核心素养。
知识目标
一、知道配位键的特点,认识简单配合物的成键特征;
二、认识配位键与共价键、离子键的异同,能用配位键描述、解释实验现象。
活动一:探秘配合物的成键特点
无水硫酸铜
硫酸铜溶液
CuSO4 5H2O
任务一:请同学们利用老师提供的实验用品,小组讨论,设计实验方案探究颜色变化的原因
活动一:探秘配合物的成键特点
实验试剂
无水硫酸铜粉末、氯化铜固体、硫酸钠固体、氯化钠固体、溴化铜固体、溴化钠固体
活动一:探秘配合物的成键特点
交流分享
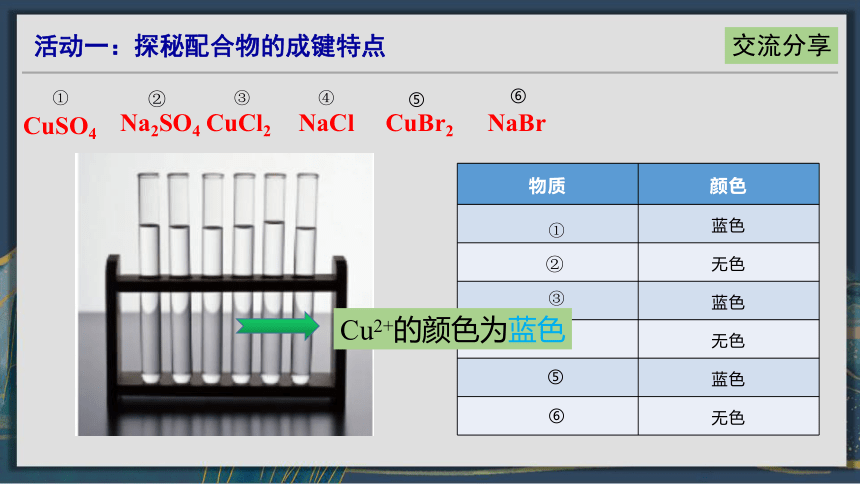
CuSO4
①
Na2SO4
②
CuCl2
③
NaCl
④
CuBr2
⑤
NaBr
⑥
物质 颜色
蓝色
无色
蓝色
无色
蓝色
无色
①
②
③
④
⑤
⑥
Cu2+的颜色为蓝色
活动一:探秘配合物的成键特点
交流分享
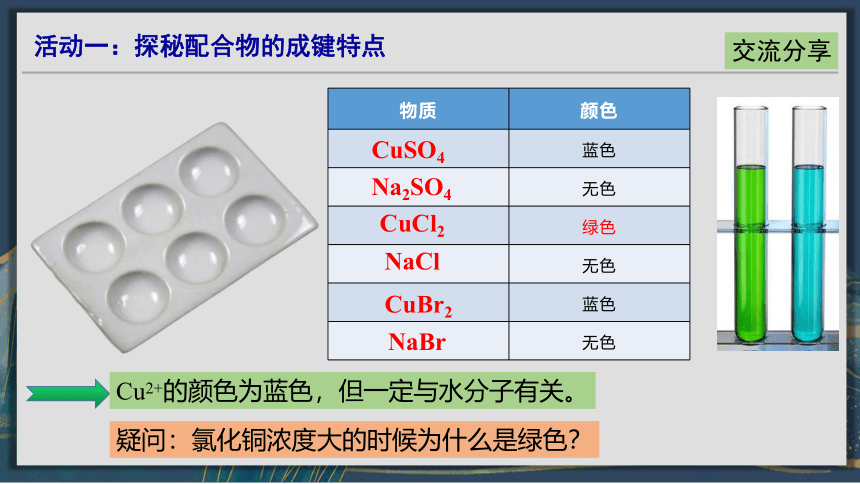
Cu2+的颜色为蓝色,但一定与水分子有关。
物质 颜色
蓝色
无色
绿色
无色
蓝色
无色
NaCl
CuBr2
NaBr
Na2SO4
CuSO4
CuCl2
疑问:氯化铜浓度大的时候为什么是绿色?
活动一:探秘配合物的成键特点
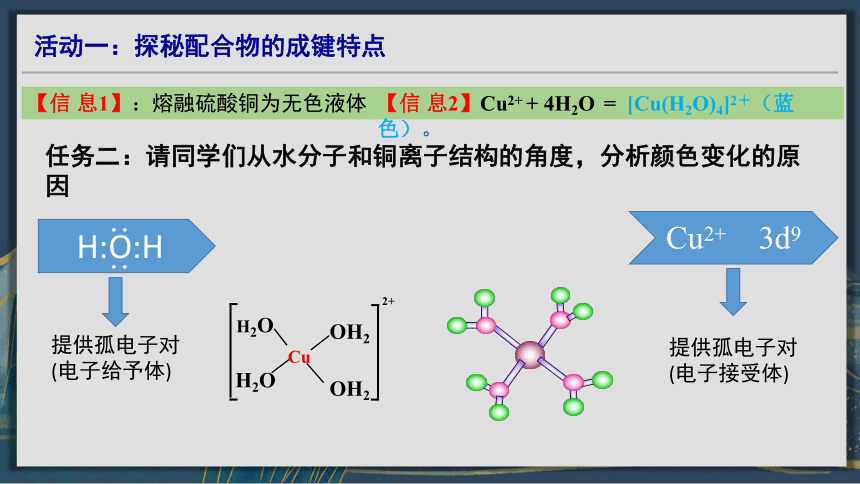
【信 息1】:熔融硫酸铜为无色液体
任务二:请同学们从水分子和铜离子结构的角度,分析颜色变化的原因
Cu2+ 3d9
H:O:H
:
:
提供孤电子对
(电子给予体)
提供孤电子对
(电子接受体)
【信 息2】Cu2+ + 4H2O = [Cu(H2O)4]2+(蓝色)。
Cu
OH2
H2O
H2O
2+
OH2
活动一:探秘配合物的成键特点
配位键:“电子对给予-接受”键,是一类特殊的共价键
形成条件
一方能给予孤电子对
另一方能接受电子对(有空轨道)
NH3、H2O、Cl-、SCN-等。
H+、Ag+、Fe3+、Cu2+、Zn2+、Mg2+、Al3+、Fe、Ni等
配位化合物:通常把金属离子或原子(中心原子或离子)与某些分子或离子(配体)以配位键结合形成的化合物成为配位化合物,简称配合物
探究活动二:再探配合物在水溶液中的行为
演示实验
逐滴加入氨水
任务三:小组合作,分析溶液变成深蓝色的原因,并设计实验验证猜想
加氨水至过量
氢氧化铜具有两性
Cu2+与氨分子作用的结果
Cu2+、SO42-与氨分子作用的结果
探究活动二:再探配合物在水溶液中的行为
逐滴加入
NaOH溶液
加NaOH溶液至过量
CuSO4
实验结论:深蓝色溶液是Cu2+与氨水中微粒作用的结果
放入一根
光亮的铁钉
无明显实验现象
加入BaCl2溶液
有白色沉淀产生
实验验证
氢氧化铜具有两性
Cu2+参与形成使溶液呈深蓝色的微粒
SO42-未参与形成使溶液呈深蓝色的微粒
探究活动二:再探配合物在水溶液中的行为
阳离子
[Cu(NH3)4]2+
(深蓝色)
任务四:请你根据氨水中微粒和铜离子的结构,写出使溶液呈深蓝色的微粒的化学式。
中心离子
配位数
外界
内界
[Cu(NH3)4]SO4·H2O
配体
符号表征
蓝色晶体
阴离子
SO42-
加95%乙醇
总反应:[Cu(H2O)4]2++ 4NH3 [Cu(NH3)4]2+ + 4H2O
配体发生了转化
探究活动二:再探配合物在水溶液中的行为
拓展延伸
思考交流:[Cu(H2O)4]2++ 4NH3 = [Cu(NH3)4]2+ + 4H2O该转化为什么可
以发生呢?
+
4NH3
[Cu(NH3)4]2+
[Cu(H2O)4]2+ Cu2+ + 4H2O
配离子中配体可以相互转化的原因:配位键有强有弱,弱配位键更容易转化
为强配位键
H2O
Cu
H2O
H2O
OH2
2+
NH3
Cu
NH3
H3N
NH3
2+
稳定性
<
探究活动二:再探配合物在水溶液中的行为
得出结论
4NH3
+
[Cu(NH3)4]2+
溶质
溶剂
4H2O
+
[Cu(H2O)4]2+
[Cu(H2O)4]2+
SO42- H2O
[Cu(NH3)4]2+
SO42- H2O
溶液变
深蓝色
导致变化
1
配合物外界完全电离
2
配合物内界的电离非常微弱,存在电离平衡
3
配合物中的配体可以相互转化
CuSO4= SO42-+ Cu2+
[Cu(H2O)4]2+ Cu2++4H2O
溶液变蓝色
导致变化
溶液组成
相互作用
微粒种类
宏观现象
相互作用
微粒种类
宏观现象
任务五:小组讨论,提出假设并设计实验验证
疑问:氯化铜浓度大的时候为什么是绿色?
学以致用
1
Cl- 浓度大导致溶液颜色是绿色
2
Cu2+ 浓度大导致溶液颜色是绿色
探究活动二:再探配合物在水溶液中的行为
学以致用
①
加入CuSO4固体
溶液蓝色加深,但未变绿
②
加入NaCl固体
溶液变绿
Cl-与Cu2+ 形成了新的微粒
[Cu(H2O)4]2+ Cu2+ + 4H2O
+
4Cl-
[Cu(Cl-)4]2-
原因
分析
探究活动二:再探配合物在水溶液中的行为
文献资料
探究活动三:三探配合物的制备
任务六:小组实验,完成实验3-4或者3-5,探究配合物形成
【实验3-4】
向盛有少量0.1 mol/L FeCl3溶液(或任何含Fe3+的溶液)的试管中滴加1滴0.1 mol/L硫氰化钾(KSCN)溶液,观察实验现象。
Fe3++nSCN- = [Fe(SCN)n]3-n
n = 1-6,随SCN-的浓度而异
应用于Fe3+的检验、影视剧和魔术表演中。
动手实验
探究活动三:三探配合物的制备
【实验3-5】
向盛有少量0.1 mol/L NaCl溶液的试管里滴几滴0.1 mol/L AgNO3溶液,产生难溶于水的白色的AgCl沉淀,再滴入1 mol/L氨水,振荡,观察实验现象。
Ag++Cl-=AgCl↓
AgCl+2NH3= [Ag(NH3)2]Cl
动手实验
探究活动三:三探配合物的制备
动手实验
思考
在形成配合物时,对物质的性质有哪些影响?
颜色往往会发生改变
稳定性往往会增强
溶解性会发生改变
探究活动四:探秘配合物的结构与应用
信息:药物Pt(NH3)2Cl2用于癌症治疗,可有效阻止癌细胞分裂。
任务七:Pt(NH3)2Cl2的空间构型会是什么样呢?
小组讨论,说出你的依据。
探究活动四:探秘配合物的结构与应用
你能画出他的两种结构吗?
探究活动四:探秘配合物的结构与应用
探究活动四:探秘配合物的结构与应用
你能解释一氧化碳中毒的原理吗?
为什么会有如此高的死亡率吗?
一氧化碳中毒的病人如何救治?
+
CO
HbCO
Hb+O2 HbO2
总结提升
总结提升
1
完成课后练习,有能力的同学完成分层练习
有兴趣的同学检索影响配位键强弱的因素,并撰写报告
2
谢谢观看,欢迎各位老师批评指正
情境导入
资料:据新华网统计,我国每年死于煤气中毒的人数近3000人,排在交通事故和生产事故的后面第三位。
第三章 第四节 配合物与超分子
第一课时 配合物
学习目标
素养目标
一、发展宏观辨识与微观探析化学学科核心素养;
二、培养实验探究与创新意识的化学学科核心素养。
知识目标
一、知道配位键的特点,认识简单配合物的成键特征;
二、认识配位键与共价键、离子键的异同,能用配位键描述、解释实验现象。
活动一:探秘配合物的成键特点
无水硫酸铜
硫酸铜溶液
CuSO4 5H2O
任务一:请同学们利用老师提供的实验用品,小组讨论,设计实验方案探究颜色变化的原因
活动一:探秘配合物的成键特点
实验试剂
无水硫酸铜粉末、氯化铜固体、硫酸钠固体、氯化钠固体、溴化铜固体、溴化钠固体
活动一:探秘配合物的成键特点
交流分享
CuSO4
①
Na2SO4
②
CuCl2
③
NaCl
④
CuBr2
⑤
NaBr
⑥
物质 颜色
蓝色
无色
蓝色
无色
蓝色
无色
①
②
③
④
⑤
⑥
Cu2+的颜色为蓝色
活动一:探秘配合物的成键特点
交流分享
Cu2+的颜色为蓝色,但一定与水分子有关。
物质 颜色
蓝色
无色
绿色
无色
蓝色
无色
NaCl
CuBr2
NaBr
Na2SO4
CuSO4
CuCl2
疑问:氯化铜浓度大的时候为什么是绿色?
活动一:探秘配合物的成键特点
【信 息1】:熔融硫酸铜为无色液体
任务二:请同学们从水分子和铜离子结构的角度,分析颜色变化的原因
Cu2+ 3d9
H:O:H
:
:
提供孤电子对
(电子给予体)
提供孤电子对
(电子接受体)
【信 息2】Cu2+ + 4H2O = [Cu(H2O)4]2+(蓝色)。
Cu
OH2
H2O
H2O
2+
OH2
活动一:探秘配合物的成键特点
配位键:“电子对给予-接受”键,是一类特殊的共价键
形成条件
一方能给予孤电子对
另一方能接受电子对(有空轨道)
NH3、H2O、Cl-、SCN-等。
H+、Ag+、Fe3+、Cu2+、Zn2+、Mg2+、Al3+、Fe、Ni等
配位化合物:通常把金属离子或原子(中心原子或离子)与某些分子或离子(配体)以配位键结合形成的化合物成为配位化合物,简称配合物
探究活动二:再探配合物在水溶液中的行为
演示实验
逐滴加入氨水
任务三:小组合作,分析溶液变成深蓝色的原因,并设计实验验证猜想
加氨水至过量
氢氧化铜具有两性
Cu2+与氨分子作用的结果
Cu2+、SO42-与氨分子作用的结果
探究活动二:再探配合物在水溶液中的行为
逐滴加入
NaOH溶液
加NaOH溶液至过量
CuSO4
实验结论:深蓝色溶液是Cu2+与氨水中微粒作用的结果
放入一根
光亮的铁钉
无明显实验现象
加入BaCl2溶液
有白色沉淀产生
实验验证
氢氧化铜具有两性
Cu2+参与形成使溶液呈深蓝色的微粒
SO42-未参与形成使溶液呈深蓝色的微粒
探究活动二:再探配合物在水溶液中的行为
阳离子
[Cu(NH3)4]2+
(深蓝色)
任务四:请你根据氨水中微粒和铜离子的结构,写出使溶液呈深蓝色的微粒的化学式。
中心离子
配位数
外界
内界
[Cu(NH3)4]SO4·H2O
配体
符号表征
蓝色晶体
阴离子
SO42-
加95%乙醇
总反应:[Cu(H2O)4]2++ 4NH3 [Cu(NH3)4]2+ + 4H2O
配体发生了转化
探究活动二:再探配合物在水溶液中的行为
拓展延伸
思考交流:[Cu(H2O)4]2++ 4NH3 = [Cu(NH3)4]2+ + 4H2O该转化为什么可
以发生呢?
+
4NH3
[Cu(NH3)4]2+
[Cu(H2O)4]2+ Cu2+ + 4H2O
配离子中配体可以相互转化的原因:配位键有强有弱,弱配位键更容易转化
为强配位键
H2O
Cu
H2O
H2O
OH2
2+
NH3
Cu
NH3
H3N
NH3
2+
稳定性
<
探究活动二:再探配合物在水溶液中的行为
得出结论
4NH3
+
[Cu(NH3)4]2+
溶质
溶剂
4H2O
+
[Cu(H2O)4]2+
[Cu(H2O)4]2+
SO42- H2O
[Cu(NH3)4]2+
SO42- H2O
溶液变
深蓝色
导致变化
1
配合物外界完全电离
2
配合物内界的电离非常微弱,存在电离平衡
3
配合物中的配体可以相互转化
CuSO4= SO42-+ Cu2+
[Cu(H2O)4]2+ Cu2++4H2O
溶液变蓝色
导致变化
溶液组成
相互作用
微粒种类
宏观现象
相互作用
微粒种类
宏观现象
任务五:小组讨论,提出假设并设计实验验证
疑问:氯化铜浓度大的时候为什么是绿色?
学以致用
1
Cl- 浓度大导致溶液颜色是绿色
2
Cu2+ 浓度大导致溶液颜色是绿色
探究活动二:再探配合物在水溶液中的行为
学以致用
①
加入CuSO4固体
溶液蓝色加深,但未变绿
②
加入NaCl固体
溶液变绿
Cl-与Cu2+ 形成了新的微粒
[Cu(H2O)4]2+ Cu2+ + 4H2O
+
4Cl-
[Cu(Cl-)4]2-
原因
分析
探究活动二:再探配合物在水溶液中的行为
文献资料
探究活动三:三探配合物的制备
任务六:小组实验,完成实验3-4或者3-5,探究配合物形成
【实验3-4】
向盛有少量0.1 mol/L FeCl3溶液(或任何含Fe3+的溶液)的试管中滴加1滴0.1 mol/L硫氰化钾(KSCN)溶液,观察实验现象。
Fe3++nSCN- = [Fe(SCN)n]3-n
n = 1-6,随SCN-的浓度而异
应用于Fe3+的检验、影视剧和魔术表演中。
动手实验
探究活动三:三探配合物的制备
【实验3-5】
向盛有少量0.1 mol/L NaCl溶液的试管里滴几滴0.1 mol/L AgNO3溶液,产生难溶于水的白色的AgCl沉淀,再滴入1 mol/L氨水,振荡,观察实验现象。
Ag++Cl-=AgCl↓
AgCl+2NH3= [Ag(NH3)2]Cl
动手实验
探究活动三:三探配合物的制备
动手实验
思考
在形成配合物时,对物质的性质有哪些影响?
颜色往往会发生改变
稳定性往往会增强
溶解性会发生改变
探究活动四:探秘配合物的结构与应用
信息:药物Pt(NH3)2Cl2用于癌症治疗,可有效阻止癌细胞分裂。
任务七:Pt(NH3)2Cl2的空间构型会是什么样呢?
小组讨论,说出你的依据。
探究活动四:探秘配合物的结构与应用
你能画出他的两种结构吗?
探究活动四:探秘配合物的结构与应用
探究活动四:探秘配合物的结构与应用
你能解释一氧化碳中毒的原理吗?
为什么会有如此高的死亡率吗?
一氧化碳中毒的病人如何救治?
+
CO
HbCO
Hb+O2 HbO2
总结提升
总结提升
1
完成课后练习,有能力的同学完成分层练习
有兴趣的同学检索影响配位键强弱的因素,并撰写报告
2
谢谢观看,欢迎各位老师批评指正
