2022-2023学年鲁教版高中化学必修一 3.3.2 氨的转化(共21张PPT)
文档属性
| 名称 | 2022-2023学年鲁教版高中化学必修一 3.3.2 氨的转化(共21张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 15.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-15 00:00:00 | ||
图片预览






文档简介
(共21张PPT)
第3章 物质的性质与转化
第3节 氮的循环
第2课时 氨的转化与生成
鲁科版化学必修第一册
学习目标 核心素养培养
1.认识氨气的物理性质
2.通过实验探究,掌握氨气和铵盐的化学性质,建立从物质类别、元素价态角度研究物质性质的思路和方法。(重点) 证据推理与模型认知
3.能够应用氨气的转化与生成,分析解释生产生活、实验现象、物质保存等问题。 宏观辨识与微观探析
3.3.2 氨的转化与生成
一、氨气
1.物理性质
以小组为单位,观察试管中的氨气归纳其物理性质
无色气体
刺激性气味
<
氨气 液氨
液化
汽化
观察色态:
扇闻气味:
分析密度:
ρNH3 ρ空气
液氨做制冷剂(液氨汽化时要吸收大量的热)
氨是氮肥工业和硝酸工业的重要原料
3.氨的用途
性质
用途
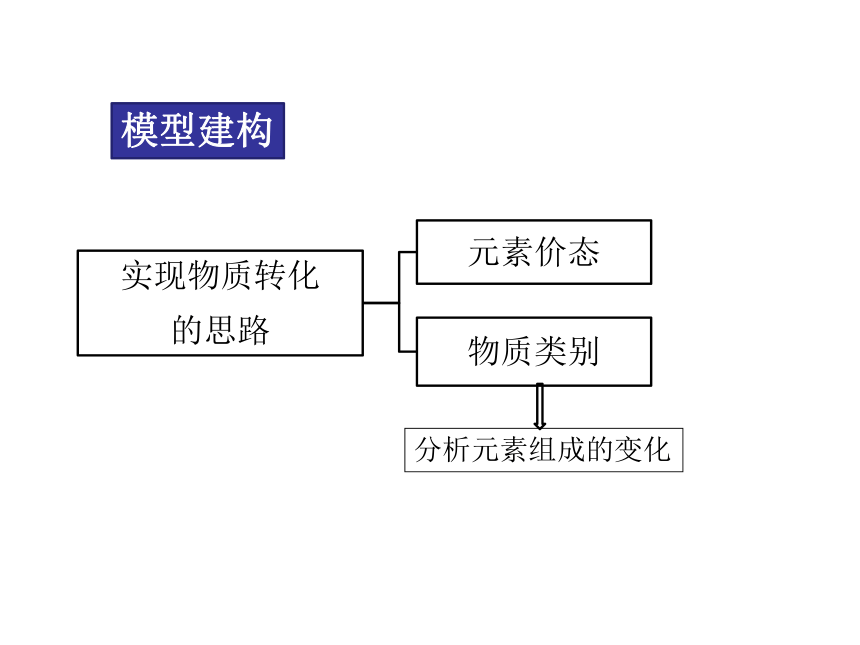
模型建构
分析元素组成的变化
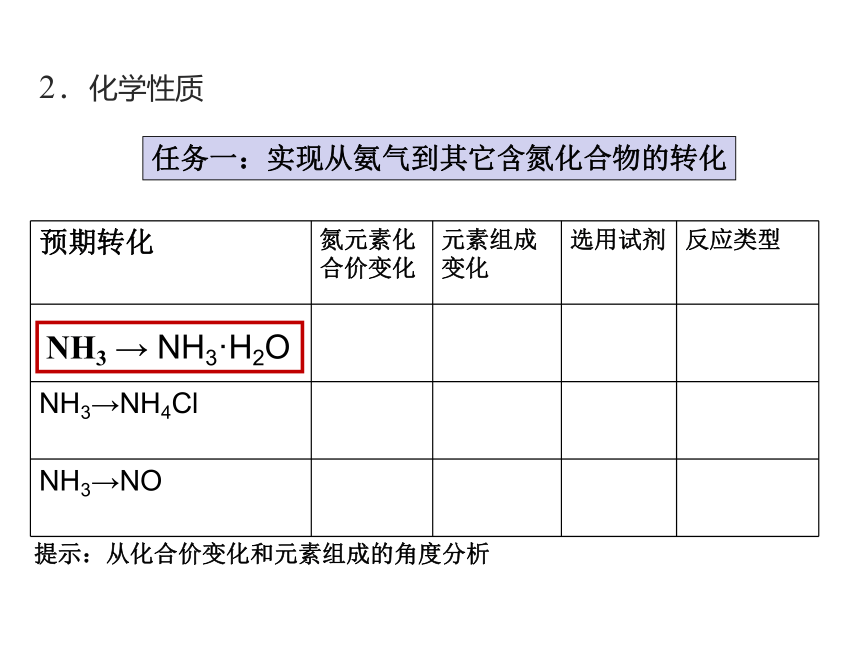
预期转化 氮元素化合价变化 元素组成变化 选用试剂 反应类型
NH3→NH4Cl
NH3→NO
提示:从化合价变化和元素组成的角度分析
2.化学性质
任务一:实现从氨气到其它含氮化合物的转化
NH3 → NH3·H2O
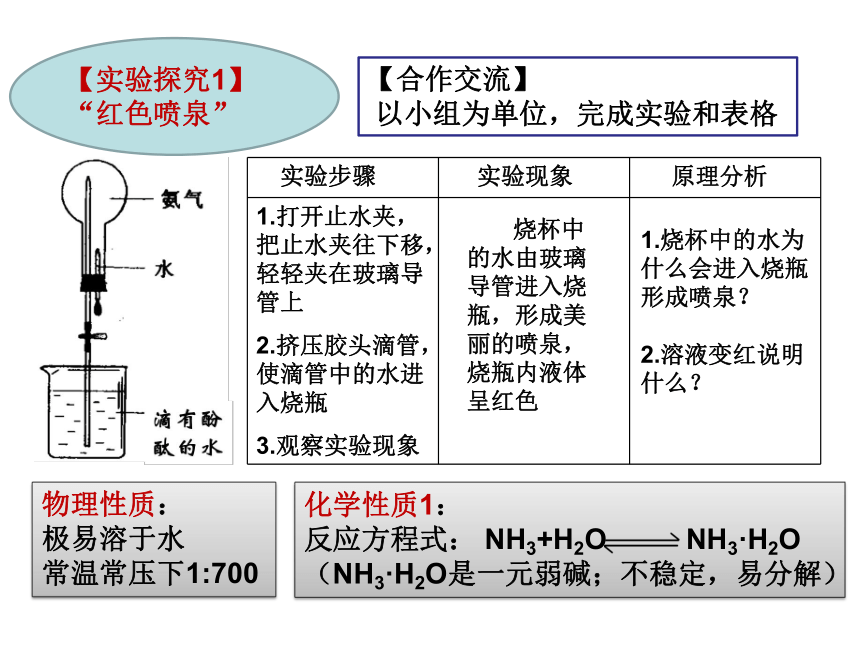
实验步骤 实验现象 原理分析
1.打开止水夹,把止水夹往下移,轻轻夹在玻璃导管上 2.挤压胶头滴管,使滴管中的水进入烧瓶 3.观察实验现象
【合作交流】
以小组为单位,完成实验和表格
【实验探究1】“红色喷泉”
烧杯中的水由玻璃导管进入烧瓶,形成美丽的喷泉,烧瓶内液体呈红色
1.烧杯中的水为什么会进入烧瓶形成喷泉?
2.溶液变红说明什么?
化学性质1:
反应方程式: NH3+H2O NH3·H2O
(NH3·H2O是一元弱碱;不稳定,易分解)
物理性质:
极易溶于水
常温常压下1:700
预期转化 氮元素化合价变化 元素组成变化 选用试剂 反应类型
NH3→NO
提示:从化合价变化和元素组成的角度分析
2.化学性质
任务一:实现从氨气到其它化合物的转化
NH3 → NH3·H2O
NH3→NH4Cl
【实验2】“空瓶生白烟”
NH3+HCl=NH4Cl(白烟)
1.抽去玻片,你观察到了什么现象?
2.产生该现象的原因是什么?
3.有人用两支分别蘸有浓盐酸和浓氨水的玻璃棒相互靠近(不接触),也会产生类似的现象,为什么?
4.将3中的浓盐酸换成浓硫酸,是否会产生类似的现象?为什么?是因为不反应吗?
产生白烟
浓盐酸和浓氨水均具有挥发性,挥发出来的气体发生上述反应
不会(浓硫酸不具有挥发性)
发生反应:2NH3+H2SO4=(NH4)2SO4
性质2:与酸反应生成铵盐
观察实验,思考问题
铵盐:由铵根离子和酸根离子构成的盐
预期转化 氮元素化合价变化 元素组成变化 选用试剂 反应类型
提示:从化合价变化和元素组成的角度分析
2.化学性质
任务一:实现从氨气到其它化合物的转化
NH3 → NH3·H2O
NH3→NH4Cl
NH3→NO
注意:
①是工业制硝酸中的关键步骤
②反应条件:催化剂、加热
氨中氮元素的化合价为最低价,因此氨具有还原性,能与具有氧化性的物质发生反应。
NH3→NO→NO2→HNO3
氨的催化氧化
4NH3+5O2 4NO+6H2O
(利用氧化还原反应中的电子守恒配平)
性质3:具有还原性,能与氧化剂反应
预期转化 氮元素化合价变化 设计思路 选用试剂 反应类型
N2→NH3
提示:从化合价变化和元素组成的角度分析
任务二:实现从氮气和铵盐到氨气的的转化
铵盐→NH3
NH4Cl === NH3↑+ HCl↑
△
试管底部固体逐渐减少,上端内壁有白色固体附着
受热时,氯化铵分解生成NH3、HCl
冷却时,两者在管口又重新结合生成NH4Cl
问题4:实验室能否用加热氯化铵固体的方法制取氨气?为什么?
不能。分解时会产生HCl杂质气体,且二者容易重新化合成NH4Cl
NH4Cl→NH3
问题1:你观察到了什么现象?
问题3:用化学反应方程式表示该过程?
问题2:产生该现象的原因是什么?
NH3+HCl=NH4Cl
【观看视频,完成以下问题】
NH4HCO3 === NH3↑+CO2 ↑ + H2O
△
澄清石灰水变浑浊,试管内壁有水珠,有刺激性气味的气体产生
NH4HCO3 →NH3
问题1:总结视频中的实验现象。
问题2:根据现象写出化学反应方程式
问题3:实验室能否用加热碳酸氢铵固体的方法制取氨气?为什么?
不能。分解时会产生CO2杂质气体
铵盐性质1:受热易分解(不一定产生氨气)
【观看视频,完成以下问题】
铵盐与碱反应 →NH3
应用1:实验室制氨气
原理:2NH4Cl+Ca(OH)2 === CaCl2+2NH3↑+2H2O
(装置的选用、氨气的净化、收集和尾气处理→下节课讨论)
应用2:检验溶液中的 NH4+
取少量待测液于试管中,加入氢氧化钠溶液,加热,将湿润的红色石蕊试纸(或蘸有浓盐酸的玻璃棒)放在试管口,若试纸变蓝(或产生白烟),则说明待测液中含有NH4+
离子反应方程式:NH4+ +OH- === NH3↑ + H2O
△
△
选用NH4Cl和Ca(OH)2
怎么验证产生氨气?
结合铵盐的性质,为铵态氮肥储存和施用提出合理的建议,并说明你的依据
【化学与生活】
密封包装,并放在阴凉通风处(受热易分解 )
不能与碱性物质如草木灰混用(与碱反应降低肥效)
化学源于生产生活
也服务于生产生活
一、氨气的性质
与水反应NH3+H2O NH3·H2O
与酸反应NH3+HCl=NH4Cl
2NH3+H2SO4=(NH4)2SO4
还原性4NH3+5O2 4NO+6H2O
1.物理性质
密度比空气小,有刺激性气味的无色气体,沸点低易液化
2.化学性质
二、铵盐的性质
1.受热易分解
NH4HCO3 === NH3↑+CO2 ↑ + H2O
△
NH4Cl === NH3↑+ HCl↑
△
NH4+ +OH- === NH3↑ + H2O
△
2.与碱反应
2NH4Cl+Ca(OH)2 === CaCl2+2NH3↑+2H2O
△
氨气的转化
氨
气
的
生
成
【课堂小结】
你学会了吗?
来挑战一下吧!
【化学与生活】
假如你在液氨泄露的事故现场,将会采取哪些急救措施?(以小组为单位,进行交流)
拨打报警电话求助(110,119)
低头弯腰,往低处跑(氨气密度比空气小)
捂湿毛巾,利用周围水源向槽罐喷水(氨气与水反应)
用食醋打湿毛巾,捂住口鼻(氨气与酸反应)
化学的伟大:维护生命安全
课后作业:
画一幅氨的转化与生成的思维导图
第3章 物质的性质与转化
第3节 氮的循环
第2课时 氨的转化与生成
鲁科版化学必修第一册
学习目标 核心素养培养
1.认识氨气的物理性质
2.通过实验探究,掌握氨气和铵盐的化学性质,建立从物质类别、元素价态角度研究物质性质的思路和方法。(重点) 证据推理与模型认知
3.能够应用氨气的转化与生成,分析解释生产生活、实验现象、物质保存等问题。 宏观辨识与微观探析
3.3.2 氨的转化与生成
一、氨气
1.物理性质
以小组为单位,观察试管中的氨气归纳其物理性质
无色气体
刺激性气味
<
氨气 液氨
液化
汽化
观察色态:
扇闻气味:
分析密度:
ρNH3 ρ空气
液氨做制冷剂(液氨汽化时要吸收大量的热)
氨是氮肥工业和硝酸工业的重要原料
3.氨的用途
性质
用途
模型建构
分析元素组成的变化
预期转化 氮元素化合价变化 元素组成变化 选用试剂 反应类型
NH3→NH4Cl
NH3→NO
提示:从化合价变化和元素组成的角度分析
2.化学性质
任务一:实现从氨气到其它含氮化合物的转化
NH3 → NH3·H2O
实验步骤 实验现象 原理分析
1.打开止水夹,把止水夹往下移,轻轻夹在玻璃导管上 2.挤压胶头滴管,使滴管中的水进入烧瓶 3.观察实验现象
【合作交流】
以小组为单位,完成实验和表格
【实验探究1】“红色喷泉”
烧杯中的水由玻璃导管进入烧瓶,形成美丽的喷泉,烧瓶内液体呈红色
1.烧杯中的水为什么会进入烧瓶形成喷泉?
2.溶液变红说明什么?
化学性质1:
反应方程式: NH3+H2O NH3·H2O
(NH3·H2O是一元弱碱;不稳定,易分解)
物理性质:
极易溶于水
常温常压下1:700
预期转化 氮元素化合价变化 元素组成变化 选用试剂 反应类型
NH3→NO
提示:从化合价变化和元素组成的角度分析
2.化学性质
任务一:实现从氨气到其它化合物的转化
NH3 → NH3·H2O
NH3→NH4Cl
【实验2】“空瓶生白烟”
NH3+HCl=NH4Cl(白烟)
1.抽去玻片,你观察到了什么现象?
2.产生该现象的原因是什么?
3.有人用两支分别蘸有浓盐酸和浓氨水的玻璃棒相互靠近(不接触),也会产生类似的现象,为什么?
4.将3中的浓盐酸换成浓硫酸,是否会产生类似的现象?为什么?是因为不反应吗?
产生白烟
浓盐酸和浓氨水均具有挥发性,挥发出来的气体发生上述反应
不会(浓硫酸不具有挥发性)
发生反应:2NH3+H2SO4=(NH4)2SO4
性质2:与酸反应生成铵盐
观察实验,思考问题
铵盐:由铵根离子和酸根离子构成的盐
预期转化 氮元素化合价变化 元素组成变化 选用试剂 反应类型
提示:从化合价变化和元素组成的角度分析
2.化学性质
任务一:实现从氨气到其它化合物的转化
NH3 → NH3·H2O
NH3→NH4Cl
NH3→NO
注意:
①是工业制硝酸中的关键步骤
②反应条件:催化剂、加热
氨中氮元素的化合价为最低价,因此氨具有还原性,能与具有氧化性的物质发生反应。
NH3→NO→NO2→HNO3
氨的催化氧化
4NH3+5O2 4NO+6H2O
(利用氧化还原反应中的电子守恒配平)
性质3:具有还原性,能与氧化剂反应
预期转化 氮元素化合价变化 设计思路 选用试剂 反应类型
N2→NH3
提示:从化合价变化和元素组成的角度分析
任务二:实现从氮气和铵盐到氨气的的转化
铵盐→NH3
NH4Cl === NH3↑+ HCl↑
△
试管底部固体逐渐减少,上端内壁有白色固体附着
受热时,氯化铵分解生成NH3、HCl
冷却时,两者在管口又重新结合生成NH4Cl
问题4:实验室能否用加热氯化铵固体的方法制取氨气?为什么?
不能。分解时会产生HCl杂质气体,且二者容易重新化合成NH4Cl
NH4Cl→NH3
问题1:你观察到了什么现象?
问题3:用化学反应方程式表示该过程?
问题2:产生该现象的原因是什么?
NH3+HCl=NH4Cl
【观看视频,完成以下问题】
NH4HCO3 === NH3↑+CO2 ↑ + H2O
△
澄清石灰水变浑浊,试管内壁有水珠,有刺激性气味的气体产生
NH4HCO3 →NH3
问题1:总结视频中的实验现象。
问题2:根据现象写出化学反应方程式
问题3:实验室能否用加热碳酸氢铵固体的方法制取氨气?为什么?
不能。分解时会产生CO2杂质气体
铵盐性质1:受热易分解(不一定产生氨气)
【观看视频,完成以下问题】
铵盐与碱反应 →NH3
应用1:实验室制氨气
原理:2NH4Cl+Ca(OH)2 === CaCl2+2NH3↑+2H2O
(装置的选用、氨气的净化、收集和尾气处理→下节课讨论)
应用2:检验溶液中的 NH4+
取少量待测液于试管中,加入氢氧化钠溶液,加热,将湿润的红色石蕊试纸(或蘸有浓盐酸的玻璃棒)放在试管口,若试纸变蓝(或产生白烟),则说明待测液中含有NH4+
离子反应方程式:NH4+ +OH- === NH3↑ + H2O
△
△
选用NH4Cl和Ca(OH)2
怎么验证产生氨气?
结合铵盐的性质,为铵态氮肥储存和施用提出合理的建议,并说明你的依据
【化学与生活】
密封包装,并放在阴凉通风处(受热易分解 )
不能与碱性物质如草木灰混用(与碱反应降低肥效)
化学源于生产生活
也服务于生产生活
一、氨气的性质
与水反应NH3+H2O NH3·H2O
与酸反应NH3+HCl=NH4Cl
2NH3+H2SO4=(NH4)2SO4
还原性4NH3+5O2 4NO+6H2O
1.物理性质
密度比空气小,有刺激性气味的无色气体,沸点低易液化
2.化学性质
二、铵盐的性质
1.受热易分解
NH4HCO3 === NH3↑+CO2 ↑ + H2O
△
NH4Cl === NH3↑+ HCl↑
△
NH4+ +OH- === NH3↑ + H2O
△
2.与碱反应
2NH4Cl+Ca(OH)2 === CaCl2+2NH3↑+2H2O
△
氨气的转化
氨
气
的
生
成
【课堂小结】
你学会了吗?
来挑战一下吧!
【化学与生活】
假如你在液氨泄露的事故现场,将会采取哪些急救措施?(以小组为单位,进行交流)
拨打报警电话求助(110,119)
低头弯腰,往低处跑(氨气密度比空气小)
捂湿毛巾,利用周围水源向槽罐喷水(氨气与水反应)
用食醋打湿毛巾,捂住口鼻(氨气与酸反应)
化学的伟大:维护生命安全
课后作业:
画一幅氨的转化与生成的思维导图
