2022-2023学年鲁教版高中化学必修一 3.1亚铁盐和铁盐(共20张PPT)
文档属性
| 名称 | 2022-2023学年鲁教版高中化学必修一 3.1亚铁盐和铁盐(共20张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 8.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-15 19:43:11 | ||
图片预览








文档简介
(共20张PPT)
第3章 物质的性质与转化
第1节 铁的多样性
1.结合实例认识铁的多样性 ,运用“价-类”二维图进行整理和分类。
2.通过探究亚铁盐和铁盐的性质—以FeSO4、 FeCl3为例,建构基于物质类别和元素价态对物质性质进行预测和验证的认识模型,并能设计实验进行验证。发展“证据推理与模型认知”“科学探究与创新意识”的核心素养。
3.能利用离子方程式正确表示Fe2+、Fe3+的相互转化
4.能分析实验室、生产、生活中铁及其化合物的问题,提升解决真实问题的能力。
学习与评价目标
学业目标
化学眼 看材料——广泛存在的铁
伟大的“世纪工程”
港珠澳大桥是世界最长的跨海大桥!
祖国的强大离不开铁!!!
同学们的茁壮成长离不开铁!这些物质多以铁盐的形式存在。
真实情景激疑
1. Fe3+ 的检验:
如何检验该补铁剂是否变质?
滴加KSCN溶液
FeC13溶液 反应后溶液显红色
Fe3++3SCN- Fe(SCN)3
==
【活动·探究】
【实验目的】
以FeSO4、FeCl3 为例,通过实验探究亚铁盐和铁盐的性质
一、亚铁盐和铁盐
走进实验室
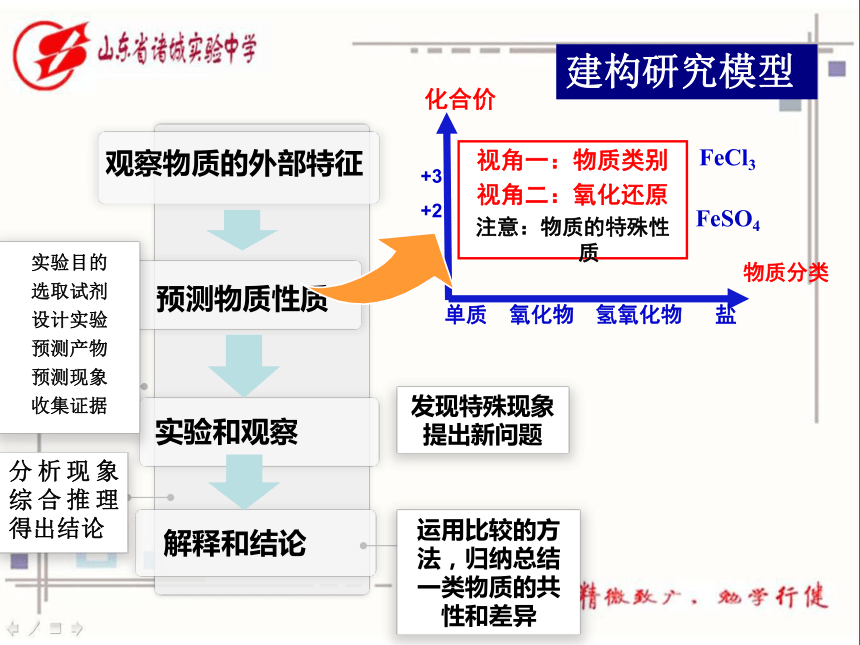
思考:通过第一章的学习,你知道研究物质性质的程序是怎么样的?从哪些角度预测物质性质呢?
发现特殊现象
提出新问题
解释和结论
运用比较的方法,归纳总结一类物质的共性和差异
实验和观察
预测物质性质
观察物质的外部特征
实验目的
选取试剂
设计实验
预测产物
预测现象
收集证据
分析现象综合推理得出结论
建构研究模型
单质 氧化物 氢氧化物 盐
+3
+2
0
物质分类
化合价
FeCl3
FeSO4
视角一:物质类别
视角二:氧化还原
注意:物质的特殊性质
任务分解
第一步:预测与假设
1.请你根据研究物质性质的角度,预测FeSO4、FeCl3具有什么样的性质?并说出你的依据。
自主思考
单质 氧化物 氢氧化物 盐
+3
+2
0
物质分类
化合价
FeCl3
FeSO4
视角一:物质类别
视角二:氧化还原
注意:物质的特殊性质
加入氧化剂,使其化合价升高;
加入还原剂,使其化合价降低;
探究物质具
有还原性
探究方法
探究物质具有氧化性
方法导引
任务分解
第一步:预测与假设
1.请你根据研究物质性质的角度,预测FeSO4 、FeCl3具有什么样的性质?
自主思考小组交流
第二步:试剂分类根据所提供的试剂选择合适的试剂,设计合理的实验方案验证你的预测。
具有氧化性的试剂: ,
具有还原性的试剂: 。
氧化剂:FeCl3溶液、 FeSO4溶液、氯水、酸性高锰酸钾溶液
还原剂: FeSO4溶液、Zn、Fe、Cu、KI溶液
第三步:设计探究实验方案
根据所提供的试剂选择合适的试剂,设计合理的实验方案验证你的预测;如果你的预测是正确的,请写出你预测的实验现象
物质 预测角度 预测性质 选取试剂 预测现象
实验现象 实验结论
离子方程式
FeSO4 物质类别 与碱反应
元素化合价 还原性
氧化性
FeCl3 物质类别 与碱反应
元素化合价
氧化性
自主思考小组交流
任务分解
第三步:设计探究实验方案
根据所提供的试剂选择合适的试剂,设计合理的实验方案验证你的预测;
物质 预测角度 预测性质 选取试剂 预测现象
实验现象 实验结论
离子方程式
FeSO4 物质类别 与碱反应 NaOH溶液
元素化合价 还原性
氧化性
FeCl3 物质类别 与碱反应 NaOH溶液
元素化合价
氧化性
自主思考小组交流
任务分解
FeCl3溶液、FeSO4溶液、氯水、高锰酸钾
FeSO4溶液、Zn、Fe、Cu、KI溶液
FeSO4溶液、Zn、Fe、Cu 、KI溶液
√
√
√
√
√
√
√
理论支撑:氧化还原反应规律
如何借助其他试剂证明你的预测?
方法导引:Fe3+ 与KSCN溶液反应显红色
第三步:设计探究实验方案
根据所提供的试剂选择合适的试剂,设计合理的实验方案验证你的预测;如果你的预测是正确的,请写出你预测的实验现象
物质 预测角度 预测性质 选取试剂 预测现象
实验现象 实验结论
离子方程式
FeSO4 物质类别 与碱反应 NaOH溶液 白色沉淀
元素化合价 还原性
KMnO4溶液 紫色退去
氯水KSCN 溶液变为血红色
氧化性 锌片 浅绿色变浅
FeCl3 物质类别 与碱反应 NaOH溶液 红褐色沉淀
元素化合价
氧化性
Fe粉、Zn片 黄色溶液变为浅绿色
铜片 铜片溶解溶液变为蓝色
KI溶液 加淀粉变蓝
自主思考小组交流
任务分解
物质 预测角度 预测性质 选取试剂 预测现象
实验现象 实验结论
离子方程式
FeSO4 物质类别 与碱反应 NaOH溶液 白色沉淀
元素化合价 还原性
KMnO4溶液 紫色退去
氯水、KSCN 溶液变为血红色
氧化性 锌片 浅绿色变浅
FeCl3 物质类别 与碱反应 NaOH溶液 红褐色沉淀
元素化合价
氧化性
Fe粉、Zn片 黄色溶液变为浅绿色
铜片 铜片溶解溶液变为蓝色
KI溶液 加淀粉变蓝
任务分解
第四步:实验与观察
1.安全提示:氯水有腐蚀性,注意安全
2.小组分工合作:记录现象
3.试剂参考用量: 液体:1-2ml 铁粉:1/3药匙
KSCN溶液:2-3滴 铜片:两片
4.实验操作要规范。
物质 预测角度 预测性质 选取试剂 预测现象
实验现象 实验结论
离子方程式
FeSO4 物质类别 与碱反应 NaOH溶液 白色沉淀
元素化合价 还原性
KMnO4溶液 紫色退去 正确
具有还原性
氯水KSCN 溶液变为血红色 正确
氧化性 锌片 浅绿色变浅 具有氧化性
FeCl3 物质类别 与碱反应 NaOH溶液 红褐色沉淀 正确
元素化合价
氧化性
Fe粉、Zn片 黄色溶液变为浅绿色
具有氧化性
铜片 铜片溶解溶液变为蓝色 正确
KI溶液 加淀粉变蓝 正确
任务分解
第五步:解释及结论
白色沉淀迅速变成灰绿色最终变成红褐色
二价铁的代表物质
三价铁的代表物质
相同价态的物 质具有相同的氧化性或还原性
单质 氧化物 氢氧化物 盐
+3
+2
0
Fe
Fe(OH)2
Fe(OH)3
物质分类
化合价
FeO
Fe2O3
Fe3O4
Fe3+
Fe2+
视角一:物质类别
视角二:氧化还原
注意:物质的特殊性质
写出实验中涉及的化学反应的离子方程式
1.方法收获
2.知识收获
这种思想将引领我们元素化合物的学习!
1.工业上利用氯化铁溶液腐蚀铜箔制印刷线路板的原理是什么?
2.为什么在配制好的FeSO4溶液中常常加入铁钉或铁粉?试着说出其中的道理并分析所发生的化学反应。
学以致用
课堂 实验室 社会 生活
第3章 物质的性质与转化
第1节 铁的多样性
1.结合实例认识铁的多样性 ,运用“价-类”二维图进行整理和分类。
2.通过探究亚铁盐和铁盐的性质—以FeSO4、 FeCl3为例,建构基于物质类别和元素价态对物质性质进行预测和验证的认识模型,并能设计实验进行验证。发展“证据推理与模型认知”“科学探究与创新意识”的核心素养。
3.能利用离子方程式正确表示Fe2+、Fe3+的相互转化
4.能分析实验室、生产、生活中铁及其化合物的问题,提升解决真实问题的能力。
学习与评价目标
学业目标
化学眼 看材料——广泛存在的铁
伟大的“世纪工程”
港珠澳大桥是世界最长的跨海大桥!
祖国的强大离不开铁!!!
同学们的茁壮成长离不开铁!这些物质多以铁盐的形式存在。
真实情景激疑
1. Fe3+ 的检验:
如何检验该补铁剂是否变质?
滴加KSCN溶液
FeC13溶液 反应后溶液显红色
Fe3++3SCN- Fe(SCN)3
==
【活动·探究】
【实验目的】
以FeSO4、FeCl3 为例,通过实验探究亚铁盐和铁盐的性质
一、亚铁盐和铁盐
走进实验室
思考:通过第一章的学习,你知道研究物质性质的程序是怎么样的?从哪些角度预测物质性质呢?
发现特殊现象
提出新问题
解释和结论
运用比较的方法,归纳总结一类物质的共性和差异
实验和观察
预测物质性质
观察物质的外部特征
实验目的
选取试剂
设计实验
预测产物
预测现象
收集证据
分析现象综合推理得出结论
建构研究模型
单质 氧化物 氢氧化物 盐
+3
+2
0
物质分类
化合价
FeCl3
FeSO4
视角一:物质类别
视角二:氧化还原
注意:物质的特殊性质
任务分解
第一步:预测与假设
1.请你根据研究物质性质的角度,预测FeSO4、FeCl3具有什么样的性质?并说出你的依据。
自主思考
单质 氧化物 氢氧化物 盐
+3
+2
0
物质分类
化合价
FeCl3
FeSO4
视角一:物质类别
视角二:氧化还原
注意:物质的特殊性质
加入氧化剂,使其化合价升高;
加入还原剂,使其化合价降低;
探究物质具
有还原性
探究方法
探究物质具有氧化性
方法导引
任务分解
第一步:预测与假设
1.请你根据研究物质性质的角度,预测FeSO4 、FeCl3具有什么样的性质?
自主思考小组交流
第二步:试剂分类根据所提供的试剂选择合适的试剂,设计合理的实验方案验证你的预测。
具有氧化性的试剂: ,
具有还原性的试剂: 。
氧化剂:FeCl3溶液、 FeSO4溶液、氯水、酸性高锰酸钾溶液
还原剂: FeSO4溶液、Zn、Fe、Cu、KI溶液
第三步:设计探究实验方案
根据所提供的试剂选择合适的试剂,设计合理的实验方案验证你的预测;如果你的预测是正确的,请写出你预测的实验现象
物质 预测角度 预测性质 选取试剂 预测现象
实验现象 实验结论
离子方程式
FeSO4 物质类别 与碱反应
元素化合价 还原性
氧化性
FeCl3 物质类别 与碱反应
元素化合价
氧化性
自主思考小组交流
任务分解
第三步:设计探究实验方案
根据所提供的试剂选择合适的试剂,设计合理的实验方案验证你的预测;
物质 预测角度 预测性质 选取试剂 预测现象
实验现象 实验结论
离子方程式
FeSO4 物质类别 与碱反应 NaOH溶液
元素化合价 还原性
氧化性
FeCl3 物质类别 与碱反应 NaOH溶液
元素化合价
氧化性
自主思考小组交流
任务分解
FeCl3溶液、FeSO4溶液、氯水、高锰酸钾
FeSO4溶液、Zn、Fe、Cu、KI溶液
FeSO4溶液、Zn、Fe、Cu 、KI溶液
√
√
√
√
√
√
√
理论支撑:氧化还原反应规律
如何借助其他试剂证明你的预测?
方法导引:Fe3+ 与KSCN溶液反应显红色
第三步:设计探究实验方案
根据所提供的试剂选择合适的试剂,设计合理的实验方案验证你的预测;如果你的预测是正确的,请写出你预测的实验现象
物质 预测角度 预测性质 选取试剂 预测现象
实验现象 实验结论
离子方程式
FeSO4 物质类别 与碱反应 NaOH溶液 白色沉淀
元素化合价 还原性
KMnO4溶液 紫色退去
氯水KSCN 溶液变为血红色
氧化性 锌片 浅绿色变浅
FeCl3 物质类别 与碱反应 NaOH溶液 红褐色沉淀
元素化合价
氧化性
Fe粉、Zn片 黄色溶液变为浅绿色
铜片 铜片溶解溶液变为蓝色
KI溶液 加淀粉变蓝
自主思考小组交流
任务分解
物质 预测角度 预测性质 选取试剂 预测现象
实验现象 实验结论
离子方程式
FeSO4 物质类别 与碱反应 NaOH溶液 白色沉淀
元素化合价 还原性
KMnO4溶液 紫色退去
氯水、KSCN 溶液变为血红色
氧化性 锌片 浅绿色变浅
FeCl3 物质类别 与碱反应 NaOH溶液 红褐色沉淀
元素化合价
氧化性
Fe粉、Zn片 黄色溶液变为浅绿色
铜片 铜片溶解溶液变为蓝色
KI溶液 加淀粉变蓝
任务分解
第四步:实验与观察
1.安全提示:氯水有腐蚀性,注意安全
2.小组分工合作:记录现象
3.试剂参考用量: 液体:1-2ml 铁粉:1/3药匙
KSCN溶液:2-3滴 铜片:两片
4.实验操作要规范。
物质 预测角度 预测性质 选取试剂 预测现象
实验现象 实验结论
离子方程式
FeSO4 物质类别 与碱反应 NaOH溶液 白色沉淀
元素化合价 还原性
KMnO4溶液 紫色退去 正确
具有还原性
氯水KSCN 溶液变为血红色 正确
氧化性 锌片 浅绿色变浅 具有氧化性
FeCl3 物质类别 与碱反应 NaOH溶液 红褐色沉淀 正确
元素化合价
氧化性
Fe粉、Zn片 黄色溶液变为浅绿色
具有氧化性
铜片 铜片溶解溶液变为蓝色 正确
KI溶液 加淀粉变蓝 正确
任务分解
第五步:解释及结论
白色沉淀迅速变成灰绿色最终变成红褐色
二价铁的代表物质
三价铁的代表物质
相同价态的物 质具有相同的氧化性或还原性
单质 氧化物 氢氧化物 盐
+3
+2
0
Fe
Fe(OH)2
Fe(OH)3
物质分类
化合价
FeO
Fe2O3
Fe3O4
Fe3+
Fe2+
视角一:物质类别
视角二:氧化还原
注意:物质的特殊性质
写出实验中涉及的化学反应的离子方程式
1.方法收获
2.知识收获
这种思想将引领我们元素化合物的学习!
1.工业上利用氯化铁溶液腐蚀铜箔制印刷线路板的原理是什么?
2.为什么在配制好的FeSO4溶液中常常加入铁钉或铁粉?试着说出其中的道理并分析所发生的化学反应。
学以致用
课堂 实验室 社会 生活
