1.1 原子结构(第2课时) 课件(30张ppt) 2022-2023学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 1.1 原子结构(第2课时) 课件(30张ppt) 2022-2023学年高二化学人教版(2019)选择性必修2 |

|
|
| 格式 | zip | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-15 00:00:00 | ||
图片预览







文档简介
(共30张PPT)
第一节 原子结构
(第二课时)
高二—人教版—化学—选择性必修2—第一章
学习目标
结合构造原理形成核外电子排布式书写的思维模型,能够熟练书写1~36号元素的电子排布式。
(1)各能层最多能容纳2n2个电子。
(2)最外层电子数目不超过8个(K层为最外层时不超过2个);
次外层电子数最多不超过18个;
倒数第三层不超过32个。
(3)核外电子总是尽量先排满能量最低、离核最近的能层,
然后才由里往外,依次排在能量较高能层。
而失电子总是先失最外层电子。
核外电子在能层中的排布规律
能层中填充电子表示方法——原子结构示意图
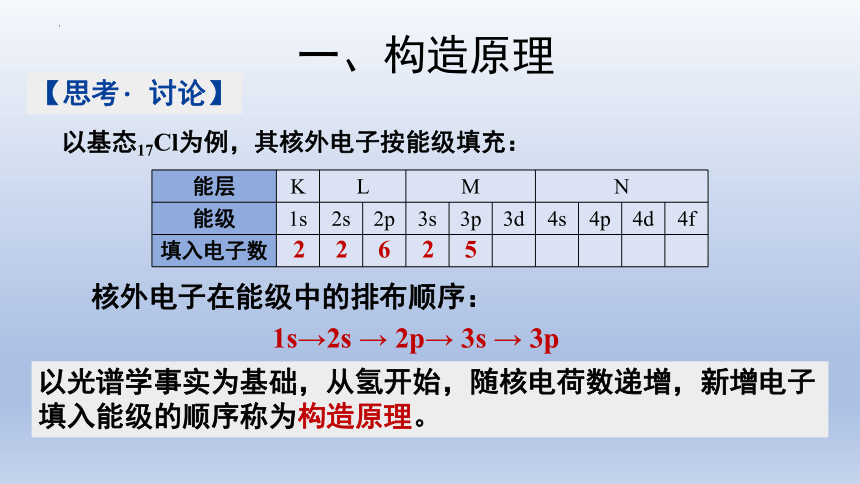
能层 K L M N 能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
填入电子数
将1~18号元素核外电子按能级填充填下面的表格,直至填满。
【思考 讨论】
能层 K L M N 能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
填入电子数
1s→2s → 2p→ 3s → 3p
以基态17Cl为例,其核外电子按能级填充:
【思考 讨论】
一、构造原理
以光谱学事实为基础,从氢开始,随核电荷数递增,新增电子填入能级的顺序称为构造原理。
核外电子在能级中的排布顺序:
2
2
6
2
5
【巩固 评价】
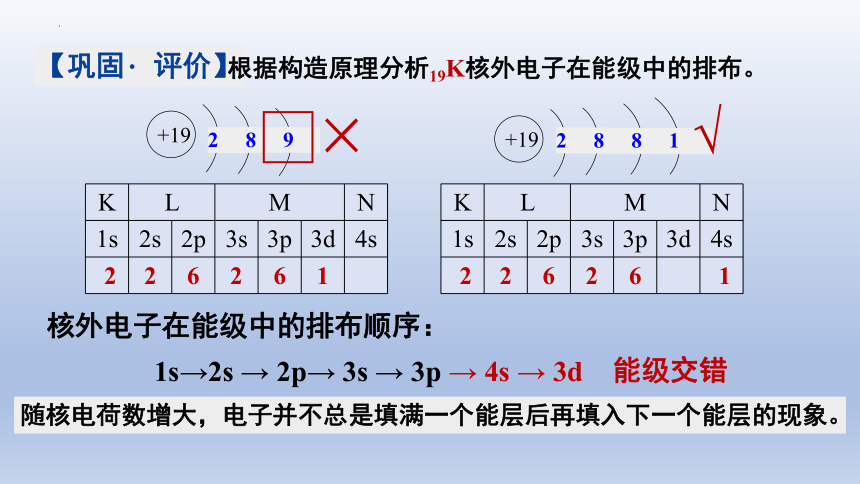
根据构造原理分析19K核外电子在能级中的排布。
+19
2 8 9
+19
2 8 8 1
1s→2s → 2p→ 3s → 3p → 4s → 3d
能级交错
K L M N
1s 2s 2p 3s 3p 3d 4s
2 2 6 2 6 1
K L M N
1s 2s 2p 3s 3p 3d 4s
2 2 6 2 6 1
√
随核电荷数增大,电子并不总是填满一个能层后再填入下一个能层的现象。
核外电子在能级中的排布顺序:
×
书本P10
构造原理:
1s→2s → 2p→ 3s → 3p
→ 4s → 3d → 4p
→ 5s → 4d → 5p
→ 6s → 4f → 5d → 6p
→ 7s → 5f → 6d → 7p
构造原理规律
ns→(n-2)f→(n-1)d→np (n为能层序数)
二、电子排布式
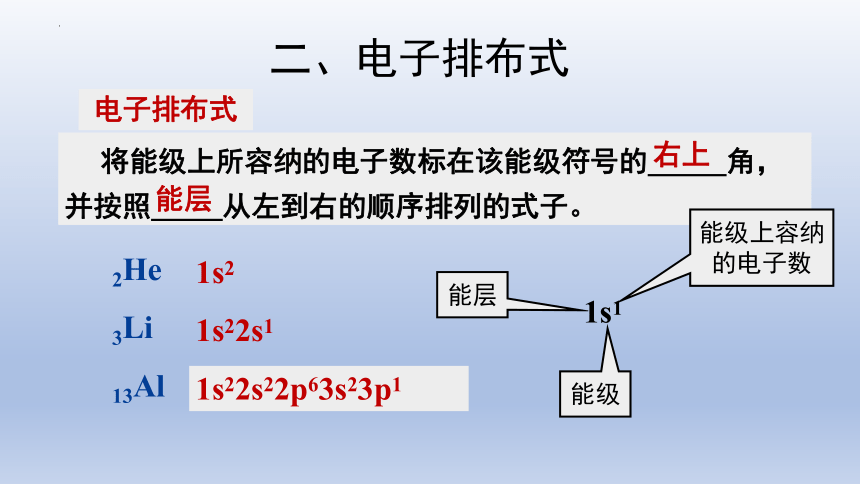
2He
3Li
13Al
1s22s1
1s22s22p63s23p1
1s2
将能级上所容纳的电子数标在该能级符号的 角,并按照 从左到右的顺序排列的式子。
电子排布式
右上
能层
1s1
能层
能级上容纳的电子数
能级
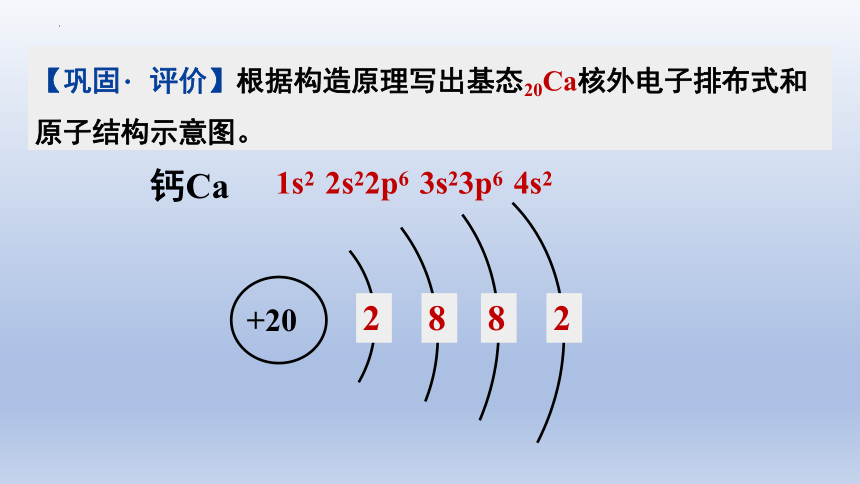
1s2 2s22p6 3s23p6 4s2
钙Ca
+20
2
8
8
2
【巩固 评价】根据构造原理写出基态20Ca核外电子排布式和原子结构示意图。
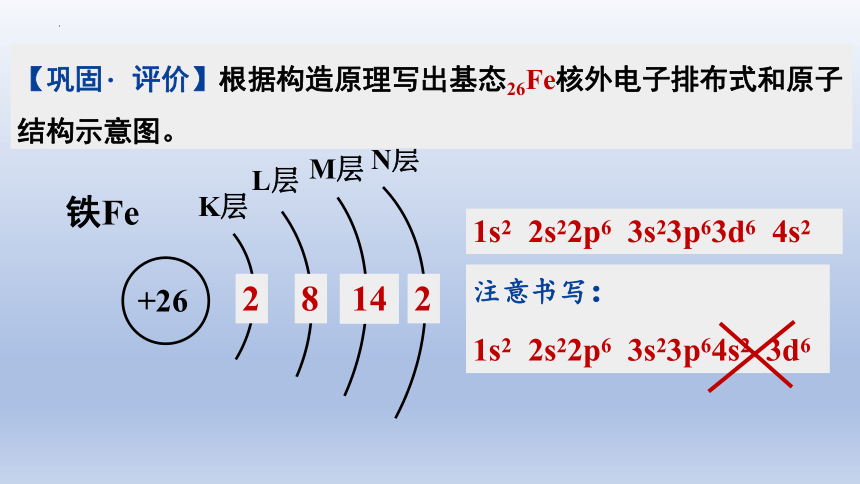
铁Fe
+26
K层
L层
M层
2
8
14
2
N层
1s2 2s22p6 3s23p63d6 4s2
注意书写:
1s2 2s22p6 3s23p64s2 3d6
【巩固 评价】根据构造原理写出基态26Fe核外电子排布式和原子结构示意图。
【巩固 评价】请写出第1—36号元素原子的基态电子排布式。
原子 序数 元素 名称 元素 符号 电子排布式 K L M
1 氢 H 1s1
2 氦 He 1s2
【巩固 评价】请写出第1—36号元素原子的基态电子排布式。
原子 序数 元素 名称 元素 符号 电子排布式 K L M
3 锂 Li 1s2 2s1
4 铍 Be 1s2 2s2
5 硼 B 1s2 2s22p1
6 碳 C 1s2 2s22p2
7 氮 N 1s2 2s22p3
8 氧 O 1s2 2s22p4
9 氟 F 1s2 2s22p5
10 氖 Ne 1s2 2s22p6
原子序数 元素 名称 元素符号 电子排布式 K L M
11 钠 Na 1s2 2s22p6 3s1
12 镁 Mg 1s2 2s22p6 3s2
13 铝 Al 1s2 2s22p6 3s23p1
14 硅 Si 1s2 2s22p6 3s23p2
15 磷 P 1s2 2s22p6 3s23p3
16 硫 S 1s2 2s22p6 3s23p4
17 氯 Cl 1s2 2s22p6 3s23p5
18 氩 Ar 1s2 2s22p6 3s23p6
【巩固 评价】请写出第1—36号元素原子的基态电子排布式。
原子序数 元素名称 元素符号 电子排布式 K L M N
19 钾 K 1s2 2s22p6 3s23p6 4s1
20 钙 Ca 1s2 2s22p6 3s23p6 4s2
21 钪 Sc 1s2 2s22p6 3s23p63d1 4s2
22 钛 Ti 1s2 2s22p6 3s23p63d2 4s2
【巩固 评价】请写出第1—36号元素原子的基态电子排布式。
原子序数 元素名称 元素符号 电子排布式 K L M N
23 钒 V 1s2 2s22p6 3s23p63d3 4s2
24 铬 Cr 1s2 2s22p6 3s23p63d4 4s1
25 锰 Mn 1s2 2s22p6 3s23p63d5 4s2
26 铁 Fe 1s2 2s22p6 3s23p63d6 4s2
27 钴 Co 1s2 2s22p6 3s23p63d7 4s2
28 镍 Ni 1s2 2s22p6 3s23p63d8 4s2
29 铜 Cu 1s2 2s22p6 3s23p63d10 4s1
30 锌 Zn 1s2 2s22p6 3s23p63d10 4s2
【巩固 评价】请写出第1—36号元素原子的基态电子排布式。
原子序数 元素名称 元素符号 电子排布式 K L M N
31 镓 Ga 1s2 2s22p6 3s23p63d10 4s24p1
32 锗 Ge 1s2 2s22p6 3s23p63d10 4s24p2
33 砷 As 1s2 2s22p6 3s23p63d10 4s24p3
34 硒 Se 1s2 2s22p6 3s23p63d10 4s24p4
35 溴 Br 1s2 2s22p6 3s23p63d10 4s24p5
36 氪 Kr 1s2 2s22p6 3s23p63d10 4s24p6
【巩固 评价】请写出第1—36号元素原子的基态电子排布式。
1.按照构造原理写出稀有气体2He、10Ne、18Ar、36Kr、54Xe和86Rn的基态原子的最外层电子排布;除氦外它们的通式是什么?
1s2
2s2 2p6
3s2 3p6
4s2 4p6
5s2 5p6
6s2 6p6
通式:ns2 np6
【思考 讨论】
书本P11
2He
10Ne
18Ar
36Kr
54Xe
86Rn
2. 电子排布式可以简化,如钠的电子排布式可简化为[Ne]3s1。 试问: [Ne]的意义是什么?仿照该式,写出8O、14Si和22Ti的简化电子排布式。
【思考 讨论】
书本P11
[Ne]表示内层电子已达到稀有气体Ne结构的部分,可称为原子实。
带有原子实的电子排布式称为简化电子排布式。
2. 电子排布式可以简化,如钠的电子排布式可简化为[Ne]3s1。 试问: [Ne]的意义是什么?仿照该式,写出8O、14Si和22Ti的简化电子排布式。
8O
14Si
22Ti
[He] 2s22p4
[Ne] 3s23p2
[Ar] 3d24s2
【思考 讨论】
书本P11
该元素的上一周期的稀有气体
在价层的电子称为价层电子,决定元素的化学性质。
在化学反应中可能发生电子变动的能级称为价电子层,简称价层。
[Ne]3s1
11Na 1s22s22p63s1
3s1
简化
简化
电子排布式
简化电子排布式
价层电子排布式
简化电子排布式和价层电子排布式
只有价电子层的电子排布式称为价层电子排布式
3. 请写出26Fe、33Ga基态电子排布式、简化电子排布式和价层电子排布。
基态电子排布式:1s22s22p63s23p63d64s2 1s22s22p63s23p63d104s24p1
简化电子排布式: [Ar]3d64s2 [Ar] 3d104s24p1
价层电子排布式: 3d64s2 4s24p1
【思考 讨论】
书本P11
26 Fe 33Ga
4. 请写出Na+ 、 Fe3+、Cl-电子排布式。
【思考 讨论】
Fe3+
1s22s22p63s23p6
Na+
Cl-
1s22s22p63s23p63d64s2
1s22s22p63s23p5
1s22s22p63s23p63d5
1s22s22p63s1
1s22s22p6
1s22s22p63s2
基态镁原子
(3)基态与激发态相互转化的关系:
基态与激发态
(1)基态原子:处于最低能量的原子叫基态原子。
(2)激发态原子:当基态原子的电子吸收能量后,电子会跃迁到较高
的能级,变成激发态原子。
基态原子
激发态原子
吸收能量
释放能量
1s22s22p63s13p1
激发态镁原子
原子光谱
能层
能级
基态、激发态
电子排布式
原子结构示意图
构造原理
构造原理
1.原子核外的电子运动状态是怎么样的?
2.不同能级中最多可容纳电子数为什么不同
能层 K L M N 最多电子数 2 8 18 32 能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
最多电子数 2 2 6 2 6 10 2 6 10 14
图片源自网络
谢谢
第一节 原子结构
(第二课时)
高二—人教版—化学—选择性必修2—第一章
学习目标
结合构造原理形成核外电子排布式书写的思维模型,能够熟练书写1~36号元素的电子排布式。
(1)各能层最多能容纳2n2个电子。
(2)最外层电子数目不超过8个(K层为最外层时不超过2个);
次外层电子数最多不超过18个;
倒数第三层不超过32个。
(3)核外电子总是尽量先排满能量最低、离核最近的能层,
然后才由里往外,依次排在能量较高能层。
而失电子总是先失最外层电子。
核外电子在能层中的排布规律
能层中填充电子表示方法——原子结构示意图
能层 K L M N 能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
填入电子数
将1~18号元素核外电子按能级填充填下面的表格,直至填满。
【思考 讨论】
能层 K L M N 能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
填入电子数
1s→2s → 2p→ 3s → 3p
以基态17Cl为例,其核外电子按能级填充:
【思考 讨论】
一、构造原理
以光谱学事实为基础,从氢开始,随核电荷数递增,新增电子填入能级的顺序称为构造原理。
核外电子在能级中的排布顺序:
2
2
6
2
5
【巩固 评价】
根据构造原理分析19K核外电子在能级中的排布。
+19
2 8 9
+19
2 8 8 1
1s→2s → 2p→ 3s → 3p → 4s → 3d
能级交错
K L M N
1s 2s 2p 3s 3p 3d 4s
2 2 6 2 6 1
K L M N
1s 2s 2p 3s 3p 3d 4s
2 2 6 2 6 1
√
随核电荷数增大,电子并不总是填满一个能层后再填入下一个能层的现象。
核外电子在能级中的排布顺序:
×
书本P10
构造原理:
1s→2s → 2p→ 3s → 3p
→ 4s → 3d → 4p
→ 5s → 4d → 5p
→ 6s → 4f → 5d → 6p
→ 7s → 5f → 6d → 7p
构造原理规律
ns→(n-2)f→(n-1)d→np (n为能层序数)
二、电子排布式
2He
3Li
13Al
1s22s1
1s22s22p63s23p1
1s2
将能级上所容纳的电子数标在该能级符号的 角,并按照 从左到右的顺序排列的式子。
电子排布式
右上
能层
1s1
能层
能级上容纳的电子数
能级
1s2 2s22p6 3s23p6 4s2
钙Ca
+20
2
8
8
2
【巩固 评价】根据构造原理写出基态20Ca核外电子排布式和原子结构示意图。
铁Fe
+26
K层
L层
M层
2
8
14
2
N层
1s2 2s22p6 3s23p63d6 4s2
注意书写:
1s2 2s22p6 3s23p64s2 3d6
【巩固 评价】根据构造原理写出基态26Fe核外电子排布式和原子结构示意图。
【巩固 评价】请写出第1—36号元素原子的基态电子排布式。
原子 序数 元素 名称 元素 符号 电子排布式 K L M
1 氢 H 1s1
2 氦 He 1s2
【巩固 评价】请写出第1—36号元素原子的基态电子排布式。
原子 序数 元素 名称 元素 符号 电子排布式 K L M
3 锂 Li 1s2 2s1
4 铍 Be 1s2 2s2
5 硼 B 1s2 2s22p1
6 碳 C 1s2 2s22p2
7 氮 N 1s2 2s22p3
8 氧 O 1s2 2s22p4
9 氟 F 1s2 2s22p5
10 氖 Ne 1s2 2s22p6
原子序数 元素 名称 元素符号 电子排布式 K L M
11 钠 Na 1s2 2s22p6 3s1
12 镁 Mg 1s2 2s22p6 3s2
13 铝 Al 1s2 2s22p6 3s23p1
14 硅 Si 1s2 2s22p6 3s23p2
15 磷 P 1s2 2s22p6 3s23p3
16 硫 S 1s2 2s22p6 3s23p4
17 氯 Cl 1s2 2s22p6 3s23p5
18 氩 Ar 1s2 2s22p6 3s23p6
【巩固 评价】请写出第1—36号元素原子的基态电子排布式。
原子序数 元素名称 元素符号 电子排布式 K L M N
19 钾 K 1s2 2s22p6 3s23p6 4s1
20 钙 Ca 1s2 2s22p6 3s23p6 4s2
21 钪 Sc 1s2 2s22p6 3s23p63d1 4s2
22 钛 Ti 1s2 2s22p6 3s23p63d2 4s2
【巩固 评价】请写出第1—36号元素原子的基态电子排布式。
原子序数 元素名称 元素符号 电子排布式 K L M N
23 钒 V 1s2 2s22p6 3s23p63d3 4s2
24 铬 Cr 1s2 2s22p6 3s23p63d4 4s1
25 锰 Mn 1s2 2s22p6 3s23p63d5 4s2
26 铁 Fe 1s2 2s22p6 3s23p63d6 4s2
27 钴 Co 1s2 2s22p6 3s23p63d7 4s2
28 镍 Ni 1s2 2s22p6 3s23p63d8 4s2
29 铜 Cu 1s2 2s22p6 3s23p63d10 4s1
30 锌 Zn 1s2 2s22p6 3s23p63d10 4s2
【巩固 评价】请写出第1—36号元素原子的基态电子排布式。
原子序数 元素名称 元素符号 电子排布式 K L M N
31 镓 Ga 1s2 2s22p6 3s23p63d10 4s24p1
32 锗 Ge 1s2 2s22p6 3s23p63d10 4s24p2
33 砷 As 1s2 2s22p6 3s23p63d10 4s24p3
34 硒 Se 1s2 2s22p6 3s23p63d10 4s24p4
35 溴 Br 1s2 2s22p6 3s23p63d10 4s24p5
36 氪 Kr 1s2 2s22p6 3s23p63d10 4s24p6
【巩固 评价】请写出第1—36号元素原子的基态电子排布式。
1.按照构造原理写出稀有气体2He、10Ne、18Ar、36Kr、54Xe和86Rn的基态原子的最外层电子排布;除氦外它们的通式是什么?
1s2
2s2 2p6
3s2 3p6
4s2 4p6
5s2 5p6
6s2 6p6
通式:ns2 np6
【思考 讨论】
书本P11
2He
10Ne
18Ar
36Kr
54Xe
86Rn
2. 电子排布式可以简化,如钠的电子排布式可简化为[Ne]3s1。 试问: [Ne]的意义是什么?仿照该式,写出8O、14Si和22Ti的简化电子排布式。
【思考 讨论】
书本P11
[Ne]表示内层电子已达到稀有气体Ne结构的部分,可称为原子实。
带有原子实的电子排布式称为简化电子排布式。
2. 电子排布式可以简化,如钠的电子排布式可简化为[Ne]3s1。 试问: [Ne]的意义是什么?仿照该式,写出8O、14Si和22Ti的简化电子排布式。
8O
14Si
22Ti
[He] 2s22p4
[Ne] 3s23p2
[Ar] 3d24s2
【思考 讨论】
书本P11
该元素的上一周期的稀有气体
在价层的电子称为价层电子,决定元素的化学性质。
在化学反应中可能发生电子变动的能级称为价电子层,简称价层。
[Ne]3s1
11Na 1s22s22p63s1
3s1
简化
简化
电子排布式
简化电子排布式
价层电子排布式
简化电子排布式和价层电子排布式
只有价电子层的电子排布式称为价层电子排布式
3. 请写出26Fe、33Ga基态电子排布式、简化电子排布式和价层电子排布。
基态电子排布式:1s22s22p63s23p63d64s2 1s22s22p63s23p63d104s24p1
简化电子排布式: [Ar]3d64s2 [Ar] 3d104s24p1
价层电子排布式: 3d64s2 4s24p1
【思考 讨论】
书本P11
26 Fe 33Ga
4. 请写出Na+ 、 Fe3+、Cl-电子排布式。
【思考 讨论】
Fe3+
1s22s22p63s23p6
Na+
Cl-
1s22s22p63s23p63d64s2
1s22s22p63s23p5
1s22s22p63s23p63d5
1s22s22p63s1
1s22s22p6
1s22s22p63s2
基态镁原子
(3)基态与激发态相互转化的关系:
基态与激发态
(1)基态原子:处于最低能量的原子叫基态原子。
(2)激发态原子:当基态原子的电子吸收能量后,电子会跃迁到较高
的能级,变成激发态原子。
基态原子
激发态原子
吸收能量
释放能量
1s22s22p63s13p1
激发态镁原子
原子光谱
能层
能级
基态、激发态
电子排布式
原子结构示意图
构造原理
构造原理
1.原子核外的电子运动状态是怎么样的?
2.不同能级中最多可容纳电子数为什么不同
能层 K L M N 最多电子数 2 8 18 32 能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
最多电子数 2 2 6 2 6 10 2 6 10 14
图片源自网络
谢谢
