第1章 物质及其变化 单元测验(含答案)
文档属性
| 名称 | 第1章 物质及其变化 单元测验(含答案) |
|
|
| 格式 | zip | ||
| 文件大小 | 318.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-01-16 00:00:00 | ||
图片预览


文档简介
第一章物质及其变化单元测验
一、选择题(每题3分,共15题)
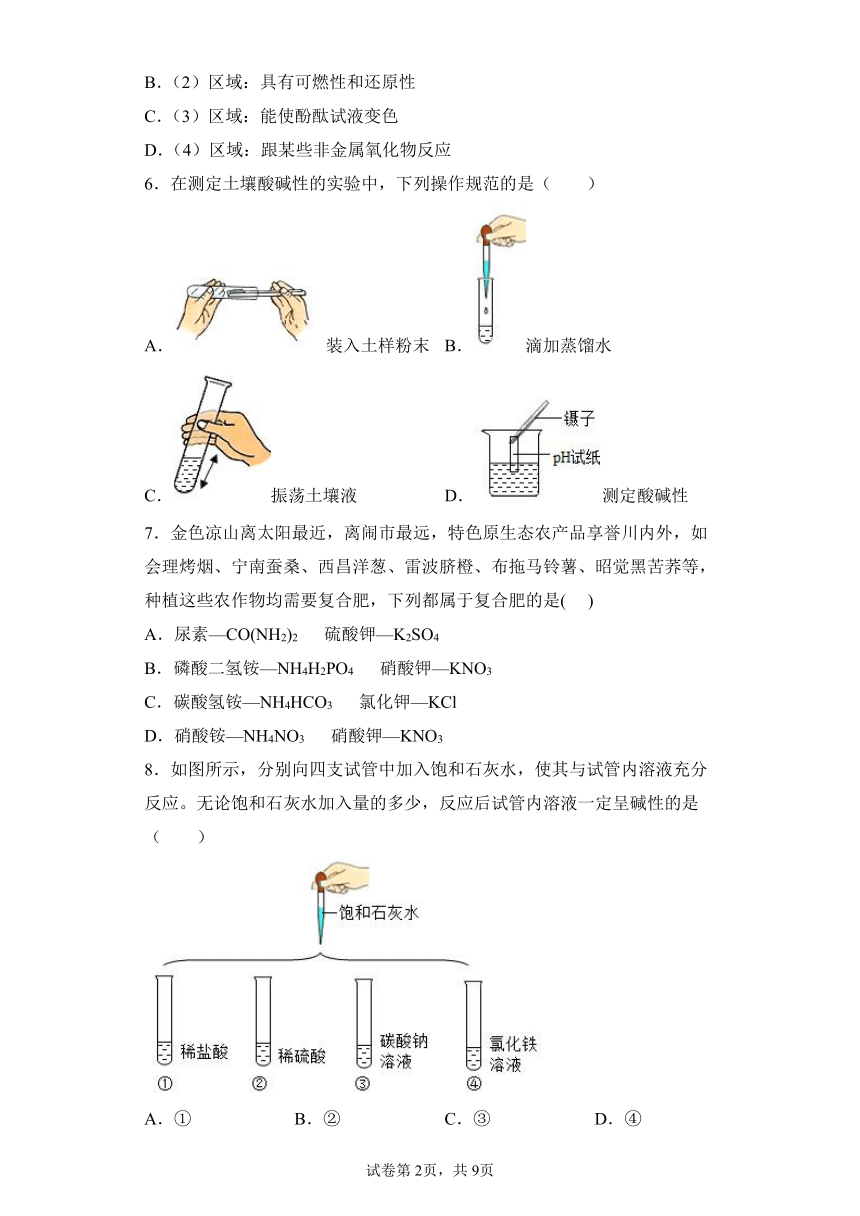
1.稀释浓硫酸并进行硫酸性质实验的操作中,正确的是( )
A.稀释浓硫酸 B.测稀硫酸的pH
C.取用稀硫酸 D.闻稀硫酸的气味
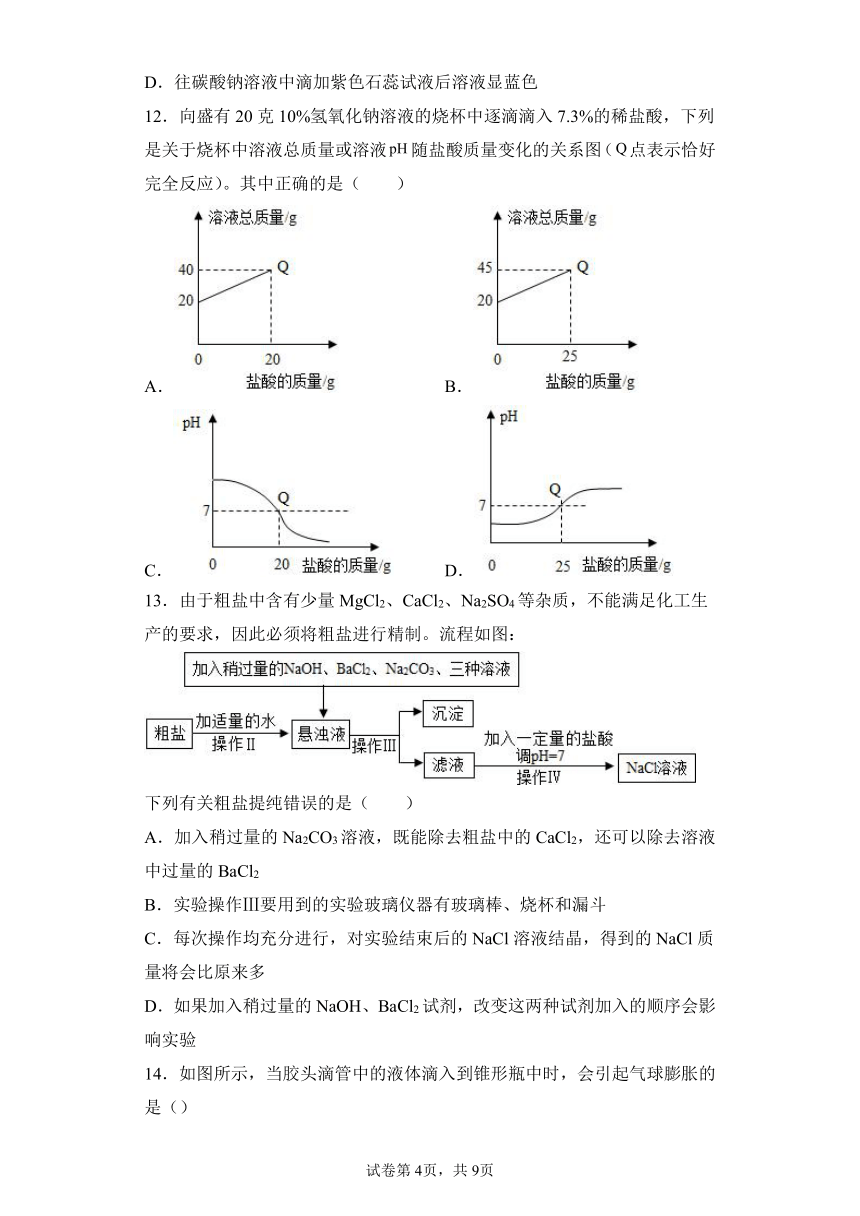
2.下列物质敞口放置,质量会减轻的是( )
A.浓盐酸 B.浓硫酸 C.氢氧化钠 D.碳酸钙
3.下列说法中,正确的是( )
A.水电解生成氢气和氧气,说明水中含有氢分子和氧分子
B.在水的电解反应中,氢原子和氧原子都没有发生变化
C.水的蒸发和水的电解都生成气体,它们都是化学变化
D.物质在变化中所表现出的性质,就是物质的化学性质
4.某地种植的植株矮小,必须施用含有氮元素和磷元素的复合肥。下列化肥中最适合的是( )
A.(NH4)2HPO4 B.Ca3(PO4)2 C.KNO3 D.CO(NH2)2
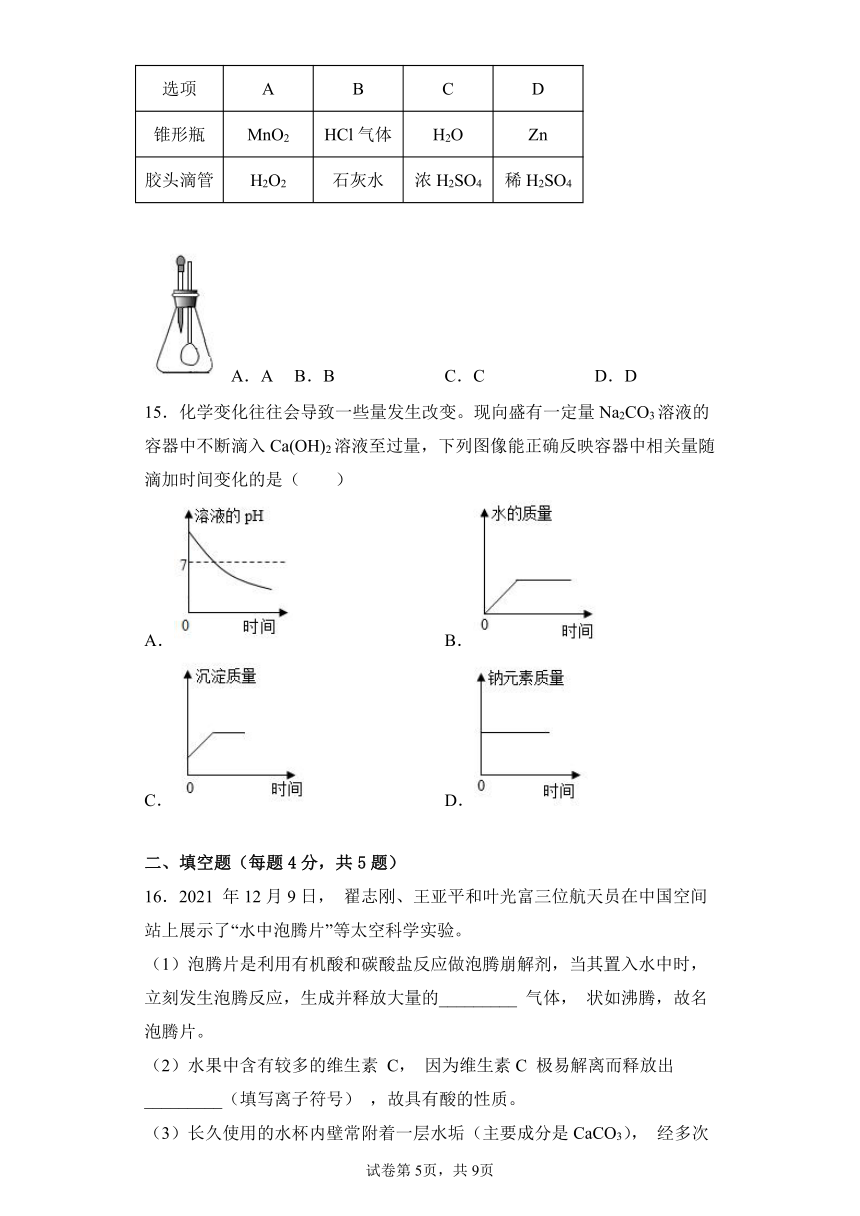
5.归纳总结、对比分析是常用的科学方法,如图所示:两圆重叠的区域表示它们的共同特征(相似点),重叠区域以外的部分表示它们的独有特征(不同点),某同学对(1)(2)(3)(4)区域相对应的内容填写错误的是( )
A.(1)区域:由碳元素和氧元素组成
B.(2)区域:具有可燃性和还原性
C.(3)区域:能使酚酞试液变色
D.(4)区域:跟某些非金属氧化物反应
6.在测定土壤酸碱性的实验中,下列操作规范的是( )
A.装入土样粉末 B.滴加蒸馏水
C.振荡土壤液 D.测定酸碱性
7.金色凉山离太阳最近,离闹市最远,特色原生态农产品享誉川内外,如会理烤烟、宁南蚕桑、西昌洋葱、雷波脐橙、布拖马铃薯、昭觉黑苦荞等,种植这些农作物均需要复合肥,下列都属于复合肥的是( )
A.尿素—CO(NH2)2 硫酸钾—K2SO4
B.磷酸二氢铵—NH4H2PO4 硝酸钾—KNO3
C.碳酸氢铵—NH4HCO3 氯化钾—KCl
D.硝酸铵—NH4NO3 硝酸钾—KNO3
8.如图所示,分别向四支试管中加入饱和石灰水,使其与试管内溶液充分反应。无论饱和石灰水加入量的多少,反应后试管内溶液一定呈碱性的是( )
A.① B.② C.③ D.④
9.2021 年 12 月 9 日王亚平在太空授课时,邀请地面的同学一起演示将泡腾片放入水中的实验。甲图,学 生在地面将泡腾片放入水中,有许多气泡从水面逸出; 乙图,王亚平在空间站将同样的泡腾片放入水球中,产生的气泡大部分留在水球中。下列分析不正确的是( )
A.泡腾片呈黄色是它的物理性质
B.将一片泡腾片分成两半,是物理变化
C.甲、乙两图中气泡运动情况不同,说明泡腾片从地面带到空间站发生了化学变化。
D.不管是在地面上还是在空间站里,同样的泡腾片在水里都发生反应生成气泡,体现了它的化学性质。
10.下图为氢氧化钠溶液与稀盐酸反应过程中的pH随时间变化曲线,有关分析错误的( )
A.该实验是将氢氧化钠溶液滴入稀盐酸中
B.a点对应溶液的溶质为氯化钠和氯化氢
C.b点表示氢氧化钠和稀盐酸恰好完全反应
D.a点到b点的曲线变化证明该反应放热
11.Na2CO3的水溶液呈碱性,下列说法错误的是( )
A.碳酸钠在水中会电离出 OH -
B.往碳酸钠溶液中加稀硫酸后溶液的 pH 降低
C.碳酸钠溶液中存在 OH -
D.往碳酸钠溶液中滴加紫色石蕊试液后溶液显蓝色
12.向盛有20克10%氢氧化钠溶液的烧杯中逐滴滴入7.3%的稀盐酸,下列是关于烧杯中溶液总质量或溶液随盐酸质量变化的关系图(点表示恰好完全反应)。其中正确的是( )
A. B.
C. D.
13.由于粗盐中含有少量MgCl2、CaCl2、Na2SO4等杂质,不能满足化工生产的要求,因此必须将粗盐进行精制。流程如图:
下列有关粗盐提纯错误的是( )
A.加入稍过量的Na2CO3溶液,既能除去粗盐中的CaCl2,还可以除去溶液中过量的BaCl2
B.实验操作Ⅲ要用到的实验玻璃仪器有玻璃棒、烧杯和漏斗
C.每次操作均充分进行,对实验结束后的NaCl溶液结晶,得到的NaCl质量将会比原来多
D.如果加入稍过量的NaOH、BaCl2试剂,改变这两种试剂加入的顺序会影响实验
14.如图所示,当胶头滴管中的液体滴入到锥形瓶中时,会引起气球膨胀的是()
选项 A B C D
锥形瓶 MnO2 HCl气体 H2O Zn
胶头滴管 H2O2 石灰水 浓H2SO4 稀H2SO4
A.A B.B C.C D.D
15.化学变化往往会导致一些量发生改变。现向盛有一定量Na2CO3溶液的容器中不断滴入Ca(OH)2溶液至过量,下列图像能正确反映容器中相关量随滴加时间变化的是( )
A. B.
C. D.
二、填空题(每题4分,共5题)
16.2021 年12月9日, 翟志刚、王亚平和叶光富三位航天员在中国空间站上展示了“水中泡腾片”等太空科学实验。
(1)泡腾片是利用有机酸和碳酸盐反应做泡腾崩解剂,当其置入水中时,立刻发生泡腾反应,生成并释放大量的_________ 气体, 状如沸腾,故名泡腾片。
(2)水果中含有较多的维生素 C, 因为维生素C 极易解离而释放出 _________(填写离子符号) ,故具有酸的性质。
(3)长久使用的水杯内壁常附着一层水垢(主要成分是CaCO3), 经多次维生素C泡腾片溶液浸泡后, 水杯内水垢会消失,说明碳酸的酸性比维生素C的酸性 ___________ 。
17.某一废水中含有一定质量CaCl2和HCl,往混合溶液中逐滴滴入Na2CO3溶液的质量,与反应中产生气体或沉淀的质量关系如下图。已知OE段发生化学反应时产生气体,请用化学方程式来表示:___________;完全反应后G点溶液的pH___________7( 选“大于、 小于、等于”)
18.室温时,随着向盛有稀硫酸的烧杯中逐滴加入Ba(OH)2溶液,烧杯内溶液中的溶质质量变化如图所示(忽略溶液温度的变化)。b点溶液中含量较多的阳离子有_______,d点溶液中滴加紫色石蕊试液,溶液变_______。
19.如图表示酸溶液在发生化学变化时得到的不同颜色的溶液,请根据图回答:
(1)试剂A的名称是___________。
(2)若B是氧化物,则B的化学式为___________。
(3)若C是单质,则X与C的反应现象为___________。
(4)若X是稀硫酸,D是碱,则X和D反应的化学方程式为___________。
20.及时归纳是学好科学的主要方法之一、利用如图所示的结构图归纳盐的四个方面的科学性质(图中编号①-④),请归纳有关知识。
(1)在归纳性质②时,选取了硫酸铜和氢氧化钠两种物质,它们在溶液中相互反应时产生的现象是___________,化学方程式为___________。
(2)在性质③中,X代表___________类物质。
三、探究题(每题10分,共2题)
21.某学习小组在探究“酸碱反应"时,向滴有酚酞的氢氧化钠溶液中加盐酸并振荡,观察到红色消失。他们认为“红色消失”可能有2种原因:①可能氢氧化钠和盐酸反应了;②可能酚酞和盐酸反应了。所以不能根据“红色消失"得出“氢氧化钠和盐酸能反应"的结论。
于是,他们继续进行探究:检验反应后的溶液中是否存在氢氧化钠、酚酞。
[实验过程]
实验步骤 具体操作 实验现象 分析并得出结论
第一步 将反应后的A溶液分成B和C两等份 / A溶液中不存在___________,说明氢氧化钠和盐酸发生了反应
第二步 在B中滴加酚酞,振荡 溶液不变红
第三步 在C中滴加氢氧化钠溶液,振荡 溶液变红
[交流反思]小科认为要得出“酸和碱能反应”的普遍规律,还需进行的实验是___________。
小科按自己的想法继续实验后得出“酸和碱能反应”。小科通过进一步学习,知道酸和碱反应有水生成。那怎么验证酸和碱反应有水生成呢?
[资料补充]①硅胶固体遇水会变色。②冰醋酸为纯净物。
[实验设计]
[实验分析]实验中出现___________现象,说明冰醋酸和氢氧化钠反应有水生成。
22.电导率和pH 传感器可辅助探究复分解反应的实质。某兴趣小组运用电导率和 pH 传感器探究硫酸和氢氧化钡溶液的反应。实验装置如图甲所示,实验数据如图乙所示。注:电导率是以数字表示的溶液传导电流的能力,单位以微西门子每厘米(μS/cm)表示。
根据以上信息回答下列问题:
(1)实验开始时,溶液电导率较高的原因是溶液含有大量自由移动的______离子(写离子符号)。
(2)如图乙,C点电导率最低的原因是______;
(3)将恒压滴液漏斗中液体换成以下哪种溶液,测得电导率图像与图乙相似______;
A.HCl B.CuSO4 C.MgSO4 D.NaNO3
四、简答题
23.(7分)为了除去实验室NaCl溶液中含有少量的MgCl2、CaCl2和Na2SO4等杂质,某小组同学选用。Na2CO3溶液、稀盐酸、Ba(OH)2溶液三种试剂,按一定的顺序进行如图所示的实验。
回答下列问题:
(1)操作Ⅰ用到玻璃棒的作用是___________
(2)实验Ⅰ中加入试剂A除去的杂质是___________
(3)实验Ⅲ中发生的中和反应的化学方程式是___________
24.(8分)黑白复印机用的墨粉中常添加Fe3O4粉末。Fe3O4是由 Fe2+、Fe3+和O2-按1 :2: 4的个数比构成的。下图是氧化沉淀法生产复印用Fe3O4粉末的流程简图。
(1)Fe3O4粉末在复印机的电磁场作用下能使墨粉形成字迹或图案,这不仅利用了Fe3O4有磁性,还利用了Fe3O4是___________色。
(2)在第①步反应的化学方程式是Fe+H2SO4=FeSO4+H2↑,求至少需要溶质质量分数为9.8%的稀硫酸多少克?
(3)第③步反应的化学方程式是: 4Fe (OH)2+O2+2H2O=4Fe(OH)3,该反应中其原子失去电子的元素是___________。已知第④步反应中铁的化合价保持不变,要确保反应最终完全生成Fe3O4,第③步要控制通入的O2量,反应后使Fe(OH)2和生成的Fe(OH)3的质量比等于___________ 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.A
3.B
4.A
5.C
6.A
7.B
8.C
9.C
10.D
11.A
12.B
13.D
14.B
15.D
16. 二氧化碳##CO2 H+ 弱
17. Na2CO3+2HCl=2NaCl+H2O+CO2↑ 大于
18. H+ 蓝色
19. 紫色石蕊试液 Fe2O3 溶液由无色变为浅绿色,且有气泡产生 Cu(OH)2+H2SO4=CuSO4+2H2O
20. 生成蓝色絮状沉淀,溶液由蓝色逐渐变成无色 2NaOH+CuSO4=Cu(OH2)↓+Na2SO4 酸
21. NaOH ##氢氧化钠 再用其他不同种类的酸与碱进行多次实验 甲、乙试管中硅胶固体不变色,丙试管中硅胶固体变色
22. 混合液中几乎没有自由离子(或“和,和完全反应”、“硫酸和氢氧化钡完全反应”) BC
23. 引流 MgCl2和Na2SO4 NaOH+HCl=NaCl+H2O
24.(1)黑
(2)解:设与280g铁粉反应,需要的硫酸的质量为x
即需要溶质质量分数为9.8%的稀硫酸的质量为:
(3)铁;90:214(或45:107)
答案第1页,共2页
答案第1页,共2页
一、选择题(每题3分,共15题)
1.稀释浓硫酸并进行硫酸性质实验的操作中,正确的是( )
A.稀释浓硫酸 B.测稀硫酸的pH
C.取用稀硫酸 D.闻稀硫酸的气味
2.下列物质敞口放置,质量会减轻的是( )
A.浓盐酸 B.浓硫酸 C.氢氧化钠 D.碳酸钙
3.下列说法中,正确的是( )
A.水电解生成氢气和氧气,说明水中含有氢分子和氧分子
B.在水的电解反应中,氢原子和氧原子都没有发生变化
C.水的蒸发和水的电解都生成气体,它们都是化学变化
D.物质在变化中所表现出的性质,就是物质的化学性质
4.某地种植的植株矮小,必须施用含有氮元素和磷元素的复合肥。下列化肥中最适合的是( )
A.(NH4)2HPO4 B.Ca3(PO4)2 C.KNO3 D.CO(NH2)2
5.归纳总结、对比分析是常用的科学方法,如图所示:两圆重叠的区域表示它们的共同特征(相似点),重叠区域以外的部分表示它们的独有特征(不同点),某同学对(1)(2)(3)(4)区域相对应的内容填写错误的是( )
A.(1)区域:由碳元素和氧元素组成
B.(2)区域:具有可燃性和还原性
C.(3)区域:能使酚酞试液变色
D.(4)区域:跟某些非金属氧化物反应
6.在测定土壤酸碱性的实验中,下列操作规范的是( )
A.装入土样粉末 B.滴加蒸馏水
C.振荡土壤液 D.测定酸碱性
7.金色凉山离太阳最近,离闹市最远,特色原生态农产品享誉川内外,如会理烤烟、宁南蚕桑、西昌洋葱、雷波脐橙、布拖马铃薯、昭觉黑苦荞等,种植这些农作物均需要复合肥,下列都属于复合肥的是( )
A.尿素—CO(NH2)2 硫酸钾—K2SO4
B.磷酸二氢铵—NH4H2PO4 硝酸钾—KNO3
C.碳酸氢铵—NH4HCO3 氯化钾—KCl
D.硝酸铵—NH4NO3 硝酸钾—KNO3
8.如图所示,分别向四支试管中加入饱和石灰水,使其与试管内溶液充分反应。无论饱和石灰水加入量的多少,反应后试管内溶液一定呈碱性的是( )
A.① B.② C.③ D.④
9.2021 年 12 月 9 日王亚平在太空授课时,邀请地面的同学一起演示将泡腾片放入水中的实验。甲图,学 生在地面将泡腾片放入水中,有许多气泡从水面逸出; 乙图,王亚平在空间站将同样的泡腾片放入水球中,产生的气泡大部分留在水球中。下列分析不正确的是( )
A.泡腾片呈黄色是它的物理性质
B.将一片泡腾片分成两半,是物理变化
C.甲、乙两图中气泡运动情况不同,说明泡腾片从地面带到空间站发生了化学变化。
D.不管是在地面上还是在空间站里,同样的泡腾片在水里都发生反应生成气泡,体现了它的化学性质。
10.下图为氢氧化钠溶液与稀盐酸反应过程中的pH随时间变化曲线,有关分析错误的( )
A.该实验是将氢氧化钠溶液滴入稀盐酸中
B.a点对应溶液的溶质为氯化钠和氯化氢
C.b点表示氢氧化钠和稀盐酸恰好完全反应
D.a点到b点的曲线变化证明该反应放热
11.Na2CO3的水溶液呈碱性,下列说法错误的是( )
A.碳酸钠在水中会电离出 OH -
B.往碳酸钠溶液中加稀硫酸后溶液的 pH 降低
C.碳酸钠溶液中存在 OH -
D.往碳酸钠溶液中滴加紫色石蕊试液后溶液显蓝色
12.向盛有20克10%氢氧化钠溶液的烧杯中逐滴滴入7.3%的稀盐酸,下列是关于烧杯中溶液总质量或溶液随盐酸质量变化的关系图(点表示恰好完全反应)。其中正确的是( )
A. B.
C. D.
13.由于粗盐中含有少量MgCl2、CaCl2、Na2SO4等杂质,不能满足化工生产的要求,因此必须将粗盐进行精制。流程如图:
下列有关粗盐提纯错误的是( )
A.加入稍过量的Na2CO3溶液,既能除去粗盐中的CaCl2,还可以除去溶液中过量的BaCl2
B.实验操作Ⅲ要用到的实验玻璃仪器有玻璃棒、烧杯和漏斗
C.每次操作均充分进行,对实验结束后的NaCl溶液结晶,得到的NaCl质量将会比原来多
D.如果加入稍过量的NaOH、BaCl2试剂,改变这两种试剂加入的顺序会影响实验
14.如图所示,当胶头滴管中的液体滴入到锥形瓶中时,会引起气球膨胀的是()
选项 A B C D
锥形瓶 MnO2 HCl气体 H2O Zn
胶头滴管 H2O2 石灰水 浓H2SO4 稀H2SO4
A.A B.B C.C D.D
15.化学变化往往会导致一些量发生改变。现向盛有一定量Na2CO3溶液的容器中不断滴入Ca(OH)2溶液至过量,下列图像能正确反映容器中相关量随滴加时间变化的是( )
A. B.
C. D.
二、填空题(每题4分,共5题)
16.2021 年12月9日, 翟志刚、王亚平和叶光富三位航天员在中国空间站上展示了“水中泡腾片”等太空科学实验。
(1)泡腾片是利用有机酸和碳酸盐反应做泡腾崩解剂,当其置入水中时,立刻发生泡腾反应,生成并释放大量的_________ 气体, 状如沸腾,故名泡腾片。
(2)水果中含有较多的维生素 C, 因为维生素C 极易解离而释放出 _________(填写离子符号) ,故具有酸的性质。
(3)长久使用的水杯内壁常附着一层水垢(主要成分是CaCO3), 经多次维生素C泡腾片溶液浸泡后, 水杯内水垢会消失,说明碳酸的酸性比维生素C的酸性 ___________ 。
17.某一废水中含有一定质量CaCl2和HCl,往混合溶液中逐滴滴入Na2CO3溶液的质量,与反应中产生气体或沉淀的质量关系如下图。已知OE段发生化学反应时产生气体,请用化学方程式来表示:___________;完全反应后G点溶液的pH___________7( 选“大于、 小于、等于”)
18.室温时,随着向盛有稀硫酸的烧杯中逐滴加入Ba(OH)2溶液,烧杯内溶液中的溶质质量变化如图所示(忽略溶液温度的变化)。b点溶液中含量较多的阳离子有_______,d点溶液中滴加紫色石蕊试液,溶液变_______。
19.如图表示酸溶液在发生化学变化时得到的不同颜色的溶液,请根据图回答:
(1)试剂A的名称是___________。
(2)若B是氧化物,则B的化学式为___________。
(3)若C是单质,则X与C的反应现象为___________。
(4)若X是稀硫酸,D是碱,则X和D反应的化学方程式为___________。
20.及时归纳是学好科学的主要方法之一、利用如图所示的结构图归纳盐的四个方面的科学性质(图中编号①-④),请归纳有关知识。
(1)在归纳性质②时,选取了硫酸铜和氢氧化钠两种物质,它们在溶液中相互反应时产生的现象是___________,化学方程式为___________。
(2)在性质③中,X代表___________类物质。
三、探究题(每题10分,共2题)
21.某学习小组在探究“酸碱反应"时,向滴有酚酞的氢氧化钠溶液中加盐酸并振荡,观察到红色消失。他们认为“红色消失”可能有2种原因:①可能氢氧化钠和盐酸反应了;②可能酚酞和盐酸反应了。所以不能根据“红色消失"得出“氢氧化钠和盐酸能反应"的结论。
于是,他们继续进行探究:检验反应后的溶液中是否存在氢氧化钠、酚酞。
[实验过程]
实验步骤 具体操作 实验现象 分析并得出结论
第一步 将反应后的A溶液分成B和C两等份 / A溶液中不存在___________,说明氢氧化钠和盐酸发生了反应
第二步 在B中滴加酚酞,振荡 溶液不变红
第三步 在C中滴加氢氧化钠溶液,振荡 溶液变红
[交流反思]小科认为要得出“酸和碱能反应”的普遍规律,还需进行的实验是___________。
小科按自己的想法继续实验后得出“酸和碱能反应”。小科通过进一步学习,知道酸和碱反应有水生成。那怎么验证酸和碱反应有水生成呢?
[资料补充]①硅胶固体遇水会变色。②冰醋酸为纯净物。
[实验设计]
[实验分析]实验中出现___________现象,说明冰醋酸和氢氧化钠反应有水生成。
22.电导率和pH 传感器可辅助探究复分解反应的实质。某兴趣小组运用电导率和 pH 传感器探究硫酸和氢氧化钡溶液的反应。实验装置如图甲所示,实验数据如图乙所示。注:电导率是以数字表示的溶液传导电流的能力,单位以微西门子每厘米(μS/cm)表示。
根据以上信息回答下列问题:
(1)实验开始时,溶液电导率较高的原因是溶液含有大量自由移动的______离子(写离子符号)。
(2)如图乙,C点电导率最低的原因是______;
(3)将恒压滴液漏斗中液体换成以下哪种溶液,测得电导率图像与图乙相似______;
A.HCl B.CuSO4 C.MgSO4 D.NaNO3
四、简答题
23.(7分)为了除去实验室NaCl溶液中含有少量的MgCl2、CaCl2和Na2SO4等杂质,某小组同学选用。Na2CO3溶液、稀盐酸、Ba(OH)2溶液三种试剂,按一定的顺序进行如图所示的实验。
回答下列问题:
(1)操作Ⅰ用到玻璃棒的作用是___________
(2)实验Ⅰ中加入试剂A除去的杂质是___________
(3)实验Ⅲ中发生的中和反应的化学方程式是___________
24.(8分)黑白复印机用的墨粉中常添加Fe3O4粉末。Fe3O4是由 Fe2+、Fe3+和O2-按1 :2: 4的个数比构成的。下图是氧化沉淀法生产复印用Fe3O4粉末的流程简图。
(1)Fe3O4粉末在复印机的电磁场作用下能使墨粉形成字迹或图案,这不仅利用了Fe3O4有磁性,还利用了Fe3O4是___________色。
(2)在第①步反应的化学方程式是Fe+H2SO4=FeSO4+H2↑,求至少需要溶质质量分数为9.8%的稀硫酸多少克?
(3)第③步反应的化学方程式是: 4Fe (OH)2+O2+2H2O=4Fe(OH)3,该反应中其原子失去电子的元素是___________。已知第④步反应中铁的化合价保持不变,要确保反应最终完全生成Fe3O4,第③步要控制通入的O2量,反应后使Fe(OH)2和生成的Fe(OH)3的质量比等于___________ 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.A
3.B
4.A
5.C
6.A
7.B
8.C
9.C
10.D
11.A
12.B
13.D
14.B
15.D
16. 二氧化碳##CO2 H+ 弱
17. Na2CO3+2HCl=2NaCl+H2O+CO2↑ 大于
18. H+ 蓝色
19. 紫色石蕊试液 Fe2O3 溶液由无色变为浅绿色,且有气泡产生 Cu(OH)2+H2SO4=CuSO4+2H2O
20. 生成蓝色絮状沉淀,溶液由蓝色逐渐变成无色 2NaOH+CuSO4=Cu(OH2)↓+Na2SO4 酸
21. NaOH ##氢氧化钠 再用其他不同种类的酸与碱进行多次实验 甲、乙试管中硅胶固体不变色,丙试管中硅胶固体变色
22. 混合液中几乎没有自由离子(或“和,和完全反应”、“硫酸和氢氧化钡完全反应”) BC
23. 引流 MgCl2和Na2SO4 NaOH+HCl=NaCl+H2O
24.(1)黑
(2)解:设与280g铁粉反应,需要的硫酸的质量为x
即需要溶质质量分数为9.8%的稀硫酸的质量为:
(3)铁;90:214(或45:107)
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
