化学人教版(2019)必修第一册2.1.2氧化钠和过氧化钠(共19张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.1.2氧化钠和过氧化钠(共19张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 23.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-16 17:23:03 | ||
图片预览





文档简介
(共19张PPT)
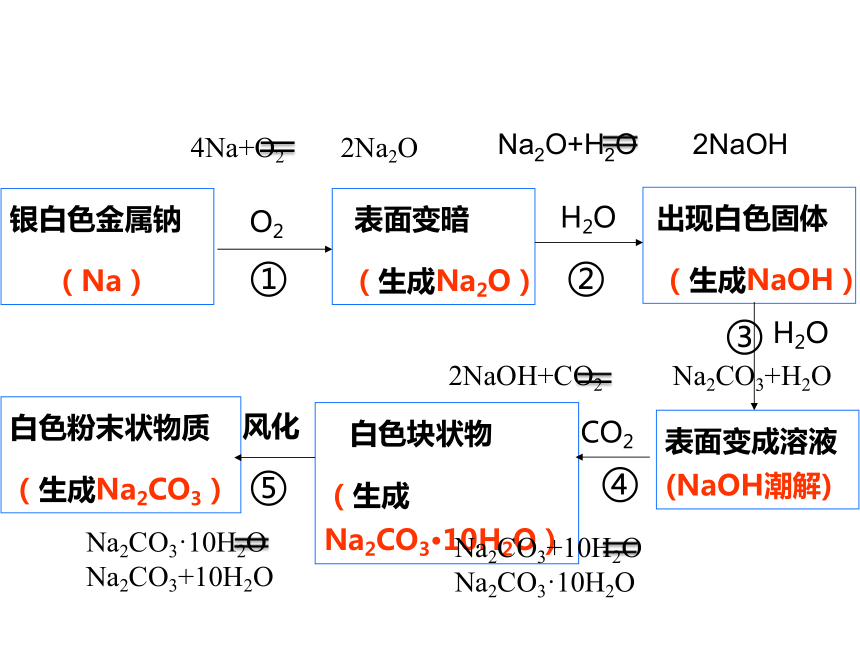
下列说法正确的是( )。
A.①发生了氧化还原反应
B.②变白色是因为生成了碳酸钠
C.③是碳酸钠吸收空气中的水蒸气形成了溶液
D.④只发生物理变化
观察是研究物质性质的一种基本方法。某同学将一小块金属钠露置于空气中,观察到下列现象:银白色 变灰暗 变白色 出现液滴 白色固体 白色粉末。
A
课
前
检
测
银白色金属钠
(Na)
表面变暗
(生成Na2O)
出现白色固体
(生成NaOH)
表面变成溶液 (NaOH潮解)
白色粉末状物质
(生成Na2CO3)
白色块状物
(生成Na2CO3·10H2O)
O2
风化
CO2
H2O
H2O
①
④
②
4Na+O2 2Na2O
Na2O+H2O 2NaOH
2NaOH+CO2 Na2CO3+H2O
Na2CO3+10H2O Na2CO3·10H2O
Na2CO3·10H2O Na2CO3+10H2O
③
⑤
三、用途
1.钠钾合金(液态)可用于原子反应堆的 。
2.用作电光源,制作高压钠灯。
3.冶炼某些金属:金属钠具有强还原性, 状态下可以用于制取某些金属。
如4Na+TiCl4(熔融)= 4NaCl+Ti。
导热剂
熔融
高温
四、钠单质的制备和保存
1.制备
钠非常活泼,工业中通常采用 来制备,
2NaCl(熔融) = 2Na+Cl2↑
2.保存
钠易与空气中的O2、H2O反应,
且钠的密度比煤油的密度大,不与煤油反应,
故通常将钠保存在煤油或石蜡油中。
电解法
电解
第二章 海水中的重要元素——钠和氯
第2课时 氧化钠和过氧化钠
教
学
目
标
通过对比的方法记住氧化钠和过氧化钠的化学性质并且会书写相应的化学方程式
第一节 钠及其化合物
【思考与讨论】
(1)根据前面做过的实验,描述氧化钠和过氧化钠的颜色、状态。
(2)从物质分类的角度来看,氧化钠属于什么氧化物?请类比氧化钙写出氧化钠与H2O、 CO2 、HCl发生反应的化学方程式。
Na2O2淡黄色固体
一、氧化钠和过氧化钠
1.氧化钠的性质——碱性氧化物
(1)与水反应: Na2O+H2O=2NaOH
(2)与酸性氧化物反应: Na2O+CO2=Na2CO3
(3)与酸反应: Na2O+2HCl=2NaCl+H2O
Na2O 白色固体
[实验2-3]
【思考】 Na2O2也属于氧化物是否同Na2O一样也能与水、
CO2、盐酸反应?产物是否相同?
把1~2 mL水滴入在盛有1~2 g 过氧化钠固体的试管中,立即用带火星木条的伸入试管口,检验生成的气体。用手轻轻触摸试管外壁,有什么感觉?用 pH试纸检验溶液的酸碱性。
有气泡产生,试管外壁发热,放出的气体能使带火星的木条复燃,溶液滴到pH试纸上,试纸变蓝。
为什么酚酞溶液会先变红后褪色呢?
过氧化钠与水反应的历程:
①Na2O2+2H2O=H2O2+2NaOH
②2H2O2=2H2O+O2↑
已知,H2O2具有漂白性。
所以氢氧化钠先使酚酞变红, H2O2使酚酞褪色
总方程:2Na2O2+2H2O=4NaOH+O2↑
①×2+②可得:
2Na2O2 + 2CO2 = 2Na2CO3+O2
取一小块脱脂棉与石棉网上,再取半角匙过氧化钠粉末至于脱脂棉上,小心包裹后,向包有过氧化钠的脱脂棉吹气。观察现象。
实验探究
氧化钠能与二氧化碳反应生成碳酸钠 :Na2O + CO2 = Na2CO3
过氧化钠能与二氧化碳反应吗?
类比Na2O2与水的反应,写出其与盐酸的反应方程式
2Na2O2+4HCl=4NaCl+2H2O+O2 ↑
思考1: Na2O2是不是碱性氧化物?
不是,Na2O2是过氧化物。
思考2:如何理解Na2O、Na2O2性质上的差异?
在Na2O2中,氧是-1价介于氧的两种较稳定化合价0价和-2价之间,因此Na2O2既具有氧化性又具有还原性, 但主要以氧化性为主。
2Na2O2 + 2H2O=4NaOH + O2↑
2Na2O2 + 2H2O = 4NaOH +O2↑
-1 -2 0
失去2e-,化合价升高,被氧化
得到2e-,化合价降低,被还原
既是氧化剂又是还原剂
2e-
2Na2O2+2H2O=4NaOH+O2↑
1.分别用双线桥和单线桥法表示氧化钠与水的反应,并指出氧化剂和还原剂
随
堂
练
习
歧化反应
潜水艇的供氧原理
既是氧化剂又是还原剂
2Na2O2 + 2CO2 = 2Na2CO3+O2
得到2e-,化合价降低,被还原
失去2e-,化合价升高,被氧化
-1 -2 0
2.用双线桥法表示过氧化钠与二氧化碳的反应,并指出氧化剂和还原剂
歧化反应
呼吸面具的供氧原理
注意理解:
①Na2O2 与H2O、CO2发生的反应都是歧化反应,Na2O2既是氧化剂又是还原剂,两个反应电子转移的数目都是2e-
②Na2O2吸收H2O的实质是吸收H2,Na2O2吸收CO2的实质是吸收CO
③Na2O2同时遇到H2O与CO2时,先与CO2反应再与H2O反应,因为即使Na2O2先与H2O反应生成的NaOH也会与CO2 反应。
2.过氧化钠的性质 过氧化物
2Na2O2 + 2H2O = 4NaOH +O2↑
2Na2O2 + 2CO2 = 2Na2CO3+O2
2Na2O2+4HCl=4NaCl+2H2O+O2 ↑
3.将7.2 g CO和H2的混合气体与足量O2充分燃烧后,立即通入足量的Na2O2固体中,固体的质量增加( )。
A.2.1 g B.3.6 g
C.7.2 g D.无法确定
C
随
堂
练
习
作供氧剂
用在潜水艇和呼吸面具中。
常作漂白剂
漂白织物、麦秆、羽毛等。
3.过氧化钠的用途
4.为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有Na2O2颗粒的装置,它的用途是产生氧气。下列关于Na2O2的叙述正确的是( )。
A.Na2O2中阴、阳离子的个数之比为1∶1
B.Na2O2分别与H2O及CO2反应产生相同量的O2时,需要H2O和CO2的质量相等
C.Na2O2分别与H2O及CO2反应产生相同量的O2时,转移电子的数目相等
D.Na2O2的漂白原理与木炭的漂白原理相同
C
随
堂
练
习
5.向紫色石蕊溶液中加入过量Na2O2粉末,振荡,正确的叙述是( )
A.最后溶液变蓝色
B.溶液先变蓝色最后褪色
C.溶液仍为紫色
D.因为Na2O2与石蕊发生氧化还原反应而无气泡产生
B
随
堂
练
习
物质 氧化钠(Na2O) 过氧化钠(Na2O2)
组成结构
氧元素化合价
类别
颜色状态
与H2O反应
与CO2反应
与H+反应
转化关系
用途
由Na+和O2-构n(Na+):n(O2-)=2:1
由Na+和O22- 构成n(Na+):n(O22- )=2:1
-2
-1
碱性氧化物
过氧化物
白色固体
淡黄色固体
Na2O + H2O 2NaOH
用于制备氢氧化钠等
可作漂白剂、强氧化剂、供氧剂
小结:Na2O与Na2O2对比分析
Na2O + CO2 Na2CO3
Na2O+2H+ 2Na++H2O
2Na2O2+2H2O 4NaOH+O2↑
2Na2O2+2CO2 2Na2CO3+O2
Na2O2+4H+ 4Na++2H2O+O2↑
2Na2O+ O2 2Na2O2
课
堂
小
结
布
置
作
业
卷行天下课时练
2.过氧化钠的性质
氧化钠与过氧化钠
3.过氧化钠的用途
1.氧化钠的性质
下列说法正确的是( )。
A.①发生了氧化还原反应
B.②变白色是因为生成了碳酸钠
C.③是碳酸钠吸收空气中的水蒸气形成了溶液
D.④只发生物理变化
观察是研究物质性质的一种基本方法。某同学将一小块金属钠露置于空气中,观察到下列现象:银白色 变灰暗 变白色 出现液滴 白色固体 白色粉末。
A
课
前
检
测
银白色金属钠
(Na)
表面变暗
(生成Na2O)
出现白色固体
(生成NaOH)
表面变成溶液 (NaOH潮解)
白色粉末状物质
(生成Na2CO3)
白色块状物
(生成Na2CO3·10H2O)
O2
风化
CO2
H2O
H2O
①
④
②
4Na+O2 2Na2O
Na2O+H2O 2NaOH
2NaOH+CO2 Na2CO3+H2O
Na2CO3+10H2O Na2CO3·10H2O
Na2CO3·10H2O Na2CO3+10H2O
③
⑤
三、用途
1.钠钾合金(液态)可用于原子反应堆的 。
2.用作电光源,制作高压钠灯。
3.冶炼某些金属:金属钠具有强还原性, 状态下可以用于制取某些金属。
如4Na+TiCl4(熔融)= 4NaCl+Ti。
导热剂
熔融
高温
四、钠单质的制备和保存
1.制备
钠非常活泼,工业中通常采用 来制备,
2NaCl(熔融) = 2Na+Cl2↑
2.保存
钠易与空气中的O2、H2O反应,
且钠的密度比煤油的密度大,不与煤油反应,
故通常将钠保存在煤油或石蜡油中。
电解法
电解
第二章 海水中的重要元素——钠和氯
第2课时 氧化钠和过氧化钠
教
学
目
标
通过对比的方法记住氧化钠和过氧化钠的化学性质并且会书写相应的化学方程式
第一节 钠及其化合物
【思考与讨论】
(1)根据前面做过的实验,描述氧化钠和过氧化钠的颜色、状态。
(2)从物质分类的角度来看,氧化钠属于什么氧化物?请类比氧化钙写出氧化钠与H2O、 CO2 、HCl发生反应的化学方程式。
Na2O2淡黄色固体
一、氧化钠和过氧化钠
1.氧化钠的性质——碱性氧化物
(1)与水反应: Na2O+H2O=2NaOH
(2)与酸性氧化物反应: Na2O+CO2=Na2CO3
(3)与酸反应: Na2O+2HCl=2NaCl+H2O
Na2O 白色固体
[实验2-3]
【思考】 Na2O2也属于氧化物是否同Na2O一样也能与水、
CO2、盐酸反应?产物是否相同?
把1~2 mL水滴入在盛有1~2 g 过氧化钠固体的试管中,立即用带火星木条的伸入试管口,检验生成的气体。用手轻轻触摸试管外壁,有什么感觉?用 pH试纸检验溶液的酸碱性。
有气泡产生,试管外壁发热,放出的气体能使带火星的木条复燃,溶液滴到pH试纸上,试纸变蓝。
为什么酚酞溶液会先变红后褪色呢?
过氧化钠与水反应的历程:
①Na2O2+2H2O=H2O2+2NaOH
②2H2O2=2H2O+O2↑
已知,H2O2具有漂白性。
所以氢氧化钠先使酚酞变红, H2O2使酚酞褪色
总方程:2Na2O2+2H2O=4NaOH+O2↑
①×2+②可得:
2Na2O2 + 2CO2 = 2Na2CO3+O2
取一小块脱脂棉与石棉网上,再取半角匙过氧化钠粉末至于脱脂棉上,小心包裹后,向包有过氧化钠的脱脂棉吹气。观察现象。
实验探究
氧化钠能与二氧化碳反应生成碳酸钠 :Na2O + CO2 = Na2CO3
过氧化钠能与二氧化碳反应吗?
类比Na2O2与水的反应,写出其与盐酸的反应方程式
2Na2O2+4HCl=4NaCl+2H2O+O2 ↑
思考1: Na2O2是不是碱性氧化物?
不是,Na2O2是过氧化物。
思考2:如何理解Na2O、Na2O2性质上的差异?
在Na2O2中,氧是-1价介于氧的两种较稳定化合价0价和-2价之间,因此Na2O2既具有氧化性又具有还原性, 但主要以氧化性为主。
2Na2O2 + 2H2O=4NaOH + O2↑
2Na2O2 + 2H2O = 4NaOH +O2↑
-1 -2 0
失去2e-,化合价升高,被氧化
得到2e-,化合价降低,被还原
既是氧化剂又是还原剂
2e-
2Na2O2+2H2O=4NaOH+O2↑
1.分别用双线桥和单线桥法表示氧化钠与水的反应,并指出氧化剂和还原剂
随
堂
练
习
歧化反应
潜水艇的供氧原理
既是氧化剂又是还原剂
2Na2O2 + 2CO2 = 2Na2CO3+O2
得到2e-,化合价降低,被还原
失去2e-,化合价升高,被氧化
-1 -2 0
2.用双线桥法表示过氧化钠与二氧化碳的反应,并指出氧化剂和还原剂
歧化反应
呼吸面具的供氧原理
注意理解:
①Na2O2 与H2O、CO2发生的反应都是歧化反应,Na2O2既是氧化剂又是还原剂,两个反应电子转移的数目都是2e-
②Na2O2吸收H2O的实质是吸收H2,Na2O2吸收CO2的实质是吸收CO
③Na2O2同时遇到H2O与CO2时,先与CO2反应再与H2O反应,因为即使Na2O2先与H2O反应生成的NaOH也会与CO2 反应。
2.过氧化钠的性质 过氧化物
2Na2O2 + 2H2O = 4NaOH +O2↑
2Na2O2 + 2CO2 = 2Na2CO3+O2
2Na2O2+4HCl=4NaCl+2H2O+O2 ↑
3.将7.2 g CO和H2的混合气体与足量O2充分燃烧后,立即通入足量的Na2O2固体中,固体的质量增加( )。
A.2.1 g B.3.6 g
C.7.2 g D.无法确定
C
随
堂
练
习
作供氧剂
用在潜水艇和呼吸面具中。
常作漂白剂
漂白织物、麦秆、羽毛等。
3.过氧化钠的用途
4.为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有Na2O2颗粒的装置,它的用途是产生氧气。下列关于Na2O2的叙述正确的是( )。
A.Na2O2中阴、阳离子的个数之比为1∶1
B.Na2O2分别与H2O及CO2反应产生相同量的O2时,需要H2O和CO2的质量相等
C.Na2O2分别与H2O及CO2反应产生相同量的O2时,转移电子的数目相等
D.Na2O2的漂白原理与木炭的漂白原理相同
C
随
堂
练
习
5.向紫色石蕊溶液中加入过量Na2O2粉末,振荡,正确的叙述是( )
A.最后溶液变蓝色
B.溶液先变蓝色最后褪色
C.溶液仍为紫色
D.因为Na2O2与石蕊发生氧化还原反应而无气泡产生
B
随
堂
练
习
物质 氧化钠(Na2O) 过氧化钠(Na2O2)
组成结构
氧元素化合价
类别
颜色状态
与H2O反应
与CO2反应
与H+反应
转化关系
用途
由Na+和O2-构n(Na+):n(O2-)=2:1
由Na+和O22- 构成n(Na+):n(O22- )=2:1
-2
-1
碱性氧化物
过氧化物
白色固体
淡黄色固体
Na2O + H2O 2NaOH
用于制备氢氧化钠等
可作漂白剂、强氧化剂、供氧剂
小结:Na2O与Na2O2对比分析
Na2O + CO2 Na2CO3
Na2O+2H+ 2Na++H2O
2Na2O2+2H2O 4NaOH+O2↑
2Na2O2+2CO2 2Na2CO3+O2
Na2O2+4H+ 4Na++2H2O+O2↑
2Na2O+ O2 2Na2O2
课
堂
小
结
布
置
作
业
卷行天下课时练
2.过氧化钠的性质
氧化钠与过氧化钠
3.过氧化钠的用途
1.氧化钠的性质
