人教版(2019)高二化学选择性必修三 4第四章 生物大分子 单元小结 课件(28张ppt)
文档属性
| 名称 | 人教版(2019)高二化学选择性必修三 4第四章 生物大分子 单元小结 课件(28张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-17 13:13:49 | ||
图片预览




文档简介
(共28张PPT)
单 元 小 结
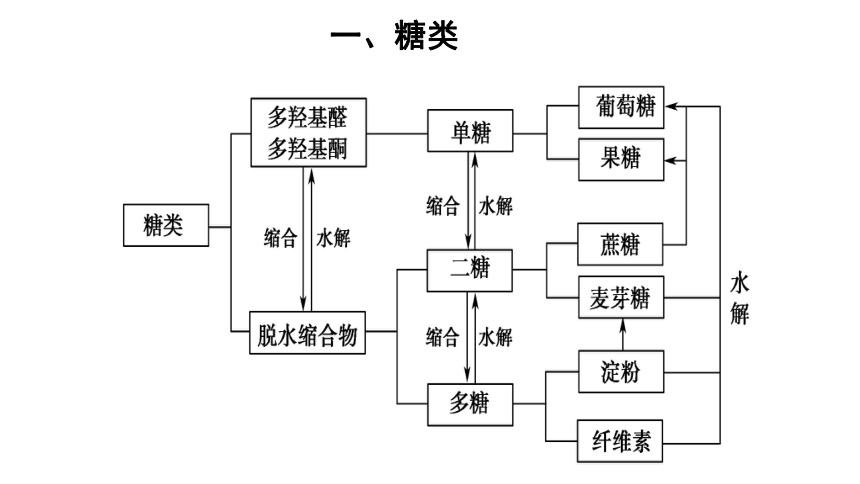
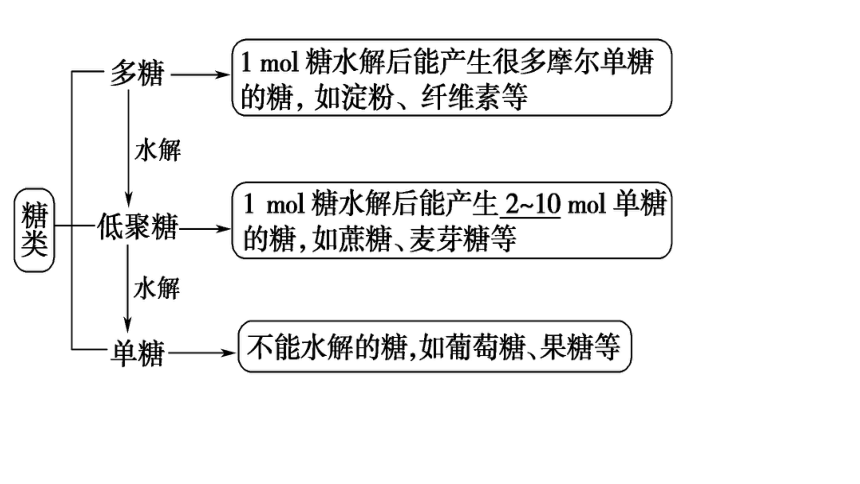
一、糖类
1.糖类
(1)糖类的概念和分类
①概念:从分子结构上看,糖类可定义为多羟基醛、多羟基酮和它们的脱水缩合物。
②组成:主要包含C、H、O三种元素。大多数糖类化合物的通式为Cn(H2O)m,所以糖类也叫碳水化合物。
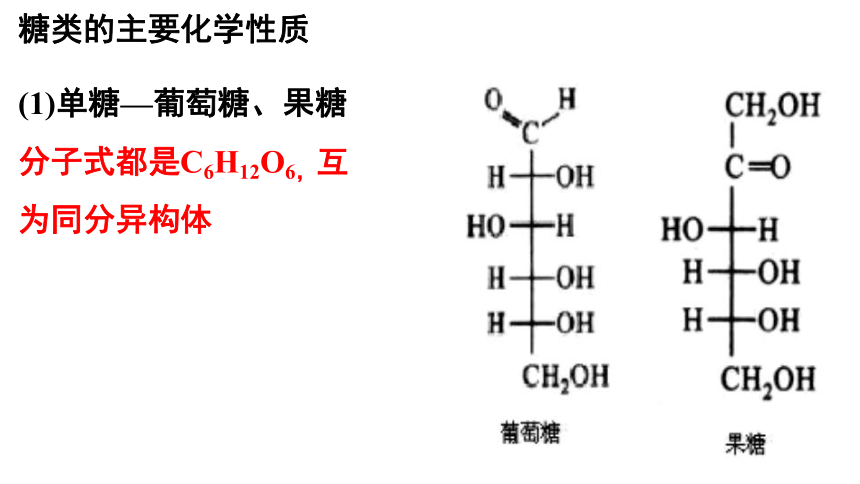
糖类的主要化学性质
(1)单糖—葡萄糖、果糖
分子式都是C6H12O6,互为同分异构体
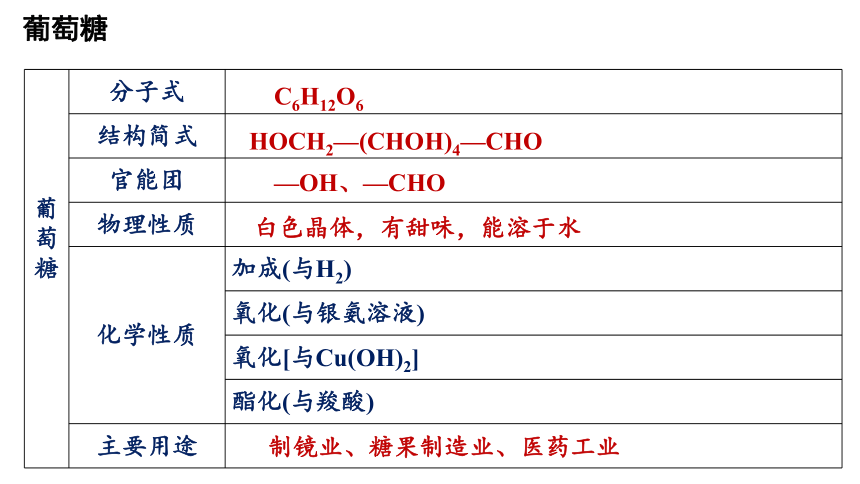
葡 萄 糖 分子式
结构简式
官能团
物理性质
化学性质 加成(与H2)
氧化(与银氨溶液)
氧化[与Cu(OH)2]
酯化(与羧酸)
主要用途
C6H12O6
HOCH2—(CHOH)4—CHO
—OH、—CHO
白色晶体,有甜味,能溶于水
制镜业、糖果制造业、医药工业
葡萄糖
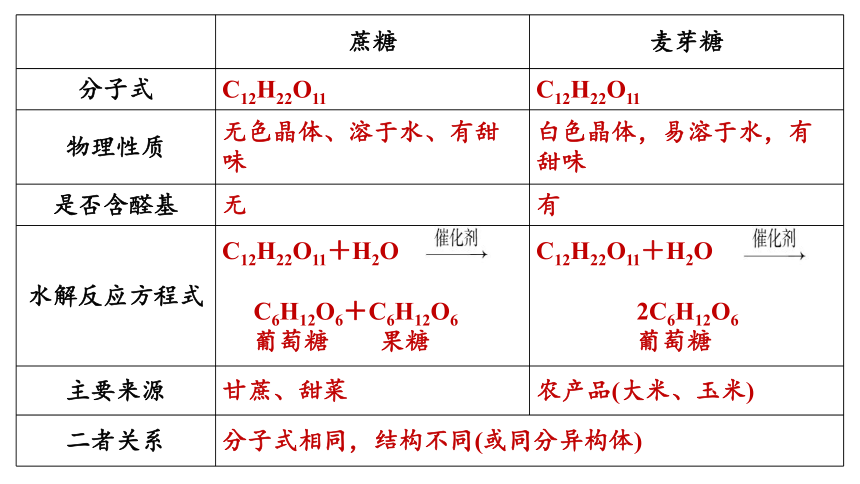
(2)蔗糖与麦芽糖
①相同点a.组成相同,分子式均为C12H22O11,二者互为同分异构体。b.都属于双糖,能发生水解反应。
②不同点a.官能团不同:蔗糖分子中不含醛基,麦芽糖分子中含有醛基。b.水解产物不同。
蔗糖 麦芽糖
分子式 C12H22O11 C12H22O11
物理性质 无色晶体、溶于水、有甜味 白色晶体,易溶于水,有甜味
是否含醛基 无 有
水解反应方程式 C12H22O11+H2O C6H12O6+C6H12O6 葡萄糖 果糖 C12H22O11+H2O
2C6H12O6
葡萄糖
主要来源 甘蔗、甜菜 农产品(大米、玉米)
二者关系 分子式相同,结构不同(或同分异构体)
(3)淀粉与纤维素
①相同点a.都属于高分子化合物,属于多糖,分子式都可表示为(C6H10O5)n。b.都能发生水解反应,
或纤维素
或酶
②不同点
a.通式中n值不同,不是同分异构体;
b.淀粉遇碘呈现特殊的蓝色。
淀 粉 纤维素
物理性质 不溶于冷水,白色粉末 白色无嗅无味物质,不溶于水,不溶于一般的有机溶剂
主要化学 性质 遇I2显蓝色 在酸性条件下水解,方程式: (C6H10O5)n+ nH2O nC6H12O6 葡萄糖 在酸性条件下水解,方程式:
(C6H10O5)n+n(H2O)
nC6H12O6
葡萄糖
存在与 制法 植物的种子、块茎和根里 木材、棉花
用途 食物、制葡萄糖、酒精 制硝酸纤维、纤维素乙酸酯、造纸、粘胶纤维
能否水解 水解产物 醛糖/酮糖 还原性
葡萄糖
果糖
蔗糖
麦芽糖
淀粉
纤维素
否
能
否
有
酮糖
不水解
有
醛糖
不水解
能
——
葡萄糖和果糖
有
无
——
葡萄糖
能
能
葡萄糖
——
无
无
葡萄糖
——
二、蛋白质
1、氨基酸
(1)氨基酸的结构与性质
官能团:氨基 羧基
蛋白质水解后得到的几乎为α 氨基酸
(2)氨基酸化学性质
①两性
②成肽反应 两分子氨基酸缩水形成二肽
多种氨基酸分子间脱水以肽键相互结合,可形成蛋白质。
蛋白质含有C、H、O、N、S等元素,蛋白质属于天然有机高分子化合物。
a.水解:在酸、碱或酶的作用下最终水解生成氨基酸。
b.两性:氨基-NH2有碱性,-COOH羧基有酸性。
c.盐析:向蛋白质溶液中加入某些浓的无机盐[如(NH4)2SO4、Na2SO4等]溶液后,可以使蛋白质的溶解度降低而从溶液中析出,为可逆过程,可用于分离和提纯蛋白质。
2、蛋白质
多种氨基酸分子按不同的排列顺序以肽键相互结合,可以形成千百万种具有不同的理化性质和生理活性的多肽链。相对分子量在10 000以上的,并具有一定空间结构的多肽,称为蛋白质。
d.变性:加热、紫外线、X射线、强酸、强碱、重金属盐、一些有机物(甲醛、酒精、苯甲酸等)会使蛋白质变性,属于不可逆过程。
e.显色反应:含有苯基的蛋白质遇浓HNO3变黄色,该性质可用于蛋白质的检验。
f.灼烧:蛋白质灼烧有烧焦羽毛的气味。检验毛丝纺织品
3、酶
①绝大多数酶是蛋白质,易变性。
②酶是一种生物催化剂,催化作用具有以下特点
a.条件温和,不需加热;
b.具有高度的专一性;
c.具有高效催化作用。
三、核酸
核酸是一类含磷的生物高分子化合物。它在生物体的生长、繁殖、遗传、变异等生命现象中起着决定性的作用。
分类 脱氧核糖核酸(DNA) 核糖核酸(RNA)
存在 大量存在于细胞核中 主要存在于细胞质中
生理作用 生物体遗传信息的载体;蛋白质合成的模板 参与生物体内蛋白质的合成
(1)有机化合物水解反应的含义
有机化合物分子在一定条件下断裂特定的化学键,分别与水分子中的氢原子、羟基相结合生成新的有机化合物分子的反应。
(2)有机化合物的水解,包括卤代烃、酯类(油脂)、糖类(二糖和多糖)以及多肽和蛋白质的水解反应。
四、有机化合物的水解反应
(3)有机化合物水解原理的比较
(1)溶解性法
有机化合物的溶解性不尽相同,有的易溶于水,如醇、醛、羧酸、单糖、二糖等;卤代烃、油脂等酯类化合物不溶于水易溶于有机溶剂。根据它们的溶解性不同,可以进行检验和鉴别。常用的试剂是水,如加水检验,观察是否溶解,可以鉴别乙酸和乙酸乙酯、乙醇和氯乙烷、甘油和油脂等。
(2)密度法
有机化合物的密度存在着差异。根据有机化合物密度的不同,尤其是相对于水的密度大小,通过观察不溶于水的有机化合物在水中的沉浮,而达到检验和鉴别的目的。如用水可以鉴别苯和硝基苯,也可以用水鉴别乙醇、苯和四氯化碳等。
五、鉴别有机化合物的常用方法
(3)燃烧法
观察有机化合物能否燃烧,以及燃烧过程中的实验现象,燃烧后产生的气体气味等,可以检验和鉴别某些有机化合物。如观察燃烧时是否产生黑烟和黑烟的多少可以检验和鉴别乙烷、乙烯和乙炔等;通过观察是否燃烧可以区别四氯化碳和其他有机化合物,因为四氯化碳在空气中不燃烧;通过闻燃烧时的气味可以区别聚氯乙烯和蛋白质等。
(4)官能团法
有机化合物的性质差别在于其官能团,根据有机化合物官能团的差别检验和鉴别有机化合物,是最常用的化学方法。其一般思路是:官能团→性质→方法。常用的试剂和方法如下表。
物质 试剂和方法 现象和结论
饱和烃和不饱和烃 溴水或酸性KMnO4溶液 褪色的是不饱和烃
苯和某些苯 的同系物 酸性KMnO4溶液 褪色的是苯的同系物
含醛基的物质 银氨溶液、水浴加热或与新制Cu(OH)2共热 产生银镜;加热后出现红色沉淀
醇 金属钠 有气体放出
羧酸 紫色石蕊溶液或NaHCO3溶液 显红色;有气体逸出
酯 加稀硫酸 检验水解产物
酚类物质 FeCl3溶液或加溴水 显紫色;白色沉淀
淀粉溶液 碘水 显蓝色
蛋白质检验 浓硝酸或灼烧 显黄色;类似烧焦羽毛气味
单 元 小 结
一、糖类
1.糖类
(1)糖类的概念和分类
①概念:从分子结构上看,糖类可定义为多羟基醛、多羟基酮和它们的脱水缩合物。
②组成:主要包含C、H、O三种元素。大多数糖类化合物的通式为Cn(H2O)m,所以糖类也叫碳水化合物。
糖类的主要化学性质
(1)单糖—葡萄糖、果糖
分子式都是C6H12O6,互为同分异构体
葡 萄 糖 分子式
结构简式
官能团
物理性质
化学性质 加成(与H2)
氧化(与银氨溶液)
氧化[与Cu(OH)2]
酯化(与羧酸)
主要用途
C6H12O6
HOCH2—(CHOH)4—CHO
—OH、—CHO
白色晶体,有甜味,能溶于水
制镜业、糖果制造业、医药工业
葡萄糖
(2)蔗糖与麦芽糖
①相同点a.组成相同,分子式均为C12H22O11,二者互为同分异构体。b.都属于双糖,能发生水解反应。
②不同点a.官能团不同:蔗糖分子中不含醛基,麦芽糖分子中含有醛基。b.水解产物不同。
蔗糖 麦芽糖
分子式 C12H22O11 C12H22O11
物理性质 无色晶体、溶于水、有甜味 白色晶体,易溶于水,有甜味
是否含醛基 无 有
水解反应方程式 C12H22O11+H2O C6H12O6+C6H12O6 葡萄糖 果糖 C12H22O11+H2O
2C6H12O6
葡萄糖
主要来源 甘蔗、甜菜 农产品(大米、玉米)
二者关系 分子式相同,结构不同(或同分异构体)
(3)淀粉与纤维素
①相同点a.都属于高分子化合物,属于多糖,分子式都可表示为(C6H10O5)n。b.都能发生水解反应,
或纤维素
或酶
②不同点
a.通式中n值不同,不是同分异构体;
b.淀粉遇碘呈现特殊的蓝色。
淀 粉 纤维素
物理性质 不溶于冷水,白色粉末 白色无嗅无味物质,不溶于水,不溶于一般的有机溶剂
主要化学 性质 遇I2显蓝色 在酸性条件下水解,方程式: (C6H10O5)n+ nH2O nC6H12O6 葡萄糖 在酸性条件下水解,方程式:
(C6H10O5)n+n(H2O)
nC6H12O6
葡萄糖
存在与 制法 植物的种子、块茎和根里 木材、棉花
用途 食物、制葡萄糖、酒精 制硝酸纤维、纤维素乙酸酯、造纸、粘胶纤维
能否水解 水解产物 醛糖/酮糖 还原性
葡萄糖
果糖
蔗糖
麦芽糖
淀粉
纤维素
否
能
否
有
酮糖
不水解
有
醛糖
不水解
能
——
葡萄糖和果糖
有
无
——
葡萄糖
能
能
葡萄糖
——
无
无
葡萄糖
——
二、蛋白质
1、氨基酸
(1)氨基酸的结构与性质
官能团:氨基 羧基
蛋白质水解后得到的几乎为α 氨基酸
(2)氨基酸化学性质
①两性
②成肽反应 两分子氨基酸缩水形成二肽
多种氨基酸分子间脱水以肽键相互结合,可形成蛋白质。
蛋白质含有C、H、O、N、S等元素,蛋白质属于天然有机高分子化合物。
a.水解:在酸、碱或酶的作用下最终水解生成氨基酸。
b.两性:氨基-NH2有碱性,-COOH羧基有酸性。
c.盐析:向蛋白质溶液中加入某些浓的无机盐[如(NH4)2SO4、Na2SO4等]溶液后,可以使蛋白质的溶解度降低而从溶液中析出,为可逆过程,可用于分离和提纯蛋白质。
2、蛋白质
多种氨基酸分子按不同的排列顺序以肽键相互结合,可以形成千百万种具有不同的理化性质和生理活性的多肽链。相对分子量在10 000以上的,并具有一定空间结构的多肽,称为蛋白质。
d.变性:加热、紫外线、X射线、强酸、强碱、重金属盐、一些有机物(甲醛、酒精、苯甲酸等)会使蛋白质变性,属于不可逆过程。
e.显色反应:含有苯基的蛋白质遇浓HNO3变黄色,该性质可用于蛋白质的检验。
f.灼烧:蛋白质灼烧有烧焦羽毛的气味。检验毛丝纺织品
3、酶
①绝大多数酶是蛋白质,易变性。
②酶是一种生物催化剂,催化作用具有以下特点
a.条件温和,不需加热;
b.具有高度的专一性;
c.具有高效催化作用。
三、核酸
核酸是一类含磷的生物高分子化合物。它在生物体的生长、繁殖、遗传、变异等生命现象中起着决定性的作用。
分类 脱氧核糖核酸(DNA) 核糖核酸(RNA)
存在 大量存在于细胞核中 主要存在于细胞质中
生理作用 生物体遗传信息的载体;蛋白质合成的模板 参与生物体内蛋白质的合成
(1)有机化合物水解反应的含义
有机化合物分子在一定条件下断裂特定的化学键,分别与水分子中的氢原子、羟基相结合生成新的有机化合物分子的反应。
(2)有机化合物的水解,包括卤代烃、酯类(油脂)、糖类(二糖和多糖)以及多肽和蛋白质的水解反应。
四、有机化合物的水解反应
(3)有机化合物水解原理的比较
(1)溶解性法
有机化合物的溶解性不尽相同,有的易溶于水,如醇、醛、羧酸、单糖、二糖等;卤代烃、油脂等酯类化合物不溶于水易溶于有机溶剂。根据它们的溶解性不同,可以进行检验和鉴别。常用的试剂是水,如加水检验,观察是否溶解,可以鉴别乙酸和乙酸乙酯、乙醇和氯乙烷、甘油和油脂等。
(2)密度法
有机化合物的密度存在着差异。根据有机化合物密度的不同,尤其是相对于水的密度大小,通过观察不溶于水的有机化合物在水中的沉浮,而达到检验和鉴别的目的。如用水可以鉴别苯和硝基苯,也可以用水鉴别乙醇、苯和四氯化碳等。
五、鉴别有机化合物的常用方法
(3)燃烧法
观察有机化合物能否燃烧,以及燃烧过程中的实验现象,燃烧后产生的气体气味等,可以检验和鉴别某些有机化合物。如观察燃烧时是否产生黑烟和黑烟的多少可以检验和鉴别乙烷、乙烯和乙炔等;通过观察是否燃烧可以区别四氯化碳和其他有机化合物,因为四氯化碳在空气中不燃烧;通过闻燃烧时的气味可以区别聚氯乙烯和蛋白质等。
(4)官能团法
有机化合物的性质差别在于其官能团,根据有机化合物官能团的差别检验和鉴别有机化合物,是最常用的化学方法。其一般思路是:官能团→性质→方法。常用的试剂和方法如下表。
物质 试剂和方法 现象和结论
饱和烃和不饱和烃 溴水或酸性KMnO4溶液 褪色的是不饱和烃
苯和某些苯 的同系物 酸性KMnO4溶液 褪色的是苯的同系物
含醛基的物质 银氨溶液、水浴加热或与新制Cu(OH)2共热 产生银镜;加热后出现红色沉淀
醇 金属钠 有气体放出
羧酸 紫色石蕊溶液或NaHCO3溶液 显红色;有气体逸出
酯 加稀硫酸 检验水解产物
酚类物质 FeCl3溶液或加溴水 显紫色;白色沉淀
淀粉溶液 碘水 显蓝色
蛋白质检验 浓硝酸或灼烧 显黄色;类似烧焦羽毛气味
