【金榜教师用书课件 人教参考】2014年春高中化学必修二:13 化学键(68ppt,含2013试题,含达标测试)
文档属性
| 名称 | 【金榜教师用书课件 人教参考】2014年春高中化学必修二:13 化学键(68ppt,含2013试题,含达标测试) |  | |
| 格式 | zip | ||
| 文件大小 | 3.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-02-27 21:04:14 | ||
图片预览





文档简介
课件68张PPT。第三节 化 学 键1.了解化学键的概念,了解离子键、共价键的概念及形成。
2.了解离子化合物和共价化合物的概念。
3.认识化学反应的实质。一、离子键
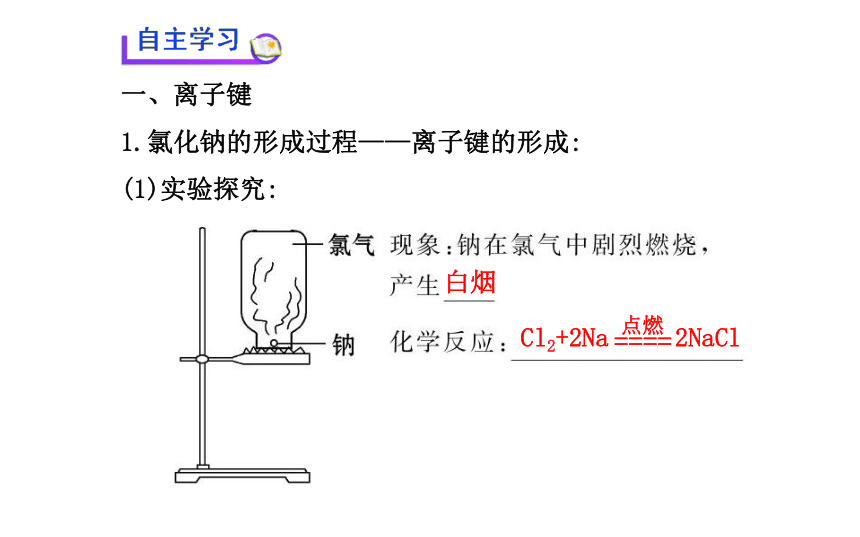
1.氯化钠的形成过程——离子键的形成:
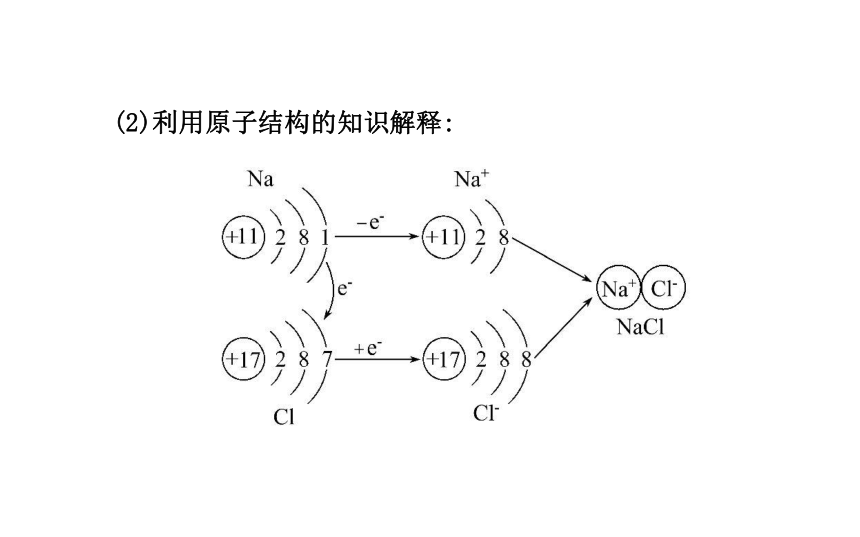
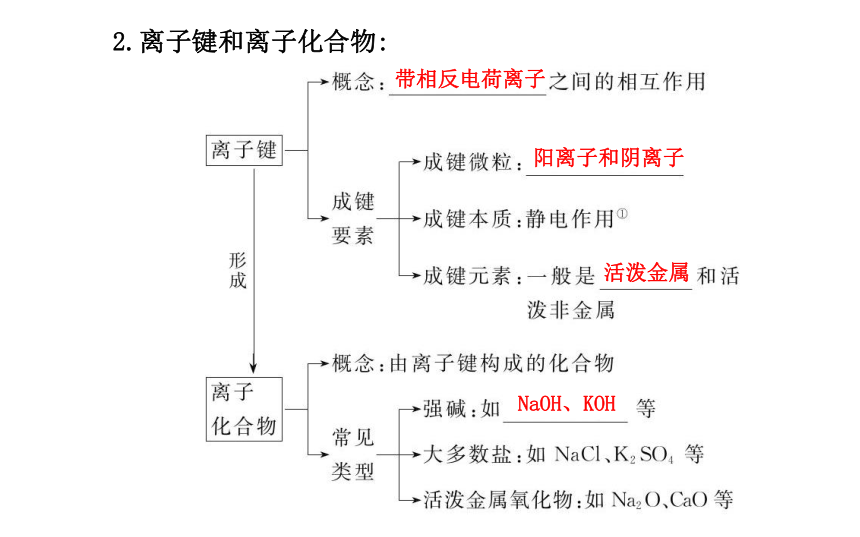
(1)实验探究:白烟Cl2+2Na 2NaCl (2)利用原子结构的知识解释:2.离子键和离子化合物:带相反电荷离子阳离子和阴离子活泼金属NaOH、KOH 二、共价键
1.共价键:
(1)概念:原子间通过___________所形成的相互作用。
(2)成键三要素:
成键微粒:_____;
成键本质:___________;
成键元素:一般是___________________元素。共用电子对原子共用电子对同种或不同种非金属(3)分类:2.共价化合物:
(1)概念:以___________形成分子的化合物。
(2)四类常见的共价化合物:
①非金属氢化物:如________等;
②非金属氧化物:如________等;
③含氧酸:如___________等;
④大多数有机化合物②:如___________等。共用电子对HCl、H2OCO2、SO3H2SO4、HNO3甲烷、酒精三、电子式
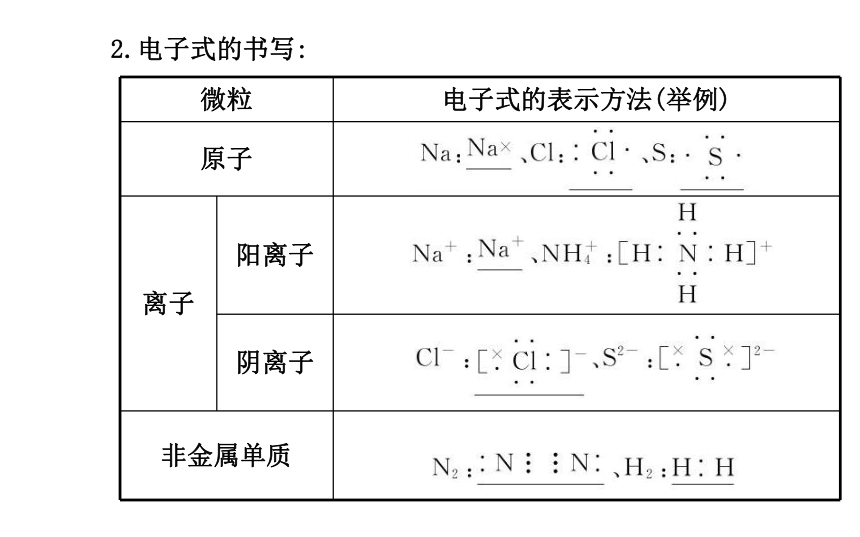
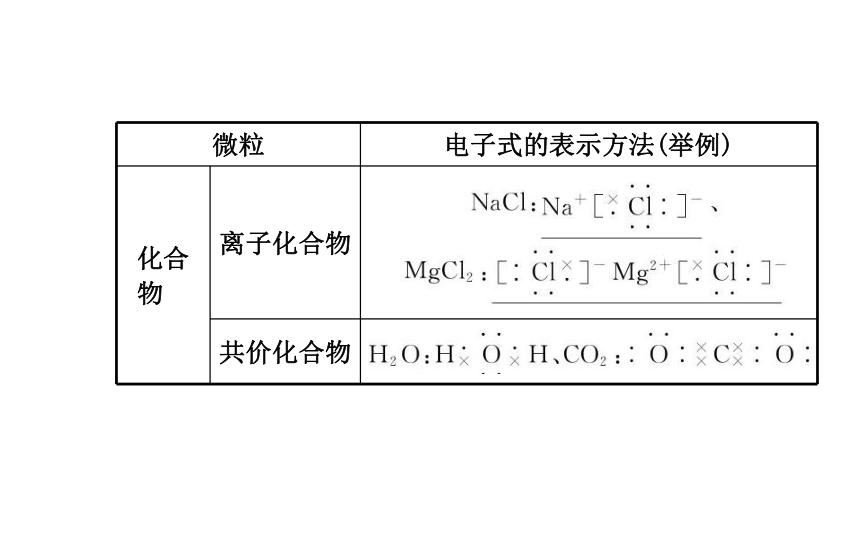
1.定义:在元素符号周围用“·”或“×”表示原子的最外层电子的式子。2.电子式的书写:四、化学键
1.概念:使_________________________的作用力。
2.分类:离子相结合或使原子相结合3.化学反应的本质:
表象:_________________________________;
本质:_________的断裂和_________的形成。反应物中的原子重新组合为产物分子旧化学键新化学键【思考辨析】
1.判断正误:
(1)离子键就是阴、阳离子间的静电吸引。( )
分析:离子键是阴、阳离子间的静电作用,包括静电吸引和静电
排斥。
(2)非金属元素间一定形成共价键。( )
分析:非金属和非金属也能形成离子键,如氯化铵。××(3)共价键只存在于共价化合物中。( )
分析:共价键存在于非金属单质的双原子分子中、共价化合物
和某些离子化合物中,如NaOH、Na2O2。
(4)所有的物质中都含有化学键。( )
分析:不是,稀有气体元素的原子已达2个电子或8个电子稳定结
构,故稀有气体的单质内无化学键。××2.问题思考:
(1)所有的金属与非金属化合都形成离子化合物吗?
分析:不一定。一般活泼金属与活泼非金属化合都形成离子化合物,但也可能生成共价化合物,如AlCl3。
(2)离子化合物中一定只含有离子键吗?
分析:不一定。离子化合物中一定含有离子键,但也可能含有共价键,如KOH除含有离子键外还含有O—H共价键。【知识链接】
①静电作用
静电作用是离子键形成的本质,它包括静电引力和静电斥力。由于静电引力没有方向性,阴阳离子之间的作用可在任何方向上,离子键没有方向性。只要条件允许,阳离子周围可以尽可能多地吸引阴离子,反之亦然,离子键没有饱和性。
②有机化合物
通常把含碳元素的化合物叫做有机化合物,简称有机物。其组成中除含有碳外,还通常含有H、O、S、N、P等元素。有机物中一般含有碳元素,但组成中含有碳元素的物质不一定是有机物。一、离子键和共价键、离子化合物和共价化合物的比较
1.离子键和共价键的比较:2.离子化合物和共价化合物的比较:【知识备选】分子间作用力、氢键与化学键比较【学而后思】
(1)离子键存在于哪类物质中?
提示:离子化合物中一定存在离子键。离子键存在于大多数强碱、盐、金属氧化物等离子化合物中。例如:NaOH、NaCl、NaHCO3、NH4NO3、Na2O2、CaO等均属于离子化合物。(2)从元素原子结构特点来看,离子键和共价键形成的条件是什么?即什么样的元素原子之间容易形成离子键,什么样的元素原子之间可以形成共价键?
提示:从元素原子结构特点分析,元素原子的半径越小,最外层电子数越多,则原子越容易通过得到电子的方式而达到稳定结构;元素原子的半径越大,最外层电子数越少,则原子越容易通过失去电子的方式而达到稳定结构;前者一般是非金属元素原子,后者一般是金属元素原子。一般情况下,活泼金属元素原子与活泼非金属元素原子之间容易形成离子键,而非金属元素原子之间形成的是共价键。需要注意的是这里说的是一般情况,也就是说还可能有特殊情况存在。二、用电子式表示物质及其形成过程
1.用电子式表示物质:
(1)原子:
方法:在元素符号周围用“·”或“×”来代表原子的最外层电子。
实例:(2)离子:
①主族元素的简单阳离子
方法:电子式就是其离子符号。
实例:Na、Mg的电子式分别是Na+、Mg2+。
②主族元素的简单阴离子
方法:在其原子电子式的符号外加[ ],然后在[ ]右上角标上
电荷符号。
实例:Cl-的电子式是 。③原子团离子
方法:表示出离子内原子间的共用电子对,然后加[ ],并在[ ]右上角标上电荷符号。
实例:(3)离子化合物:
方法:表示出构成离子化合物的阴阳离子,但同性离子不能直接相邻。
实例:(4)共价分子(包括非金属单质和化合物):
方法:表示出原子之间的共用电子对,且未形成共用电子对的原子的最外层电子也要标出。
实例:2.用电子式表示物质的形成过程:
(1)离子化合物:
方法:左端是原子的电子式,右端是离子化合物的电子式,中间
用→连接。注意用 表示电子的转移。
实例:
(2)共价化合物:
方法:左端是原子的电子式,右端是共价化合物的电子式,中间
用→连接。
实例:【学而后思】
(1)下列电子式的书写是否正确?若错误,原因是什么?提示:A、B不正确,错误原因是化合物类型判断错误,NaCl属于
离子化合物,HCl属于共价化合物,二者的表示形式错误。C正
确,D不正确。原因是漏写了未成键的孤电子对,氯原子还有3对
没有参与成键的孤电子对。E不正确,错误原因是将相同的离子
合并,正确电子式为 。(2)用电子式表示NH3分子的形成过程,并分析化学键的极性。
提示: ,在NH3分子中N的吸引电子
的能力比H强,所以共用电子对偏向N一方,故NH3分子中的共价
键属于极性共价键。类型 一 化学键的概念?
【典例】(双选)下列叙述正确的是( )
A.两种元素组成的共价化合物中的化学键都是极性键
B.两种不同的非金属元素原子间形成的化学键都是极性键
C.只有金属和非金属化合时才能形成离子键
D.含有离子键的化合物一定是离子化合物【解题指南】解答本题要注意以下3点:
(1)含有离子键的化合物一定是离子化合物。
(2)非极性键可以存在于非金属单质分子、共价化合物和离子化合物中。
(3)非金属元素也可以形成离子化合物,如铵盐。【解析】选B、D。H2O2分子中既有极性键,又有非极性键,A
不正确;两种不同的非金属原子吸引共用电子对的能力肯定不
相同,B正确;NH4Cl中 与Cl-间也存在离子键, C不正
确;离子化合物是指含有离子键的化合物,D正确。【误区警示】化学键判断的“四个不是”
(1)不是所有的物质都含有化学键,如稀有气体中不含化学键。
(2)不是只要含有共价键的物质就属于共价化合物,单质例外。
(3)不是离子化合物一定含有金属元素,如铵盐中含离子键。
(4)不是只要含有金属元素的化合物就是离子化合物,如氯化铝是共价化合物。【变式训练】(双选)下列各组元素既能形成离子化合物,又能形成共价化合物的是( )
A.C、H、O B.K、Mg、Cl
C.N、Cl、H D.Na、S、H
【解析】选C、D。根据已知元素特点联系常见化合物的成键情况判断化合物的形成。A项,全部为非金属,且不能形成铵盐,不能形成离子化合物,不符合题意;B项,只有一种非金属,只能形成离子化合物,不符合题意;C项,既能形成NH3、HCl等共价化合物,又可形成离子化合物NH4Cl,符合题意;D项,既能形成H2S等共价化合物,又可形成Na2S等离子化合物,符合题意。类型 二 物质中化学键的判断?
【典例】(2013·郑州高一检测)下列各物质中,化学键类型完全相同的是( )
A.Na2O2和NaOH
B.CH3COONa和NaOH
C.CCl4和H2O
D.CO2和H2O2【解题指南】解答本题要注意以下两点:
(1)离子化合物中一定含有离子键,也可能含有共价键。
(2)共价化合物中一定没有离子键。共价键又可分为极性键和非极性键。【解析】选C。Na2O2中有离子键和非极性键,NaOH中有离子键和极性键,CH3COONa中含有离子键、非极性键和极性键;CCl4和H2O中均只含有极性键;CO2中只有极性键,H2O2中含有非极性键和极性键。【名师点评】讲解本题时应注意以下3点:
(1)重点讲述化合物类型的判定方法。
(2)师生共同总结化学键在化合物中的存在关系。
(3)让学生根据规律举例,加强巩固效果。【误区警示】化学键和化合物关系的“三个一定”和“三个可能”
(1)“三个一定”:
①离子化合物中一定含离子键;
②含离子键的一定是离子化合物;
③共价化合物中一定不含离子键。
(2)“三个可能”:
①离子化合物中可能含有共价键,如NaOH;
②金属与非金属形成的化合物可能是共价化合物,如AlCl3;
③完全由非金属形成的化合物可能是离子化合物,如NH4Cl。【变式训练】(2012·大纲版全国卷改编)下列有关化学键的叙述,正确的是( )
A.离子化合物中一定含有离子键
B.单质分子中均不存在化学键
C.含有非极性键的分子一定是单质分子
D.含有共价键的化合物一定是共价化合物【解析】选A。离子化合物一定含有离子键,A项正确;稀有气体
分子中不存在化学键,其他非金属单质分子中存在化学键,B项
错误;非金属的多原子单质分子一定含有非极性键,但含有非极
性键的分子不一定是单质分子,如H2O2分子含有非极性键
O—O,C项错误;含有共价键的化合物可能是共价化合物(如HCl)
,也可能是离子化合物(如NH4Cl),共价化合物是只含有共价键
的化合物,D项错误。【变式备选】下列反应过程中,同时有离子键、极性共价键和
非极性共价键的断裂和形成的反应是( )
A.NH4Cl NH3↑+HCl↑
B.NH3+CO2+H2O====NH4HCO3
C.2NaOH+Cl2====NaCl+NaClO+H2O
D.2Na2O2+2CO2====2Na2CO3+O2【解析】选D。本题以四个化学反应为载体综合考查了学生对离子键、极性共价键和非极性共价键的认识程度。A、B中无非极性键的断裂和形成;C中有非极性键(Cl—Cl)的断裂但无非极性键的形成;D中Na2O2既有离子键又有非极性共价键,CO2中有极性共价键,Na2CO3中有离子键和极性共价键,O2中有非极性共价键,故选D。类型 三 电子式的书写?
【典例】(2013·大庆高一检测)下列电子式中正确的是( )【解题指南】解答该题要注意以下3点:
(1)电子式中同性离子不能合并;
(2)正确判断化合物的种类;
(3)电子式中离子或原子的最外层是2或8个电子的稳定结构。【解析】选C。氧化钠中钠离子不能合并,应为
,A错误;硫化氢是共价化合物,应为
,B错误;钡离子的电子式就是其离子符号,氢氧根
离子的电子式是 C正确;二硫化碳分子中,硫原子
的最外层不是8个电子,漏掉了电子,应为 ,D错
误。【方法规律】快速判断8电子稳定结构
(1)分子中若含氢元素,则氢原子满足的是2电子稳定结构。
(2)判断8电子结构的方法有以下两种:
方法一:原子最外层电子数+共用电子对数=8,例:HCl中对氯原子来说,最外层有7个电子,共用电子对数为1,则氯原子能满足8电子结构。对氢原子则不能满足8电子结构。
方法二:分子中各原子的最外层电子数之和=8×分子中原子总数-2×共用电子数,例:PCl3最外层电子数为26=8×(1+3)-2×3,磷和氯都能满足8电子结构。【变式训练】下列分子中所有原子都满足最外层为8电子结构的是( )
A.BF3 B.H2O C.SiCl4 D.PCl5
【解析】选C。A项,BF3中形成三个共用电子对,硼原子最外层只有6个电子,未达到8电子结构,A错;B项,H2O中氢原子最外层只有2个电子,B错;C项,SiCl4中Si与Cl形成4个共用电子对,两种原子的最外层电子均达到8电子结构,C对;D项,PCl5中P不符合8电子结构,D错。【变式备选】下列用电子式表示的化合物的形成过程正确的是
( )【解析】选C。A中产物为离子化合物,其电子式应为
;B中产物的电子式书写错误,应为
;D中用电子式表示化合
物形成过程时不能用“====”,应用“ ”。1.下列能形成离子键的是( )
A.任意两种元素之间的化合
B.两种非金属元素之间的化合
C.任何金属元素与非金属元素之间的化合
D.特别活泼金属元素与特别活泼非金属元素之间的化合
【解析】选D。活泼的金属元素与活泼非金属元素之间的化合形成离子键,D正确。2.(双选)(2013·中山高一检测)下列物质中,既有离子键,又有共价键的是( )
A.HCl B.KOH C.CaCl2 D.NH4NO3
【解析】选B、D。HCl中只有共价键,CaCl2中只有离子键,KOH和NH4NO3中既有离子键又有共价键。3.(2013·宿州高一检测)关于化学键的下列叙述中正确的是
( )
A.离子化合物不含共价键
B.共价化合物可能含有离子键
C.离子化合物中只含离子键
D.共价化合物不含离子键
【解析】选D。离子化合物一定含离子键,可能含共价键,如NaOH中含离子键和共价键;共价化合物中一定无离子键,只含共价键,故D正确。4.(2013·聊城高一检测)下列分子的电子式书写正确的是
( )
A.氨气:
B.四氯化碳:
C.氮气:
D.二氧化碳:【解析】选C。选项A中氮原子的最外层电子没有全部标出;B项
中氯原子的最外层电子也没有全部标出;D项中C、O共用电子对
数目标错,碳原子不满足8e-稳定结构,正确写法为5.(2013·无锡高一检测)有下列七种物质:A.干冰、B.氧化镁、C.氯化铵、D.固态碘、E.碱、F.冰、G.过氧化钾
(1)熔化时需要破坏共价键和离子键的是 (填序号,下同);
(2)熔点最低的是 ;
(3)既有离子键又有共价键的是 ;
(4)只含有极性键的是 ;
(5)含非极性键的是 。【解析】NH4Cl是离子化合物,受热时分解,破坏了离子键和共价键。在常温下,CO2是七种物质中唯一的气体,故熔点最低。共价化合物中一定含极性键,可能含非极性键,如H2O2。
答案:(1)C (2)A (3)CEG (4)AF (5)DG化合物类型及其所含化学键的判断
氮化钠(Na3N)是科学家制备的一种重要化合物,它与水作用生成NH3和氢氧化钠。
(1)Na3N中含什么化学键?与水反应属于什么反应类型,是氧化还原反应吗?
提示:钠是活泼金属,氮是较活泼非金属,Na3N属于离子化合物,含离子键。据条件可写出该反应方程式是Na3N+3H2O====NH3+
3NaOH,属于复分解反应,不是氧化还原反应。(2)Na3N与盐酸反应生成几种盐?它们的电子式如何书写?
提示:由Na3N与水反应生成NH3和NaOH可知Na3N与盐酸反应可生
成2种盐,分别是NaCl、NH4Cl,电子式分别是
。(3)比较Na3N中两种粒子Na+与N3-的半径。
提示:Na+与N3-具有相同的核外电子排布,核电荷数越大,其离子半径越小,故Na+比N3-的半径小。
(4)Na3N熔化时破坏什么化学键?有化学键断裂就一定发生化学反应吗?
提示:Na3N属于离子化合物,熔化时破坏离子键,但没有发生化学反应,化学键断裂和化学键形成同时发生时才发生化学反应。
2.了解离子化合物和共价化合物的概念。
3.认识化学反应的实质。一、离子键
1.氯化钠的形成过程——离子键的形成:
(1)实验探究:白烟Cl2+2Na 2NaCl (2)利用原子结构的知识解释:2.离子键和离子化合物:带相反电荷离子阳离子和阴离子活泼金属NaOH、KOH 二、共价键
1.共价键:
(1)概念:原子间通过___________所形成的相互作用。
(2)成键三要素:
成键微粒:_____;
成键本质:___________;
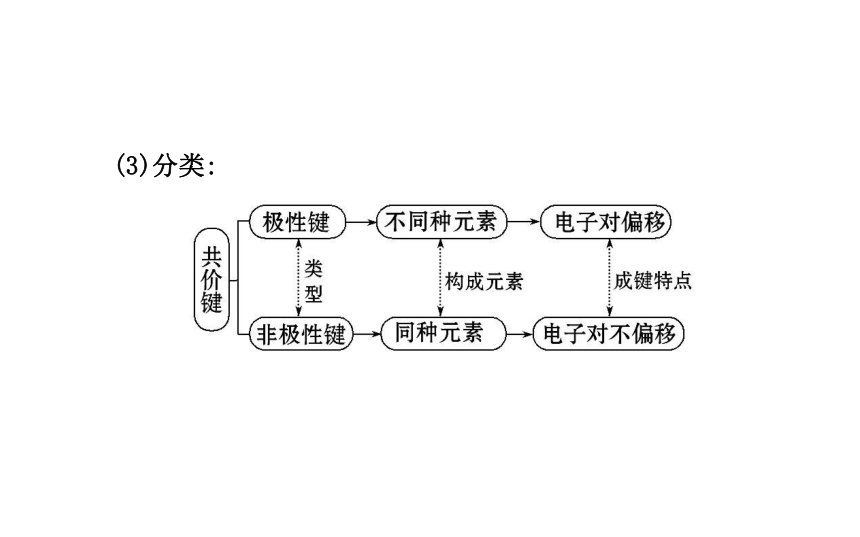
成键元素:一般是___________________元素。共用电子对原子共用电子对同种或不同种非金属(3)分类:2.共价化合物:
(1)概念:以___________形成分子的化合物。
(2)四类常见的共价化合物:
①非金属氢化物:如________等;
②非金属氧化物:如________等;
③含氧酸:如___________等;
④大多数有机化合物②:如___________等。共用电子对HCl、H2OCO2、SO3H2SO4、HNO3甲烷、酒精三、电子式
1.定义:在元素符号周围用“·”或“×”表示原子的最外层电子的式子。2.电子式的书写:四、化学键
1.概念:使_________________________的作用力。
2.分类:离子相结合或使原子相结合3.化学反应的本质:
表象:_________________________________;
本质:_________的断裂和_________的形成。反应物中的原子重新组合为产物分子旧化学键新化学键【思考辨析】
1.判断正误:
(1)离子键就是阴、阳离子间的静电吸引。( )
分析:离子键是阴、阳离子间的静电作用,包括静电吸引和静电
排斥。
(2)非金属元素间一定形成共价键。( )
分析:非金属和非金属也能形成离子键,如氯化铵。××(3)共价键只存在于共价化合物中。( )
分析:共价键存在于非金属单质的双原子分子中、共价化合物
和某些离子化合物中,如NaOH、Na2O2。
(4)所有的物质中都含有化学键。( )
分析:不是,稀有气体元素的原子已达2个电子或8个电子稳定结
构,故稀有气体的单质内无化学键。××2.问题思考:
(1)所有的金属与非金属化合都形成离子化合物吗?
分析:不一定。一般活泼金属与活泼非金属化合都形成离子化合物,但也可能生成共价化合物,如AlCl3。
(2)离子化合物中一定只含有离子键吗?
分析:不一定。离子化合物中一定含有离子键,但也可能含有共价键,如KOH除含有离子键外还含有O—H共价键。【知识链接】
①静电作用
静电作用是离子键形成的本质,它包括静电引力和静电斥力。由于静电引力没有方向性,阴阳离子之间的作用可在任何方向上,离子键没有方向性。只要条件允许,阳离子周围可以尽可能多地吸引阴离子,反之亦然,离子键没有饱和性。
②有机化合物
通常把含碳元素的化合物叫做有机化合物,简称有机物。其组成中除含有碳外,还通常含有H、O、S、N、P等元素。有机物中一般含有碳元素,但组成中含有碳元素的物质不一定是有机物。一、离子键和共价键、离子化合物和共价化合物的比较
1.离子键和共价键的比较:2.离子化合物和共价化合物的比较:【知识备选】分子间作用力、氢键与化学键比较【学而后思】
(1)离子键存在于哪类物质中?
提示:离子化合物中一定存在离子键。离子键存在于大多数强碱、盐、金属氧化物等离子化合物中。例如:NaOH、NaCl、NaHCO3、NH4NO3、Na2O2、CaO等均属于离子化合物。(2)从元素原子结构特点来看,离子键和共价键形成的条件是什么?即什么样的元素原子之间容易形成离子键,什么样的元素原子之间可以形成共价键?
提示:从元素原子结构特点分析,元素原子的半径越小,最外层电子数越多,则原子越容易通过得到电子的方式而达到稳定结构;元素原子的半径越大,最外层电子数越少,则原子越容易通过失去电子的方式而达到稳定结构;前者一般是非金属元素原子,后者一般是金属元素原子。一般情况下,活泼金属元素原子与活泼非金属元素原子之间容易形成离子键,而非金属元素原子之间形成的是共价键。需要注意的是这里说的是一般情况,也就是说还可能有特殊情况存在。二、用电子式表示物质及其形成过程
1.用电子式表示物质:
(1)原子:
方法:在元素符号周围用“·”或“×”来代表原子的最外层电子。
实例:(2)离子:
①主族元素的简单阳离子
方法:电子式就是其离子符号。
实例:Na、Mg的电子式分别是Na+、Mg2+。
②主族元素的简单阴离子
方法:在其原子电子式的符号外加[ ],然后在[ ]右上角标上
电荷符号。
实例:Cl-的电子式是 。③原子团离子
方法:表示出离子内原子间的共用电子对,然后加[ ],并在[ ]右上角标上电荷符号。
实例:(3)离子化合物:
方法:表示出构成离子化合物的阴阳离子,但同性离子不能直接相邻。
实例:(4)共价分子(包括非金属单质和化合物):
方法:表示出原子之间的共用电子对,且未形成共用电子对的原子的最外层电子也要标出。
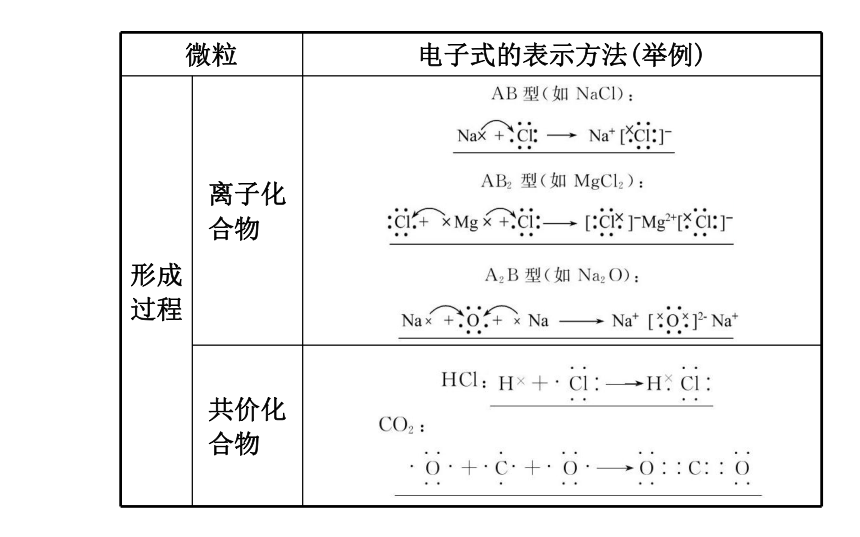
实例:2.用电子式表示物质的形成过程:
(1)离子化合物:
方法:左端是原子的电子式,右端是离子化合物的电子式,中间
用→连接。注意用 表示电子的转移。
实例:
(2)共价化合物:
方法:左端是原子的电子式,右端是共价化合物的电子式,中间
用→连接。
实例:【学而后思】
(1)下列电子式的书写是否正确?若错误,原因是什么?提示:A、B不正确,错误原因是化合物类型判断错误,NaCl属于
离子化合物,HCl属于共价化合物,二者的表示形式错误。C正
确,D不正确。原因是漏写了未成键的孤电子对,氯原子还有3对
没有参与成键的孤电子对。E不正确,错误原因是将相同的离子
合并,正确电子式为 。(2)用电子式表示NH3分子的形成过程,并分析化学键的极性。
提示: ,在NH3分子中N的吸引电子
的能力比H强,所以共用电子对偏向N一方,故NH3分子中的共价
键属于极性共价键。类型 一 化学键的概念?
【典例】(双选)下列叙述正确的是( )
A.两种元素组成的共价化合物中的化学键都是极性键
B.两种不同的非金属元素原子间形成的化学键都是极性键
C.只有金属和非金属化合时才能形成离子键
D.含有离子键的化合物一定是离子化合物【解题指南】解答本题要注意以下3点:
(1)含有离子键的化合物一定是离子化合物。
(2)非极性键可以存在于非金属单质分子、共价化合物和离子化合物中。
(3)非金属元素也可以形成离子化合物,如铵盐。【解析】选B、D。H2O2分子中既有极性键,又有非极性键,A
不正确;两种不同的非金属原子吸引共用电子对的能力肯定不
相同,B正确;NH4Cl中 与Cl-间也存在离子键, C不正
确;离子化合物是指含有离子键的化合物,D正确。【误区警示】化学键判断的“四个不是”
(1)不是所有的物质都含有化学键,如稀有气体中不含化学键。
(2)不是只要含有共价键的物质就属于共价化合物,单质例外。
(3)不是离子化合物一定含有金属元素,如铵盐中含离子键。
(4)不是只要含有金属元素的化合物就是离子化合物,如氯化铝是共价化合物。【变式训练】(双选)下列各组元素既能形成离子化合物,又能形成共价化合物的是( )
A.C、H、O B.K、Mg、Cl
C.N、Cl、H D.Na、S、H
【解析】选C、D。根据已知元素特点联系常见化合物的成键情况判断化合物的形成。A项,全部为非金属,且不能形成铵盐,不能形成离子化合物,不符合题意;B项,只有一种非金属,只能形成离子化合物,不符合题意;C项,既能形成NH3、HCl等共价化合物,又可形成离子化合物NH4Cl,符合题意;D项,既能形成H2S等共价化合物,又可形成Na2S等离子化合物,符合题意。类型 二 物质中化学键的判断?
【典例】(2013·郑州高一检测)下列各物质中,化学键类型完全相同的是( )
A.Na2O2和NaOH
B.CH3COONa和NaOH
C.CCl4和H2O
D.CO2和H2O2【解题指南】解答本题要注意以下两点:
(1)离子化合物中一定含有离子键,也可能含有共价键。
(2)共价化合物中一定没有离子键。共价键又可分为极性键和非极性键。【解析】选C。Na2O2中有离子键和非极性键,NaOH中有离子键和极性键,CH3COONa中含有离子键、非极性键和极性键;CCl4和H2O中均只含有极性键;CO2中只有极性键,H2O2中含有非极性键和极性键。【名师点评】讲解本题时应注意以下3点:
(1)重点讲述化合物类型的判定方法。
(2)师生共同总结化学键在化合物中的存在关系。
(3)让学生根据规律举例,加强巩固效果。【误区警示】化学键和化合物关系的“三个一定”和“三个可能”
(1)“三个一定”:
①离子化合物中一定含离子键;
②含离子键的一定是离子化合物;
③共价化合物中一定不含离子键。
(2)“三个可能”:
①离子化合物中可能含有共价键,如NaOH;
②金属与非金属形成的化合物可能是共价化合物,如AlCl3;
③完全由非金属形成的化合物可能是离子化合物,如NH4Cl。【变式训练】(2012·大纲版全国卷改编)下列有关化学键的叙述,正确的是( )
A.离子化合物中一定含有离子键
B.单质分子中均不存在化学键
C.含有非极性键的分子一定是单质分子
D.含有共价键的化合物一定是共价化合物【解析】选A。离子化合物一定含有离子键,A项正确;稀有气体
分子中不存在化学键,其他非金属单质分子中存在化学键,B项
错误;非金属的多原子单质分子一定含有非极性键,但含有非极
性键的分子不一定是单质分子,如H2O2分子含有非极性键
O—O,C项错误;含有共价键的化合物可能是共价化合物(如HCl)
,也可能是离子化合物(如NH4Cl),共价化合物是只含有共价键
的化合物,D项错误。【变式备选】下列反应过程中,同时有离子键、极性共价键和
非极性共价键的断裂和形成的反应是( )
A.NH4Cl NH3↑+HCl↑
B.NH3+CO2+H2O====NH4HCO3
C.2NaOH+Cl2====NaCl+NaClO+H2O
D.2Na2O2+2CO2====2Na2CO3+O2【解析】选D。本题以四个化学反应为载体综合考查了学生对离子键、极性共价键和非极性共价键的认识程度。A、B中无非极性键的断裂和形成;C中有非极性键(Cl—Cl)的断裂但无非极性键的形成;D中Na2O2既有离子键又有非极性共价键,CO2中有极性共价键,Na2CO3中有离子键和极性共价键,O2中有非极性共价键,故选D。类型 三 电子式的书写?
【典例】(2013·大庆高一检测)下列电子式中正确的是( )【解题指南】解答该题要注意以下3点:
(1)电子式中同性离子不能合并;
(2)正确判断化合物的种类;
(3)电子式中离子或原子的最外层是2或8个电子的稳定结构。【解析】选C。氧化钠中钠离子不能合并,应为
,A错误;硫化氢是共价化合物,应为
,B错误;钡离子的电子式就是其离子符号,氢氧根
离子的电子式是 C正确;二硫化碳分子中,硫原子
的最外层不是8个电子,漏掉了电子,应为 ,D错
误。【方法规律】快速判断8电子稳定结构
(1)分子中若含氢元素,则氢原子满足的是2电子稳定结构。
(2)判断8电子结构的方法有以下两种:
方法一:原子最外层电子数+共用电子对数=8,例:HCl中对氯原子来说,最外层有7个电子,共用电子对数为1,则氯原子能满足8电子结构。对氢原子则不能满足8电子结构。
方法二:分子中各原子的最外层电子数之和=8×分子中原子总数-2×共用电子数,例:PCl3最外层电子数为26=8×(1+3)-2×3,磷和氯都能满足8电子结构。【变式训练】下列分子中所有原子都满足最外层为8电子结构的是( )
A.BF3 B.H2O C.SiCl4 D.PCl5
【解析】选C。A项,BF3中形成三个共用电子对,硼原子最外层只有6个电子,未达到8电子结构,A错;B项,H2O中氢原子最外层只有2个电子,B错;C项,SiCl4中Si与Cl形成4个共用电子对,两种原子的最外层电子均达到8电子结构,C对;D项,PCl5中P不符合8电子结构,D错。【变式备选】下列用电子式表示的化合物的形成过程正确的是
( )【解析】选C。A中产物为离子化合物,其电子式应为
;B中产物的电子式书写错误,应为
;D中用电子式表示化合
物形成过程时不能用“====”,应用“ ”。1.下列能形成离子键的是( )
A.任意两种元素之间的化合
B.两种非金属元素之间的化合
C.任何金属元素与非金属元素之间的化合
D.特别活泼金属元素与特别活泼非金属元素之间的化合
【解析】选D。活泼的金属元素与活泼非金属元素之间的化合形成离子键,D正确。2.(双选)(2013·中山高一检测)下列物质中,既有离子键,又有共价键的是( )
A.HCl B.KOH C.CaCl2 D.NH4NO3
【解析】选B、D。HCl中只有共价键,CaCl2中只有离子键,KOH和NH4NO3中既有离子键又有共价键。3.(2013·宿州高一检测)关于化学键的下列叙述中正确的是
( )
A.离子化合物不含共价键
B.共价化合物可能含有离子键
C.离子化合物中只含离子键
D.共价化合物不含离子键
【解析】选D。离子化合物一定含离子键,可能含共价键,如NaOH中含离子键和共价键;共价化合物中一定无离子键,只含共价键,故D正确。4.(2013·聊城高一检测)下列分子的电子式书写正确的是
( )
A.氨气:
B.四氯化碳:
C.氮气:
D.二氧化碳:【解析】选C。选项A中氮原子的最外层电子没有全部标出;B项
中氯原子的最外层电子也没有全部标出;D项中C、O共用电子对
数目标错,碳原子不满足8e-稳定结构,正确写法为5.(2013·无锡高一检测)有下列七种物质:A.干冰、B.氧化镁、C.氯化铵、D.固态碘、E.碱、F.冰、G.过氧化钾
(1)熔化时需要破坏共价键和离子键的是 (填序号,下同);
(2)熔点最低的是 ;
(3)既有离子键又有共价键的是 ;
(4)只含有极性键的是 ;
(5)含非极性键的是 。【解析】NH4Cl是离子化合物,受热时分解,破坏了离子键和共价键。在常温下,CO2是七种物质中唯一的气体,故熔点最低。共价化合物中一定含极性键,可能含非极性键,如H2O2。
答案:(1)C (2)A (3)CEG (4)AF (5)DG化合物类型及其所含化学键的判断
氮化钠(Na3N)是科学家制备的一种重要化合物,它与水作用生成NH3和氢氧化钠。
(1)Na3N中含什么化学键?与水反应属于什么反应类型,是氧化还原反应吗?
提示:钠是活泼金属,氮是较活泼非金属,Na3N属于离子化合物,含离子键。据条件可写出该反应方程式是Na3N+3H2O====NH3+
3NaOH,属于复分解反应,不是氧化还原反应。(2)Na3N与盐酸反应生成几种盐?它们的电子式如何书写?
提示:由Na3N与水反应生成NH3和NaOH可知Na3N与盐酸反应可生
成2种盐,分别是NaCl、NH4Cl,电子式分别是
。(3)比较Na3N中两种粒子Na+与N3-的半径。
提示:Na+与N3-具有相同的核外电子排布,核电荷数越大,其离子半径越小,故Na+比N3-的半径小。
(4)Na3N熔化时破坏什么化学键?有化学键断裂就一定发生化学反应吗?
提示:Na3N属于离子化合物,熔化时破坏离子键,但没有发生化学反应,化学键断裂和化学键形成同时发生时才发生化学反应。
