【金榜教师用书课件 人教参考】2014年春高中化学必修二:21 化学能与热能(72ppt,含2013试题,含达标测试)
文档属性
| 名称 | 【金榜教师用书课件 人教参考】2014年春高中化学必修二:21 化学能与热能(72ppt,含2013试题,含达标测试) |

|
|
| 格式 | zip | ||
| 文件大小 | 3.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-02-27 21:05:40 | ||
图片预览







文档简介
课件72张PPT。第二章 化学反应与能量
第一节 化学能与热能1.知道化学键的断裂与形成是化学反应中能量变化的主要原因。
2.知道反应物总能量与生成物总能量的相对高低是反应过程中能量变化的决定因素。
3.了解化学能与热能的相互转化。
4.了解能量转化在生产、生活中的应用。一、化学键与化学反应中能量变化的关系
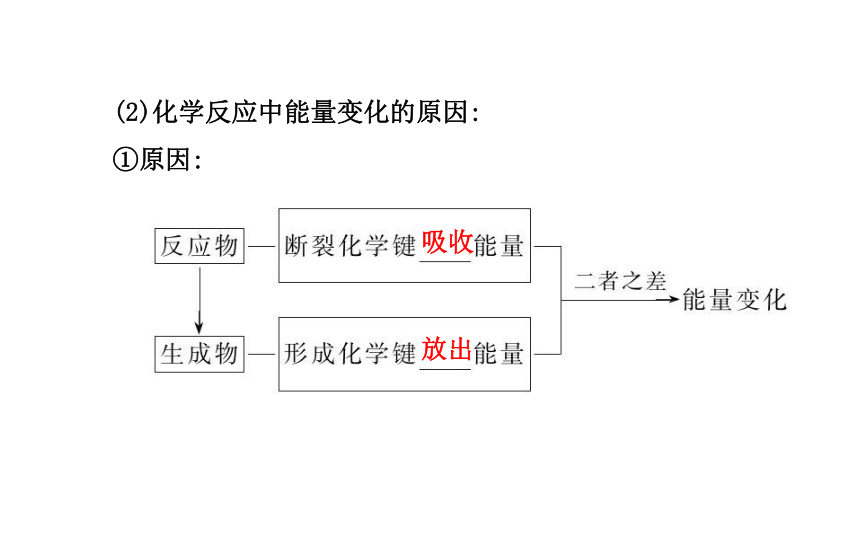
1.化学反应中能量①变化的原因——微观角度:
(1)化学反应的实质:原子的重新组合,即反应物中旧化学键的
_____和生成物中新化学键的_____过程。断裂形成(2)化学反应中能量变化的原因:
①原因:吸收放出②实例:
断裂1 mol H—H键(H—H→2H)_____436 kJ能量,
形成1 mol H—H键(2H→H—H)_____436 kJ能量;
断裂4 mol C—H键(CH4→C+4H)_____1 660 kJ能量,
形成1 mol C—H键(C—H→C+H)_____415 kJ能量。
③结论:化学反应中能量变化的主要原因是_______________
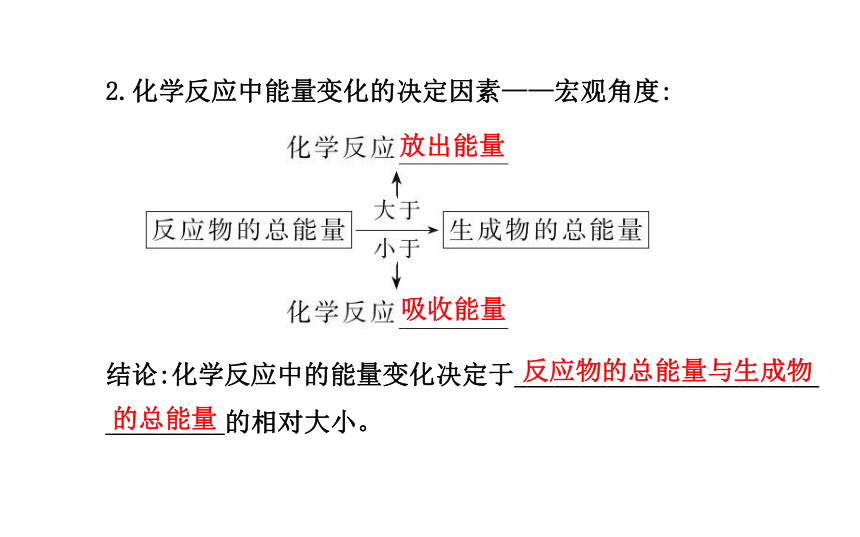
_____。吸收放出吸收放出化学键的断裂和形成2.化学反应中能量变化的决定因素——宏观角度:
结论:化学反应中的能量变化决定于_______________________
_________的相对大小。放出能量 吸收能量反应物的总能量与生成物的总能量二、化学能与热能的相互转化
1.两个基本自然规律②——“质量守恒”和“能量守恒”:
(1)质量守恒定律:自然界中的物质发生转化时_______保持不
变。
(2)能量守恒定律:不同形式的能量发生转化时_______保持不
变。总质量总能量2.吸热反应和放热反应:
(1)定义:
吸热反应:_____热量的化学反应;
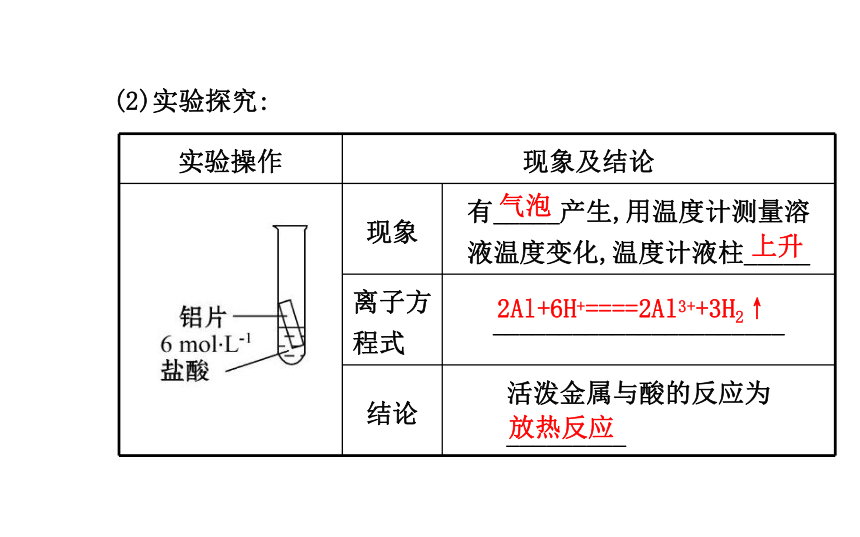
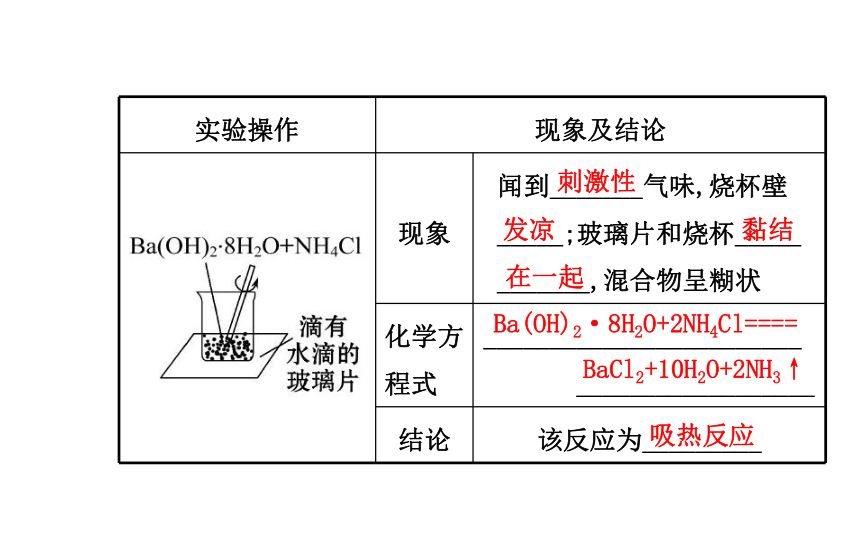
放热反应:_____热量的化学反应。吸收放出(2)实验探究:气泡上升2Al+6H+====2Al3++3H2↑ 放热反应刺激性发凉黏结在一起Ba(OH)2·8H2O+2NH4Cl====BaCl2+10H2O+2NH3↑吸热反应高OH-+H+====H2O 放热反应【思考辨析】
1.判断正误:
(1)化学键断裂需要吸收能量,化学键形成会放出能量。( )
分析:断裂化学键时吸收能量,形成化学键时放出能量。
(2)化学反应必然伴随着能量的变化。( )
分析:化学反应的本质是旧键断裂和新键形成,反应物旧键断裂
时吸收的热量和生成物新键形成时放出的热量不可能完全相同,
故化学反应必然伴随着能量的变化。√√(3)相同质量的氢气在氧气中燃烧比与氧气混合发生爆炸反应
放出的热量少。( )
分析:化学反应中能量变化的多少与反应物的量有关,与反应的
形式和反应条件无关。
(4)化学反应中的能量变化全部是以热量的形式变化的。( )
分析:化学反应中的能量变化通常表现为热量的变化,如氢气的
燃烧;但还会有其他的能量形式,如光能、电能等。××2.问题思考:
(1)有能量放出的变化都是放热反应吗?吸收能量的变化都是吸热反应吗?
分析:不一定。如图,物质的状态变化也伴随热量的变化,但它们属于物理变化;而放热反应和吸热反应指的是化学变化。(2)人体运动所消耗的能量与太阳能有关吗?
分析:有关。人体所需的能量是食物在人体内的氧化反应所释放的能量,而食物中的能量是通过植物的光合作用将太阳能储存在植物中,所以人体运动所消耗的能量应该说是来自于太阳能。【知识链接】
①能量
能量是度量物质运动的一种物理量。能量分为机械能、分子内能、电能、化学能、原子能等,在一定条件下,不同形式的能量可以相互转化。
②自然规律
自然规律是指不经人为干预,客观事物自身运动、变化和发展的内在必然联系。一、放热反应和吸热反应的理解
1.放热反应和吸热反应的比较:
E:物质的总能量;Q(吸):反应物分子断键时吸收的总能量;Q(放):生成物分子成键时放出的总能量。2.常见的放热反应和吸热反应:【知识备选】中和热的测定
1.中和热的概念:酸与碱发生中和反应生成1 mol H2O时所释放出的热量。
2.计算原理:
(1)反应放出的热量:
Q=cm·Δt
其中:c为体系的比热容,m指体系的质量,Δt为反应前后的温度差。
(2)中和热数值:
中和热数值=反应放出的热量÷生成水的物质的量3.实验设计:
(1)组装装置:(2)实验步骤:
①测量初始温度t1
a.向小烧杯中加入0.50 mol·L-1的盐酸50 mL,并用温度计测量盐酸的温度,然后把温度计上的酸用水冲洗干净。
b.在另一小烧杯中加入50 mL 0.55 mol·L-1的NaOH溶液,并用温度计测量NaOH溶液的温度。
c.求两温度的平均值作为t1。②测量终止温度t2
a.把温度计和环形玻璃搅拌棒放入盛有盐酸的小烧杯中;
b.把NaOH溶液一次倒入盛有盐酸的小烧杯中;
c.用环形玻璃搅拌棒轻轻搅动溶液,并准确读取混合溶液的最高温度t2。
③重复实验操作
重复实验2次~3次,取测量所得数据的平均值作为计算依据。
④实验数据处理
根据数据计算中和热。4.实验注意事项:
(1)作为量热的仪器装置,要保温、隔热,尽量减少热量散失。
①环形玻璃搅拌棒不能用铁丝代替以免引起实验误差;
②温度计的读数要准确。
(2)实验操作要快,尽量减少热量的损失。【学而后思】
(1)做实验时,不管是吸热反应还是放热反应都可能用到酒精灯,怎样根据加热的方法判断该反应是吸热反应还是放热反应?放热反应加热的目的是什么?
提示:持续用酒精灯加热,撤掉酒精灯反应就停止的反应是吸热反应;开始用酒精灯加热,反应开始后,撤去酒精灯仍能继续反应的反应是放热反应。放热反应加热的目的一般是引发反应进行或加快反应速率。(2)放热反应一定容易发生,吸热反应一定难发生吗?
提示:不一定。反应放热和吸热与反应的条件无关,有些放热反应必须加热才能发生,如木炭的燃烧;而有些吸热反应在常温下就能发生,如Ba(OH)2·8H2O与NH4Cl的反应。二、利用化学键计算化学反应中的能量变化
1.化学键与能量变化的关系:2.计算公式的推导分析:
以H2+Cl2====2HCl为例:
(1)图示分析:(2)计算分析:3.计算公式:
用Q(吸)表示反应物分子断裂时吸收的总能量,Q(放)表示生成
物分子成键时放出的总能量。
公式:ΔQ=Q(吸)-Q(放)
利用化学键的能量变化计算化学反应中的能量变化:
ΔQ=Q(吸)-Q(放)ΔQ<0,为放热反应
ΔQ>0,为吸热反应【学而后思】
(1)对于放热反应:2H2+O2 2H2O来说,“断裂1个H—H键和1
个O O键所吸收的能量小于形成1个H—O键所放出的能量”这
种说法是否正确?
提示:不正确。在反应2H2+O2 2H2O中,每断裂1个O O键,
同时断裂2个H—H键,形成4个H—O键;正确的说法是:断裂2个
H—H键和1个O O键所吸收的能量小于形成4个H—O键所放出
的能量。===(2)如图是1 mol氢气燃烧的能量变化图,试分析a、b表示的含义。提示:化学反应发生时首先断裂反应物中的化学键,再形成生成物中的化学键,故a表示破坏1 mol H—H键、0.5 mol O O键所吸收的能量,b表示形成2 mol H—O键所放出的能量与断裂
1 mol H—H键、0.5 mol O O键所吸收的总能量的差。==类型 一 化学反应中的能量变化?
【典例】(2013·北京海淀区高一检测)已知反应X+Y====M+N为吸热反应,对这个反应的下列说法中正确的是( )
A.X的能量一定低于M的,Y的能量一定低于N的
B.因为该反应为吸热反应,故一定要加热,反应才能进行
C.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量
D.X和Y的总能量一定低于M和N的总能量【解题指南】解答本题要注意以下3点:
(1)反应物的总能量<生成物的总能量;
(2)断键吸收的能量>成键放出的能量;
(3)吸热反应不一定必须加热才能发生。【解析】选D。吸热反应中反应物的总能量<生成物的总能量,不能单指某一种反应物与某一种生成物的能量大小,A错误,D正确;吸热反应不一定必须加热才能发生,B错误;从微观角度解释,吸热反应中破坏反应物中的化学键所吸收的能量大于形成生成物中化学键所放出的能量,C错误。【互动探究】(1)该题C项描述的是什么反应?
提示:破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量,则该反应是放热反应。
(2)假设该反应是可逆反应,则M+N====X+Y是什么反应?该反应一定不需要加热吗?
提示:因为反应X+Y====M+N为吸热反应,即X和Y的总能量一定低于M和N的总能量,所以M+N====X+Y是放热反应,反应可能需要加热才能发生。【方法规律】放热反应和吸热反应的判断方法
(1)根据反应物和生成物的总能量大小判断——反应物的总能量大于生成物的总能量的反应为放热反应,反之为吸热反应。
(2)根据化学键断裂和形成时能量变化大小关系判断——破坏反应物中化学键吸收的能量大于形成生成物中化学键放出的能量的反应为吸热反应,反之为放热反应。
(3)根据经验规律判断——用常见吸热和放热的反应类型来判断。(4)根据生成物和反应物的相对稳定性判断——由稳定性的物质生成不稳定的物质的反应为吸热反应,反之为放热反应。
(5)根据反应条件判断——凡是需持续加热才能进行的反应就是吸热反应。反之,一般为放热反应。【变式训练】研究物质变化时,人们可以从不同的角度、不同的层面来认识物质变化时所引起的化学键及能量变化。据此判断以下叙述中错误的是( )
A.金属钠与氯气反应生成氯化钠后,其结构稳定性增强,体系的能量降低
B.物质燃烧可看成“储存”在物质内部的能量(化学能)转化为热能释放出来
C.氮分子内部存在着很强的共价键,故通常状况下氮气化学性质很活泼
D.需要加热才能发生的反应不一定是吸收能量的反应【解析】选C。钠原子最外层只有1个电子,当它失去1个电子后可以形成8电子稳定结构,使体系的能量降低,A正确;物质燃烧放热,化学能转化为热能,B正确;氮分子内部存在着很强的共价键,很难被破坏,所以在通常状况下氮气性质很稳定,C错误;任何化学反应都经历了旧键断裂(吸收能量)和新键形成(放出能量)的过程,都伴随着能量的变化,但无论是释放能量还是吸收能量,都不是由反应条件确定的,如合成氨需要在高温下进行,但它却是释放能量的反应,D正确。【变式备选】下列变化中属于吸热反应的是 。
①液态水汽化
②将胆矾加热变为白色粉末
③苛性钠固体溶于水
④氯酸钾分解制氧气
⑤生石灰跟水反应生成熟石灰
⑥干冰升华【解析】吸热过程或放热过程与吸热反应或放热反应不同:
①水汽化是物理变化,不属于吸热反应。
②CuSO4·5H2O受热分解生成CuSO4和H2O,属于吸热反应。④氯酸钾受热分解生成KCl和O2,属于吸热反应。⑤是放热反应,
③⑥均为物理变化。
答案:②④类型 二 化学键与化学反应中能量变化的关系?
【典例】(2012·重庆高考)肼(H2NNH2)是一种高能燃料,有关
化学反应的能量变化如图所示,已知断裂1 mol化学键所需的能
量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol
N—H键所需的能量(kJ)是( )
A.194 B.391 C.516 D.658【解题指南】解答本题可以按照以下思路:【解析】选B。利用图示可知肼和氧气变成原子时断键需要的
能量为2 752 kJ-534 kJ=2 218 kJ。肼和氧气断键变为原子时
要断裂1个N—N键,4个N—H键,1个O O键,所以1×154+4×
(N—H键能)+1×500=2 218,解得N—H键能为391,单位为kJ,
选B。=【名师点评】讲解本题时应注意以下3点:
(1)引导学生观察图像,分析反应物、生成物和各个过程的含义。
(2)归纳总结化学反应中能量变化与化学键断裂和形成的能量变化的关系。
(3)强调断裂1 mol某化学键吸收的能量和形成1 mol该化学键放出的能量相等。【互动探究】
(1)根据图示分析,该反应属于放热反应还是吸热反应?
提示:由图可知反应物N2H4(g)和O2(g)的总能量大于生成物N2(g)和2H2O(g)的总能量,故该反应属于放热反应。
(2)若反应后生成液态水,则该反应的能量变化Q与原反应的能量变化Q1有什么关系?
提示:气态水生成液态水时要放出热量,故反应生成液态水时放出的热量多,则Q>Q1。【变式训练】(2013·郑州高一检测)化学反应A2+B2====2AB的
能量变化如图所示,则下列说法正确的是( )
A.该反应是吸热反应
B.1 mol A—A键和1 mol B—B键
断裂能放出xkJ的能量
C.2 mol A—B键断裂需要吸收ykJ
的能量
D.2 mol AB的总能量高于1 mol A2和1 mol B2的总能量【解析】选C。由图知1 mol A2和1 mol B2的总能量大于2 mol AB的总能量,该反应为放热反应,A、D错误;化学键断裂时吸热,B错误;由图知2 mol A—B键断裂吸收ykJ的能量,C正确。【变式备选】下表中的数据是破坏1 mol物质中的化学键所吸收的能量(kJ)。这一数据的大小可以衡量化学键的强弱,也可用于估算化学反应的能量变化。根据上面的数据回答下列问题:
(1)在HCl、HBr、HI中,最稳定的是 ;
(2)对于反应X2+H2====2HX(X2代表Cl2、Br2、I2),相同条件下,消耗等量氢气时,放出热量最多的是 ;
(3)反应Br2+H2====2HBr,当生成2 mol HBr时放出 kJ能量。【解析】(1)因化学键越强,破坏物质中的化学键所吸收的能量也越大,化合物也就越稳定,由表可知:在HCl、HBr、HI中,破坏1 mol HCl中的化学键所吸收的能量最大,为431 kJ,故答案为HCl。(2)因化学反应所吸收或放出的能量即为反应热,反应热等于反应中断裂旧化学键消耗的能量之和与反应中形成新化学键放出的能量之和的差,以氯元素为例计算:断开1 mol Cl—Cl键和H—H键需吸收的能量为243 kJ+436 kJ=679 kJ,而形成2 mol H—Cl键放出的能量为2×431 kJ=862 kJ,所以在Cl2+H2====
2HCl反应中放出862 kJ-679 kJ=183 kJ的能量,同理可计算在Br2+H2====2HBr、I2+H2====2HI反应中分别放出103 kJ、9 kJ的能量,故答案为Cl2。(3)反应Br2+H2====2HBr中,断开1 mol Br—Br键和H—H键需吸收的能量为193 kJ+436 kJ=629 kJ,而形成2 mol H—Br键放出的能量为2×366 kJ=732 kJ,所以在Br2+H2====2HBr反应中放出732 kJ-629 kJ=103 kJ的热量,故答案为103。
答案:(1)HCl (2)Cl2 (3)1031.(双选)(2013·温州高一检测)下列说法中正确的是( )
A.大多数的化合反应是释放能量的反应
B.大多数的分解反应是吸收能量的反应
C.释放能量的反应都不需要加热
D.吸收能量的反应都需要加热【解析】选A、B。大多数化合反应是释放能量的反应,A正确;而大多数分解反应是吸收能量的反应,B正确;释放能量的反应有的也需要加热,如氢气与氧气反应生成水则需点燃,C错误;反应Ba(OH)2·8H2O+2NH4Cl====BaCl2+2NH3↑+10H2O是吸热的,常温下就能进行,D错误。2.下列对化学反应的认识错误的是( )
A.一定会有化学键的变化
B.一定会产生新的物质
C.必然引起物质状态的变化
D.有能量变化的过程不一定是化学反应
【解析】选C。化学反应的本质是旧化学键的断裂和新化学键
的形成,化学反应中会产生新的物质并伴随能量变化,但物质状
态不一定发生变化,如N2(g)+3H2(g) 2NH3(g);物质
的状态发生变化也会伴有能量的变化,但不属于化学反应。3.(2013·临沂高一检测)下列说法正确的是( )
A.对于吸热反应,反应物所具有的总能量总是低于生成物所具有的总能量
B.任何放热反应在常温条件下一定能发生反应
C.形成生成物化学键释放的能量大于破坏反应物化学键所吸收的能量时,反应为吸热反应
D.等量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多【解析】选A。放热反应在常温下不一定能发生,如煤的燃烧,B错误。形成生成物化学键释放的能量大于破坏反应物化学键所吸收的能量时,反应为放热反应,C错误;等量的硫蒸气和硫固体分别完全燃烧,后者放出的热量少,D错误。4.下列反应符合图示的是( )
A.铝片与盐酸的反应
B.消石灰与NH4Cl晶体的反应
C.酸碱中和反应
D.甲烷在氧气中的燃烧反应【解析】选B。由于反应物的总能量比生成物的总能量低,所以该反应是吸热反应。而上述反应中只有消石灰和NH4Cl晶体的反应是吸热的,所以答案选B。5.某同学做如下实验,以检验反应中的能量变化。(1)在实验中发现反应后(a)中温度升高,由此可以判断(a)中反应是 热反应;(b)中温度降低,由此可以判断(b)中反应是 热反应。
(2)写出铝与盐酸反应的离子方程式 。
(3)根据能量守恒定律,(b)中反应物的总能量应该 其生成物的总能量。【解析】(1)反应后(a)中温度升高,(b)中温度降低,说明
(a)中反应为放热反应,(b)中反应为吸热反应。
(2)铝与盐酸反应的离子方程式为2Al+6H+====2Al3++3H2↑。
(3)(b)中反应为吸热反应,根据能量守恒定律,(b)中反应物的总能量应该低于其生成物的总能量。
答案:(1)放 吸 (2)2Al+6H+====2Al3++3H2↑
(3)低于探究盐酸与氢氧化钠溶液反应的中和热
如图所示:在大烧杯中放入碎纸屑,把盛有50 mL 0.50 mol·L-1
盐酸的小烧杯放到大烧杯中,两只烧杯间填满碎纸屑。用泡沫
塑料板做成大烧杯盖,通过盖子插入一根玻璃搅拌器(末端呈半
圆环的玻璃棒)和一只温度计,测定溶液的温度。迅速往盐酸溶
液中加入50 mL 0.55 mol·L-1烧碱溶液,盖好,搅拌溶液,观察
温度的变化。当温度保持稳定时,记录读数,取出装反应液的烧
杯,倒出溶液,清洗干净,保持内外杯壁干燥。重复进行三次实
验。用这一实验可以粗略测定中和热。(1)烧杯间为什么要填满碎纸屑?如果烧杯不盖硬纸板,反应放出的热量如何变化?
提示:烧杯间填满碎纸屑的目的是保温、隔热、减少实验过程中放出的热量的损失;烧杯如果不盖硬纸板,实验中就会有热量损失,则放出的热量减少。
(2)实验为什么要重复进行三次?
提示:重复进行三次实验是为了减少实验过程中的误差。(3)实验中若改用60 mL 0.50 mol·L-1盐酸和50 mL
0.55 mol·L-1烧碱溶液进行上述反应,与上述实验相比,所放出的热量如何变化?
提示:因为此时反应生成的水多了,所以放出的热量增多。
(4)酸与碱发生中和反应生成1 mol水时放出的热量叫中和热。若该实验中放出的热量是1.43 kJ,则该反应的中和热是多少?
提示:因为反应生成0.05 L×0.50 mol·L-1=0.025 mol水时放出1.43 kJ热量,故中和热是1.43 kJ÷0.025 mol=
57.2 kJ·mol-1。(5)浓硫酸与等体积的氢氧化钠溶液反应,生成1 mol H2O时放出的热量为Q,能否说中和热为QkJ·mol-1?
提示:浓硫酸与其他溶液混合时要放出大量的热,热量Q包括中和反应的热量和溶解热,故中和热小于QkJ·mol-1。
第一节 化学能与热能1.知道化学键的断裂与形成是化学反应中能量变化的主要原因。
2.知道反应物总能量与生成物总能量的相对高低是反应过程中能量变化的决定因素。
3.了解化学能与热能的相互转化。
4.了解能量转化在生产、生活中的应用。一、化学键与化学反应中能量变化的关系
1.化学反应中能量①变化的原因——微观角度:
(1)化学反应的实质:原子的重新组合,即反应物中旧化学键的
_____和生成物中新化学键的_____过程。断裂形成(2)化学反应中能量变化的原因:
①原因:吸收放出②实例:
断裂1 mol H—H键(H—H→2H)_____436 kJ能量,
形成1 mol H—H键(2H→H—H)_____436 kJ能量;
断裂4 mol C—H键(CH4→C+4H)_____1 660 kJ能量,
形成1 mol C—H键(C—H→C+H)_____415 kJ能量。
③结论:化学反应中能量变化的主要原因是_______________
_____。吸收放出吸收放出化学键的断裂和形成2.化学反应中能量变化的决定因素——宏观角度:
结论:化学反应中的能量变化决定于_______________________
_________的相对大小。放出能量 吸收能量反应物的总能量与生成物的总能量二、化学能与热能的相互转化
1.两个基本自然规律②——“质量守恒”和“能量守恒”:
(1)质量守恒定律:自然界中的物质发生转化时_______保持不
变。
(2)能量守恒定律:不同形式的能量发生转化时_______保持不
变。总质量总能量2.吸热反应和放热反应:
(1)定义:
吸热反应:_____热量的化学反应;
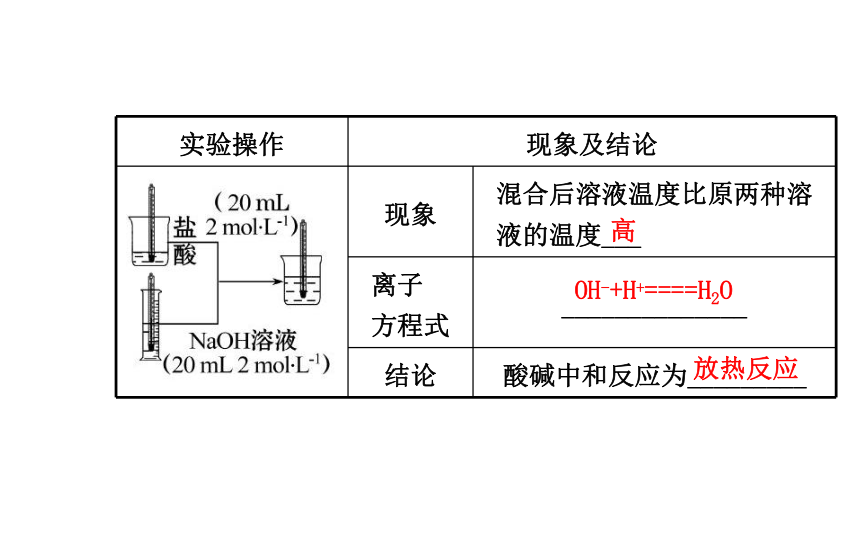
放热反应:_____热量的化学反应。吸收放出(2)实验探究:气泡上升2Al+6H+====2Al3++3H2↑ 放热反应刺激性发凉黏结在一起Ba(OH)2·8H2O+2NH4Cl====BaCl2+10H2O+2NH3↑吸热反应高OH-+H+====H2O 放热反应【思考辨析】
1.判断正误:
(1)化学键断裂需要吸收能量,化学键形成会放出能量。( )
分析:断裂化学键时吸收能量,形成化学键时放出能量。
(2)化学反应必然伴随着能量的变化。( )
分析:化学反应的本质是旧键断裂和新键形成,反应物旧键断裂
时吸收的热量和生成物新键形成时放出的热量不可能完全相同,
故化学反应必然伴随着能量的变化。√√(3)相同质量的氢气在氧气中燃烧比与氧气混合发生爆炸反应
放出的热量少。( )
分析:化学反应中能量变化的多少与反应物的量有关,与反应的
形式和反应条件无关。
(4)化学反应中的能量变化全部是以热量的形式变化的。( )
分析:化学反应中的能量变化通常表现为热量的变化,如氢气的
燃烧;但还会有其他的能量形式,如光能、电能等。××2.问题思考:
(1)有能量放出的变化都是放热反应吗?吸收能量的变化都是吸热反应吗?
分析:不一定。如图,物质的状态变化也伴随热量的变化,但它们属于物理变化;而放热反应和吸热反应指的是化学变化。(2)人体运动所消耗的能量与太阳能有关吗?
分析:有关。人体所需的能量是食物在人体内的氧化反应所释放的能量,而食物中的能量是通过植物的光合作用将太阳能储存在植物中,所以人体运动所消耗的能量应该说是来自于太阳能。【知识链接】
①能量
能量是度量物质运动的一种物理量。能量分为机械能、分子内能、电能、化学能、原子能等,在一定条件下,不同形式的能量可以相互转化。
②自然规律
自然规律是指不经人为干预,客观事物自身运动、变化和发展的内在必然联系。一、放热反应和吸热反应的理解
1.放热反应和吸热反应的比较:
E:物质的总能量;Q(吸):反应物分子断键时吸收的总能量;Q(放):生成物分子成键时放出的总能量。2.常见的放热反应和吸热反应:【知识备选】中和热的测定
1.中和热的概念:酸与碱发生中和反应生成1 mol H2O时所释放出的热量。
2.计算原理:
(1)反应放出的热量:
Q=cm·Δt
其中:c为体系的比热容,m指体系的质量,Δt为反应前后的温度差。
(2)中和热数值:
中和热数值=反应放出的热量÷生成水的物质的量3.实验设计:
(1)组装装置:(2)实验步骤:
①测量初始温度t1
a.向小烧杯中加入0.50 mol·L-1的盐酸50 mL,并用温度计测量盐酸的温度,然后把温度计上的酸用水冲洗干净。
b.在另一小烧杯中加入50 mL 0.55 mol·L-1的NaOH溶液,并用温度计测量NaOH溶液的温度。
c.求两温度的平均值作为t1。②测量终止温度t2
a.把温度计和环形玻璃搅拌棒放入盛有盐酸的小烧杯中;
b.把NaOH溶液一次倒入盛有盐酸的小烧杯中;
c.用环形玻璃搅拌棒轻轻搅动溶液,并准确读取混合溶液的最高温度t2。
③重复实验操作
重复实验2次~3次,取测量所得数据的平均值作为计算依据。
④实验数据处理
根据数据计算中和热。4.实验注意事项:
(1)作为量热的仪器装置,要保温、隔热,尽量减少热量散失。
①环形玻璃搅拌棒不能用铁丝代替以免引起实验误差;
②温度计的读数要准确。
(2)实验操作要快,尽量减少热量的损失。【学而后思】
(1)做实验时,不管是吸热反应还是放热反应都可能用到酒精灯,怎样根据加热的方法判断该反应是吸热反应还是放热反应?放热反应加热的目的是什么?
提示:持续用酒精灯加热,撤掉酒精灯反应就停止的反应是吸热反应;开始用酒精灯加热,反应开始后,撤去酒精灯仍能继续反应的反应是放热反应。放热反应加热的目的一般是引发反应进行或加快反应速率。(2)放热反应一定容易发生,吸热反应一定难发生吗?
提示:不一定。反应放热和吸热与反应的条件无关,有些放热反应必须加热才能发生,如木炭的燃烧;而有些吸热反应在常温下就能发生,如Ba(OH)2·8H2O与NH4Cl的反应。二、利用化学键计算化学反应中的能量变化
1.化学键与能量变化的关系:2.计算公式的推导分析:
以H2+Cl2====2HCl为例:
(1)图示分析:(2)计算分析:3.计算公式:
用Q(吸)表示反应物分子断裂时吸收的总能量,Q(放)表示生成
物分子成键时放出的总能量。
公式:ΔQ=Q(吸)-Q(放)
利用化学键的能量变化计算化学反应中的能量变化:
ΔQ=Q(吸)-Q(放)ΔQ<0,为放热反应
ΔQ>0,为吸热反应【学而后思】
(1)对于放热反应:2H2+O2 2H2O来说,“断裂1个H—H键和1
个O O键所吸收的能量小于形成1个H—O键所放出的能量”这
种说法是否正确?
提示:不正确。在反应2H2+O2 2H2O中,每断裂1个O O键,
同时断裂2个H—H键,形成4个H—O键;正确的说法是:断裂2个
H—H键和1个O O键所吸收的能量小于形成4个H—O键所放出
的能量。===(2)如图是1 mol氢气燃烧的能量变化图,试分析a、b表示的含义。提示:化学反应发生时首先断裂反应物中的化学键,再形成生成物中的化学键,故a表示破坏1 mol H—H键、0.5 mol O O键所吸收的能量,b表示形成2 mol H—O键所放出的能量与断裂
1 mol H—H键、0.5 mol O O键所吸收的总能量的差。==类型 一 化学反应中的能量变化?
【典例】(2013·北京海淀区高一检测)已知反应X+Y====M+N为吸热反应,对这个反应的下列说法中正确的是( )
A.X的能量一定低于M的,Y的能量一定低于N的
B.因为该反应为吸热反应,故一定要加热,反应才能进行
C.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量
D.X和Y的总能量一定低于M和N的总能量【解题指南】解答本题要注意以下3点:
(1)反应物的总能量<生成物的总能量;
(2)断键吸收的能量>成键放出的能量;
(3)吸热反应不一定必须加热才能发生。【解析】选D。吸热反应中反应物的总能量<生成物的总能量,不能单指某一种反应物与某一种生成物的能量大小,A错误,D正确;吸热反应不一定必须加热才能发生,B错误;从微观角度解释,吸热反应中破坏反应物中的化学键所吸收的能量大于形成生成物中化学键所放出的能量,C错误。【互动探究】(1)该题C项描述的是什么反应?
提示:破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量,则该反应是放热反应。
(2)假设该反应是可逆反应,则M+N====X+Y是什么反应?该反应一定不需要加热吗?
提示:因为反应X+Y====M+N为吸热反应,即X和Y的总能量一定低于M和N的总能量,所以M+N====X+Y是放热反应,反应可能需要加热才能发生。【方法规律】放热反应和吸热反应的判断方法
(1)根据反应物和生成物的总能量大小判断——反应物的总能量大于生成物的总能量的反应为放热反应,反之为吸热反应。
(2)根据化学键断裂和形成时能量变化大小关系判断——破坏反应物中化学键吸收的能量大于形成生成物中化学键放出的能量的反应为吸热反应,反之为放热反应。
(3)根据经验规律判断——用常见吸热和放热的反应类型来判断。(4)根据生成物和反应物的相对稳定性判断——由稳定性的物质生成不稳定的物质的反应为吸热反应,反之为放热反应。
(5)根据反应条件判断——凡是需持续加热才能进行的反应就是吸热反应。反之,一般为放热反应。【变式训练】研究物质变化时,人们可以从不同的角度、不同的层面来认识物质变化时所引起的化学键及能量变化。据此判断以下叙述中错误的是( )
A.金属钠与氯气反应生成氯化钠后,其结构稳定性增强,体系的能量降低
B.物质燃烧可看成“储存”在物质内部的能量(化学能)转化为热能释放出来
C.氮分子内部存在着很强的共价键,故通常状况下氮气化学性质很活泼
D.需要加热才能发生的反应不一定是吸收能量的反应【解析】选C。钠原子最外层只有1个电子,当它失去1个电子后可以形成8电子稳定结构,使体系的能量降低,A正确;物质燃烧放热,化学能转化为热能,B正确;氮分子内部存在着很强的共价键,很难被破坏,所以在通常状况下氮气性质很稳定,C错误;任何化学反应都经历了旧键断裂(吸收能量)和新键形成(放出能量)的过程,都伴随着能量的变化,但无论是释放能量还是吸收能量,都不是由反应条件确定的,如合成氨需要在高温下进行,但它却是释放能量的反应,D正确。【变式备选】下列变化中属于吸热反应的是 。
①液态水汽化
②将胆矾加热变为白色粉末
③苛性钠固体溶于水
④氯酸钾分解制氧气
⑤生石灰跟水反应生成熟石灰
⑥干冰升华【解析】吸热过程或放热过程与吸热反应或放热反应不同:
①水汽化是物理变化,不属于吸热反应。
②CuSO4·5H2O受热分解生成CuSO4和H2O,属于吸热反应。④氯酸钾受热分解生成KCl和O2,属于吸热反应。⑤是放热反应,
③⑥均为物理变化。
答案:②④类型 二 化学键与化学反应中能量变化的关系?
【典例】(2012·重庆高考)肼(H2NNH2)是一种高能燃料,有关
化学反应的能量变化如图所示,已知断裂1 mol化学键所需的能
量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol
N—H键所需的能量(kJ)是( )
A.194 B.391 C.516 D.658【解题指南】解答本题可以按照以下思路:【解析】选B。利用图示可知肼和氧气变成原子时断键需要的
能量为2 752 kJ-534 kJ=2 218 kJ。肼和氧气断键变为原子时
要断裂1个N—N键,4个N—H键,1个O O键,所以1×154+4×
(N—H键能)+1×500=2 218,解得N—H键能为391,单位为kJ,
选B。=【名师点评】讲解本题时应注意以下3点:
(1)引导学生观察图像,分析反应物、生成物和各个过程的含义。
(2)归纳总结化学反应中能量变化与化学键断裂和形成的能量变化的关系。
(3)强调断裂1 mol某化学键吸收的能量和形成1 mol该化学键放出的能量相等。【互动探究】
(1)根据图示分析,该反应属于放热反应还是吸热反应?
提示:由图可知反应物N2H4(g)和O2(g)的总能量大于生成物N2(g)和2H2O(g)的总能量,故该反应属于放热反应。
(2)若反应后生成液态水,则该反应的能量变化Q与原反应的能量变化Q1有什么关系?
提示:气态水生成液态水时要放出热量,故反应生成液态水时放出的热量多,则Q>Q1。【变式训练】(2013·郑州高一检测)化学反应A2+B2====2AB的
能量变化如图所示,则下列说法正确的是( )
A.该反应是吸热反应
B.1 mol A—A键和1 mol B—B键
断裂能放出xkJ的能量
C.2 mol A—B键断裂需要吸收ykJ
的能量
D.2 mol AB的总能量高于1 mol A2和1 mol B2的总能量【解析】选C。由图知1 mol A2和1 mol B2的总能量大于2 mol AB的总能量,该反应为放热反应,A、D错误;化学键断裂时吸热,B错误;由图知2 mol A—B键断裂吸收ykJ的能量,C正确。【变式备选】下表中的数据是破坏1 mol物质中的化学键所吸收的能量(kJ)。这一数据的大小可以衡量化学键的强弱,也可用于估算化学反应的能量变化。根据上面的数据回答下列问题:
(1)在HCl、HBr、HI中,最稳定的是 ;
(2)对于反应X2+H2====2HX(X2代表Cl2、Br2、I2),相同条件下,消耗等量氢气时,放出热量最多的是 ;
(3)反应Br2+H2====2HBr,当生成2 mol HBr时放出 kJ能量。【解析】(1)因化学键越强,破坏物质中的化学键所吸收的能量也越大,化合物也就越稳定,由表可知:在HCl、HBr、HI中,破坏1 mol HCl中的化学键所吸收的能量最大,为431 kJ,故答案为HCl。(2)因化学反应所吸收或放出的能量即为反应热,反应热等于反应中断裂旧化学键消耗的能量之和与反应中形成新化学键放出的能量之和的差,以氯元素为例计算:断开1 mol Cl—Cl键和H—H键需吸收的能量为243 kJ+436 kJ=679 kJ,而形成2 mol H—Cl键放出的能量为2×431 kJ=862 kJ,所以在Cl2+H2====
2HCl反应中放出862 kJ-679 kJ=183 kJ的能量,同理可计算在Br2+H2====2HBr、I2+H2====2HI反应中分别放出103 kJ、9 kJ的能量,故答案为Cl2。(3)反应Br2+H2====2HBr中,断开1 mol Br—Br键和H—H键需吸收的能量为193 kJ+436 kJ=629 kJ,而形成2 mol H—Br键放出的能量为2×366 kJ=732 kJ,所以在Br2+H2====2HBr反应中放出732 kJ-629 kJ=103 kJ的热量,故答案为103。
答案:(1)HCl (2)Cl2 (3)1031.(双选)(2013·温州高一检测)下列说法中正确的是( )
A.大多数的化合反应是释放能量的反应
B.大多数的分解反应是吸收能量的反应
C.释放能量的反应都不需要加热
D.吸收能量的反应都需要加热【解析】选A、B。大多数化合反应是释放能量的反应,A正确;而大多数分解反应是吸收能量的反应,B正确;释放能量的反应有的也需要加热,如氢气与氧气反应生成水则需点燃,C错误;反应Ba(OH)2·8H2O+2NH4Cl====BaCl2+2NH3↑+10H2O是吸热的,常温下就能进行,D错误。2.下列对化学反应的认识错误的是( )
A.一定会有化学键的变化
B.一定会产生新的物质
C.必然引起物质状态的变化
D.有能量变化的过程不一定是化学反应
【解析】选C。化学反应的本质是旧化学键的断裂和新化学键
的形成,化学反应中会产生新的物质并伴随能量变化,但物质状
态不一定发生变化,如N2(g)+3H2(g) 2NH3(g);物质
的状态发生变化也会伴有能量的变化,但不属于化学反应。3.(2013·临沂高一检测)下列说法正确的是( )
A.对于吸热反应,反应物所具有的总能量总是低于生成物所具有的总能量
B.任何放热反应在常温条件下一定能发生反应
C.形成生成物化学键释放的能量大于破坏反应物化学键所吸收的能量时,反应为吸热反应
D.等量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多【解析】选A。放热反应在常温下不一定能发生,如煤的燃烧,B错误。形成生成物化学键释放的能量大于破坏反应物化学键所吸收的能量时,反应为放热反应,C错误;等量的硫蒸气和硫固体分别完全燃烧,后者放出的热量少,D错误。4.下列反应符合图示的是( )
A.铝片与盐酸的反应
B.消石灰与NH4Cl晶体的反应
C.酸碱中和反应
D.甲烷在氧气中的燃烧反应【解析】选B。由于反应物的总能量比生成物的总能量低,所以该反应是吸热反应。而上述反应中只有消石灰和NH4Cl晶体的反应是吸热的,所以答案选B。5.某同学做如下实验,以检验反应中的能量变化。(1)在实验中发现反应后(a)中温度升高,由此可以判断(a)中反应是 热反应;(b)中温度降低,由此可以判断(b)中反应是 热反应。
(2)写出铝与盐酸反应的离子方程式 。
(3)根据能量守恒定律,(b)中反应物的总能量应该 其生成物的总能量。【解析】(1)反应后(a)中温度升高,(b)中温度降低,说明
(a)中反应为放热反应,(b)中反应为吸热反应。
(2)铝与盐酸反应的离子方程式为2Al+6H+====2Al3++3H2↑。
(3)(b)中反应为吸热反应,根据能量守恒定律,(b)中反应物的总能量应该低于其生成物的总能量。
答案:(1)放 吸 (2)2Al+6H+====2Al3++3H2↑
(3)低于探究盐酸与氢氧化钠溶液反应的中和热
如图所示:在大烧杯中放入碎纸屑,把盛有50 mL 0.50 mol·L-1
盐酸的小烧杯放到大烧杯中,两只烧杯间填满碎纸屑。用泡沫
塑料板做成大烧杯盖,通过盖子插入一根玻璃搅拌器(末端呈半
圆环的玻璃棒)和一只温度计,测定溶液的温度。迅速往盐酸溶
液中加入50 mL 0.55 mol·L-1烧碱溶液,盖好,搅拌溶液,观察
温度的变化。当温度保持稳定时,记录读数,取出装反应液的烧
杯,倒出溶液,清洗干净,保持内外杯壁干燥。重复进行三次实
验。用这一实验可以粗略测定中和热。(1)烧杯间为什么要填满碎纸屑?如果烧杯不盖硬纸板,反应放出的热量如何变化?
提示:烧杯间填满碎纸屑的目的是保温、隔热、减少实验过程中放出的热量的损失;烧杯如果不盖硬纸板,实验中就会有热量损失,则放出的热量减少。
(2)实验为什么要重复进行三次?
提示:重复进行三次实验是为了减少实验过程中的误差。(3)实验中若改用60 mL 0.50 mol·L-1盐酸和50 mL
0.55 mol·L-1烧碱溶液进行上述反应,与上述实验相比,所放出的热量如何变化?
提示:因为此时反应生成的水多了,所以放出的热量增多。
(4)酸与碱发生中和反应生成1 mol水时放出的热量叫中和热。若该实验中放出的热量是1.43 kJ,则该反应的中和热是多少?
提示:因为反应生成0.05 L×0.50 mol·L-1=0.025 mol水时放出1.43 kJ热量,故中和热是1.43 kJ÷0.025 mol=
57.2 kJ·mol-1。(5)浓硫酸与等体积的氢氧化钠溶液反应,生成1 mol H2O时放出的热量为Q,能否说中和热为QkJ·mol-1?
提示:浓硫酸与其他溶液混合时要放出大量的热,热量Q包括中和反应的热量和溶解热,故中和热小于QkJ·mol-1。
