【金榜教师用书课件 人教参考】2014年春高中化学必修二:第一章 物质结构 元素周期律 阶段复习课(28ppt,含2013试题)
文档属性
| 名称 | 【金榜教师用书课件 人教参考】2014年春高中化学必修二:第一章 物质结构 元素周期律 阶段复习课(28ppt,含2013试题) |  | |
| 格式 | zip | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-02-27 20:43:31 | ||
图片预览






文档简介
课件28张PPT。阶段复习课
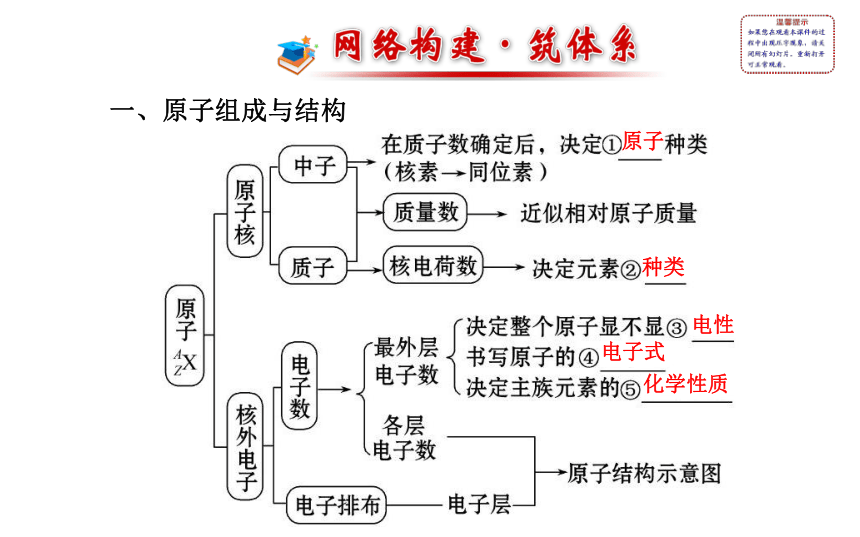
第一章一、原子组成与结构原子种类电性化学性质电子式二、化学键三、元素周期律和元素周期表考点 一 原子结构
【例题】 可以作为核聚变材料。下列关于 的叙述正确的
是( )
A. 和 互为同位素
B. 原子核内中子数为2
C. 代表原子核内有2个质子和3个中子的氦原子
D. 原子核外电子数为2【解析】选D。A中 和 质子数不同,故不互为同位素;B
中 原子核内中子数为1;C中 代表原子核内有2个质子和1
个中子的氦原子;D正确。【知识扫描】
1.原子核外电子排布:
(1)核外电子排布规律:
①核外电子总是尽可能先排布在能量最低的电子层里。
②各电子层最多容纳的电子数目是2n2。
③最外层电子数不超过8个(K层为最外层时不超过2个)。
④次外层电子数不超过18个,倒数第三层电子数不超过32个。(2)部分短周期元素核外电子排布的特殊性:
短周期元素核外电子排布的特殊性是解答元素推断题的突破口。
如:原子核中无中子的原子是H;最外层电子数是次外层电子数2倍的元素是C;最外层电子数是次外层电子数3倍的元素是O;最外层电子数是次外层电子数4倍的元素是Ne等。2.元素、核素、同位素的关系:(1)核素的“两同两不同”:同元素、同质子数;不同中子数、不同原子。
(2)同种元素可以有若干种不同的核素。
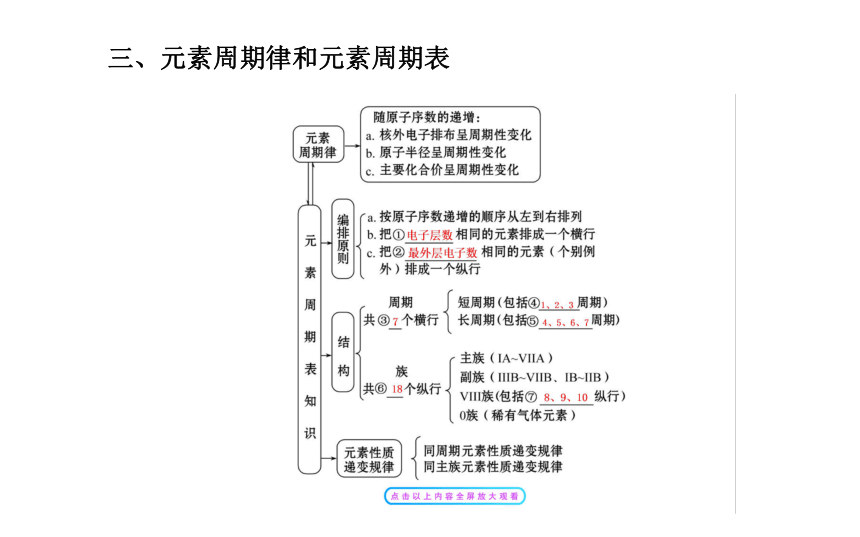
(3)同位素是同一元素的不同核素之间的互相称谓,不指具体的原子。考点 二 素周期律和元素周期表?
【例题】短周期元素A、B、C的原子序数依次增大,其原子的最外层电子数之和为10,则A与C在周期表中位置上下相邻,B原子最外层电子数等于A原子次外层电子数,下列有关叙述不正确的是( )
A.A与C可形成共价化合物
B.A的氢化物的稳定性大于C的氢化物的稳定性
C.原子半径AD.B的氧化物的熔点比A的氧化物熔点高【解析】选C。A与C在周期表中位置上下相邻,A、C同主族,由A、B、C三原子最外层电子数之和为10,可知A不可能为氢元素也不可能为氦元素,则A在第2周期,且次外层电子数为2,B原子最外层电子数等于A原子次外层电子数,B为镁元素,据A、B、C三原子的最外层电子数之和为10,则A为碳元素,C为硅元素,A与C可形成共价化合物SiC,A正确;CH4稳定性大于SiH4稳定性,B正确;原子半径B>C>A,C错误;常温下MgO为固态,常温下A的氧化物CO、CO2为气态,D正确。【知识扫描】
判断元素金属性和非金属性强弱的“五注意”
(1)注意不能用最外层电子数的多少判断,而应根据得失电子的难易程度;
(2)注意短周期中最高价氧化物的水化物呈强碱性的只有氢氧化钠,表现两性的是氢氧化铝;
(3)注意短周期中最高价氧化物的水化物呈强酸性的是硝酸、硫酸和高氯酸,氟元素无正价,无含氧酸;(4)注意不能根据氢化物的酸性判断元素的非金属性强弱,可根据氢化物的稳定性或还原性判断;
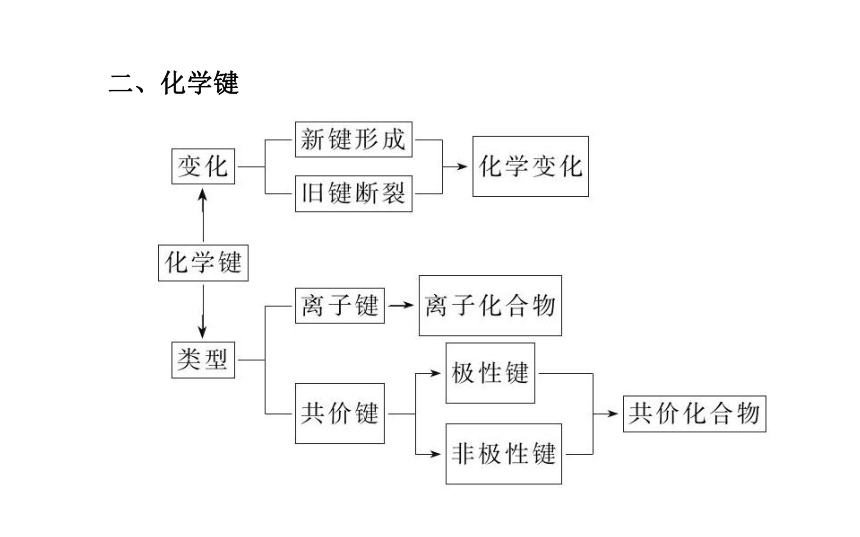
(5)注意不仅金属间可发生置换反应,非金属间也可以,前者体现的是还原性强弱,而后者体现的是氧化性强弱。考点 三 化学键?
【例题】以下各种说法不正确的是( )
①在水中氢、氧原子间均以化学键相结合
②金属和非金属化合时一定形成离子键
③离子键是阳离子、阴离子的相互吸引作用
④根据电离方程式:HCl====H++Cl-,可判断HCl分子里存在离子键
⑤H2分子和Cl2分子的反应过程是H2、Cl2分子里共价键发生断裂生成氢、氯原子,而后氢、氯原子形成离子键的过程
A.①②⑤ B.都不正确
C.④ D.②③④⑤【解析】选B。水中存在分子内氢、氧原子之间的相互作用,分子间的氢、氧原子也存在相互作用。而化学键只指分子内相邻原子间强烈的相互作用,故①叙述不正确。金属和非金属化合时不一定形成离子键,如AlCl3中的化学键为共价键,故②叙述不正确。在离子化合物中,阴、阳离子间存在相互作用,但不单指吸引力还有相互排斥力,故③叙述不正确;氯化氢分子中不存在离子,它属于共价化合物,分子中没有离子键,故④叙述不正确;化学反应的本质是旧键断裂、新键形成的过程,但HCl中存在共价键而非离子键,故⑤不正确。【知识扫描】
1.化学键分类及表示方法:2.化学键概念“五澄清”:
(1)离子化合物一定含离子键,可能含共价键。
(2)共价化合物只含共价键,一定无离子键,含共价键的也可能是非金属单质。
(3)含活泼金属元素的化合物不一定是离子化合物,如AlCl3。
(4)不含金属元素的化合物也可能是离子化合物,如铵盐。
(5)化学键被破坏不一定发生化学反应,但化学反应中一定有化学键的断裂和形成。考点 四 元素推断?
【例题】有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表所示:(1)写出化合物Y所含的化学键名称 。
(2)D、E、F的简单离子半径由大到小的顺序是(用化学式表示) 。
(3)写出两种均含A、B、C、F四种元素的化合物在溶液中相互反应的离子方程式: 。
(4)向Fe和D单质组成的混合物中加入足量F的最高价氧化物对应水化物的稀溶液,固体全部溶解。向所得的溶液中加入过量的氢氧化钠溶液,将产生的沉淀过滤出来,经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等,则原混合物中D单质的质量分数为 。【解析】题中要求推断出六种短周期元素,要抓住元素特征信息进行推断,题中所给的元素特征信息主要有元素与周期表的关系、元素的原子结构、元素组成物质的性质、元素的化合价情况、相关物质的用途等。推断时要抓住关键信息,大胆猜测、合理推理、逐一验证。密度最小的物质是氢气,即A为氢元素;B能与冷水反应,则B可能是Na、K等活泼金属,反应后生成的碱性溶液中含OH-,则B为钠元素;C元素原子的核外电子排布情况为第一层2个,第二层6个,C为氧元素;第3周期中简单离子半径最小的是Al3+,即D为铝元素;B、C、E组成的化合物NaClO可
作为家用消毒剂,所以E为氯元素;F元素的最高正价为+6,最低
负价为-2,代数和为4,则F为硫元素。经过以上推断,前三小题
很容易得出答案。第(4)小题中反应前为铁与铝的混合物,经过
题中一系列反应后得到Fe2O3固体,即原混合物中铝的质量分数
等于Fe2O3中氧的质量分数。
答案:(1)离子键、共价键 (2)S2->Cl->Al3+
(3)H++ ====SO2↑+H2O (4)30%【知识扫描】元素推断的一般思路【知识备选】周期表中的“序差”关系
元素周期表是元素周期律的具体表现形式,是学习和研究化学的一种重要的工具,其内容抽象,规律性强,同时也是历年高考的热点,以下是元素的原子序数之间的差值关系总结的一些规律。
1.不同周期同主族相邻元素的原子序数之差规律:“左上右下”规律。
“左上”,即过渡元素左侧(即ⅠA族、ⅡA族)上下相邻元素的原子序数之差等于上面元素所在周期内元素的种类数;“右下”,即过渡元素右侧(即ⅢA族~ⅦA族)上下相邻元素的原子序数之差等于下面元素所在周期内元素的种类数。2.同周期不同主族相邻元素的原子序数之差规律。同周期不同主族相邻元素的原子序数之差等于1,但如果是ⅡA族和ⅢA族的序数差就不一定是1。同周期第ⅡA族和第ⅢA族元素原子序数差:
第2、3周期元素,原子序数差为1;
第4、5周期元素,原子序数差为11(因为这两周期包括副族元素7种,第Ⅷ族元素3种);
第6周期元素,原子序数差为25(因为此周期包括镧系15种,副族元素6种,第Ⅷ族元素3种)。3.同周期不相邻主族元素的原子序数之差规律
同周期中不相邻的两种元素之间如果不存在过渡元素,则原子序数之差等于两种元素所在族的序数之差。如果存在过渡元素,则原子序数之差等于两种元素所在族的序数之差与10或24之和。
4.主族元素原子的序数与化合价之间的关系
“价奇序奇,价偶序偶”,即元素的化合价是奇数,那么其原子序数一般就是奇数;元素的化合价是偶数,那么其原子序数一般就是偶数。
第一章一、原子组成与结构原子种类电性化学性质电子式二、化学键三、元素周期律和元素周期表考点 一 原子结构
【例题】 可以作为核聚变材料。下列关于 的叙述正确的
是( )
A. 和 互为同位素
B. 原子核内中子数为2
C. 代表原子核内有2个质子和3个中子的氦原子
D. 原子核外电子数为2【解析】选D。A中 和 质子数不同,故不互为同位素;B
中 原子核内中子数为1;C中 代表原子核内有2个质子和1
个中子的氦原子;D正确。【知识扫描】
1.原子核外电子排布:
(1)核外电子排布规律:
①核外电子总是尽可能先排布在能量最低的电子层里。
②各电子层最多容纳的电子数目是2n2。
③最外层电子数不超过8个(K层为最外层时不超过2个)。
④次外层电子数不超过18个,倒数第三层电子数不超过32个。(2)部分短周期元素核外电子排布的特殊性:
短周期元素核外电子排布的特殊性是解答元素推断题的突破口。
如:原子核中无中子的原子是H;最外层电子数是次外层电子数2倍的元素是C;最外层电子数是次外层电子数3倍的元素是O;最外层电子数是次外层电子数4倍的元素是Ne等。2.元素、核素、同位素的关系:(1)核素的“两同两不同”:同元素、同质子数;不同中子数、不同原子。
(2)同种元素可以有若干种不同的核素。
(3)同位素是同一元素的不同核素之间的互相称谓,不指具体的原子。考点 二 素周期律和元素周期表?
【例题】短周期元素A、B、C的原子序数依次增大,其原子的最外层电子数之和为10,则A与C在周期表中位置上下相邻,B原子最外层电子数等于A原子次外层电子数,下列有关叙述不正确的是( )
A.A与C可形成共价化合物
B.A的氢化物的稳定性大于C的氢化物的稳定性
C.原子半径A
判断元素金属性和非金属性强弱的“五注意”
(1)注意不能用最外层电子数的多少判断,而应根据得失电子的难易程度;
(2)注意短周期中最高价氧化物的水化物呈强碱性的只有氢氧化钠,表现两性的是氢氧化铝;
(3)注意短周期中最高价氧化物的水化物呈强酸性的是硝酸、硫酸和高氯酸,氟元素无正价,无含氧酸;(4)注意不能根据氢化物的酸性判断元素的非金属性强弱,可根据氢化物的稳定性或还原性判断;
(5)注意不仅金属间可发生置换反应,非金属间也可以,前者体现的是还原性强弱,而后者体现的是氧化性强弱。考点 三 化学键?
【例题】以下各种说法不正确的是( )
①在水中氢、氧原子间均以化学键相结合
②金属和非金属化合时一定形成离子键
③离子键是阳离子、阴离子的相互吸引作用
④根据电离方程式:HCl====H++Cl-,可判断HCl分子里存在离子键
⑤H2分子和Cl2分子的反应过程是H2、Cl2分子里共价键发生断裂生成氢、氯原子,而后氢、氯原子形成离子键的过程
A.①②⑤ B.都不正确
C.④ D.②③④⑤【解析】选B。水中存在分子内氢、氧原子之间的相互作用,分子间的氢、氧原子也存在相互作用。而化学键只指分子内相邻原子间强烈的相互作用,故①叙述不正确。金属和非金属化合时不一定形成离子键,如AlCl3中的化学键为共价键,故②叙述不正确。在离子化合物中,阴、阳离子间存在相互作用,但不单指吸引力还有相互排斥力,故③叙述不正确;氯化氢分子中不存在离子,它属于共价化合物,分子中没有离子键,故④叙述不正确;化学反应的本质是旧键断裂、新键形成的过程,但HCl中存在共价键而非离子键,故⑤不正确。【知识扫描】
1.化学键分类及表示方法:2.化学键概念“五澄清”:
(1)离子化合物一定含离子键,可能含共价键。
(2)共价化合物只含共价键,一定无离子键,含共价键的也可能是非金属单质。
(3)含活泼金属元素的化合物不一定是离子化合物,如AlCl3。
(4)不含金属元素的化合物也可能是离子化合物,如铵盐。
(5)化学键被破坏不一定发生化学反应,但化学反应中一定有化学键的断裂和形成。考点 四 元素推断?
【例题】有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表所示:(1)写出化合物Y所含的化学键名称 。
(2)D、E、F的简单离子半径由大到小的顺序是(用化学式表示) 。
(3)写出两种均含A、B、C、F四种元素的化合物在溶液中相互反应的离子方程式: 。
(4)向Fe和D单质组成的混合物中加入足量F的最高价氧化物对应水化物的稀溶液,固体全部溶解。向所得的溶液中加入过量的氢氧化钠溶液,将产生的沉淀过滤出来,经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等,则原混合物中D单质的质量分数为 。【解析】题中要求推断出六种短周期元素,要抓住元素特征信息进行推断,题中所给的元素特征信息主要有元素与周期表的关系、元素的原子结构、元素组成物质的性质、元素的化合价情况、相关物质的用途等。推断时要抓住关键信息,大胆猜测、合理推理、逐一验证。密度最小的物质是氢气,即A为氢元素;B能与冷水反应,则B可能是Na、K等活泼金属,反应后生成的碱性溶液中含OH-,则B为钠元素;C元素原子的核外电子排布情况为第一层2个,第二层6个,C为氧元素;第3周期中简单离子半径最小的是Al3+,即D为铝元素;B、C、E组成的化合物NaClO可
作为家用消毒剂,所以E为氯元素;F元素的最高正价为+6,最低
负价为-2,代数和为4,则F为硫元素。经过以上推断,前三小题
很容易得出答案。第(4)小题中反应前为铁与铝的混合物,经过
题中一系列反应后得到Fe2O3固体,即原混合物中铝的质量分数
等于Fe2O3中氧的质量分数。
答案:(1)离子键、共价键 (2)S2->Cl->Al3+
(3)H++ ====SO2↑+H2O (4)30%【知识扫描】元素推断的一般思路【知识备选】周期表中的“序差”关系
元素周期表是元素周期律的具体表现形式,是学习和研究化学的一种重要的工具,其内容抽象,规律性强,同时也是历年高考的热点,以下是元素的原子序数之间的差值关系总结的一些规律。
1.不同周期同主族相邻元素的原子序数之差规律:“左上右下”规律。
“左上”,即过渡元素左侧(即ⅠA族、ⅡA族)上下相邻元素的原子序数之差等于上面元素所在周期内元素的种类数;“右下”,即过渡元素右侧(即ⅢA族~ⅦA族)上下相邻元素的原子序数之差等于下面元素所在周期内元素的种类数。2.同周期不同主族相邻元素的原子序数之差规律。同周期不同主族相邻元素的原子序数之差等于1,但如果是ⅡA族和ⅢA族的序数差就不一定是1。同周期第ⅡA族和第ⅢA族元素原子序数差:
第2、3周期元素,原子序数差为1;
第4、5周期元素,原子序数差为11(因为这两周期包括副族元素7种,第Ⅷ族元素3种);
第6周期元素,原子序数差为25(因为此周期包括镧系15种,副族元素6种,第Ⅷ族元素3种)。3.同周期不相邻主族元素的原子序数之差规律
同周期中不相邻的两种元素之间如果不存在过渡元素,则原子序数之差等于两种元素所在族的序数之差。如果存在过渡元素,则原子序数之差等于两种元素所在族的序数之差与10或24之和。
4.主族元素原子的序数与化合价之间的关系
“价奇序奇,价偶序偶”,即元素的化合价是奇数,那么其原子序数一般就是奇数;元素的化合价是偶数,那么其原子序数一般就是偶数。
