【金榜教师用书课件 人教参考】2014年春高中化学必修二:第二章 化学反应与能量 阶段复习课(29ppt,含2013试题)
文档属性
| 名称 | 【金榜教师用书课件 人教参考】2014年春高中化学必修二:第二章 化学反应与能量 阶段复习课(29ppt,含2013试题) |  | |
| 格式 | zip | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-02-27 20:40:26 | ||
图片预览





文档简介
课件29张PPT。阶段复习课
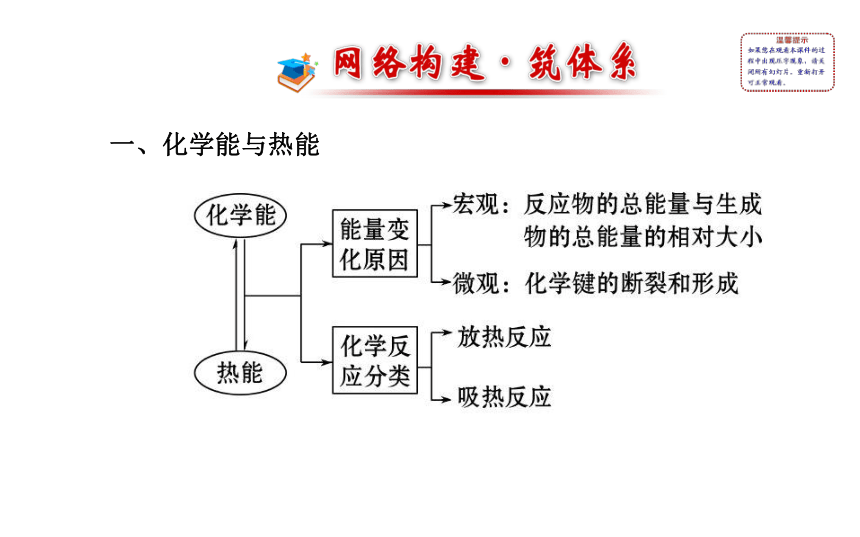
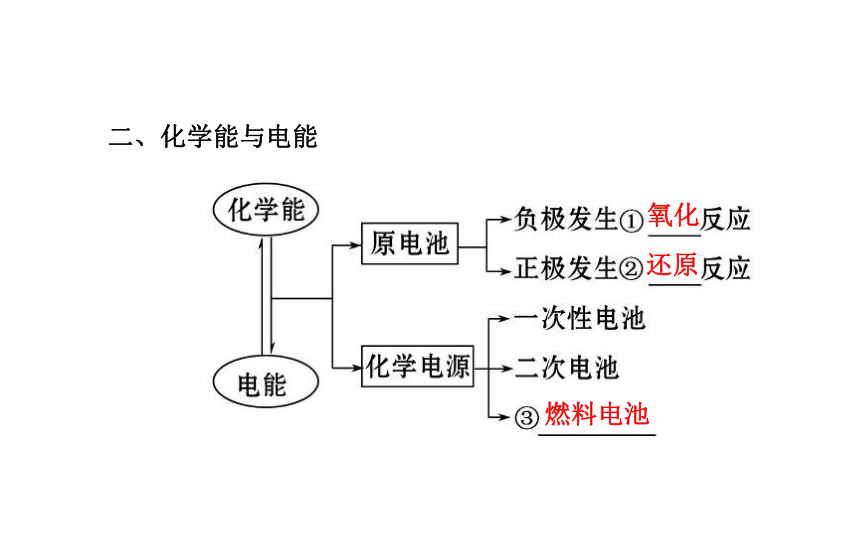
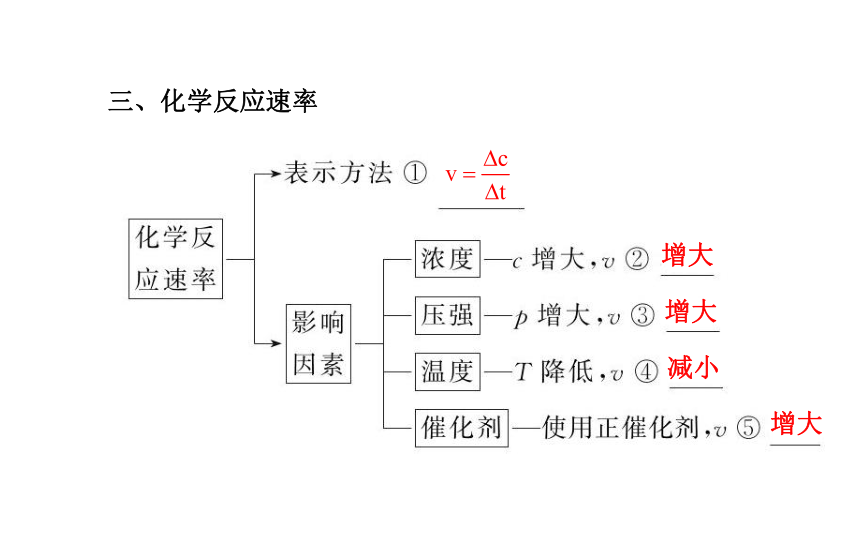
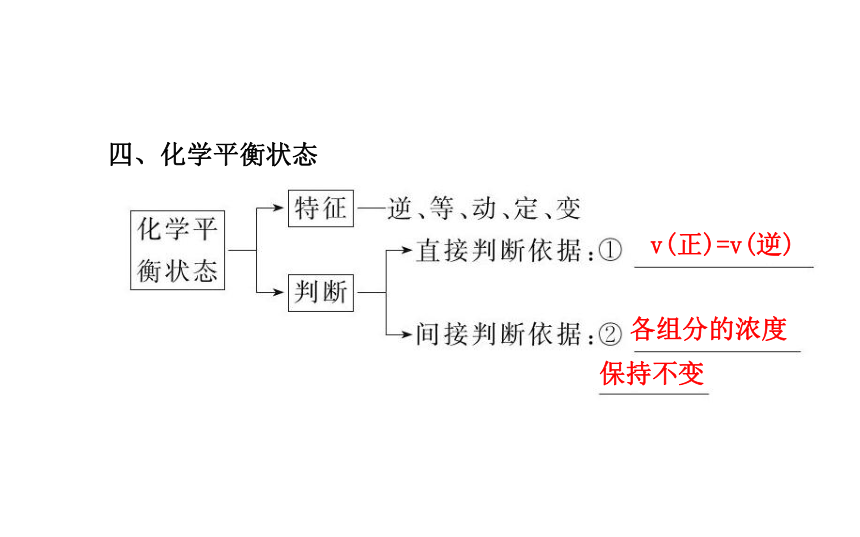
第二章一、化学能与热能二、化学能与电能氧化还原燃料电池三、化学反应速率增大增大减小增大四、化学平衡状态v(正)=v(逆) 各组分的浓度保持不变考点 一 化学反应中的能量变化?
【例1】下列说法不正确的是( )
A.在化学反应中,随着物质的变化,既有化学键的断裂,又有化学键的形成,还有化学能的改变
B.化学反应过程中是放出热量还是吸收热量,取决于反应物的总能量与生成物的总能量的相对大小
C.需要加热才能发生的化学反应,一定是吸热反应
D.物质具有的能量越低,其稳定性越大,反应越难以发生;物质具有的能量越高,其稳定性越小,反应越容易发生【解析】选C。需要加热才能发生的反应,不一定是吸热反应,如碳在空气中燃烧时需要加热才能进行,但反应后放出大量的热量,C项错误;A、B、D都是正确的。【例2】下列反应中生成物的总能量高于反应物的总能量的是
( )
A.碳酸钙受热分解 B.乙醇燃烧
C.钠与水反应 D.氧化钙溶于水
【解析】选A。生成物总能量高于反应物总能量,说明该反应是
吸热反应,A是吸热反应;乙醇燃烧、钠与水反应、氧化钙溶于
水均是放热反应,B、C、D错误。【知识扫描】
1.对吸热反应和放热反应理解的两个误区:
(1)误认为吸热反应很难进行,放热反应较易进行。
吸热反应、放热反应只是从能量的变化角度分析的,吸收热量的化学反应是吸热反应,放出热量的化学反应是放热反应,与反应的难易无关。
(2)误认为吸热反应一定需要加热或点燃,放热反应一定不用加热或点燃。
吸热反应、放热反应与反应条件无必然的关系。有些吸热反应常温下就能进行,如NH4Cl(s)与Ba(OH)2·8H2O(s)的反应,有些放热反应需要加热或点燃才能发生,如木炭的燃烧。2.化学反应中能量变化的计算:
(1)用E(反应物)表示反应物的总能量,E(生成物)表示生成物的总能量,ΔQ表示能量变化,则:
ΔQ=E(生成物)-E(反应物)。
(2)用Q(吸)表示反应物分子断裂时吸收的总能量,Q(放)表示生成物分子成键时放出的总能量,ΔQ表示能量变化,则:ΔQ=Q(吸)-Q(放)。考点 二 原电池?
【例1】(2013·荆州高一检测)如图所示,电流
表A发生偏转,同时A极逐渐变粗,B极逐渐变细,
C为电解质溶液。则A、B、C为( )
A.A是Zn,B是Cu,C是稀硫酸
B.A是Cu,B是Zn,C是稀硫酸
C.A是Fe,B是Ag,C是稀AgNO3溶液
D.A是Ag,B是Fe,C是稀AgNO3溶液【解析】选D。由于A极变粗,所以A是正极且电解质溶液中应该含有金属阳离子,B极变细,说明B是负极,且应该是活泼的金属能够被溶解,该电极的材料应该比A极活泼,所以根据以上分析,D正确。【例2】高铁电池是一种新型可充电电池,与普通高能电池相比,
该电池能长时间保持稳定的放电电压。高铁电池的总反应为
3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述
不正确的是( )
A.放电时负极反应为Zn-2e-+2OH-====Zn(OH)2
B.放电时正极发生氧化反应
C.放电时每转移2 mol电子,反应的锌是65 g
D.放电时化学能转化为电能放电
充电【解析】选B。该电池放电时负极发生氧化反应:
Zn-2e-+2OH-====Zn(OH)2,正极发生还原反应,电路中每1 mol锌(65 g)反应,转移2 mol电子,A、C正确,B错误;放电时,作原电池,化学能转化为电能,D正确。【知识扫描】
1.原电池工作原理:2.原电池原理的应用:
(1)加快化学反应速率。
(2)比较金属活动性强弱。
(3)防止金属的腐蚀(设计成原电池的正极)。
(4)设计化学电源。考点 三 化学反应速率和限度?
【例1】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的
物质的量随时间变化的曲线如图所示,下列描述正确的是( )A.反应开始到10 s,用Z表示的反应速率为0.158 mol·L-1·s-1
B.10 s后,该反应停止进行
C.反应的化学方程式为2X(g)+Y(g) 2Z(g)
D.反应开始到10 s时,平均反应速率:
v(X)=v(Y)=0.039 5 mol·L-1·s-1【解析】选D。反应开始到10 s,用Z表示的反应速率为
1.58 mol÷2 L÷10 s=0.079 mol·L-1·s-1,A错误;10 s后,反
应达到平衡状态,但没有停止进行,B错误;据题图可知,10 s时
X、Y、Z三种物质的物质的量变化量分别是0.79 mol、
0.79 mol、1.58 mol,故反应为X(g)+Y(g) 2Z(g),C错误;
反应开始到10 s时,v(X)=v(Y)=0.79 mol÷2 L÷10 s=
0.039 5 mol·L-1·s-1,D正确。【例2】一定温度下,可逆反应3X(g)+Y(g) 2Z(g)达到限度
的标志是( )
A.单位时间内生成3nmol X,同时消耗nmol Y
B.X的生成速率与Z的生成速率相等
C.X、Y、Z的浓度相等
D.X、Y、Z的分子个数比为3∶1∶2【解析】选A。单位时间内生成3n mol X即生成n mol Y,同时消耗nmol Y,即Y的生成速率和消耗速率相等,A正确;X、Z的化学计量数不相等,达到平衡时,X的生成速率与Z的生成速率不相等,B错误;化学反应达到平衡时,各成分的浓度保持不变,并非浓度相等或等于化学计量数之比,C、D错误。【知识扫描】
1.有关化学平衡状态的理解和判断的误区:
(1)对化学平衡状态理解的“三种误区”:
①误认为反应物能够完全转化成生成物。
可逆反应中反应物不能100%转化,反应物和生成物共存。
②误认为达到平衡时化学反应停止了。
反应达到化学平衡状态时,反应并没有停止,实际上正反应与逆反应始终在进行,只是正反应速率等于逆反应速率。
③误认为外界条件改变对平衡状态无影响。
任何化学平衡状态均是相对的、有条件的,当外界条件变化时,化学平衡状态也会发生相应的变化。(2)化学平衡状态判断的“两种误区”:
①误认为各组分的浓度相等证明反应达到平衡状态。
②误认为各组分的分子数之比等于化学计量数之比证明反应达到平衡状态。
反应达到化学平衡状态时各组分的浓度保持不变,但不一定相等,也不一定等于化学计量数之比。2.化学反应速率和化学平衡的图像分析:另外,对于多元曲线,一般应先分析一条,再对比分析多条,分析多条曲线时还可作辅助线;对于横坐标为时间的多元曲线,要充分利用“先拐先平衡的即为高温线或高压线”的规律。【知识备选】压强对反应速率影响的注意事项
对于有气体参加的反应而言,改变压强,对化学反应速率产生影响的根本原因是引起浓度改变所致。所以,在讨论压强对反应速率的影响时,应区分引起压强改变的原因。
对于气体反应体系,有以下几种情况:
(1)恒温时:(2)恒容时:
①
②
(3)恒压时:
第二章一、化学能与热能二、化学能与电能氧化还原燃料电池三、化学反应速率增大增大减小增大四、化学平衡状态v(正)=v(逆) 各组分的浓度保持不变考点 一 化学反应中的能量变化?
【例1】下列说法不正确的是( )
A.在化学反应中,随着物质的变化,既有化学键的断裂,又有化学键的形成,还有化学能的改变
B.化学反应过程中是放出热量还是吸收热量,取决于反应物的总能量与生成物的总能量的相对大小
C.需要加热才能发生的化学反应,一定是吸热反应
D.物质具有的能量越低,其稳定性越大,反应越难以发生;物质具有的能量越高,其稳定性越小,反应越容易发生【解析】选C。需要加热才能发生的反应,不一定是吸热反应,如碳在空气中燃烧时需要加热才能进行,但反应后放出大量的热量,C项错误;A、B、D都是正确的。【例2】下列反应中生成物的总能量高于反应物的总能量的是
( )
A.碳酸钙受热分解 B.乙醇燃烧
C.钠与水反应 D.氧化钙溶于水
【解析】选A。生成物总能量高于反应物总能量,说明该反应是
吸热反应,A是吸热反应;乙醇燃烧、钠与水反应、氧化钙溶于
水均是放热反应,B、C、D错误。【知识扫描】
1.对吸热反应和放热反应理解的两个误区:
(1)误认为吸热反应很难进行,放热反应较易进行。
吸热反应、放热反应只是从能量的变化角度分析的,吸收热量的化学反应是吸热反应,放出热量的化学反应是放热反应,与反应的难易无关。
(2)误认为吸热反应一定需要加热或点燃,放热反应一定不用加热或点燃。
吸热反应、放热反应与反应条件无必然的关系。有些吸热反应常温下就能进行,如NH4Cl(s)与Ba(OH)2·8H2O(s)的反应,有些放热反应需要加热或点燃才能发生,如木炭的燃烧。2.化学反应中能量变化的计算:
(1)用E(反应物)表示反应物的总能量,E(生成物)表示生成物的总能量,ΔQ表示能量变化,则:
ΔQ=E(生成物)-E(反应物)。
(2)用Q(吸)表示反应物分子断裂时吸收的总能量,Q(放)表示生成物分子成键时放出的总能量,ΔQ表示能量变化,则:ΔQ=Q(吸)-Q(放)。考点 二 原电池?
【例1】(2013·荆州高一检测)如图所示,电流
表A发生偏转,同时A极逐渐变粗,B极逐渐变细,
C为电解质溶液。则A、B、C为( )
A.A是Zn,B是Cu,C是稀硫酸
B.A是Cu,B是Zn,C是稀硫酸
C.A是Fe,B是Ag,C是稀AgNO3溶液
D.A是Ag,B是Fe,C是稀AgNO3溶液【解析】选D。由于A极变粗,所以A是正极且电解质溶液中应该含有金属阳离子,B极变细,说明B是负极,且应该是活泼的金属能够被溶解,该电极的材料应该比A极活泼,所以根据以上分析,D正确。【例2】高铁电池是一种新型可充电电池,与普通高能电池相比,
该电池能长时间保持稳定的放电电压。高铁电池的总反应为
3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述
不正确的是( )
A.放电时负极反应为Zn-2e-+2OH-====Zn(OH)2
B.放电时正极发生氧化反应
C.放电时每转移2 mol电子,反应的锌是65 g
D.放电时化学能转化为电能放电
充电【解析】选B。该电池放电时负极发生氧化反应:
Zn-2e-+2OH-====Zn(OH)2,正极发生还原反应,电路中每1 mol锌(65 g)反应,转移2 mol电子,A、C正确,B错误;放电时,作原电池,化学能转化为电能,D正确。【知识扫描】
1.原电池工作原理:2.原电池原理的应用:
(1)加快化学反应速率。
(2)比较金属活动性强弱。
(3)防止金属的腐蚀(设计成原电池的正极)。
(4)设计化学电源。考点 三 化学反应速率和限度?
【例1】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的
物质的量随时间变化的曲线如图所示,下列描述正确的是( )A.反应开始到10 s,用Z表示的反应速率为0.158 mol·L-1·s-1
B.10 s后,该反应停止进行
C.反应的化学方程式为2X(g)+Y(g) 2Z(g)
D.反应开始到10 s时,平均反应速率:
v(X)=v(Y)=0.039 5 mol·L-1·s-1【解析】选D。反应开始到10 s,用Z表示的反应速率为
1.58 mol÷2 L÷10 s=0.079 mol·L-1·s-1,A错误;10 s后,反
应达到平衡状态,但没有停止进行,B错误;据题图可知,10 s时
X、Y、Z三种物质的物质的量变化量分别是0.79 mol、
0.79 mol、1.58 mol,故反应为X(g)+Y(g) 2Z(g),C错误;
反应开始到10 s时,v(X)=v(Y)=0.79 mol÷2 L÷10 s=
0.039 5 mol·L-1·s-1,D正确。【例2】一定温度下,可逆反应3X(g)+Y(g) 2Z(g)达到限度
的标志是( )
A.单位时间内生成3nmol X,同时消耗nmol Y
B.X的生成速率与Z的生成速率相等
C.X、Y、Z的浓度相等
D.X、Y、Z的分子个数比为3∶1∶2【解析】选A。单位时间内生成3n mol X即生成n mol Y,同时消耗nmol Y,即Y的生成速率和消耗速率相等,A正确;X、Z的化学计量数不相等,达到平衡时,X的生成速率与Z的生成速率不相等,B错误;化学反应达到平衡时,各成分的浓度保持不变,并非浓度相等或等于化学计量数之比,C、D错误。【知识扫描】
1.有关化学平衡状态的理解和判断的误区:
(1)对化学平衡状态理解的“三种误区”:
①误认为反应物能够完全转化成生成物。
可逆反应中反应物不能100%转化,反应物和生成物共存。
②误认为达到平衡时化学反应停止了。
反应达到化学平衡状态时,反应并没有停止,实际上正反应与逆反应始终在进行,只是正反应速率等于逆反应速率。
③误认为外界条件改变对平衡状态无影响。
任何化学平衡状态均是相对的、有条件的,当外界条件变化时,化学平衡状态也会发生相应的变化。(2)化学平衡状态判断的“两种误区”:
①误认为各组分的浓度相等证明反应达到平衡状态。
②误认为各组分的分子数之比等于化学计量数之比证明反应达到平衡状态。
反应达到化学平衡状态时各组分的浓度保持不变,但不一定相等,也不一定等于化学计量数之比。2.化学反应速率和化学平衡的图像分析:另外,对于多元曲线,一般应先分析一条,再对比分析多条,分析多条曲线时还可作辅助线;对于横坐标为时间的多元曲线,要充分利用“先拐先平衡的即为高温线或高压线”的规律。【知识备选】压强对反应速率影响的注意事项
对于有气体参加的反应而言,改变压强,对化学反应速率产生影响的根本原因是引起浓度改变所致。所以,在讨论压强对反应速率的影响时,应区分引起压强改变的原因。
对于气体反应体系,有以下几种情况:
(1)恒温时:(2)恒容时:
①
②
(3)恒压时:
