化学人教版(2019)选择性必修2 3.3.2离子晶体(共25张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 3.3.2离子晶体(共25张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 15.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-17 13:35:33 | ||
图片预览



文档简介
(共25张PPT)
第三章 晶体结构与性质
第三节 金属晶体与离子晶体
第2课时
导入新课
交流讨论
熔融的NaCl或者NaCl的水溶液能够导电,而NaCl晶体却不能导电,这是为什么呢?
没有自由移动的Na+和Cl
NaCl晶体中微粒是怎样分布的,NaCl晶体模型又是怎样的呢?
资料卡片
1913年布拉格用X射线衍射法测定出NaCl晶体的结构
氯化钠晶体的微观结构
X射线衍射仪
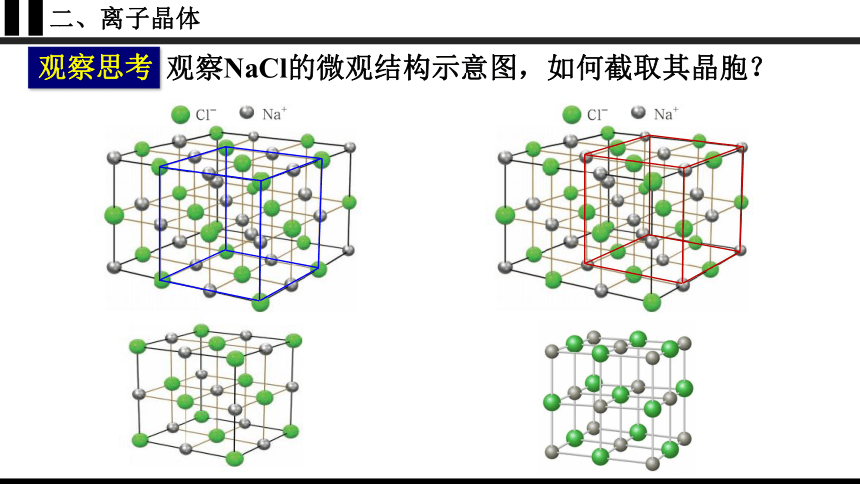
二、离子晶体
观察思考
观察NaCl的微观结构示意图,如何截取其晶胞?
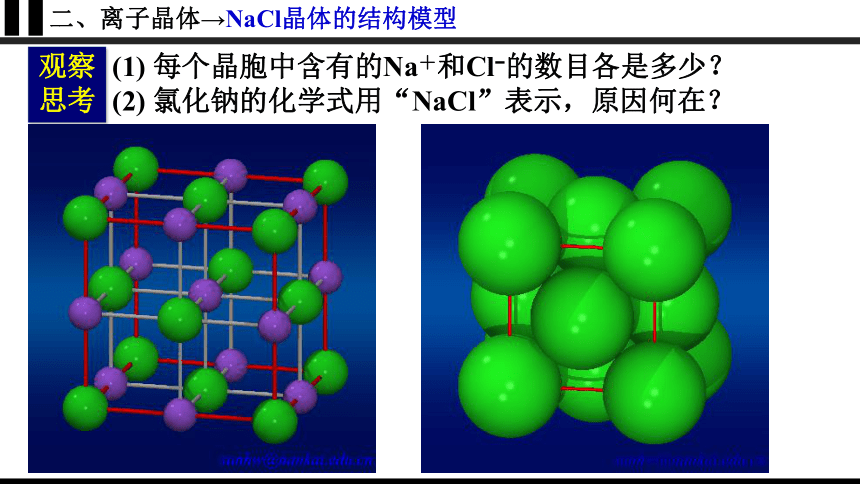
二、离子晶体→NaCl晶体的结构模型
(1) 每个晶胞中含有的Na+和Cl 的数目各是多少?
(2) 氯化钠的化学式用“NaCl”表示,原因何在?
观察
思考
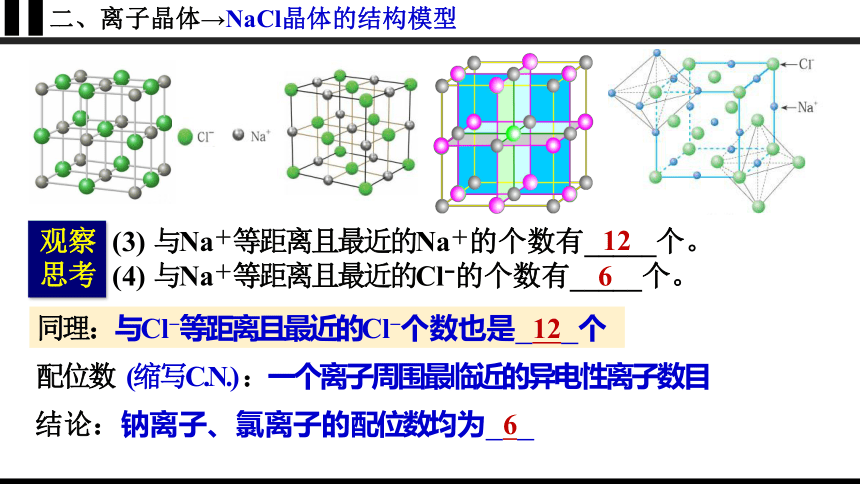
二、离子晶体→NaCl晶体的结构模型
(3) 与Na+等距离且最近的Na+的个数有_____个。
(4) 与Na+等距离且最近的Cl 的个数有_____个。
观察思考
12
同理:与Cl 等距离且最近的Cl 个数也是 12 个
配位数 (缩写C.N.) :一个离子周围最临近的异电性离子数目
6
结论:钠离子、氯离子的配位数均为 6
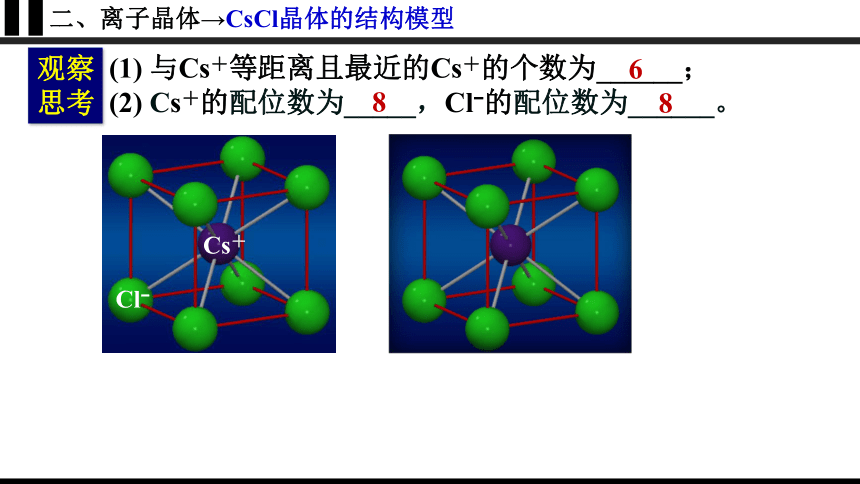
二、离子晶体→CsCl晶体的结构模型
(1) 与Cs+等距离且最近的Cs+的个数为______;
(2) Cs+的配位数为_____,Cl 的配位数为______。
观察
思考
Cl
Cs+
6
8
8
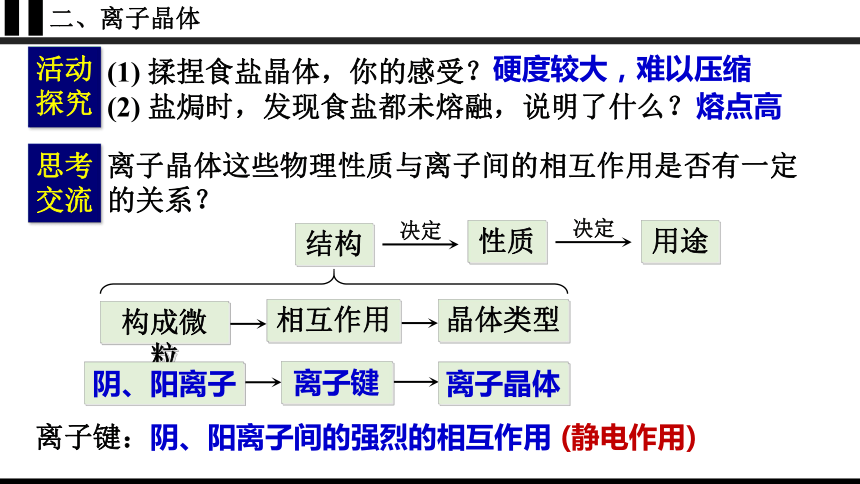
二、离子晶体
活动
探究
(1) 揉捏食盐晶体,你的感受?
(2) 盐焗时,发现食盐都未熔融,说明了什么?
硬度较大,难以压缩
熔点高
离子晶体
离子键
结构
决定
性质
决定
用途
构成微粒
相互作用
晶体类型
阴、阳离子
思考交流
离子晶体这些物理性质与离子间的相互作用是否有一定的关系?
离子键:阴、阳离子间的强烈的相互作用 (静电作用)
二、离子晶体
归纳总结
请根据离子晶体的微观结构描述离子键的特征?
离子键特征:无方向性和饱和性
离子晶体:是阴、阳离子在空间呈现周期性重复排列所形成的晶体
共价键特征:有方向性和饱和性
二、离子晶体
晶体 离子间距/pm 电荷数 熔点/℃
NaCl 276 1 801
NaBr 290 1 750
MgO 205 2 2800
CaO 239 2 2576
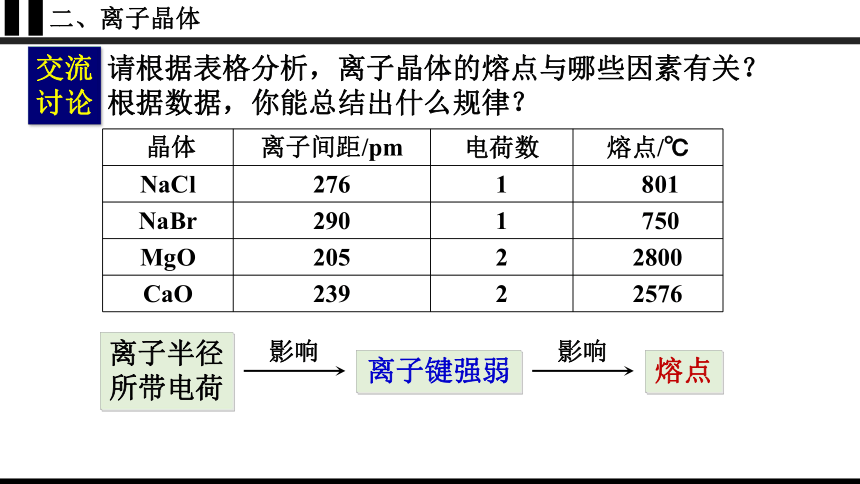
交流讨论
请根据表格分析,离子晶体的熔点与哪些因素有关?
根据数据,你能总结出什么规律?
离子半径
所带电荷
影响
离子键强弱
熔点
影响
二、离子晶体
晶体 离子间距/pm 电荷数 熔点/℃
NaCl 276 1 801
NaBr 290 1 750
MgO 205 2 2800
CaO 239 2 2576
规律:离子半径越小、所带电荷越多,离子键越强,熔点就越高,硬度也越大。
耐火材料
思考
离子晶体的熔点都很高吗?你的依据是什么吗?
交流讨论
请根据表格分析,离子晶体的熔点与哪些因素有关?
根据数据,你能总结出什么规律?
二、离子晶体
拓展视野
实际上,大量离子晶体中的阴离子或阳离子不是单原子离子
化合物 熔点/℃
NH4NO3 169.6
Ca(H2PO4)2 109
CH3COOCs 194
有的还存在电中性分子( H2O、NH3等)。
CuSO4·5H2O
KAl (SO4 )2·12H2O
有些离子组成的物质在常温下甚至以液态形式存在。
C2H5NH3NO3 12
离子液体:熔点低、稳定性强、是优良的绿色溶剂等优点。
1-乙基-3-甲基咪唑四氟硼酸盐
二、离子晶体
归纳整理
根据构成微粒和微粒间相互作用不同分为四种类型
晶体类型 分子晶体 共价晶体 金属晶体 离子晶体
微粒种类
微粒间 相互作用
典型晶体
金属阳离子和自由电子
金属键
原子
离子键
共价键
分子
分子间作用力
阴、阳离子
金属Cu
NaCl
CO2
课堂检测
练2、萤石( 氟化钙CaF2 )晶体属于立方晶系,在氟化钙的晶胞中每个Ca2+被8个F 所包围,则每个F-周围最近距离的Ca2+数目为( )
2 B. 4
C. 6 D. 8
练1、下列判断正确的是( )
A. 该晶体属于分子晶体
B. 该晶胞中Zn2+和S2 数目不相等
C. Zn2+周围等距离且最近的S2 为6
D. 氧化锌的熔点高于硫化锌
课堂检测
二、离子晶体→萤石(CaF2)型晶胞
Ca2+: 面心立方最密堆积
F : 填充在整个四面体空隙中
Ca2+
F
二、离子晶体→萤石(CaF2)型晶胞
(1) Ca2+配位数为____,F 配位数为_____;
(2) 每个F 周围最近且等距离的F 有____个;
每个Ca2+周围最近且等距离的Ca2+有_____个。
8
4
6
12
二、离子晶体→立方ZnS型晶胞
Zn2+
Zn2+:面心立方最密堆积
S2 :填充在部分四面体空隙中
二、离子晶体→立方ZnS型晶胞
(1) Zn2+配位数为____, S2 配位数为______;
(2) 每个Zn2+周围最近且等距离的Zn2+有____个;
每个S2 周围最近且等距离的S2 有_____个。
4
4
12
12
二、离子晶体
晶体 类型 晶胞 类型 晶胞结构示意图 每个晶胞含 有离子数 配位数 实例
AB NaCl型 Na+ Na+ KBr、AgCl、MgO、CaS、BaSe
Cl Cl
CsCl型 Cs+ Cs+ CsCl、CsBr、
CsI、TlCl
Cl Cl
ZnS型 Zn2+ Zn2+
ZnS、AgI、BeO
S2 S2
AB2 CaF2型 Ca2+ Ca2+ 碱土金属卤化物
碱金属氧化物
F F
4
4
6
6
1
1
8
8
4
4
4
4
4
8
4
8
导入新课
交流讨论
已知氯化亚铜(CuCl)的晶胞结构如图所示,试分析:
Cu
Cl
(1) Cu+周围等距离且最近的Cl 有____个;
Cl 周围等距离且最近的Cu+有____个。
4
4
(2) 试根据NaCl 和CuCl中Na+和Cu+半径推测两种晶体熔点高低?
离子 r/pm
Na+ 102
Cu+ 60
晶体 熔点/℃
NaCl 801
CuCl 426
事实上,纯粹的典型晶体是不多的,大多数晶体是它们之间的过渡晶体。
三、过渡晶体与混合型晶体→过渡晶体
思考交流
晶体类型之间存在绝对的界限吗?
表 3 4 几种氧化物的化学键中离子键成分的百分数
氧化物
离子键的
百分数/%
Na2O
62
MgO
50
Al2O3
41
SiO2
33
离子晶体 共价晶体
1、过渡晶体:介于某两种晶体类型之间的晶体
四种元素氧化物的化学键中离子键成分逐渐减少
结论:四种典型晶体类型都存在过渡晶体
结论:晶体性质偏向某一晶体类型的过渡晶体通常当作该晶体类型处理
三、过渡晶体与混合型晶体→过渡晶体
思考
Na2O、MgO、Al2O3、SiO2中离子键成分为何逐渐减少?
推测
请推测P2O5、SO3、Cl2O7的离子键成分变化趋势?
原因:与氧元素的电负性的差值逐渐减小
变化趋势:百分数小于33,且逐渐减少
元素性质
成因分析
电负性差值
化学键类型
成键微粒
Na2O MgO Al2O3 SiO2 P2O5 SO3 Cl2O7
离子晶体 共价晶体 分子晶体
三、过渡晶体与混合型晶体→ 混合型晶体
金刚石部分物理性质
熔点 莫氏硬度 电导率/(s·m 1)
3550℃ 10 2.11×10 13
石墨部分物理性质
熔点 莫氏硬度 电导率/(s·m 1)
3850℃ 1 2.5×103
同是碳单质的晶体,金刚石和石墨的性质存在哪
些异同?
你认为是什么造成了这种差异?
思考交流
同:熔点均较高
异:金刚石硬度很高、不导电,石墨质软、能导电
结构决定性质
三、过渡晶体与混合型晶体→ 混合型晶体 (石墨)
石墨性质特征
石墨结构特征
熔点高、 质软、 能导电
共价晶体特征
分子晶体特征
层状结构
层内碳原子之间形成共价键
未参与杂化电子可在层内运动
(层之间)范德华力维系
分子晶体特征
共价晶体特征
混合型晶体
金属晶体特征
金属晶体特征
课堂检测
练、石墨能与熔融金属钾作用,形成石墨间隙化合物,钾原子填充在石墨各层原子中。比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写为CxK,其平面图形如图所示。x的值为( )
A. 8 B. 12 C. 24 D. 60
第三章 晶体结构与性质
第三节 金属晶体与离子晶体
第2课时
导入新课
交流讨论
熔融的NaCl或者NaCl的水溶液能够导电,而NaCl晶体却不能导电,这是为什么呢?
没有自由移动的Na+和Cl
NaCl晶体中微粒是怎样分布的,NaCl晶体模型又是怎样的呢?
资料卡片
1913年布拉格用X射线衍射法测定出NaCl晶体的结构
氯化钠晶体的微观结构
X射线衍射仪
二、离子晶体
观察思考
观察NaCl的微观结构示意图,如何截取其晶胞?
二、离子晶体→NaCl晶体的结构模型
(1) 每个晶胞中含有的Na+和Cl 的数目各是多少?
(2) 氯化钠的化学式用“NaCl”表示,原因何在?
观察
思考
二、离子晶体→NaCl晶体的结构模型
(3) 与Na+等距离且最近的Na+的个数有_____个。
(4) 与Na+等距离且最近的Cl 的个数有_____个。
观察思考
12
同理:与Cl 等距离且最近的Cl 个数也是 12 个
配位数 (缩写C.N.) :一个离子周围最临近的异电性离子数目
6
结论:钠离子、氯离子的配位数均为 6
二、离子晶体→CsCl晶体的结构模型
(1) 与Cs+等距离且最近的Cs+的个数为______;
(2) Cs+的配位数为_____,Cl 的配位数为______。
观察
思考
Cl
Cs+
6
8
8
二、离子晶体
活动
探究
(1) 揉捏食盐晶体,你的感受?
(2) 盐焗时,发现食盐都未熔融,说明了什么?
硬度较大,难以压缩
熔点高
离子晶体
离子键
结构
决定
性质
决定
用途
构成微粒
相互作用
晶体类型
阴、阳离子
思考交流
离子晶体这些物理性质与离子间的相互作用是否有一定的关系?
离子键:阴、阳离子间的强烈的相互作用 (静电作用)
二、离子晶体
归纳总结
请根据离子晶体的微观结构描述离子键的特征?
离子键特征:无方向性和饱和性
离子晶体:是阴、阳离子在空间呈现周期性重复排列所形成的晶体
共价键特征:有方向性和饱和性
二、离子晶体
晶体 离子间距/pm 电荷数 熔点/℃
NaCl 276 1 801
NaBr 290 1 750
MgO 205 2 2800
CaO 239 2 2576
交流讨论
请根据表格分析,离子晶体的熔点与哪些因素有关?
根据数据,你能总结出什么规律?
离子半径
所带电荷
影响
离子键强弱
熔点
影响
二、离子晶体
晶体 离子间距/pm 电荷数 熔点/℃
NaCl 276 1 801
NaBr 290 1 750
MgO 205 2 2800
CaO 239 2 2576
规律:离子半径越小、所带电荷越多,离子键越强,熔点就越高,硬度也越大。
耐火材料
思考
离子晶体的熔点都很高吗?你的依据是什么吗?
交流讨论
请根据表格分析,离子晶体的熔点与哪些因素有关?
根据数据,你能总结出什么规律?
二、离子晶体
拓展视野
实际上,大量离子晶体中的阴离子或阳离子不是单原子离子
化合物 熔点/℃
NH4NO3 169.6
Ca(H2PO4)2 109
CH3COOCs 194
有的还存在电中性分子( H2O、NH3等)。
CuSO4·5H2O
KAl (SO4 )2·12H2O
有些离子组成的物质在常温下甚至以液态形式存在。
C2H5NH3NO3 12
离子液体:熔点低、稳定性强、是优良的绿色溶剂等优点。
1-乙基-3-甲基咪唑四氟硼酸盐
二、离子晶体
归纳整理
根据构成微粒和微粒间相互作用不同分为四种类型
晶体类型 分子晶体 共价晶体 金属晶体 离子晶体
微粒种类
微粒间 相互作用
典型晶体
金属阳离子和自由电子
金属键
原子
离子键
共价键
分子
分子间作用力
阴、阳离子
金属Cu
NaCl
CO2
课堂检测
练2、萤石( 氟化钙CaF2 )晶体属于立方晶系,在氟化钙的晶胞中每个Ca2+被8个F 所包围,则每个F-周围最近距离的Ca2+数目为( )
2 B. 4
C. 6 D. 8
练1、下列判断正确的是( )
A. 该晶体属于分子晶体
B. 该晶胞中Zn2+和S2 数目不相等
C. Zn2+周围等距离且最近的S2 为6
D. 氧化锌的熔点高于硫化锌
课堂检测
二、离子晶体→萤石(CaF2)型晶胞
Ca2+: 面心立方最密堆积
F : 填充在整个四面体空隙中
Ca2+
F
二、离子晶体→萤石(CaF2)型晶胞
(1) Ca2+配位数为____,F 配位数为_____;
(2) 每个F 周围最近且等距离的F 有____个;
每个Ca2+周围最近且等距离的Ca2+有_____个。
8
4
6
12
二、离子晶体→立方ZnS型晶胞
Zn2+
Zn2+:面心立方最密堆积
S2 :填充在部分四面体空隙中
二、离子晶体→立方ZnS型晶胞
(1) Zn2+配位数为____, S2 配位数为______;
(2) 每个Zn2+周围最近且等距离的Zn2+有____个;
每个S2 周围最近且等距离的S2 有_____个。
4
4
12
12
二、离子晶体
晶体 类型 晶胞 类型 晶胞结构示意图 每个晶胞含 有离子数 配位数 实例
AB NaCl型 Na+ Na+ KBr、AgCl、MgO、CaS、BaSe
Cl Cl
CsCl型 Cs+ Cs+ CsCl、CsBr、
CsI、TlCl
Cl Cl
ZnS型 Zn2+ Zn2+
ZnS、AgI、BeO
S2 S2
AB2 CaF2型 Ca2+ Ca2+ 碱土金属卤化物
碱金属氧化物
F F
4
4
6
6
1
1
8
8
4
4
4
4
4
8
4
8
导入新课
交流讨论
已知氯化亚铜(CuCl)的晶胞结构如图所示,试分析:
Cu
Cl
(1) Cu+周围等距离且最近的Cl 有____个;
Cl 周围等距离且最近的Cu+有____个。
4
4
(2) 试根据NaCl 和CuCl中Na+和Cu+半径推测两种晶体熔点高低?
离子 r/pm
Na+ 102
Cu+ 60
晶体 熔点/℃
NaCl 801
CuCl 426
事实上,纯粹的典型晶体是不多的,大多数晶体是它们之间的过渡晶体。
三、过渡晶体与混合型晶体→过渡晶体
思考交流
晶体类型之间存在绝对的界限吗?
表 3 4 几种氧化物的化学键中离子键成分的百分数
氧化物
离子键的
百分数/%
Na2O
62
MgO
50
Al2O3
41
SiO2
33
离子晶体 共价晶体
1、过渡晶体:介于某两种晶体类型之间的晶体
四种元素氧化物的化学键中离子键成分逐渐减少
结论:四种典型晶体类型都存在过渡晶体
结论:晶体性质偏向某一晶体类型的过渡晶体通常当作该晶体类型处理
三、过渡晶体与混合型晶体→过渡晶体
思考
Na2O、MgO、Al2O3、SiO2中离子键成分为何逐渐减少?
推测
请推测P2O5、SO3、Cl2O7的离子键成分变化趋势?
原因:与氧元素的电负性的差值逐渐减小
变化趋势:百分数小于33,且逐渐减少
元素性质
成因分析
电负性差值
化学键类型
成键微粒
Na2O MgO Al2O3 SiO2 P2O5 SO3 Cl2O7
离子晶体 共价晶体 分子晶体
三、过渡晶体与混合型晶体→ 混合型晶体
金刚石部分物理性质
熔点 莫氏硬度 电导率/(s·m 1)
3550℃ 10 2.11×10 13
石墨部分物理性质
熔点 莫氏硬度 电导率/(s·m 1)
3850℃ 1 2.5×103
同是碳单质的晶体,金刚石和石墨的性质存在哪
些异同?
你认为是什么造成了这种差异?
思考交流
同:熔点均较高
异:金刚石硬度很高、不导电,石墨质软、能导电
结构决定性质
三、过渡晶体与混合型晶体→ 混合型晶体 (石墨)
石墨性质特征
石墨结构特征
熔点高、 质软、 能导电
共价晶体特征
分子晶体特征
层状结构
层内碳原子之间形成共价键
未参与杂化电子可在层内运动
(层之间)范德华力维系
分子晶体特征
共价晶体特征
混合型晶体
金属晶体特征
金属晶体特征
课堂检测
练、石墨能与熔融金属钾作用,形成石墨间隙化合物,钾原子填充在石墨各层原子中。比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写为CxK,其平面图形如图所示。x的值为( )
A. 8 B. 12 C. 24 D. 60
