溶液配制课件
图片预览









文档简介
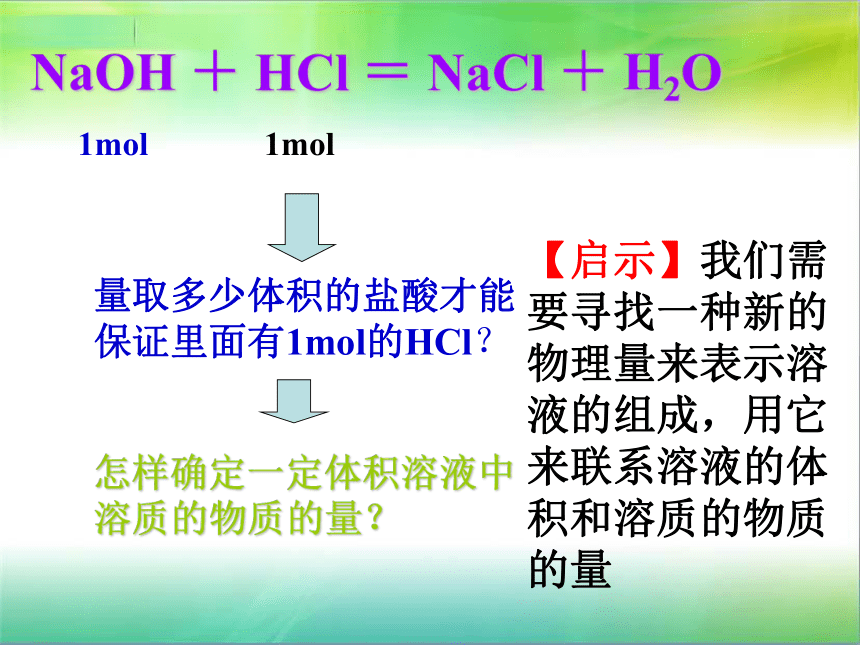
课件35张PPT。溶液的配制与分析优点:1.配制容易。2.知道溶液的质量就可以算出溶质的质量。缺点:1.称量液体的质量不如量体积方便。 2.发生反应的各物质间的质量关系要比它们的物质的量关系要复杂得多。NaOH + HCl = NaCl + H2O 1mol1mol量取多少体积的盐酸才能保证里面有1mol的HCl?怎样确定一定体积溶液中溶质的物质的量?【启示】我们需
要寻找一种新的物理量来表示溶液的组成,用它来联系溶液的体积和溶质的物质的量(一)物质的量浓度1、概念:以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的量浓度,用符号cB表示。2、表达式:cB = nBV(溶液) mol·L-13、单位:例题:将53.0gNa2CO3 溶解在水中,配成500mL溶液,求所得溶液中溶质的物质的量浓度。解:n(Na2CO3) = m(Na2CO3) /M(Na2CO3)
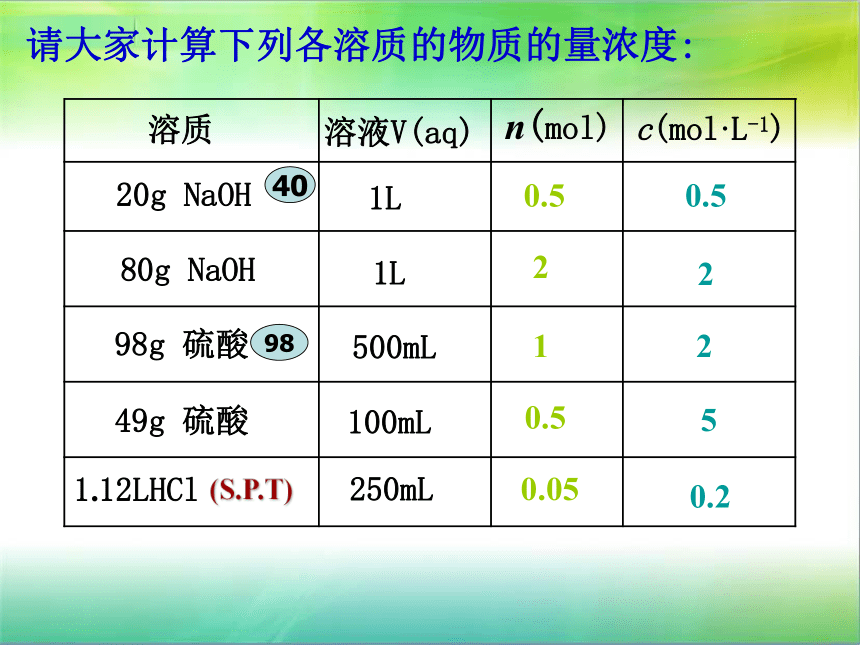
= 53.0g/106g?mol-1 = 0. 500molC(Na2CO3) = n(Na2CO3) /V = 0. 500mol/0.500L= 1.00mol/L答:溶液中Na2CO3的物质的量浓度为1.00mol/L。500mL请大家计算下列各溶质的物质的量浓度:溶质溶液V(aq)n(mol)c(mol·L-1)20g NaOH80g NaOH
98g 硫酸49g 硫酸1.12LHCl1L1L100mL250mL (S.P.T)0.52250.20.5210.50.054098【讨论】
1、将4gNaOH与水配成0.5L溶液,则所得
溶液的物质的量浓度为: 。 0.2mol·L-1 2、若将4gNaOH溶于0.5L水,则所得溶液物
质的量浓度与上是否相同? 不同注意:溶液体积不等于溶剂体积。溶质溶于溶剂后,体积会发生变化。3、从1L 1mol/L蔗糖溶液中分别取出100mL、10mL、1mL,取出的溶液中蔗糖的物质的量浓度及物质的量各是多少?从某溶液取出任意体积的溶液,其溶质的物质的量浓度相同,但所含溶质物质的量不同。(溶液是均一的、稳定的) c(mol·L-1)n(mol)100mL10mL1mL1110.10.010.001 练习
1.2molNaOH配成1000mL溶液,其物质的量浓度为____mol/L。
2.标准状况下,22.4LHCl溶于水配成0.5L盐酸,其物质的量浓度为__mol/L。
3.物质的量浓度为2mol/L的硫酸溶液500mL,含硫酸的物质的量为___mol。
4.10mol HCl能配成___L物质的量浓度为2mol/L的盐酸 ?
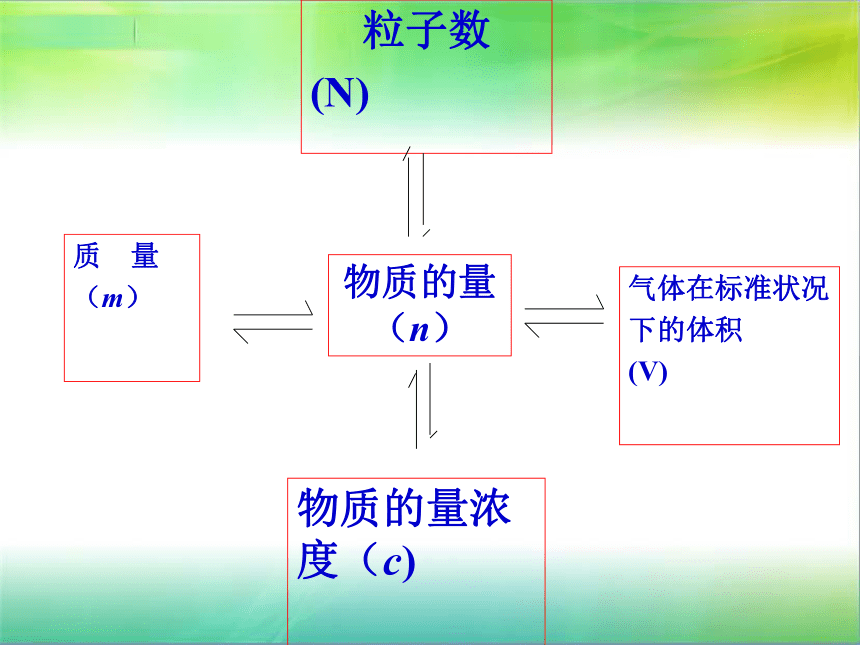
1.22粒子数
(N)
物质的量(n)物质的量浓度(c)
质 量
(m)
气体在标准状况
下的体积
(V)
1、容量瓶简介:(1)容量瓶(2)使用之前要检查是否漏水.如何检漏? 加水倒立观察瓶塞旋转180o倒立观察(3)只能用作配制的量具。不能在其中直接溶解或稀释固体或浓溶液,不能将热的溶液倒入,不能作为反应器,也不能不能长期存放溶液。移动容量瓶,应手握刻度线以上部分。形状:细颈,梨形,平底的玻璃瓶;构造:瓶上标有容积,温度,颈部标有刻度线;规格:25mL,100mL,250mL,500mL,1000mL;(二)一定物质的量浓度溶液的配制2、主要实验仪器:托盘天平(称量固体)或量筒(量取液体)、烧杯、玻璃棒、容量瓶、胶头滴管配制100mL 0.200mol/L NaCl溶液
思考:第一步应该做什么?
1、计算
溶质的质量为
m(NaCl)=0.200mol/L×0.10L×58.5g/mol = 1.17g
2 、称量
注意:要正确使用托盘天平
调零——两盘放等质量纸 ——放砝码——加药品 ——准确称量——放回砝码
用天平称取1.17g NaCl放入烧杯中3 、溶解
不能直接在容量瓶中溶解注意:在烧杯中加适量水溶解固体NaCl思考:若是浓H2SO4或NaOH溶于水,有什么现象?
溶解后能直接倒入吗?
4、冷却 冷却到室温后再倒入。
5、转移
思考:转移时直接用烧杯倒入吗?
要用玻璃棒引流。
玻璃棒下端应靠在容量瓶内壁。 请看 操作演示: 两靠一不靠将烧杯中的溶液转移至容量瓶中 6、洗涤。
用少量水洗涤烧杯和玻璃棒2-3次,洗涤液每次都要 转入容量瓶。
7 、振荡
轻轻振荡容量瓶,使溶液混合均匀8、定容
向容量瓶中加入蒸馏水,在距离刻度线1~2cm时,改用胶头滴管滴加蒸馏水至刻度线。
思考:若定容时不小心液面超过了刻度线,怎么办?能用胶头滴管把多余的液体取出吗?
必须重新配制
9、摇匀 将容量瓶盖好塞子,如图示,把容量瓶倒转和摇动多次,使得溶液混合均匀。 思考:摇匀后发现液面低于刻线,能否补充水?
不能。因为是部分溶液在润湿容量瓶瓶口磨砂处有所损失所致。
10、装瓶贴签
容量瓶中不能久放溶液,因此要把配制好的溶液转移到试剂瓶中,贴好标签,注明溶液的名称和浓度。
NaCL2、实验步骤:称量溶解转移洗涤并转移轻摇定容摇匀步骤:计算称量溶解转移洗涤定容摇匀仪器:托盘天平、药匙 、烧杯、玻璃棒、容量瓶、胶头滴管讨论:定容时俯视或仰视刻度线,对溶液的浓度有何影响? ?俯
视仰
视 俯视刻度线,实际加水量未到刻度线,使溶液的物质的量浓度增大; 仰视刻度线,实际加水量超过刻度线,使溶液的物质的量浓度减小。 记忆 “俯看偏高,仰看偏低。”3、误差判断???? 根据 c = n / V 或(n = m / MV)分析(以配制某浓度NaOH溶液为例,请同学们将c 的结果填入表中)减小 不变减小 减小 不变减小 减小 不变减小 不变减小 增大 减小 不变减小 不变增大减小不变减小 增大不变增大 减小 不变不变不变1、容量瓶上需标有①温度②浓度③容量 ④压强⑤刻度线⑥酸式或碱式 A: ①③⑤ B: ③⑤⑥ C: ①②④ D: ②④⑥
2、配制0.1mol·L-1 盐酸500mL,最适宜的一组仪器是 A:托盘天平、烧杯、容量瓶、玻璃棒 B:烧杯、量筒、玻璃棒、胶头滴管
C:烧杯、容量瓶、玻璃棒、胶头滴管 D:烧杯、容量瓶、量筒、玻璃棒、胶头滴管练习 试一试思考将硫酸铜溶液倒出1/4,其质量分数变化吗?其物质的量浓度变化吗?若将其加水至原体积呢? 结论:溶液稀释前后溶质不变
c1V1= c2V2 练习1.现欲用12mol/L的浓HNO3配制3mol/L的HNO3 100mL,则需取用多少毫升的浓HNO3 ?
2.将4gNaOH溶解在10mL水中,再稀释成1L,从中取出10mL,则取出的10mL溶液中NaOH的物质的量浓度是( )
A 1mol/L B 0.1mol/L
C 0.01mol/L D 10mol/L例题:将53.0gNa2CO3 溶解在水中,配成500mL溶液,求所得溶液中溶质的物质的量浓度。解:n(Na2CO3) = m(Na2CO3) /M(Na2CO3)
= 53.0g/106g?mol-1 = 0. 500molc(Na2CO3) = n(Na2CO3) /V = 0. 500mol/0.500L= 1.00mol/L答:溶液中Na2CO3的物质的量浓度为1.00mol/L。解: n(NaCl) =c(NaCl) × V= 0.200 mol/L × 0.500 L=0.100molm(NaCl)= n(NaCl) × M(NaCl)=0.100 mol × 58.5g/mol=5.85g答:所需NaCl的物质的量是0.1mol,质量是5.85g。 配制500ml 0.200mol/L的NaCl溶液, 需NaCl 的物质的量是多少? 质量是多少?练习 0.5 mol/L H2SO4 溶液, H+的物质的量浓度为_______mol/L , SO42-的物质的量浓度为_______ mol/L1.00.5练习 5.6L标准状况下的氨气溶于水配成500mL溶液,所得溶液的物质的量浓度为多少? 生物上高速离心机分离细胞各组分时需要使用蔗糖(C12H22O11摩尔质量为342g/mol)溶液。若某蔗糖溶液物质的量浓度为3.20mol/L,那么多少升这样的溶液中含有137克蔗糖?0.125L0.5mol/L
= 53.0g/106g?mol-1 = 0. 500molC(Na2CO3) = n(Na2CO3) /V = 0. 500mol/0.500L= 1.00mol/L答:溶液中Na2CO3的物质的量浓度为1.00mol/L。500mL请大家计算下列各溶质的物质的量浓度:溶质溶液V(aq)n(mol)c(mol·L-1)20g NaOH80g NaOH
98g 硫酸49g 硫酸1.12LHCl1L1L100mL250mL (S.P.T)0.52250.20.5210.50.054098【讨论】
1、将4gNaOH与水配成0.5L溶液,则所得
溶液的物质的量浓度为: 。 0.2mol·L-1 2、若将4gNaOH溶于0.5L水,则所得溶液物
质的量浓度与上是否相同? 不同注意:溶液体积不等于溶剂体积。溶质溶于溶剂后,体积会发生变化。3、从1L 1mol/L蔗糖溶液中分别取出100mL、10mL、1mL,取出的溶液中蔗糖的物质的量浓度及物质的量各是多少?从某溶液取出任意体积的溶液,其溶质的物质的量浓度相同,但所含溶质物质的量不同。(溶液是均一的、稳定的) c(mol·L-1)n(mol)100mL10mL1mL1110.10.010.001 练习
1.2molNaOH配成1000mL溶液,其物质的量浓度为____mol/L。
2.标准状况下,22.4LHCl溶于水配成0.5L盐酸,其物质的量浓度为__mol/L。
3.物质的量浓度为2mol/L的硫酸溶液500mL,含硫酸的物质的量为___mol。
4.10mol HCl能配成___L物质的量浓度为2mol/L的盐酸 ?
1.22粒子数
(N)
物质的量(n)物质的量浓度(c)
质 量
(m)
气体在标准状况
下的体积
(V)
1、容量瓶简介:(1)容量瓶(2)使用之前要检查是否漏水.如何检漏? 加水倒立观察瓶塞旋转180o倒立观察(3)只能用作配制的量具。不能在其中直接溶解或稀释固体或浓溶液,不能将热的溶液倒入,不能作为反应器,也不能不能长期存放溶液。移动容量瓶,应手握刻度线以上部分。形状:细颈,梨形,平底的玻璃瓶;构造:瓶上标有容积,温度,颈部标有刻度线;规格:25mL,100mL,250mL,500mL,1000mL;(二)一定物质的量浓度溶液的配制2、主要实验仪器:托盘天平(称量固体)或量筒(量取液体)、烧杯、玻璃棒、容量瓶、胶头滴管配制100mL 0.200mol/L NaCl溶液
思考:第一步应该做什么?
1、计算
溶质的质量为
m(NaCl)=0.200mol/L×0.10L×58.5g/mol = 1.17g
2 、称量
注意:要正确使用托盘天平
调零——两盘放等质量纸 ——放砝码——加药品 ——准确称量——放回砝码
用天平称取1.17g NaCl放入烧杯中3 、溶解
不能直接在容量瓶中溶解注意:在烧杯中加适量水溶解固体NaCl思考:若是浓H2SO4或NaOH溶于水,有什么现象?
溶解后能直接倒入吗?
4、冷却 冷却到室温后再倒入。
5、转移
思考:转移时直接用烧杯倒入吗?
要用玻璃棒引流。
玻璃棒下端应靠在容量瓶内壁。 请看 操作演示: 两靠一不靠将烧杯中的溶液转移至容量瓶中 6、洗涤。
用少量水洗涤烧杯和玻璃棒2-3次,洗涤液每次都要 转入容量瓶。
7 、振荡
轻轻振荡容量瓶,使溶液混合均匀8、定容
向容量瓶中加入蒸馏水,在距离刻度线1~2cm时,改用胶头滴管滴加蒸馏水至刻度线。
思考:若定容时不小心液面超过了刻度线,怎么办?能用胶头滴管把多余的液体取出吗?
必须重新配制
9、摇匀 将容量瓶盖好塞子,如图示,把容量瓶倒转和摇动多次,使得溶液混合均匀。 思考:摇匀后发现液面低于刻线,能否补充水?
不能。因为是部分溶液在润湿容量瓶瓶口磨砂处有所损失所致。
10、装瓶贴签
容量瓶中不能久放溶液,因此要把配制好的溶液转移到试剂瓶中,贴好标签,注明溶液的名称和浓度。
NaCL2、实验步骤:称量溶解转移洗涤并转移轻摇定容摇匀步骤:计算称量溶解转移洗涤定容摇匀仪器:托盘天平、药匙 、烧杯、玻璃棒、容量瓶、胶头滴管讨论:定容时俯视或仰视刻度线,对溶液的浓度有何影响? ?俯
视仰
视 俯视刻度线,实际加水量未到刻度线,使溶液的物质的量浓度增大; 仰视刻度线,实际加水量超过刻度线,使溶液的物质的量浓度减小。 记忆 “俯看偏高,仰看偏低。”3、误差判断???? 根据 c = n / V 或(n = m / MV)分析(以配制某浓度NaOH溶液为例,请同学们将c 的结果填入表中)减小 不变减小 减小 不变减小 减小 不变减小 不变减小 增大 减小 不变减小 不变增大减小不变减小 增大不变增大 减小 不变不变不变1、容量瓶上需标有①温度②浓度③容量 ④压强⑤刻度线⑥酸式或碱式 A: ①③⑤ B: ③⑤⑥ C: ①②④ D: ②④⑥
2、配制0.1mol·L-1 盐酸500mL,最适宜的一组仪器是 A:托盘天平、烧杯、容量瓶、玻璃棒 B:烧杯、量筒、玻璃棒、胶头滴管
C:烧杯、容量瓶、玻璃棒、胶头滴管 D:烧杯、容量瓶、量筒、玻璃棒、胶头滴管练习 试一试思考将硫酸铜溶液倒出1/4,其质量分数变化吗?其物质的量浓度变化吗?若将其加水至原体积呢? 结论:溶液稀释前后溶质不变
c1V1= c2V2 练习1.现欲用12mol/L的浓HNO3配制3mol/L的HNO3 100mL,则需取用多少毫升的浓HNO3 ?
2.将4gNaOH溶解在10mL水中,再稀释成1L,从中取出10mL,则取出的10mL溶液中NaOH的物质的量浓度是( )
A 1mol/L B 0.1mol/L
C 0.01mol/L D 10mol/L例题:将53.0gNa2CO3 溶解在水中,配成500mL溶液,求所得溶液中溶质的物质的量浓度。解:n(Na2CO3) = m(Na2CO3) /M(Na2CO3)
= 53.0g/106g?mol-1 = 0. 500molc(Na2CO3) = n(Na2CO3) /V = 0. 500mol/0.500L= 1.00mol/L答:溶液中Na2CO3的物质的量浓度为1.00mol/L。解: n(NaCl) =c(NaCl) × V= 0.200 mol/L × 0.500 L=0.100molm(NaCl)= n(NaCl) × M(NaCl)=0.100 mol × 58.5g/mol=5.85g答:所需NaCl的物质的量是0.1mol,质量是5.85g。 配制500ml 0.200mol/L的NaCl溶液, 需NaCl 的物质的量是多少? 质量是多少?练习 0.5 mol/L H2SO4 溶液, H+的物质的量浓度为_______mol/L , SO42-的物质的量浓度为_______ mol/L1.00.5练习 5.6L标准状况下的氨气溶于水配成500mL溶液,所得溶液的物质的量浓度为多少? 生物上高速离心机分离细胞各组分时需要使用蔗糖(C12H22O11摩尔质量为342g/mol)溶液。若某蔗糖溶液物质的量浓度为3.20mol/L,那么多少升这样的溶液中含有137克蔗糖?0.125L0.5mol/L
