2022—2023学年化学人教版九年级下册第11单元 盐 化肥 素质形成题(含答案)
文档属性
| 名称 | 2022—2023学年化学人教版九年级下册第11单元 盐 化肥 素质形成题(含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 269.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-17 16:07:28 | ||
图片预览




文档简介
2022—2023学年化学人教版九年级下册第11单元 盐 化肥 素质形成题含答案
人教第11单元 盐 化肥
一、选择题。
1、下列各组物质的溶液,不能发生复分解反应的是 ( )
A .K2CO3和Ca(OH)2 B. Na2CO3和H2SO4
C. AgNO3和BaCl2 D. KCl和CuSO4
2、在粗盐提纯的实验操作中,下列说法正确的是( )
A.过滤时用到的仪器有烧杯、玻璃棒、铁架台、滤纸
B.蒸发操作结束后,将蒸发皿放在石棉网上
C.用药匙将蒸发皿中的白色固体直接转移到纸上
D.实验结束后所得到的白色固体为氯化钠
3、属于复分解反应的是( )
A.4NH3+3O26H2O+2N2
B.Na2SiO3+H2SO4===H2SiO3↓+Na2SO4
C.2FeCl2+Cl2===2FeCl3
D.2HgO2Hg+O2↑
4、下列物质间不能发生复分解反应的是( )
A.碳酸钠溶液和氯化钙溶液 B.氢氧化钠溶液和氯化钾溶液
C.碳酸钾溶液和盐酸 D.硫酸铜溶液和氯化钡溶液
5、图 中“●”和“○”分别表示氢原子和氮原子,能保持氨气化学性质的微粒是( )
A. B. C. D.
6、向下列四种化肥样品中,分别加入熟石灰混合,研磨后能闻到刺激性气味的是( )
A.硫酸钾 B.磷矿粉 C.氯化铵 D.硝酸钾
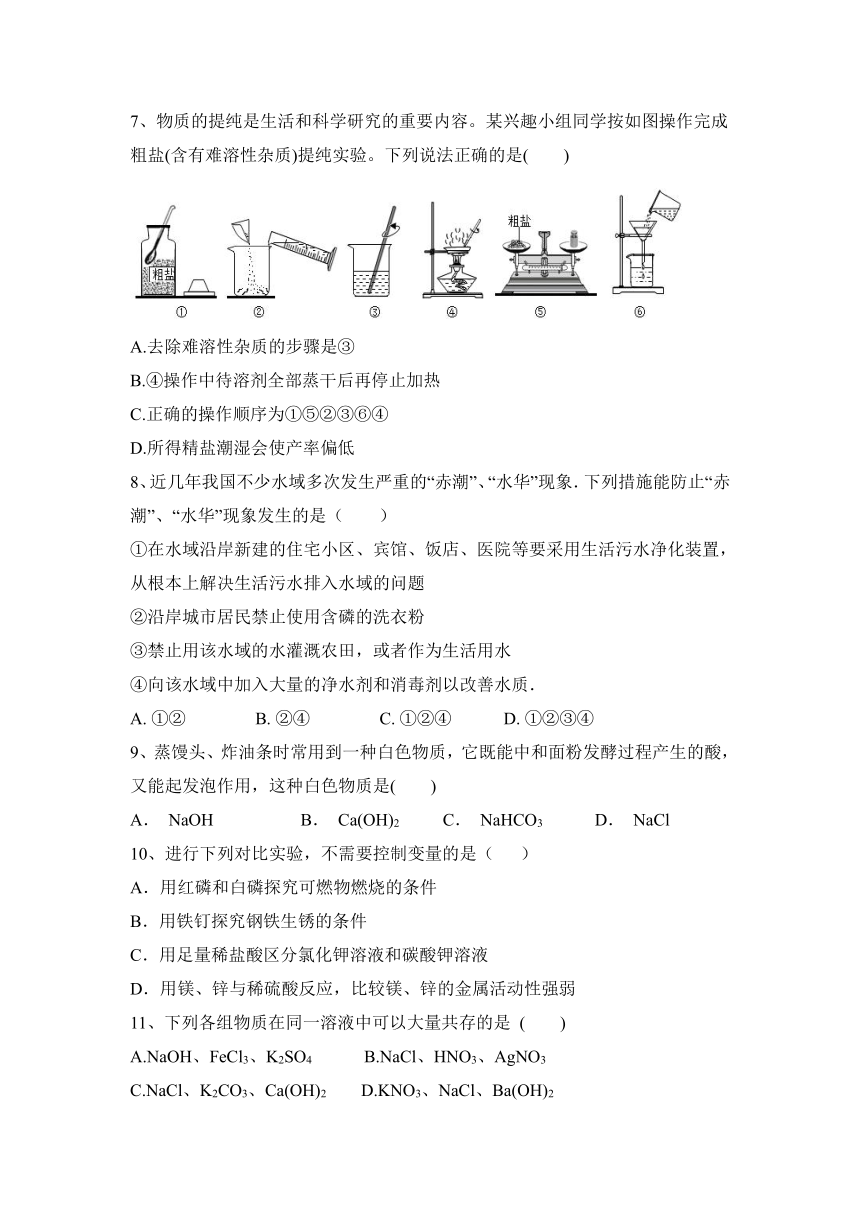
7、物质的提纯是生活和科学研究的重要内容。某兴趣小组同学按如图操作完成粗盐(含有难溶性杂质)提纯实验。下列说法正确的是( )
A.去除难溶性杂质的步骤是③
B.④操作中待溶剂全部蒸干后再停止加热
C.正确的操作顺序为①⑤②③⑥④
D.所得精盐潮湿会使产率偏低
8、近几年我国不少水域多次发生严重的“赤潮”、“水华”现象.下列措施能防止“赤潮”、“水华”现象发生的是( )
①在水域沿岸新建的住宅小区、宾馆、饭店、医院等要采用生活污水净化装置,从根本上解决生活污水排入水域的问题
②沿岸城市居民禁止使用含磷的洗衣粉
③禁止用该水域的水灌溉农田,或者作为生活用水
④向该水域中加入大量的净水剂和消毒剂以改善水质.
A. ①② B. ②④ C. ①②④ D. ①②③④
9、蒸馒头、炸油条时常用到一种白色物质,它既能中和面粉发酵过程产生的酸,又能起发泡作用,这种白色物质是( )
A. NaOH B. Ca(OH)2 C. NaHCO3 D. NaCl
10、进行下列对比实验,不需要控制变量的是( )
A.用红磷和白磷探究可燃物燃烧的条件
B.用铁钉探究钢铁生锈的条件
C.用足量稀盐酸区分氯化钾溶液和碳酸钾溶液
D.用镁、锌与稀硫酸反应,比较镁、锌的金属活动性强弱
11、下列各组物质在同一溶液中可以大量共存的是 ( )
A.NaOH、FeCl3、K2SO4 B.NaCl、HNO3、AgNO3
C.NaCl、K2CO3、Ca(OH)2 D.KNO3、NaCl、Ba(OH)2
12、为了使水污染物治理达标排放,含下列哪种元素的化合物的洗衣粉已不准使用( )
A. 氮 B. 磷 C. 钾 D. 钠
13、初中化学的很多反应可以表示为甲+乙=丙+丁,其中甲、乙、丙、丁既可能是单质也可能是化合物。下列说法中,正确的是( )
A. 若甲、乙、丙、丁均是化合物,则该反应一定是复分解反应
B. 若甲、乙、丙分别是酸、碱、盐,则丁一定是水
C. 若甲是一氧化碳,乙是金属氧化物,则丙一定是二氧化碳
D. 若甲是锌,丙是氢气,则乙一定是稀硫酸
14、(双选)下列各组物质的溶液,不用其他试剂,只用观察和组内物质的溶液相互混合的方法,就能将它们一一鉴别出来的是 ( )
A.NaCl、BaCl2、CuSO4、KNO3 B.Ba(NO3)2、NaCl、Na2SO4、HCl
C.NaOH、CuCl2、MgSO4、KCl D.HCl、Na2CO3、KCl、CaCl2
15、尿素[CO(NH2)2]是一种高效化肥,它属于( )。
A.氮肥 B.磷肥 C.钾肥 D.复合肥料
16、下列物质与HCl溶液发生的反应不属于复分解反应的是( )
A. Zn B. Al2O3 C. Ba(OH)2 D. Na2CO3
二、填空题。
17、医用氯化钙常用于合成药物。以工业碳酸钙(含少量Fe3+等杂质)为原料生产二水合氯化钙(CaCl2·2H2O)的流程图如下所示。
(1)写出第①步中碳酸钙与盐酸反应的化学方程式:
_______________________________________________________________。
(2)第②步中是否发生化学变化?________(填“是”或“否”)。
(3)操作a的名称是________,实验室进行该操作时玻璃棒的作用是:
_______________________________________________________________。
(4)青少年正处于生长发育阶段,需要摄入足够的钙,写出一种合理的补钙方法: ___________________________________________________________。
18、为增加拉面的韧性,制作过程中浅耕加了用蓬草烧制而成的草灰,即蓬灰,蓬灰中的主要成分是什么呢?科学兴趣小组猜想蓬灰的主要成分可能是K2CO3,小组成员分甲、乙两组进行部分探究。
实验过程中的操作A的名称是 。你认为 (选“甲”或“乙”)组实验方法比较理想。
19、如图是利用海水提取粗盐的过程:
(1)如图中是________池(填“蒸发”或“冷却”)。
(2)根据海水晒盐的原理,下列说法中不正确的是_________。
A.海水进入贮水池,海水的成分发生改变
B.在中,海水中氯化钠的质量逐渐增加
C.在中,海水的浓度逐渐增大
D.析出晶体后的母液是氯化钠的不饱和溶液.
(3)在粗盐变成精盐的过程中,多次用到玻璃棒,其中在蒸发过程中,玻璃棒的作用是_________
20、酸、碱、盐是我们身边重要的化合物。
(1)碱溶液有许多共同性质,是因为不同的碱溶液中都有 (填离子符号)。
(2)常用小苏打治疗胃酸过多,有关反应的化学方程式是 。
(3)将一定量的硫酸铜溶液与氢氧化钠溶液混合,充分反应后过滤,得到无色溶液。该无色溶液中一定含有溶质硫酸钠,可能含有溶质 。若要验证这种可能含有的溶质,不宜使用 (填字母)。
A.酚酞试液 B.pH试纸 C.硫酸铵 D.氯化钠
21、侯德榜是我国著名的化学家,为纯碱和氮肥工业技术的发展作出了杰出的贡献,他发明的侯氏制碱法大大提高了原料的利用率,其工业流程大致如图:
(1)上述流程中,用到的原料有空气、焦炭、水、二氧化碳、________等。
(2)上述流程中,已知步骤②发生的是化合反应,步骤⑤发生的是分解反应,则步骤②、⑤发生反应的化学方程式是:②________,⑤________。
(3)上述流程中,可循环利用的物质是________。
(4)上述流程中,“一种氮肥”的化学式是________。
22、为了提高农作物的产量,需要庄稼施肥.以玉米为例,每公顷需施用约1吨尿素,其中只有约20%被玉米吸收,其余会随水流入江中.请回答:
(1)说说你对此现象的看法 ;
(2)对此情况你的建议是 .
23、生活中食盐除了可作调味品外,当玻璃杯里结了茶垢后也可以用食盐擦洗, 去污效果非常好.食盐的主要成分NaCl中氯元素的化合价为_____;除去食盐水中泥沙等不溶性杂质的方法是_________;氯化钠还可用于制造纯碱,原理是向饱和食盐水中先后通入足量的NH3和CO2,生成小苏打(在该溶液中难溶)和一种氮肥,推测该氮肥的化学式_____ 。
三、实验题。
24、科学兴趣小组的同学在学了俗称为苏打的碳酸钠后,得知它还有一个俗称为小苏打的“兄弟”,这个“兄弟”的性质是否和它相似?它们之间能发生转化吗?
小明查阅了资料,将相关信息整理如表:
俗名 苏打 纯碱 小苏打
化学式 Na2CO3 NaHCO3
构成微粒 Na+ CO32﹣ Na+ HCO3﹣
溶解度(常温) 21.5克 9.6克
两者的转化 Na2CO3+CO2+H2O═2NaHCO3 2NaHCO3 Na2CO3+CO2↑+H2O
下面是小明同学进行的探究:
(1)用试管取适量NaHCO3溶液,向试管中滴加酚酞试液,观察试液颜色变化.此实验的目的是 。
(2)在研究Na2CO3与NaHCO3转化时,小明觉得Na2CO3转化为NaHCO3过程中,由于NaHCO3溶于水,整个过程不会有明显现象。老师笑着对小明说:“做实验吧,实验会告诉你答案。”于是小明在老师的指导下,向饱和的Na2CO3溶液中通入CO2,起初无明显现象,继续不断地通入CO2,溶液中出现了白色沉淀.这让小明很疑惑:NaHCO3溶于水,为什么还有白色沉淀呢?小明经过思考,明白了白色沉淀产生的原因是 。
(3)在小明同学的带动下,兴趣小组又对NaHCO3的其他性质进行了探究,发现两“兄弟”既有相似的性质也有不同的个性.从微观角度分析,造成两“兄弟”不同个性的原因是 不同。
四、综合应用题。
25、水是“生命之源”。请回答:
(1)含有较多可溶性钙、镁化合物的水称为____。(填“硬水”或“软水”
(2)如图是电解水的实验简图,若A试管中产生10mL气体,则B试管中产生_____mL气体。
(3)高铁酸钾(K2FeO4)和次氯酸(HClO)可用于饮用水的净化消毒,制备K2FeO4的化学反应方程式为:2Fe(OH)3+3C12+10KOH=2K2FeO4+6X+8H2O, X的化学式为____,HC1O中Cl元素的化合价为____
(4)由于粗盐中含有少量MgC12、 CaC12、 Na2SO4等杂质,不能满足化工生产的要求,因此必须将粗盐进行精制。流程如下图。
①操作III所用的玻璃仪器有:烧杯、玻璃棒和_______
②在蒸发过程中,待_______时,停止加热,利用余热将滤液蒸干。
③加入稍过量的Na2CO3溶液除了能除去粗盐中的CaC12外,它还可以除去______
④通过操作III所得滤液中的溶质有________(用化学式表示)。
(5)某同学配制100g质量分数为8.5%的氯化钠溶液,按要求回答问题:
(计算)需要氯化钠固体的质量为_____g;
(称量)用托盘天平称量氯化钠固体时,氯化钠固体应放在天平的_____盘(填 “左”或“右”);
(6)经测定,乙烯(C2H4)、甲醛(CH2O)、丙酮(C3H60)三种物质的混合物中氧元素的质量分数为44%,则100g该混合物完全燃烧后产生水的质量是(_____)
A.36g B.54g C.72g
五、计算类综合题。
26、某实验小组用石灰石(杂质不与酸反应,也不溶于水)和稀盐酸反应制取二氧化碳,在准备将反应后的废液倒进废液缸时,发现实验桌上有一瓶未知质量分数的Na2CO3溶液,他决定利用该废液,测定Na2CO3溶液中溶质的质量分数。他将废液过滤,然后向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如图所示。
(1)在加入Na2CO3溶液的过程中,开始时没有发现沉淀生成,说明滤液中的溶质有________。
(2)计算Na2CO3溶液中溶质的质量分数________。(写出计算过程,计算结果精确到0.1%)(反应的方程式:Na2CO3+CaCl2===CaCO3↓+2NaCl)
2022—2023学年化学人教版九年级下册第11单元 盐 化肥 素质形成题含答案
人教第11单元 盐 化肥
一、选择题。
1、下列各组物质的溶液,不能发生复分解反应的是 ( )
A .K2CO3和Ca(OH)2 B. Na2CO3和H2SO4
C. AgNO3和BaCl2 D. KCl和CuSO4
【答案】D
2、在粗盐提纯的实验操作中,下列说法正确的是( )
A.过滤时用到的仪器有烧杯、玻璃棒、铁架台、滤纸
B.蒸发操作结束后,将蒸发皿放在石棉网上
C.用药匙将蒸发皿中的白色固体直接转移到纸上
D.实验结束后所得到的白色固体为氯化钠
【答案】B
3、属于复分解反应的是( )
A.4NH3+3O26H2O+2N2
B.Na2SiO3+H2SO4===H2SiO3↓+Na2SO4
C.2FeCl2+Cl2===2FeCl3
D.2HgO2Hg+O2↑
【答案】B
4、下列物质间不能发生复分解反应的是( )
A.碳酸钠溶液和氯化钙溶液 B.氢氧化钠溶液和氯化钾溶液
C.碳酸钾溶液和盐酸 D.硫酸铜溶液和氯化钡溶液
【答案】B
5、图 中“●”和“○”分别表示氢原子和氮原子,能保持氨气化学性质的微粒是( )
A. B. C. D.
【答案】A
6、向下列四种化肥样品中,分别加入熟石灰混合,研磨后能闻到刺激性气味的是( )
A.硫酸钾 B.磷矿粉 C.氯化铵 D.硝酸钾
【答案】C
7、物质的提纯是生活和科学研究的重要内容。某兴趣小组同学按如图操作完成粗盐(含有难溶性杂质)提纯实验。下列说法正确的是( )
A.去除难溶性杂质的步骤是③
B.④操作中待溶剂全部蒸干后再停止加热
C.正确的操作顺序为①⑤②③⑥④
D.所得精盐潮湿会使产率偏低
【答案】C
8、近几年我国不少水域多次发生严重的“赤潮”、“水华”现象.下列措施能防止“赤潮”、“水华”现象发生的是( )
①在水域沿岸新建的住宅小区、宾馆、饭店、医院等要采用生活污水净化装置,从根本上解决生活污水排入水域的问题
②沿岸城市居民禁止使用含磷的洗衣粉
③禁止用该水域的水灌溉农田,或者作为生活用水
④向该水域中加入大量的净水剂和消毒剂以改善水质.
A. ①② B. ②④ C. ①②④ D. ①②③④
【答案】A
9、蒸馒头、炸油条时常用到一种白色物质,它既能中和面粉发酵过程产生的酸,又能起发泡作用,这种白色物质是( )
A. NaOH B. Ca(OH)2 C. NaHCO3 D. NaCl
【答案】C
10、进行下列对比实验,不需要控制变量的是( )
A.用红磷和白磷探究可燃物燃烧的条件
B.用铁钉探究钢铁生锈的条件
C.用足量稀盐酸区分氯化钾溶液和碳酸钾溶液
D.用镁、锌与稀硫酸反应,比较镁、锌的金属活动性强弱
【答案】C
11、下列各组物质在同一溶液中可以大量共存的是 ( )
A.NaOH、FeCl3、K2SO4 B.NaCl、HNO3、AgNO3
C.NaCl、K2CO3、Ca(OH)2 D.KNO3、NaCl、Ba(OH)2
【答案】D
12、为了使水污染物治理达标排放,含下列哪种元素的化合物的洗衣粉已不准使用( )
A. 氮 B. 磷 C. 钾 D. 钠
【答案】B
13、初中化学的很多反应可以表示为甲+乙=丙+丁,其中甲、乙、丙、丁既可能是单质也可能是化合物。下列说法中,正确的是( )
A. 若甲、乙、丙、丁均是化合物,则该反应一定是复分解反应
B. 若甲、乙、丙分别是酸、碱、盐,则丁一定是水
C. 若甲是一氧化碳,乙是金属氧化物,则丙一定是二氧化碳
D. 若甲是锌,丙是氢气,则乙一定是稀硫酸
【答案】B
14、(双选)下列各组物质的溶液,不用其他试剂,只用观察和组内物质的溶液相互混合的方法,就能将它们一一鉴别出来的是 ( )
A.NaCl、BaCl2、CuSO4、KNO3 B.Ba(NO3)2、NaCl、Na2SO4、HCl
C.NaOH、CuCl2、MgSO4、KCl D.HCl、Na2CO3、KCl、CaCl2
【答案】C、D
15、尿素[CO(NH2)2]是一种高效化肥,它属于( )。
A.氮肥 B.磷肥 C.钾肥 D.复合肥料
【答案】A
16、下列物质与HCl溶液发生的反应不属于复分解反应的是( )
A. Zn B. Al2O3 C. Ba(OH)2 D. Na2CO3
【答案】A
二、填空题。
17、医用氯化钙常用于合成药物。以工业碳酸钙(含少量Fe3+等杂质)为原料生产二水合氯化钙(CaCl2·2H2O)的流程图如下所示。
(1)写出第①步中碳酸钙与盐酸反应的化学方程式:
_______________________________________________________________。
(2)第②步中是否发生化学变化?________(填“是”或“否”)。
(3)操作a的名称是________,实验室进行该操作时玻璃棒的作用是:
_______________________________________________________________。
(4)青少年正处于生长发育阶段,需要摄入足够的钙,写出一种合理的补钙方法: ___________________________________________________________。
【答案】 (1)CaCO3+2HCl===CaCl2+CO2↑+H2O
(2)是 (3)过滤 引流 (4)多吃富含钙的食物(其他合理答案均可)
18、为增加拉面的韧性,制作过程中浅耕加了用蓬草烧制而成的草灰,即蓬灰,蓬灰中的主要成分是什么呢?科学兴趣小组猜想蓬灰的主要成分可能是K2CO3,小组成员分甲、乙两组进行部分探究。
实验过程中的操作A的名称是 。你认为 (选“甲”或“乙”)组实验方法比较理想。
【答案】过滤;乙。
19、如图是利用海水提取粗盐的过程:
(1)如图中是________池(填“蒸发”或“冷却”)。
(2)根据海水晒盐的原理,下列说法中不正确的是_________。
A.海水进入贮水池,海水的成分发生改变
B.在中,海水中氯化钠的质量逐渐增加
C.在中,海水的浓度逐渐增大
D.析出晶体后的母液是氯化钠的不饱和溶液.
(3)在粗盐变成精盐的过程中,多次用到玻璃棒,其中在蒸发过程中,玻璃棒的作用是_________
【答案】(1)蒸发 (2)ABD (3)防止液滴飞溅
20、酸、碱、盐是我们身边重要的化合物。
(1)碱溶液有许多共同性质,是因为不同的碱溶液中都有 (填离子符号)。
(2)常用小苏打治疗胃酸过多,有关反应的化学方程式是 。
(3)将一定量的硫酸铜溶液与氢氧化钠溶液混合,充分反应后过滤,得到无色溶液。该无色溶液中一定含有溶质硫酸钠,可能含有溶质 。若要验证这种可能含有的溶质,不宜使用 (填字母)。
A.酚酞试液 B.pH试纸 C.硫酸铵 D.氯化钠
【答案】(1)OH- (2) (3)NaOH D
21、侯德榜是我国著名的化学家,为纯碱和氮肥工业技术的发展作出了杰出的贡献,他发明的侯氏制碱法大大提高了原料的利用率,其工业流程大致如图:
(1)上述流程中,用到的原料有空气、焦炭、水、二氧化碳、________等。
(2)上述流程中,已知步骤②发生的是化合反应,步骤⑤发生的是分解反应,则步骤②、⑤发生反应的化学方程式是:②________,⑤________。
(3)上述流程中,可循环利用的物质是________。
(4)上述流程中,“一种氮肥”的化学式是________。
【答案】(1)氯化钠饱和溶液
(2)N2+3H22NH3 2NaHCO3Na2CO3+H2O+CO2↑
(3)二氧化碳、水 (4)NH4Cl
22、为了提高农作物的产量,需要庄稼施肥.以玉米为例,每公顷需施用约1吨尿素,其中只有约20%被玉米吸收,其余会随水流入江中.请回答:
(1)说说你对此现象的看法 ;
(2)对此情况你的建议是 .
【答案】(1)化肥的过量使用会造成水污染;
(2)应合理使用化肥,最好与农家肥混合使用
23、生活中食盐除了可作调味品外,当玻璃杯里结了茶垢后也可以用食盐擦洗, 去污效果非常好.食盐的主要成分NaCl中氯元素的化合价为_____;除去食盐水中泥沙等不溶性杂质的方法是_________;氯化钠还可用于制造纯碱,原理是向饱和食盐水中先后通入足量的NH3和CO2,生成小苏打(在该溶液中难溶)和一种氮肥,推测该氮肥的化学式_____ 。
【答案】﹣1 价 ;过滤 ;NH4Cl
三、实验题。
24、科学兴趣小组的同学在学了俗称为苏打的碳酸钠后,得知它还有一个俗称为小苏打的“兄弟”,这个“兄弟”的性质是否和它相似?它们之间能发生转化吗?
小明查阅了资料,将相关信息整理如表:
俗名 苏打 纯碱 小苏打
化学式 Na2CO3 NaHCO3
构成微粒 Na+ CO32﹣ Na+ HCO3﹣
溶解度(常温) 21.5克 9.6克
两者的转化 Na2CO3+CO2+H2O═2NaHCO3 2NaHCO3 Na2CO3+CO2↑+H2O
下面是小明同学进行的探究:
(1)用试管取适量NaHCO3溶液,向试管中滴加酚酞试液,观察试液颜色变化.此实验的目的是 。
(2)在研究Na2CO3与NaHCO3转化时,小明觉得Na2CO3转化为NaHCO3过程中,由于NaHCO3溶于水,整个过程不会有明显现象。老师笑着对小明说:“做实验吧,实验会告诉你答案。”于是小明在老师的指导下,向饱和的Na2CO3溶液中通入CO2,起初无明显现象,继续不断地通入CO2,溶液中出现了白色沉淀.这让小明很疑惑:NaHCO3溶于水,为什么还有白色沉淀呢?小明经过思考,明白了白色沉淀产生的原因是 。
(3)在小明同学的带动下,兴趣小组又对NaHCO3的其他性质进行了探究,发现两“兄弟”既有相似的性质也有不同的个性.从微观角度分析,造成两“兄弟”不同个性的原因是 不同。
【答案】Na2CO3溶液和NaHCO3溶液碱性的强弱;
碳酸钠与二氧化碳反应后要生成碳酸氢钠,而碳酸氢钠的溶解度小于碳酸钠,所以出现了白色沉淀; 酸根离子;
四、综合应用题。
25、水是“生命之源”。请回答:
(1)含有较多可溶性钙、镁化合物的水称为____。(填“硬水”或“软水”
(2)如图是电解水的实验简图,若A试管中产生10mL气体,则B试管中产生_____mL气体。
(3)高铁酸钾(K2FeO4)和次氯酸(HClO)可用于饮用水的净化消毒,制备K2FeO4的化学反应方程式为:2Fe(OH)3+3C12+10KOH=2K2FeO4+6X+8H2O, X的化学式为____,HC1O中Cl元素的化合价为____
(4)由于粗盐中含有少量MgC12、 CaC12、 Na2SO4等杂质,不能满足化工生产的要求,因此必须将粗盐进行精制。流程如下图。
①操作III所用的玻璃仪器有:烧杯、玻璃棒和_______
②在蒸发过程中,待_______时,停止加热,利用余热将滤液蒸干。
③加入稍过量的Na2CO3溶液除了能除去粗盐中的CaC12外,它还可以除去______
④通过操作III所得滤液中的溶质有________(用化学式表示)。
(5)某同学配制100g质量分数为8.5%的氯化钠溶液,按要求回答问题:
(计算)需要氯化钠固体的质量为_____g;
(称量)用托盘天平称量氯化钠固体时,氯化钠固体应放在天平的_____盘(填 “左”或“右”);
(6)经测定,乙烯(C2H4)、甲醛(CH2O)、丙酮(C3H60)三种物质的混合物中氧元素的质量分数为44%,则100g该混合物完全燃烧后产生水的质量是(_____)
A.36g B.54g C.72g
【答案】硬水 5 KCl、 +1 漏斗 蒸发皿中出现较多的固体 过量的氯化钡 Na2CO3、NaCl、NaOH 8.5、 左 C
五、计算类综合题。
26、某实验小组用石灰石(杂质不与酸反应,也不溶于水)和稀盐酸反应制取二氧化碳,在准备将反应后的废液倒进废液缸时,发现实验桌上有一瓶未知质量分数的Na2CO3溶液,他决定利用该废液,测定Na2CO3溶液中溶质的质量分数。他将废液过滤,然后向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如图所示。
(1)在加入Na2CO3溶液的过程中,开始时没有发现沉淀生成,说明滤液中的溶质有________。
(2)计算Na2CO3溶液中溶质的质量分数________。(写出计算过程,计算结果精确到0.1%)(反应的方程式:Na2CO3+CaCl2===CaCO3↓+2NaCl)
【答案】(1)CaCl2、HCl
(2)设:20 g Na2CO3溶液中溶质的质量为x,
解之得:x=5.3 g,
则该Na2CO3溶液中溶质的质量分数为×100%=26.5%。
【解析】(1)根据已知条件可知,开始时没有发现沉淀生成,说明滤液中除了CaCl2还有其他物质,由第一个实验可以推断,这种物质是稀盐酸;
(2)分析图意可知,有20 g Na2CO3溶液与氯化钙溶液全部反应,生成5 g碳酸钙沉淀,根据反应的化学方程式,得出各物质之间的质量比,列出比例式,就可计算出20 g Na2CO3溶液中溶质的质量,然后根据溶质的质量分数公式计算即可。
人教第11单元 盐 化肥
一、选择题。
1、下列各组物质的溶液,不能发生复分解反应的是 ( )
A .K2CO3和Ca(OH)2 B. Na2CO3和H2SO4
C. AgNO3和BaCl2 D. KCl和CuSO4
2、在粗盐提纯的实验操作中,下列说法正确的是( )
A.过滤时用到的仪器有烧杯、玻璃棒、铁架台、滤纸
B.蒸发操作结束后,将蒸发皿放在石棉网上
C.用药匙将蒸发皿中的白色固体直接转移到纸上
D.实验结束后所得到的白色固体为氯化钠
3、属于复分解反应的是( )
A.4NH3+3O26H2O+2N2
B.Na2SiO3+H2SO4===H2SiO3↓+Na2SO4
C.2FeCl2+Cl2===2FeCl3
D.2HgO2Hg+O2↑
4、下列物质间不能发生复分解反应的是( )
A.碳酸钠溶液和氯化钙溶液 B.氢氧化钠溶液和氯化钾溶液
C.碳酸钾溶液和盐酸 D.硫酸铜溶液和氯化钡溶液
5、图 中“●”和“○”分别表示氢原子和氮原子,能保持氨气化学性质的微粒是( )
A. B. C. D.
6、向下列四种化肥样品中,分别加入熟石灰混合,研磨后能闻到刺激性气味的是( )
A.硫酸钾 B.磷矿粉 C.氯化铵 D.硝酸钾
7、物质的提纯是生活和科学研究的重要内容。某兴趣小组同学按如图操作完成粗盐(含有难溶性杂质)提纯实验。下列说法正确的是( )
A.去除难溶性杂质的步骤是③
B.④操作中待溶剂全部蒸干后再停止加热
C.正确的操作顺序为①⑤②③⑥④
D.所得精盐潮湿会使产率偏低
8、近几年我国不少水域多次发生严重的“赤潮”、“水华”现象.下列措施能防止“赤潮”、“水华”现象发生的是( )
①在水域沿岸新建的住宅小区、宾馆、饭店、医院等要采用生活污水净化装置,从根本上解决生活污水排入水域的问题
②沿岸城市居民禁止使用含磷的洗衣粉
③禁止用该水域的水灌溉农田,或者作为生活用水
④向该水域中加入大量的净水剂和消毒剂以改善水质.
A. ①② B. ②④ C. ①②④ D. ①②③④
9、蒸馒头、炸油条时常用到一种白色物质,它既能中和面粉发酵过程产生的酸,又能起发泡作用,这种白色物质是( )
A. NaOH B. Ca(OH)2 C. NaHCO3 D. NaCl
10、进行下列对比实验,不需要控制变量的是( )
A.用红磷和白磷探究可燃物燃烧的条件
B.用铁钉探究钢铁生锈的条件
C.用足量稀盐酸区分氯化钾溶液和碳酸钾溶液
D.用镁、锌与稀硫酸反应,比较镁、锌的金属活动性强弱
11、下列各组物质在同一溶液中可以大量共存的是 ( )
A.NaOH、FeCl3、K2SO4 B.NaCl、HNO3、AgNO3
C.NaCl、K2CO3、Ca(OH)2 D.KNO3、NaCl、Ba(OH)2
12、为了使水污染物治理达标排放,含下列哪种元素的化合物的洗衣粉已不准使用( )
A. 氮 B. 磷 C. 钾 D. 钠
13、初中化学的很多反应可以表示为甲+乙=丙+丁,其中甲、乙、丙、丁既可能是单质也可能是化合物。下列说法中,正确的是( )
A. 若甲、乙、丙、丁均是化合物,则该反应一定是复分解反应
B. 若甲、乙、丙分别是酸、碱、盐,则丁一定是水
C. 若甲是一氧化碳,乙是金属氧化物,则丙一定是二氧化碳
D. 若甲是锌,丙是氢气,则乙一定是稀硫酸
14、(双选)下列各组物质的溶液,不用其他试剂,只用观察和组内物质的溶液相互混合的方法,就能将它们一一鉴别出来的是 ( )
A.NaCl、BaCl2、CuSO4、KNO3 B.Ba(NO3)2、NaCl、Na2SO4、HCl
C.NaOH、CuCl2、MgSO4、KCl D.HCl、Na2CO3、KCl、CaCl2
15、尿素[CO(NH2)2]是一种高效化肥,它属于( )。
A.氮肥 B.磷肥 C.钾肥 D.复合肥料
16、下列物质与HCl溶液发生的反应不属于复分解反应的是( )
A. Zn B. Al2O3 C. Ba(OH)2 D. Na2CO3
二、填空题。
17、医用氯化钙常用于合成药物。以工业碳酸钙(含少量Fe3+等杂质)为原料生产二水合氯化钙(CaCl2·2H2O)的流程图如下所示。
(1)写出第①步中碳酸钙与盐酸反应的化学方程式:
_______________________________________________________________。
(2)第②步中是否发生化学变化?________(填“是”或“否”)。
(3)操作a的名称是________,实验室进行该操作时玻璃棒的作用是:
_______________________________________________________________。
(4)青少年正处于生长发育阶段,需要摄入足够的钙,写出一种合理的补钙方法: ___________________________________________________________。
18、为增加拉面的韧性,制作过程中浅耕加了用蓬草烧制而成的草灰,即蓬灰,蓬灰中的主要成分是什么呢?科学兴趣小组猜想蓬灰的主要成分可能是K2CO3,小组成员分甲、乙两组进行部分探究。
实验过程中的操作A的名称是 。你认为 (选“甲”或“乙”)组实验方法比较理想。
19、如图是利用海水提取粗盐的过程:
(1)如图中是________池(填“蒸发”或“冷却”)。
(2)根据海水晒盐的原理,下列说法中不正确的是_________。
A.海水进入贮水池,海水的成分发生改变
B.在中,海水中氯化钠的质量逐渐增加
C.在中,海水的浓度逐渐增大
D.析出晶体后的母液是氯化钠的不饱和溶液.
(3)在粗盐变成精盐的过程中,多次用到玻璃棒,其中在蒸发过程中,玻璃棒的作用是_________
20、酸、碱、盐是我们身边重要的化合物。
(1)碱溶液有许多共同性质,是因为不同的碱溶液中都有 (填离子符号)。
(2)常用小苏打治疗胃酸过多,有关反应的化学方程式是 。
(3)将一定量的硫酸铜溶液与氢氧化钠溶液混合,充分反应后过滤,得到无色溶液。该无色溶液中一定含有溶质硫酸钠,可能含有溶质 。若要验证这种可能含有的溶质,不宜使用 (填字母)。
A.酚酞试液 B.pH试纸 C.硫酸铵 D.氯化钠
21、侯德榜是我国著名的化学家,为纯碱和氮肥工业技术的发展作出了杰出的贡献,他发明的侯氏制碱法大大提高了原料的利用率,其工业流程大致如图:
(1)上述流程中,用到的原料有空气、焦炭、水、二氧化碳、________等。
(2)上述流程中,已知步骤②发生的是化合反应,步骤⑤发生的是分解反应,则步骤②、⑤发生反应的化学方程式是:②________,⑤________。
(3)上述流程中,可循环利用的物质是________。
(4)上述流程中,“一种氮肥”的化学式是________。
22、为了提高农作物的产量,需要庄稼施肥.以玉米为例,每公顷需施用约1吨尿素,其中只有约20%被玉米吸收,其余会随水流入江中.请回答:
(1)说说你对此现象的看法 ;
(2)对此情况你的建议是 .
23、生活中食盐除了可作调味品外,当玻璃杯里结了茶垢后也可以用食盐擦洗, 去污效果非常好.食盐的主要成分NaCl中氯元素的化合价为_____;除去食盐水中泥沙等不溶性杂质的方法是_________;氯化钠还可用于制造纯碱,原理是向饱和食盐水中先后通入足量的NH3和CO2,生成小苏打(在该溶液中难溶)和一种氮肥,推测该氮肥的化学式_____ 。
三、实验题。
24、科学兴趣小组的同学在学了俗称为苏打的碳酸钠后,得知它还有一个俗称为小苏打的“兄弟”,这个“兄弟”的性质是否和它相似?它们之间能发生转化吗?
小明查阅了资料,将相关信息整理如表:
俗名 苏打 纯碱 小苏打
化学式 Na2CO3 NaHCO3
构成微粒 Na+ CO32﹣ Na+ HCO3﹣
溶解度(常温) 21.5克 9.6克
两者的转化 Na2CO3+CO2+H2O═2NaHCO3 2NaHCO3 Na2CO3+CO2↑+H2O
下面是小明同学进行的探究:
(1)用试管取适量NaHCO3溶液,向试管中滴加酚酞试液,观察试液颜色变化.此实验的目的是 。
(2)在研究Na2CO3与NaHCO3转化时,小明觉得Na2CO3转化为NaHCO3过程中,由于NaHCO3溶于水,整个过程不会有明显现象。老师笑着对小明说:“做实验吧,实验会告诉你答案。”于是小明在老师的指导下,向饱和的Na2CO3溶液中通入CO2,起初无明显现象,继续不断地通入CO2,溶液中出现了白色沉淀.这让小明很疑惑:NaHCO3溶于水,为什么还有白色沉淀呢?小明经过思考,明白了白色沉淀产生的原因是 。
(3)在小明同学的带动下,兴趣小组又对NaHCO3的其他性质进行了探究,发现两“兄弟”既有相似的性质也有不同的个性.从微观角度分析,造成两“兄弟”不同个性的原因是 不同。
四、综合应用题。
25、水是“生命之源”。请回答:
(1)含有较多可溶性钙、镁化合物的水称为____。(填“硬水”或“软水”
(2)如图是电解水的实验简图,若A试管中产生10mL气体,则B试管中产生_____mL气体。
(3)高铁酸钾(K2FeO4)和次氯酸(HClO)可用于饮用水的净化消毒,制备K2FeO4的化学反应方程式为:2Fe(OH)3+3C12+10KOH=2K2FeO4+6X+8H2O, X的化学式为____,HC1O中Cl元素的化合价为____
(4)由于粗盐中含有少量MgC12、 CaC12、 Na2SO4等杂质,不能满足化工生产的要求,因此必须将粗盐进行精制。流程如下图。
①操作III所用的玻璃仪器有:烧杯、玻璃棒和_______
②在蒸发过程中,待_______时,停止加热,利用余热将滤液蒸干。
③加入稍过量的Na2CO3溶液除了能除去粗盐中的CaC12外,它还可以除去______
④通过操作III所得滤液中的溶质有________(用化学式表示)。
(5)某同学配制100g质量分数为8.5%的氯化钠溶液,按要求回答问题:
(计算)需要氯化钠固体的质量为_____g;
(称量)用托盘天平称量氯化钠固体时,氯化钠固体应放在天平的_____盘(填 “左”或“右”);
(6)经测定,乙烯(C2H4)、甲醛(CH2O)、丙酮(C3H60)三种物质的混合物中氧元素的质量分数为44%,则100g该混合物完全燃烧后产生水的质量是(_____)
A.36g B.54g C.72g
五、计算类综合题。
26、某实验小组用石灰石(杂质不与酸反应,也不溶于水)和稀盐酸反应制取二氧化碳,在准备将反应后的废液倒进废液缸时,发现实验桌上有一瓶未知质量分数的Na2CO3溶液,他决定利用该废液,测定Na2CO3溶液中溶质的质量分数。他将废液过滤,然后向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如图所示。
(1)在加入Na2CO3溶液的过程中,开始时没有发现沉淀生成,说明滤液中的溶质有________。
(2)计算Na2CO3溶液中溶质的质量分数________。(写出计算过程,计算结果精确到0.1%)(反应的方程式:Na2CO3+CaCl2===CaCO3↓+2NaCl)
2022—2023学年化学人教版九年级下册第11单元 盐 化肥 素质形成题含答案
人教第11单元 盐 化肥
一、选择题。
1、下列各组物质的溶液,不能发生复分解反应的是 ( )
A .K2CO3和Ca(OH)2 B. Na2CO3和H2SO4
C. AgNO3和BaCl2 D. KCl和CuSO4
【答案】D
2、在粗盐提纯的实验操作中,下列说法正确的是( )
A.过滤时用到的仪器有烧杯、玻璃棒、铁架台、滤纸
B.蒸发操作结束后,将蒸发皿放在石棉网上
C.用药匙将蒸发皿中的白色固体直接转移到纸上
D.实验结束后所得到的白色固体为氯化钠
【答案】B
3、属于复分解反应的是( )
A.4NH3+3O26H2O+2N2
B.Na2SiO3+H2SO4===H2SiO3↓+Na2SO4
C.2FeCl2+Cl2===2FeCl3
D.2HgO2Hg+O2↑
【答案】B
4、下列物质间不能发生复分解反应的是( )
A.碳酸钠溶液和氯化钙溶液 B.氢氧化钠溶液和氯化钾溶液
C.碳酸钾溶液和盐酸 D.硫酸铜溶液和氯化钡溶液
【答案】B
5、图 中“●”和“○”分别表示氢原子和氮原子,能保持氨气化学性质的微粒是( )
A. B. C. D.
【答案】A
6、向下列四种化肥样品中,分别加入熟石灰混合,研磨后能闻到刺激性气味的是( )
A.硫酸钾 B.磷矿粉 C.氯化铵 D.硝酸钾
【答案】C
7、物质的提纯是生活和科学研究的重要内容。某兴趣小组同学按如图操作完成粗盐(含有难溶性杂质)提纯实验。下列说法正确的是( )
A.去除难溶性杂质的步骤是③
B.④操作中待溶剂全部蒸干后再停止加热
C.正确的操作顺序为①⑤②③⑥④
D.所得精盐潮湿会使产率偏低
【答案】C
8、近几年我国不少水域多次发生严重的“赤潮”、“水华”现象.下列措施能防止“赤潮”、“水华”现象发生的是( )
①在水域沿岸新建的住宅小区、宾馆、饭店、医院等要采用生活污水净化装置,从根本上解决生活污水排入水域的问题
②沿岸城市居民禁止使用含磷的洗衣粉
③禁止用该水域的水灌溉农田,或者作为生活用水
④向该水域中加入大量的净水剂和消毒剂以改善水质.
A. ①② B. ②④ C. ①②④ D. ①②③④
【答案】A
9、蒸馒头、炸油条时常用到一种白色物质,它既能中和面粉发酵过程产生的酸,又能起发泡作用,这种白色物质是( )
A. NaOH B. Ca(OH)2 C. NaHCO3 D. NaCl
【答案】C
10、进行下列对比实验,不需要控制变量的是( )
A.用红磷和白磷探究可燃物燃烧的条件
B.用铁钉探究钢铁生锈的条件
C.用足量稀盐酸区分氯化钾溶液和碳酸钾溶液
D.用镁、锌与稀硫酸反应,比较镁、锌的金属活动性强弱
【答案】C
11、下列各组物质在同一溶液中可以大量共存的是 ( )
A.NaOH、FeCl3、K2SO4 B.NaCl、HNO3、AgNO3
C.NaCl、K2CO3、Ca(OH)2 D.KNO3、NaCl、Ba(OH)2
【答案】D
12、为了使水污染物治理达标排放,含下列哪种元素的化合物的洗衣粉已不准使用( )
A. 氮 B. 磷 C. 钾 D. 钠
【答案】B
13、初中化学的很多反应可以表示为甲+乙=丙+丁,其中甲、乙、丙、丁既可能是单质也可能是化合物。下列说法中,正确的是( )
A. 若甲、乙、丙、丁均是化合物,则该反应一定是复分解反应
B. 若甲、乙、丙分别是酸、碱、盐,则丁一定是水
C. 若甲是一氧化碳,乙是金属氧化物,则丙一定是二氧化碳
D. 若甲是锌,丙是氢气,则乙一定是稀硫酸
【答案】B
14、(双选)下列各组物质的溶液,不用其他试剂,只用观察和组内物质的溶液相互混合的方法,就能将它们一一鉴别出来的是 ( )
A.NaCl、BaCl2、CuSO4、KNO3 B.Ba(NO3)2、NaCl、Na2SO4、HCl
C.NaOH、CuCl2、MgSO4、KCl D.HCl、Na2CO3、KCl、CaCl2
【答案】C、D
15、尿素[CO(NH2)2]是一种高效化肥,它属于( )。
A.氮肥 B.磷肥 C.钾肥 D.复合肥料
【答案】A
16、下列物质与HCl溶液发生的反应不属于复分解反应的是( )
A. Zn B. Al2O3 C. Ba(OH)2 D. Na2CO3
【答案】A
二、填空题。
17、医用氯化钙常用于合成药物。以工业碳酸钙(含少量Fe3+等杂质)为原料生产二水合氯化钙(CaCl2·2H2O)的流程图如下所示。
(1)写出第①步中碳酸钙与盐酸反应的化学方程式:
_______________________________________________________________。
(2)第②步中是否发生化学变化?________(填“是”或“否”)。
(3)操作a的名称是________,实验室进行该操作时玻璃棒的作用是:
_______________________________________________________________。
(4)青少年正处于生长发育阶段,需要摄入足够的钙,写出一种合理的补钙方法: ___________________________________________________________。
【答案】 (1)CaCO3+2HCl===CaCl2+CO2↑+H2O
(2)是 (3)过滤 引流 (4)多吃富含钙的食物(其他合理答案均可)
18、为增加拉面的韧性,制作过程中浅耕加了用蓬草烧制而成的草灰,即蓬灰,蓬灰中的主要成分是什么呢?科学兴趣小组猜想蓬灰的主要成分可能是K2CO3,小组成员分甲、乙两组进行部分探究。
实验过程中的操作A的名称是 。你认为 (选“甲”或“乙”)组实验方法比较理想。
【答案】过滤;乙。
19、如图是利用海水提取粗盐的过程:
(1)如图中是________池(填“蒸发”或“冷却”)。
(2)根据海水晒盐的原理,下列说法中不正确的是_________。
A.海水进入贮水池,海水的成分发生改变
B.在中,海水中氯化钠的质量逐渐增加
C.在中,海水的浓度逐渐增大
D.析出晶体后的母液是氯化钠的不饱和溶液.
(3)在粗盐变成精盐的过程中,多次用到玻璃棒,其中在蒸发过程中,玻璃棒的作用是_________
【答案】(1)蒸发 (2)ABD (3)防止液滴飞溅
20、酸、碱、盐是我们身边重要的化合物。
(1)碱溶液有许多共同性质,是因为不同的碱溶液中都有 (填离子符号)。
(2)常用小苏打治疗胃酸过多,有关反应的化学方程式是 。
(3)将一定量的硫酸铜溶液与氢氧化钠溶液混合,充分反应后过滤,得到无色溶液。该无色溶液中一定含有溶质硫酸钠,可能含有溶质 。若要验证这种可能含有的溶质,不宜使用 (填字母)。
A.酚酞试液 B.pH试纸 C.硫酸铵 D.氯化钠
【答案】(1)OH- (2) (3)NaOH D
21、侯德榜是我国著名的化学家,为纯碱和氮肥工业技术的发展作出了杰出的贡献,他发明的侯氏制碱法大大提高了原料的利用率,其工业流程大致如图:
(1)上述流程中,用到的原料有空气、焦炭、水、二氧化碳、________等。
(2)上述流程中,已知步骤②发生的是化合反应,步骤⑤发生的是分解反应,则步骤②、⑤发生反应的化学方程式是:②________,⑤________。
(3)上述流程中,可循环利用的物质是________。
(4)上述流程中,“一种氮肥”的化学式是________。
【答案】(1)氯化钠饱和溶液
(2)N2+3H22NH3 2NaHCO3Na2CO3+H2O+CO2↑
(3)二氧化碳、水 (4)NH4Cl
22、为了提高农作物的产量,需要庄稼施肥.以玉米为例,每公顷需施用约1吨尿素,其中只有约20%被玉米吸收,其余会随水流入江中.请回答:
(1)说说你对此现象的看法 ;
(2)对此情况你的建议是 .
【答案】(1)化肥的过量使用会造成水污染;
(2)应合理使用化肥,最好与农家肥混合使用
23、生活中食盐除了可作调味品外,当玻璃杯里结了茶垢后也可以用食盐擦洗, 去污效果非常好.食盐的主要成分NaCl中氯元素的化合价为_____;除去食盐水中泥沙等不溶性杂质的方法是_________;氯化钠还可用于制造纯碱,原理是向饱和食盐水中先后通入足量的NH3和CO2,生成小苏打(在该溶液中难溶)和一种氮肥,推测该氮肥的化学式_____ 。
【答案】﹣1 价 ;过滤 ;NH4Cl
三、实验题。
24、科学兴趣小组的同学在学了俗称为苏打的碳酸钠后,得知它还有一个俗称为小苏打的“兄弟”,这个“兄弟”的性质是否和它相似?它们之间能发生转化吗?
小明查阅了资料,将相关信息整理如表:
俗名 苏打 纯碱 小苏打
化学式 Na2CO3 NaHCO3
构成微粒 Na+ CO32﹣ Na+ HCO3﹣
溶解度(常温) 21.5克 9.6克
两者的转化 Na2CO3+CO2+H2O═2NaHCO3 2NaHCO3 Na2CO3+CO2↑+H2O
下面是小明同学进行的探究:
(1)用试管取适量NaHCO3溶液,向试管中滴加酚酞试液,观察试液颜色变化.此实验的目的是 。
(2)在研究Na2CO3与NaHCO3转化时,小明觉得Na2CO3转化为NaHCO3过程中,由于NaHCO3溶于水,整个过程不会有明显现象。老师笑着对小明说:“做实验吧,实验会告诉你答案。”于是小明在老师的指导下,向饱和的Na2CO3溶液中通入CO2,起初无明显现象,继续不断地通入CO2,溶液中出现了白色沉淀.这让小明很疑惑:NaHCO3溶于水,为什么还有白色沉淀呢?小明经过思考,明白了白色沉淀产生的原因是 。
(3)在小明同学的带动下,兴趣小组又对NaHCO3的其他性质进行了探究,发现两“兄弟”既有相似的性质也有不同的个性.从微观角度分析,造成两“兄弟”不同个性的原因是 不同。
【答案】Na2CO3溶液和NaHCO3溶液碱性的强弱;
碳酸钠与二氧化碳反应后要生成碳酸氢钠,而碳酸氢钠的溶解度小于碳酸钠,所以出现了白色沉淀; 酸根离子;
四、综合应用题。
25、水是“生命之源”。请回答:
(1)含有较多可溶性钙、镁化合物的水称为____。(填“硬水”或“软水”
(2)如图是电解水的实验简图,若A试管中产生10mL气体,则B试管中产生_____mL气体。
(3)高铁酸钾(K2FeO4)和次氯酸(HClO)可用于饮用水的净化消毒,制备K2FeO4的化学反应方程式为:2Fe(OH)3+3C12+10KOH=2K2FeO4+6X+8H2O, X的化学式为____,HC1O中Cl元素的化合价为____
(4)由于粗盐中含有少量MgC12、 CaC12、 Na2SO4等杂质,不能满足化工生产的要求,因此必须将粗盐进行精制。流程如下图。
①操作III所用的玻璃仪器有:烧杯、玻璃棒和_______
②在蒸发过程中,待_______时,停止加热,利用余热将滤液蒸干。
③加入稍过量的Na2CO3溶液除了能除去粗盐中的CaC12外,它还可以除去______
④通过操作III所得滤液中的溶质有________(用化学式表示)。
(5)某同学配制100g质量分数为8.5%的氯化钠溶液,按要求回答问题:
(计算)需要氯化钠固体的质量为_____g;
(称量)用托盘天平称量氯化钠固体时,氯化钠固体应放在天平的_____盘(填 “左”或“右”);
(6)经测定,乙烯(C2H4)、甲醛(CH2O)、丙酮(C3H60)三种物质的混合物中氧元素的质量分数为44%,则100g该混合物完全燃烧后产生水的质量是(_____)
A.36g B.54g C.72g
【答案】硬水 5 KCl、 +1 漏斗 蒸发皿中出现较多的固体 过量的氯化钡 Na2CO3、NaCl、NaOH 8.5、 左 C
五、计算类综合题。
26、某实验小组用石灰石(杂质不与酸反应,也不溶于水)和稀盐酸反应制取二氧化碳,在准备将反应后的废液倒进废液缸时,发现实验桌上有一瓶未知质量分数的Na2CO3溶液,他决定利用该废液,测定Na2CO3溶液中溶质的质量分数。他将废液过滤,然后向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如图所示。
(1)在加入Na2CO3溶液的过程中,开始时没有发现沉淀生成,说明滤液中的溶质有________。
(2)计算Na2CO3溶液中溶质的质量分数________。(写出计算过程,计算结果精确到0.1%)(反应的方程式:Na2CO3+CaCl2===CaCO3↓+2NaCl)
【答案】(1)CaCl2、HCl
(2)设:20 g Na2CO3溶液中溶质的质量为x,
解之得:x=5.3 g,
则该Na2CO3溶液中溶质的质量分数为×100%=26.5%。
【解析】(1)根据已知条件可知,开始时没有发现沉淀生成,说明滤液中除了CaCl2还有其他物质,由第一个实验可以推断,这种物质是稀盐酸;
(2)分析图意可知,有20 g Na2CO3溶液与氯化钙溶液全部反应,生成5 g碳酸钙沉淀,根据反应的化学方程式,得出各物质之间的质量比,列出比例式,就可计算出20 g Na2CO3溶液中溶质的质量,然后根据溶质的质量分数公式计算即可。
同课章节目录
