醇酚(第1课时)
图片预览








文档简介
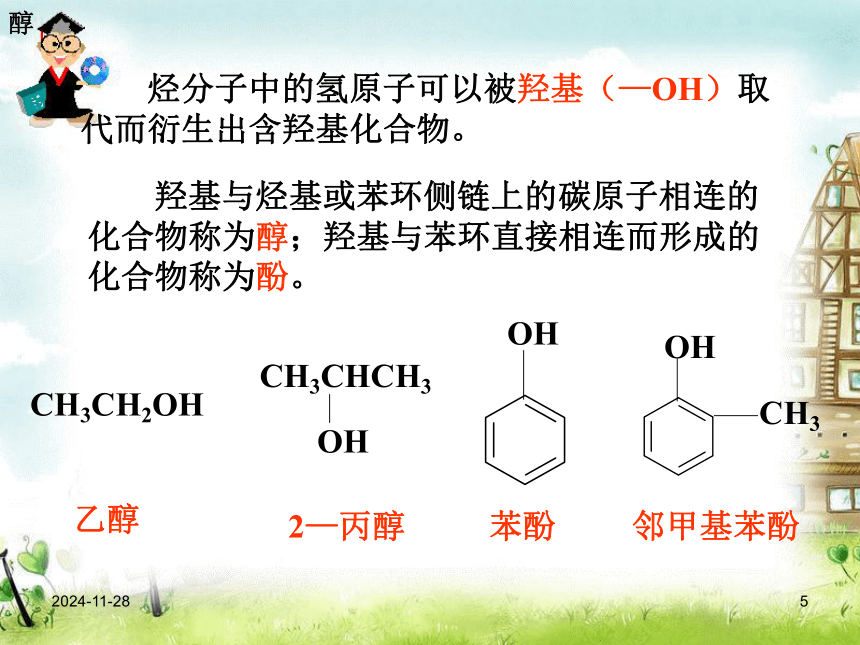
课件45张PPT。2019/1/61第三章 烃的含氧衍生物第一节 醇 酚第1课时新课标人教版高中化学课件系列选修5 有机化学基础2019/1/62 据我国《周礼》记载,早在周朝就有酿酒和制醋作坊,可见人类制造和使用有机物有很长的历史。 从结构上看,酒、醋、苹果酸、柠檬酸等有机物,可以看作是烃分子里的氢原子被含有氧原子的原子团取代而衍生成的,它们被称为烃的含氧衍生物。 烃的含氧衍生物种类很多,可分为醇、酚、醛、羧酸和酯等。烃的含氧衍生物的性质由所含官能团决定。利用有机物的性质,可以合成具有特定性质而自然界并不存在的有机物,以满足我们的需要。烃的含氧衍生物2019/1/63何以解忧
唯有——明月几时有把
问青天杜康酒乙醇教学目标:2019/1/64 1.掌握乙醇的主要化学性质
2.掌握乙醇 的工业制法和用途
3.了解醇的分类和命名
4.了解醇类的一般通性和典型醇的用途 教学重点: 乙醇的化学性质乙醇2019/1/65 烃分子中的氢原子可以被羟基(—OH)取代而衍生出含羟基化合物。 羟基与烃基或苯环侧链上的碳原子相连的化合物称为醇;羟基与苯环直接相连而形成的化合物称为酚。CH3CH2OH乙醇2—丙醇苯酚邻甲基苯酚醇2019/1/66P48 醇的命名(2)编号(1)选主链(3)写名称选最长碳链,且含—OH从离—OH最近的一端起编取代基位置— 取代基名称 — 羟基位置— 母体名称(羟基位置用阿拉伯数字表示;羟基的个数用“二”、“三”等表示。)资料卡片苯甲醇乙二醇1,2,3—丙三醇(或甘油、丙三醇)醇2019/1/67②③[练习]写出下列醇的名称①2—甲基—1—丙醇2—丁醇2,3—二甲基—3—戊醇醇2019/1/68醇的同分异构体醇类的同分异构体可有:
(1)碳链异构、
(2)羟基的位置异构,
(3)相同碳原子数的饱和一元醇和醚是官能团异构练习:写出C4H10O的所有同分异构体醇2019/1/69一、醇1.醇的分类1)根据羟基所连烃基的种类 醇2019/1/6102) 根据醇分子结构中羟基的数目,醇可分为一元醇、二元醇、三元醇…… 乙二醇和丙三醇都是无色、黏稠、有甜味的液体,都易溶于水和乙醇,是重要的化工原料。饱和一元醇通式:CnH2n+1OH或CnH2n+2O 乙二醇可用于汽车作防冻剂,丙三醇可用于配制化妆品。醇2019/1/611P49 思考与交流对比表格中的数据,你能得出什么结论?醇2019/1/6巴东县第三高级中学12醇的沸点远高于烷烃。结论:相对分子质量相近的醇和烷烃,醇的沸点远远高于烷烃醇●●●●●●醇烷why2019/1/6巴东县第三高级中学13原因:由于醇分子中羟基的氧原子与另一醇分子羟基的氢原子间存在着相互吸引作用,这种吸引作用叫氢键。(分子间形成了氢键)醇P49学与问:你能得出什么结论?2019/1/6巴东县第三高级中学14表3-2图●●●●●乙n醇丙n醇醇羟基越多沸点越高。氢键数目增多醇2019/1/6巴东县第三高级中学15 甲醇、乙醇、丙醇均可与水以任意比例混溶,这是因为甲醇、乙醇、丙醇与水形成了氢键。随碳原子的数目增多,醇的溶解性减小(原因) 乙二醇的沸点高于乙醇,1,2,3—丙三醇的沸点高于1,2—丙二醇, 1,2—丙二醇的沸点高于1—丙醇,其原因是:由于羟基数目增多,使得分子间形成的氢键增多增强,熔沸点升高。 醇2019/1/6巴东县第三高级中学16 乙二醇和丙三醇都是无色、黏稠、有甜味的液体,都易溶于水和乙醇,是重要的化工原料。饱和一元醇通式:CnH2n+1OH或CnH2n+2O 乙二醇可用于汽车作防冻剂,丙三醇可用于配制化妆品。 常见醇:醇2019/1/6巴东县第三高级中学172. 乙醇的结构 从乙烷分子中的1个H原子被—OH(羟基)取代衍变成乙醇乙醇2019/1/6巴东县第三高级中学183. 乙醇的物理性质1)无色、透明、有特殊香味的液体;
2)沸点78℃;
3)易挥发;
4)密度比水小;
5)能跟水以任意比互溶;
6)能溶解多种无机物和有机物。4. 乙醇的化学性质1)与金属钠反应(取代反应)2CH3CH2OH+2Na→2CH3CH2ONa+H2↑乙醇2019/1/6巴东县第三高级中学19思考与交流 处理反应釜中金属钠的最安全、合理的方法是第(3)种方案,向反应釜中慢慢加入乙醇,由于乙醇与金属钠的反应比水与钠的反应缓和,热效应小,因此是比较安全,可行的处理方法。 哪一个建议处理反应釜中金属钠的更合理、更安全?
建议(1):打开反应釜,用工具将反应釜内的金属钠
取出来;
建议(2):向反应釜内加水,通过化学反应“除掉”金
属钠;
建议(3):采用远程滴加乙醇的方法向反应釜内加入
乙醇,并设置放气管,排放乙醇与金属钠
反应产生的氢气和热量。乙醇2019/1/6巴东县第三高级中学20乙醇的分子式结构式及比例模型乙醇2019/1/6巴东县第三高级中学21实验探究:观察钠的保存方法,回忆钠与水的反应,并向1~2mL无水乙醇中投入一小粒金属钠(注意钠的使用安全),观察实验现象。乙醇2019/1/6巴东县第三高级中学22钠与水钠与乙醇钠是否浮在液面上浮在水面沉在液面下钠的形状是否变化熔成小球仍是块状有无声音发出嘶嘶响声没有声音有无气泡放出气泡放出气泡剧烈程度剧烈缓慢化学方程式2Na+2H2O=
2 NaOH +H2↑乙醇2019/1/6巴东县第三高级中学23思考与交流 1、根据水与钠反应的方程式,试写出乙醇跟金属钠反应的化学方程式。 2、比较乙醇与水中羟基上的H的活泼性强弱。2 H-O-H+2Na = 2NaOH + H2↑2 2 2乙醇2019/1/6巴东县第三高级中学24乙醇2019/1/6巴东县第三高级中学254. 乙醇的化学性质1)与金属钠反应(取代反应)2CH3CH2OH+2Na→2CH3CH2ONa+H2↑乙醇2019/1/6巴东县第三高级中学262)消去反应脱去—OH和与—OH相邻的碳原子上的1个H断键位置:浓硫酸的作用:催化剂和脱水剂实验3-1 P51乙醇2019/1/6巴东县第三高级中学27乙醇2019/1/6巴东县第三高级中学28制乙烯实验装置为何使液体温度迅速升到170℃?酒精与浓硫酸体积比为何 要为1∶3?放入几片碎瓷片作用是什么? 用排水集气法收集 浓硫酸的作用是什么?温度计的位置?混合液颜色如何变化?为什么?有何杂质气体?如何除去?乙醇2019/1/6巴东县第三高级中学291. 放入几片碎瓷片作用是什么? 防止暴沸 2. 浓硫酸的作用是什么?催化剂和脱水剂3. 酒精与浓硫酸体积比为何要为1∶3?因为浓硫酸是催化剂和脱水剂,为了保证有足够的脱水性,硫酸要用98%的浓硫酸,酒精要用无水酒精,酒精与浓硫酸体积比以1∶3为宜。4. 温度计的位置?温度计感温泡要置于反应物的中央位置因为需要测量的是反应物的温度。5. 为何使液体温度迅速升到170℃?因为无水酒精和浓硫酸混合物在170℃的温度下主要生成乙烯和水,而在140℃时乙醇将以另一种方式脱水,即分子间脱水,生成乙醚。乙醇2019/1/6巴东县第三高级中学30题外话:分子间脱水2CH3CH2-OH CH3CH2-O-CH2CH3+H2O140℃浓H2SO4乙醇2019/1/6巴东县第三高级中学316. 混合液颜色如何变化?为什么?烧瓶中的液体逐渐变黑。因为浓硫酸有多种特性。在加热的条件下,无水酒精和浓硫酸混合物的反应除可生成乙烯等物质以外,浓硫酸还能将无水酒精氧化生成碳的单质等多种物质,碳的单质使烧瓶内的液体带上了黑色。7. 有何杂质气体?如何除去?由于无水酒精和浓硫酸发生的氧化还原反应,反应制得的乙烯中往往混有H2O、CO2、SO2等气体。可将气体通过碱石灰。8. 为何可用排水集气法收集?因为乙烯难溶于水,密度比空气密度略小。乙醇2019/1/6巴东县第三高级中学32开拓思考:CH3CH3
结论:醇能发生消去反应的条件:
与-OH相连的碳原子相邻的碳原子有氢原子。乙醇2019/1/6巴东县第三高级中学33学与问 P50CH3CH2OHCH3CH2Br反应条件化学键的断裂化学键的生成反应产物NaOH、乙醇溶液、加热C—Br、C—HC—O、C—HC==CC==CCH2==CH2、HBrCH2==CH2、H2O浓硫酸、加热到170℃ 乙醇2019/1/6巴东县第三高级中学343)取代反应4)氧化反应 有机物分子中加入氧原子或失去氢原子的反应叫做氧化反应。条件::Cu或Ag作催化剂同时加热乙醇2019/1/6巴东县第三高级中学35乙醇2019/1/6巴东县第三高级中学36有机物的氧化反应、还原反应的含义:氧化反应:有机物分子中失去氢原子或加
入氧原子的反应(失H或加O)还原反应:有机物分子中加入氢原子或失去
氧原子的反应(加H或失O)资料卡片:P52 有机物的氧化、还原反应乙醇2019/1/6巴东县第三高级中学37
CH3-C-OH、 CH3CH2CH2OH、
CH3-CH-OH、都属于与乙醇同类的烃的衍生物,它们能否发生象乙醇那样的催化氧化反应?如能,得到什么产物?
拓展思考:CH3CH3CH3结论:羟基碳上有2个氢原子的醇被催化氧化成醛。
羟基碳上有1个氢原子的醇被催化氧化成酮。
羟基碳上没有氢原子的醇不能被催化氧化。乙醇强氧化剂氧化 实验3-2乙醇可被酸性高锰酸钾溶液或重铬酸钾酸性溶液氧化生成乙酸。氧化过程可分为两步:2019/1/6巴东县第三高级中学38乙醇2019/1/6巴东县第三高级中学39饮美酒可以去天堂酒后驾车导致车祸不断一念之间,想喝吗?乙醇2019/1/6巴东县第三高级中学40分子间脱水与HX反应②④②①③①②与金属反应消去反应催化氧化小结①乙醇2019/1/6巴东县第三高级中学41CH3CH2-OHCH3CHOCH3COOH[O][O]CH3CH2-ONaCH3CH2-BrCH2=CH2CH3CH2-O-CH2CH3乙醇的化学性质小结NaH2OHBrNaOH水溶液浓H2SO4
170℃浓H2SO4
140℃乙醇2019/1/6巴东县第三高级中学42 练习与实践:
1. 登录互联网,查阅乙醇的有关用途。
2. 家庭小实验:制作酒酿
将糯米洗净,在锅中蒸熟,冷却至 300C左右,加入研碎的酒曲,充分混合均匀,保温在300C左右的环境中,放置3天3夜即可制成酒酿。乙醇2019/1/6巴东县第三高级中学431、下列物质属于醇类且能发生
消去反应的是
A.CH3OH
B.C6H5—CH2OH
C.CH3CHOHCH3
D.HO—C6H4—CH3(C)课堂练习乙醇2019/1/6巴东县第三高级中学442、下列各醇,能发生催化氧化的是( ) CH3—C—CH2OH
CH3CH3 CH3
∣
B. CH3—C—OH
∣
CH3C.CH3—CH—CH3
∣
OH CH3
∣
D.C6H5—C—CH3
∣
OHA.AC乙醇2019/1/6巴东县第三高级中学45Thanks
谢谢您的观看!
唯有——明月几时有把
问青天杜康酒乙醇教学目标:2019/1/64 1.掌握乙醇的主要化学性质
2.掌握乙醇 的工业制法和用途
3.了解醇的分类和命名
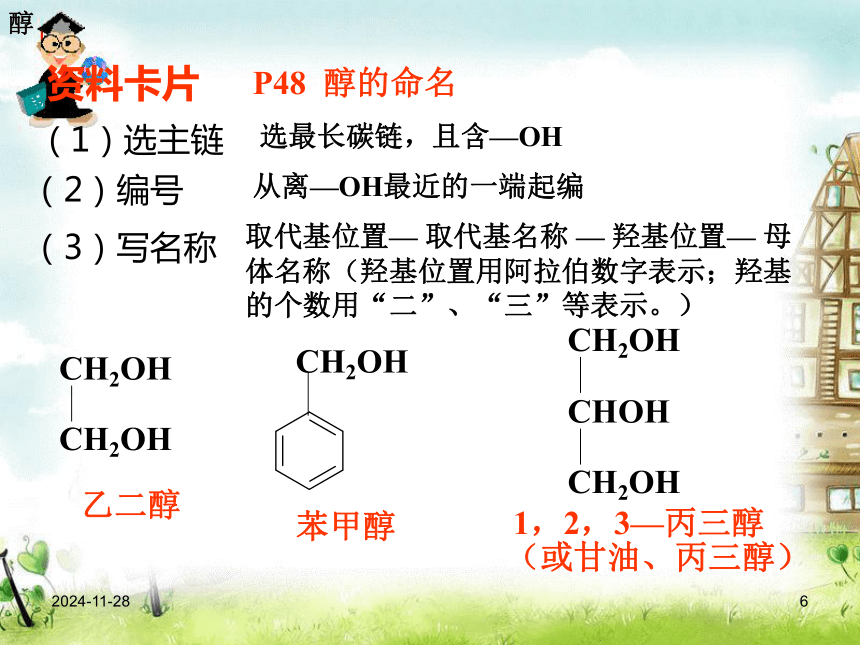
4.了解醇类的一般通性和典型醇的用途 教学重点: 乙醇的化学性质乙醇2019/1/65 烃分子中的氢原子可以被羟基(—OH)取代而衍生出含羟基化合物。 羟基与烃基或苯环侧链上的碳原子相连的化合物称为醇;羟基与苯环直接相连而形成的化合物称为酚。CH3CH2OH乙醇2—丙醇苯酚邻甲基苯酚醇2019/1/66P48 醇的命名(2)编号(1)选主链(3)写名称选最长碳链,且含—OH从离—OH最近的一端起编取代基位置— 取代基名称 — 羟基位置— 母体名称(羟基位置用阿拉伯数字表示;羟基的个数用“二”、“三”等表示。)资料卡片苯甲醇乙二醇1,2,3—丙三醇(或甘油、丙三醇)醇2019/1/67②③[练习]写出下列醇的名称①2—甲基—1—丙醇2—丁醇2,3—二甲基—3—戊醇醇2019/1/68醇的同分异构体醇类的同分异构体可有:
(1)碳链异构、
(2)羟基的位置异构,
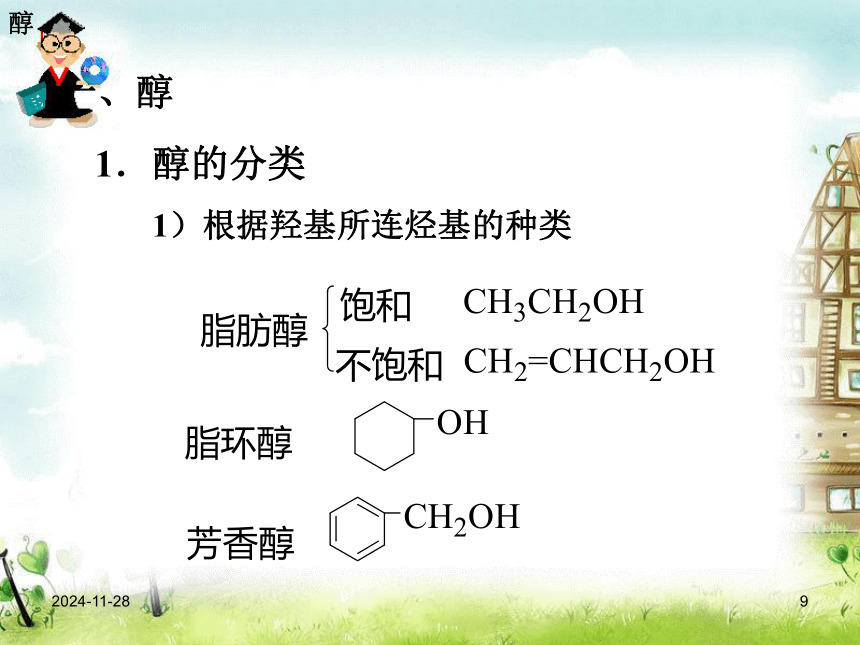
(3)相同碳原子数的饱和一元醇和醚是官能团异构练习:写出C4H10O的所有同分异构体醇2019/1/69一、醇1.醇的分类1)根据羟基所连烃基的种类 醇2019/1/6102) 根据醇分子结构中羟基的数目,醇可分为一元醇、二元醇、三元醇…… 乙二醇和丙三醇都是无色、黏稠、有甜味的液体,都易溶于水和乙醇,是重要的化工原料。饱和一元醇通式:CnH2n+1OH或CnH2n+2O 乙二醇可用于汽车作防冻剂,丙三醇可用于配制化妆品。醇2019/1/611P49 思考与交流对比表格中的数据,你能得出什么结论?醇2019/1/6巴东县第三高级中学12醇的沸点远高于烷烃。结论:相对分子质量相近的醇和烷烃,醇的沸点远远高于烷烃醇●●●●●●醇烷why2019/1/6巴东县第三高级中学13原因:由于醇分子中羟基的氧原子与另一醇分子羟基的氢原子间存在着相互吸引作用,这种吸引作用叫氢键。(分子间形成了氢键)醇P49学与问:你能得出什么结论?2019/1/6巴东县第三高级中学14表3-2图●●●●●乙n醇丙n醇醇羟基越多沸点越高。氢键数目增多醇2019/1/6巴东县第三高级中学15 甲醇、乙醇、丙醇均可与水以任意比例混溶,这是因为甲醇、乙醇、丙醇与水形成了氢键。随碳原子的数目增多,醇的溶解性减小(原因) 乙二醇的沸点高于乙醇,1,2,3—丙三醇的沸点高于1,2—丙二醇, 1,2—丙二醇的沸点高于1—丙醇,其原因是:由于羟基数目增多,使得分子间形成的氢键增多增强,熔沸点升高。 醇2019/1/6巴东县第三高级中学16 乙二醇和丙三醇都是无色、黏稠、有甜味的液体,都易溶于水和乙醇,是重要的化工原料。饱和一元醇通式:CnH2n+1OH或CnH2n+2O 乙二醇可用于汽车作防冻剂,丙三醇可用于配制化妆品。 常见醇:醇2019/1/6巴东县第三高级中学172. 乙醇的结构 从乙烷分子中的1个H原子被—OH(羟基)取代衍变成乙醇乙醇2019/1/6巴东县第三高级中学183. 乙醇的物理性质1)无色、透明、有特殊香味的液体;
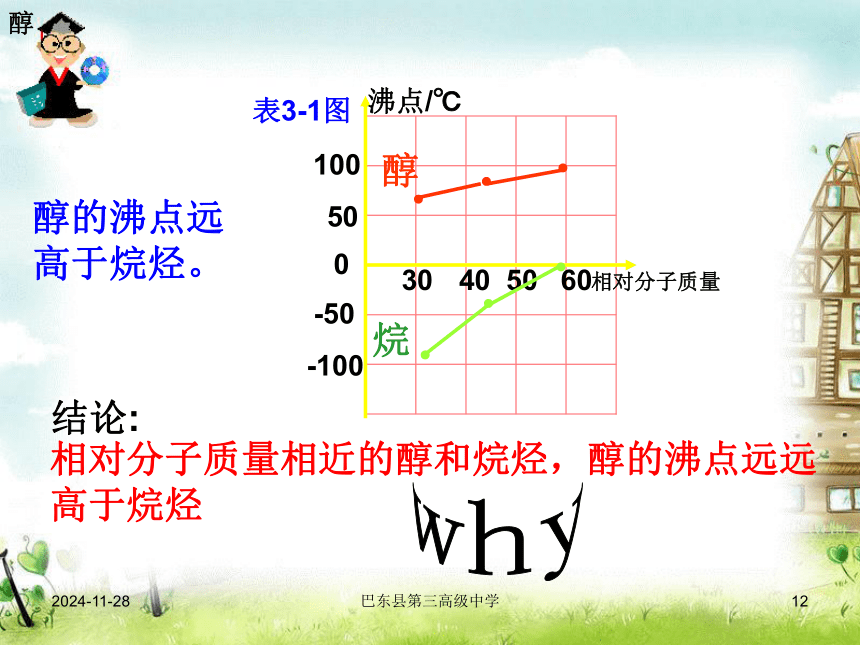
2)沸点78℃;
3)易挥发;
4)密度比水小;
5)能跟水以任意比互溶;
6)能溶解多种无机物和有机物。4. 乙醇的化学性质1)与金属钠反应(取代反应)2CH3CH2OH+2Na→2CH3CH2ONa+H2↑乙醇2019/1/6巴东县第三高级中学19思考与交流 处理反应釜中金属钠的最安全、合理的方法是第(3)种方案,向反应釜中慢慢加入乙醇,由于乙醇与金属钠的反应比水与钠的反应缓和,热效应小,因此是比较安全,可行的处理方法。 哪一个建议处理反应釜中金属钠的更合理、更安全?
建议(1):打开反应釜,用工具将反应釜内的金属钠
取出来;
建议(2):向反应釜内加水,通过化学反应“除掉”金
属钠;
建议(3):采用远程滴加乙醇的方法向反应釜内加入
乙醇,并设置放气管,排放乙醇与金属钠
反应产生的氢气和热量。乙醇2019/1/6巴东县第三高级中学20乙醇的分子式结构式及比例模型乙醇2019/1/6巴东县第三高级中学21实验探究:观察钠的保存方法,回忆钠与水的反应,并向1~2mL无水乙醇中投入一小粒金属钠(注意钠的使用安全),观察实验现象。乙醇2019/1/6巴东县第三高级中学22钠与水钠与乙醇钠是否浮在液面上浮在水面沉在液面下钠的形状是否变化熔成小球仍是块状有无声音发出嘶嘶响声没有声音有无气泡放出气泡放出气泡剧烈程度剧烈缓慢化学方程式2Na+2H2O=
2 NaOH +H2↑乙醇2019/1/6巴东县第三高级中学23思考与交流 1、根据水与钠反应的方程式,试写出乙醇跟金属钠反应的化学方程式。 2、比较乙醇与水中羟基上的H的活泼性强弱。2 H-O-H+2Na = 2NaOH + H2↑2 2 2乙醇2019/1/6巴东县第三高级中学24乙醇2019/1/6巴东县第三高级中学254. 乙醇的化学性质1)与金属钠反应(取代反应)2CH3CH2OH+2Na→2CH3CH2ONa+H2↑乙醇2019/1/6巴东县第三高级中学262)消去反应脱去—OH和与—OH相邻的碳原子上的1个H断键位置:浓硫酸的作用:催化剂和脱水剂实验3-1 P51乙醇2019/1/6巴东县第三高级中学27乙醇2019/1/6巴东县第三高级中学28制乙烯实验装置为何使液体温度迅速升到170℃?酒精与浓硫酸体积比为何 要为1∶3?放入几片碎瓷片作用是什么? 用排水集气法收集 浓硫酸的作用是什么?温度计的位置?混合液颜色如何变化?为什么?有何杂质气体?如何除去?乙醇2019/1/6巴东县第三高级中学291. 放入几片碎瓷片作用是什么? 防止暴沸 2. 浓硫酸的作用是什么?催化剂和脱水剂3. 酒精与浓硫酸体积比为何要为1∶3?因为浓硫酸是催化剂和脱水剂,为了保证有足够的脱水性,硫酸要用98%的浓硫酸,酒精要用无水酒精,酒精与浓硫酸体积比以1∶3为宜。4. 温度计的位置?温度计感温泡要置于反应物的中央位置因为需要测量的是反应物的温度。5. 为何使液体温度迅速升到170℃?因为无水酒精和浓硫酸混合物在170℃的温度下主要生成乙烯和水,而在140℃时乙醇将以另一种方式脱水,即分子间脱水,生成乙醚。乙醇2019/1/6巴东县第三高级中学30题外话:分子间脱水2CH3CH2-OH CH3CH2-O-CH2CH3+H2O140℃浓H2SO4乙醇2019/1/6巴东县第三高级中学316. 混合液颜色如何变化?为什么?烧瓶中的液体逐渐变黑。因为浓硫酸有多种特性。在加热的条件下,无水酒精和浓硫酸混合物的反应除可生成乙烯等物质以外,浓硫酸还能将无水酒精氧化生成碳的单质等多种物质,碳的单质使烧瓶内的液体带上了黑色。7. 有何杂质气体?如何除去?由于无水酒精和浓硫酸发生的氧化还原反应,反应制得的乙烯中往往混有H2O、CO2、SO2等气体。可将气体通过碱石灰。8. 为何可用排水集气法收集?因为乙烯难溶于水,密度比空气密度略小。乙醇2019/1/6巴东县第三高级中学32开拓思考:CH3CH3
结论:醇能发生消去反应的条件:
与-OH相连的碳原子相邻的碳原子有氢原子。乙醇2019/1/6巴东县第三高级中学33学与问 P50CH3CH2OHCH3CH2Br反应条件化学键的断裂化学键的生成反应产物NaOH、乙醇溶液、加热C—Br、C—HC—O、C—HC==CC==CCH2==CH2、HBrCH2==CH2、H2O浓硫酸、加热到170℃ 乙醇2019/1/6巴东县第三高级中学343)取代反应4)氧化反应 有机物分子中加入氧原子或失去氢原子的反应叫做氧化反应。条件::Cu或Ag作催化剂同时加热乙醇2019/1/6巴东县第三高级中学35乙醇2019/1/6巴东县第三高级中学36有机物的氧化反应、还原反应的含义:氧化反应:有机物分子中失去氢原子或加
入氧原子的反应(失H或加O)还原反应:有机物分子中加入氢原子或失去
氧原子的反应(加H或失O)资料卡片:P52 有机物的氧化、还原反应乙醇2019/1/6巴东县第三高级中学37
CH3-C-OH、 CH3CH2CH2OH、
CH3-CH-OH、都属于与乙醇同类的烃的衍生物,它们能否发生象乙醇那样的催化氧化反应?如能,得到什么产物?
拓展思考:CH3CH3CH3结论:羟基碳上有2个氢原子的醇被催化氧化成醛。
羟基碳上有1个氢原子的醇被催化氧化成酮。
羟基碳上没有氢原子的醇不能被催化氧化。乙醇强氧化剂氧化 实验3-2乙醇可被酸性高锰酸钾溶液或重铬酸钾酸性溶液氧化生成乙酸。氧化过程可分为两步:2019/1/6巴东县第三高级中学38乙醇2019/1/6巴东县第三高级中学39饮美酒可以去天堂酒后驾车导致车祸不断一念之间,想喝吗?乙醇2019/1/6巴东县第三高级中学40分子间脱水与HX反应②④②①③①②与金属反应消去反应催化氧化小结①乙醇2019/1/6巴东县第三高级中学41CH3CH2-OHCH3CHOCH3COOH[O][O]CH3CH2-ONaCH3CH2-BrCH2=CH2CH3CH2-O-CH2CH3乙醇的化学性质小结NaH2OHBrNaOH水溶液浓H2SO4
170℃浓H2SO4
140℃乙醇2019/1/6巴东县第三高级中学42 练习与实践:
1. 登录互联网,查阅乙醇的有关用途。
2. 家庭小实验:制作酒酿
将糯米洗净,在锅中蒸熟,冷却至 300C左右,加入研碎的酒曲,充分混合均匀,保温在300C左右的环境中,放置3天3夜即可制成酒酿。乙醇2019/1/6巴东县第三高级中学431、下列物质属于醇类且能发生
消去反应的是
A.CH3OH
B.C6H5—CH2OH
C.CH3CHOHCH3
D.HO—C6H4—CH3(C)课堂练习乙醇2019/1/6巴东县第三高级中学442、下列各醇,能发生催化氧化的是( ) CH3—C—CH2OH
CH3CH3 CH3
∣
B. CH3—C—OH
∣
CH3C.CH3—CH—CH3
∣
OH CH3
∣
D.C6H5—C—CH3
∣
OHA.AC乙醇2019/1/6巴东县第三高级中学45Thanks
谢谢您的观看!
