化学人教版(2019)选择性必修1 1.2.反应热的计算(共22张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 1.2.反应热的计算(共22张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 851.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-17 17:38:18 | ||
图片预览






文档简介
(共22张PPT)
第二节 反应热的计算
【学习目标】
1.理解盖斯定律的意义。
2.能用盖斯定律和热化学方程式进行有关反应热的简单计算。
问题:目前我们学过哪些方法可以确定一个反应的反应热?
①用量热计直接测量
②ΔH = E(生成物内能之和)— E(反应物内能之和)
③ΔH = E(反应物的键能总和)- E(生成物键能总和)
或者:ΔH = E(吸)- E(放)
如,中和反应的反应热测定
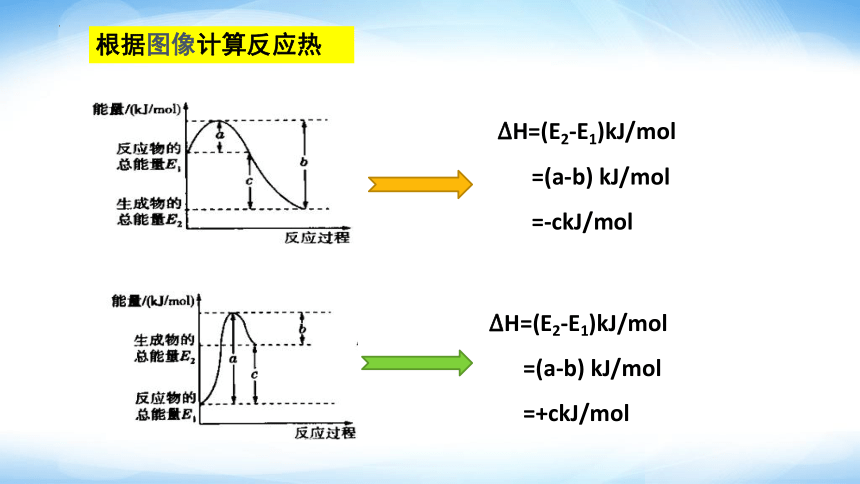
H=(E2-E1)kJ/mol
=(a-b) kJ/mol
=-ckJ/mol
H=(E2-E1)kJ/mol
=(a-b) kJ/mol
=+ckJ/mol
根据图像计算反应热
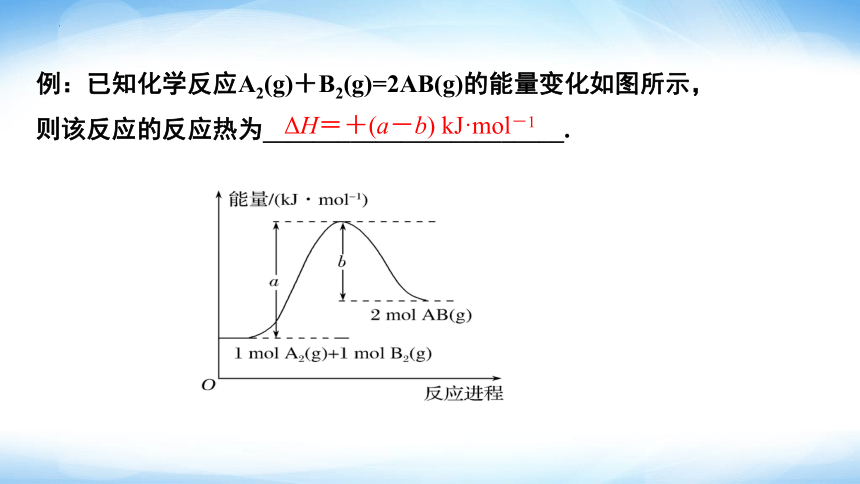
例:已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,则该反应的反应热为________________________.
ΔH=+(a-b) kJ·mol-1
④还可以利用“盖斯定律”进行计算
什么是“盖斯定律”?
请同学们看到课本P13
问题:目前我们学过哪些方法可以确定一个反应的反应热?
①用量热计直接测量
②ΔH = E(生成物内能之和)— E(反应物内能之和)
③ΔH = E(反应物的键能总和)- E(生成物键能总和)
或者:ΔH = E(吸)- E(放)
如,中和反应的反应热测定
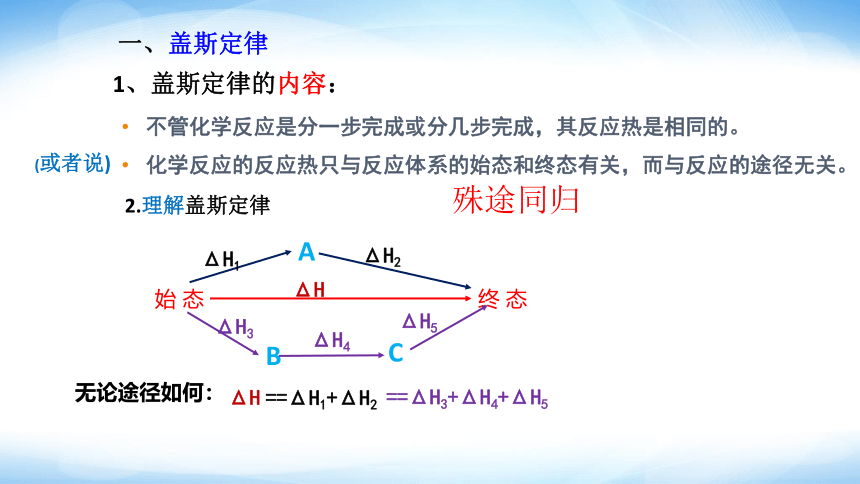
不管化学反应是分一步完成或分几步完成,其反应热是相同的。
一、盖斯定律
化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
1、盖斯定律的内容:
(或者说)
2.理解盖斯定律
始 态
终 态
A
B
C
ΔH
ΔH1
ΔH2
ΔH3
ΔH4
ΔH5
无论途径如何:
ΔH
==ΔH1+ΔH2
==ΔH3+ΔH4+ΔH5
殊途同归
3、盖斯定律在科学研究中的重要意义:
有些反应进行得很慢;
有些反应不容易直接发生;
有些反应的产品不纯(有副反应发生)。
这些都给测量反应热造成了困难,利用盖斯定律可以间接地把它们的反应热计算出来
例1:已知:①C(s)+O2(g)= CO2(g) △H1=-393.5kJ/mol
②CO(g)+ O2(g)= CO2(g) △H2=-283.0kJ/mol
求:C(s)+ O2(g)= CO (g) 的反应热△H3
CO(g)
C(s)
CO2(g)
H2
H1
H3
C(s)+ O2(g)==CO(g) △H3=?
CO(g)+ O2(g)==CO2(g) △H2=-283.0 kJ/mol
+)
由盖斯定律:△H3 + △H2 = △H1
∴△H3 = △H1 - △H2 = -110.5 kJ/mol
==ΔH1+ΔH2
ΔH1
C(s)+O2(g)==CO2(g) ) △H1=-393.5kJ/mol
例2、已知
① CO(g) + 1/2 O2(g) ====CO2(g) ΔH1= —283.0 kJ/mol
② H2(g) + 1/2 O2(g) ====H2O(l) ΔH2= —285.8 kJ/mol
③ C2H5OH(l) + 3 O2(g) ==== 2 CO2(g) + 3 H2O(l) ΔH3= —1370 kJ/mol
试计算 ④ 2CO(g)+ 4 H2(g)==== H2O(l) + C2H5OH(l) 的 ΔH
【解】:据盖斯定律,反应④不论是一步完成还是分几步完成,其反应热都是相同的。
=-283.2×2 -285.8×4 +1370 =-339.2 kJ/mol
下面就看看反应④能不能由①②③三个反应通过加、减、乘、除组合而成
①×2 + ②×4 - ③ = ④
∴ ΔH=ΔH1×2 +ΔH2×4 -ΔH3
注意: ΔH要带正负号进行计算
也就是说,看看反应④能不能分成①②③几步完成。
① ×2
② ×4
— ③
2 1 2
4 2 4
①求总反应的反应热,不能不假思索地将各步反应的反应热简单相加。
②不论一步进行还是分步进行,始态和终态完全一致,盖斯定律才成立。
③某些物质只是在分步反应中暂时出现,最后应该恰好消耗完。
归纳: 计算注意事项
归纳: 解题步骤
①确定待求的反应方程式;
②找出待求方程式中各物质出现在已知方程式的什么位置;
③根据待求方程式中各物质计量数和位置的需要,对已知方程式进行处理,或调整计量数,或调整反应方向;
④实施叠加并检验上述分析的正确与否。
关 键:
通过加、减、乘、除“四则运算式”导出目标方程式
解析:由①- ②得:
C(石墨,s) = C(金刚石,s) △H=+1.5kJ/mol
例1:已知: 25℃,101kPa时①C(石墨,s)+O2(g)==CO2(g) △H1=-393.5kJ/mol
②C(金刚石,s)+O2(g)==CO2(g) △H2=-395.0kJ/mol
写出石墨变成金刚石的热化学方程式 。
石墨能直接变成金刚石吗?
问:1、此反应说明石墨和金刚石,谁更稳定?
石墨
2、同素异形体间的热化学方程式与普通热化学方程式有什么区别?
不仅要注明物质的聚集状态,还要注明同素异形体的名称。
①P4(s、白磷)+5O2(g)=P4O10(s) △H1= -2983.2 kJ/mol
② P(s、红磷)+5/4O2(g)=1/4P4O10(s) △H2= -738.5 kJ/mol
试写出白磷转化为红磷的热化学方程式
_________________________________
P4(s、白磷)=4 P(s、红磷) △H= -29.2 kJ/mol
例2,已知:
你知道神十的火箭燃料是什么吗?
例3:神十发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。
N2(g)+2O2(g)==2NO2(g) △H1=+67.2kJ/mol
N2H4(g)+O2(g)==N2(g)+2H2O(l) △H2=-534kJ/mol
假如都在相同状态下,请写出发射火箭反应的热化学方程式。
解:依题意可知,发射火箭燃料发生如下反应
2 N2H4(g)+ 2NO2(g)== 3N2(g)+4H2O(l) △H=
即△H = 2△H2—△H1 = - 1135.2kJ/mol
(1)
(2)
(3)
依题意可知:(3) = (2) x 2 - (1)
得:2 N2H4(g)+ 2NO2(g)== 3N2(g)+4H2O(l) △H=-1135.2kJ/mol
已知:
1. 下列关于盖斯定律描述不正确的是( )
A.化学反应的反应热不仅与反应体系的始态和终态有关,也与反应的途径有关
B.盖斯定律遵守能量守恒定律
C.利用盖斯定律可间接计算通过实验难测定的反应的反应热
D.利用盖斯定律可以计算有副反应发生的反应的反应热
A
【随堂练习】
2.已知: H2(g)+1/2O2(g) = H2O (g) △H1=-241.8kJ/mol
H2O(g) = H2O (l) △H2=-44 kJ/mol
则:H2(g)+1/2O2(g) = H2O (l) △H= .
3.已知胆矾溶于水时溶液温度降低,胆矾分解的热化学方程式为:
CuSO4 5H2O(s) = CuSO4(s)+5H2O(l) △H=+Q1kJ/mol
室温下,若将1mol无水硫酸铜溶解为溶液时放热Q2kJ,则( )
A.Q1>Q2 B.Q1=Q2 C.Q1①
②
③
③ ==① + ②
-285.8kJ/mol
胆矾溶于水时是吸热过程,它包括以下步骤:
① CuSO4 5H2O(s) = CuSO4(s)+5H2O(l) △H=+Q1kJ/mol
② CuSO4(s)== Cu2+(aq) + SO42—(aq) △H= —Q2kJ/mol
吸热大于放热
A
【随堂练习】
4.已知 1mol白磷转化为红磷时放出 18.39 kJ的热量。在下列两个反应中:
4P(白、s)+ 5O2(g)=2P2O5(s);ΔH = - a kJ/mol(a > 0)
4P(红、s)+ 5O2(g)=2P2O5(s);ΔH = - b kJ/mol(b> 0),
a 和 b 的关系为 ( )
A .a < b B.a = b C.a > b D .无法确定
C
【练习】
5、一定条件下,充分燃烧一定量的丁烷放出热量为QkJ(Q>0),经测定完全吸收生成的CO2需消耗 5mol·L-1的KOH溶液100ml,恰好生成正盐,则此条件下反应:
C4H10(g)+13/2O2(g)== 4 CO2(g)+ 5H2O(g)的△H为 ( )
A.+8Q kJ B.+16Q kJ C.-8Q kJ D.-16Q kJ
CO2 + 2 KOH = K2CO3 + H2O
0.5mol
QkJ
0.25mol
C4H10(g)+13/2O2(g)==4CO2(g)+ 5H2O(g) △H== -16QkJ/mol
D
即:一定量的丁烷充分燃烧生成1molCO2放出热量为4QkJ
6、以NA代表阿伏加德罗常数,则关于热化学方程式:
C2H2(g)+5/2 O2=2CO2(g)+H2O(l);△H =-1300kJ/mol的说法中,正确的是( )
A.有10NA个电子转移时,该反应放出1300kJ的能量
B.有NA个水分子生成且为液体时,吸收1300kJ的能量
C.有2NA个碳氧共用电子对生成时,放出1300kJ的能量
D.有8NA个碳氧共用电子对生成时,放出1300kJ的能量
AD
7、已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H1 ,
2H2(g)+O2(g)=2H2O(g) △H2, 2H2(g)+O2(g)=2H2O(l) △H3。
常温下取体积比为4:1的甲烷和氢气的混合气体11.2L(已折合成标准状况),经完全燃烧后恢复至常温,则放出热量为( )
A.0.4△H1+ 0.05△H3 B. 0.4△H1 + 0.05△H2
C.0.4△H1 + 0.1△H3 D. 0.4△H1 + 0.2△H3 ]
A
8、磷在氧气中燃烧,可能生成两种固态氧化物P2O3和P2O5。3.1g单质磷(P)在3.2g O2中燃烧,至反应物耗尽,并放出X kJ热量。
(1)通过计算确定反应产物的组成及其相应的物质的量(用化学式表示)____。
0.025molP2O3、0.025mol P2O5
8、磷在氧气中燃烧,可能生成两种固态氧化物P2O3和P2O5。3.1g单质磷(P)在3.2g O2中燃烧,至反应物耗尽,并放出X kJ热量。
(1)通过计算确定反应产物的组成及其相应的物质的量(用化学式表示)____。
(2)已知单质磷的燃烧热为Y kJ·mol-1 ,则1 mol P与O2反应生成P2O3的反应热________。
P(s)+3/4O2(g) =1/2P2O3(g) △H1= - (20X—Y) KJ·mol—1
0.025molP2O3、0.025mol P2O5
第二节 反应热的计算
【学习目标】
1.理解盖斯定律的意义。
2.能用盖斯定律和热化学方程式进行有关反应热的简单计算。
问题:目前我们学过哪些方法可以确定一个反应的反应热?
①用量热计直接测量
②ΔH = E(生成物内能之和)— E(反应物内能之和)
③ΔH = E(反应物的键能总和)- E(生成物键能总和)
或者:ΔH = E(吸)- E(放)
如,中和反应的反应热测定
H=(E2-E1)kJ/mol
=(a-b) kJ/mol
=-ckJ/mol
H=(E2-E1)kJ/mol
=(a-b) kJ/mol
=+ckJ/mol
根据图像计算反应热
例:已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,则该反应的反应热为________________________.
ΔH=+(a-b) kJ·mol-1
④还可以利用“盖斯定律”进行计算
什么是“盖斯定律”?
请同学们看到课本P13
问题:目前我们学过哪些方法可以确定一个反应的反应热?
①用量热计直接测量
②ΔH = E(生成物内能之和)— E(反应物内能之和)
③ΔH = E(反应物的键能总和)- E(生成物键能总和)
或者:ΔH = E(吸)- E(放)
如,中和反应的反应热测定
不管化学反应是分一步完成或分几步完成,其反应热是相同的。
一、盖斯定律
化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
1、盖斯定律的内容:
(或者说)
2.理解盖斯定律
始 态
终 态
A
B
C
ΔH
ΔH1
ΔH2
ΔH3
ΔH4
ΔH5
无论途径如何:
ΔH
==ΔH1+ΔH2
==ΔH3+ΔH4+ΔH5
殊途同归
3、盖斯定律在科学研究中的重要意义:
有些反应进行得很慢;
有些反应不容易直接发生;
有些反应的产品不纯(有副反应发生)。
这些都给测量反应热造成了困难,利用盖斯定律可以间接地把它们的反应热计算出来
例1:已知:①C(s)+O2(g)= CO2(g) △H1=-393.5kJ/mol
②CO(g)+ O2(g)= CO2(g) △H2=-283.0kJ/mol
求:C(s)+ O2(g)= CO (g) 的反应热△H3
CO(g)
C(s)
CO2(g)
H2
H1
H3
C(s)+ O2(g)==CO(g) △H3=?
CO(g)+ O2(g)==CO2(g) △H2=-283.0 kJ/mol
+)
由盖斯定律:△H3 + △H2 = △H1
∴△H3 = △H1 - △H2 = -110.5 kJ/mol
==ΔH1+ΔH2
ΔH1
C(s)+O2(g)==CO2(g) ) △H1=-393.5kJ/mol
例2、已知
① CO(g) + 1/2 O2(g) ====CO2(g) ΔH1= —283.0 kJ/mol
② H2(g) + 1/2 O2(g) ====H2O(l) ΔH2= —285.8 kJ/mol
③ C2H5OH(l) + 3 O2(g) ==== 2 CO2(g) + 3 H2O(l) ΔH3= —1370 kJ/mol
试计算 ④ 2CO(g)+ 4 H2(g)==== H2O(l) + C2H5OH(l) 的 ΔH
【解】:据盖斯定律,反应④不论是一步完成还是分几步完成,其反应热都是相同的。
=-283.2×2 -285.8×4 +1370 =-339.2 kJ/mol
下面就看看反应④能不能由①②③三个反应通过加、减、乘、除组合而成
①×2 + ②×4 - ③ = ④
∴ ΔH=ΔH1×2 +ΔH2×4 -ΔH3
注意: ΔH要带正负号进行计算
也就是说,看看反应④能不能分成①②③几步完成。
① ×2
② ×4
— ③
2 1 2
4 2 4
①求总反应的反应热,不能不假思索地将各步反应的反应热简单相加。
②不论一步进行还是分步进行,始态和终态完全一致,盖斯定律才成立。
③某些物质只是在分步反应中暂时出现,最后应该恰好消耗完。
归纳: 计算注意事项
归纳: 解题步骤
①确定待求的反应方程式;
②找出待求方程式中各物质出现在已知方程式的什么位置;
③根据待求方程式中各物质计量数和位置的需要,对已知方程式进行处理,或调整计量数,或调整反应方向;
④实施叠加并检验上述分析的正确与否。
关 键:
通过加、减、乘、除“四则运算式”导出目标方程式
解析:由①- ②得:
C(石墨,s) = C(金刚石,s) △H=+1.5kJ/mol
例1:已知: 25℃,101kPa时①C(石墨,s)+O2(g)==CO2(g) △H1=-393.5kJ/mol
②C(金刚石,s)+O2(g)==CO2(g) △H2=-395.0kJ/mol
写出石墨变成金刚石的热化学方程式 。
石墨能直接变成金刚石吗?
问:1、此反应说明石墨和金刚石,谁更稳定?
石墨
2、同素异形体间的热化学方程式与普通热化学方程式有什么区别?
不仅要注明物质的聚集状态,还要注明同素异形体的名称。
①P4(s、白磷)+5O2(g)=P4O10(s) △H1= -2983.2 kJ/mol
② P(s、红磷)+5/4O2(g)=1/4P4O10(s) △H2= -738.5 kJ/mol
试写出白磷转化为红磷的热化学方程式
_________________________________
P4(s、白磷)=4 P(s、红磷) △H= -29.2 kJ/mol
例2,已知:
你知道神十的火箭燃料是什么吗?
例3:神十发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。
N2(g)+2O2(g)==2NO2(g) △H1=+67.2kJ/mol
N2H4(g)+O2(g)==N2(g)+2H2O(l) △H2=-534kJ/mol
假如都在相同状态下,请写出发射火箭反应的热化学方程式。
解:依题意可知,发射火箭燃料发生如下反应
2 N2H4(g)+ 2NO2(g)== 3N2(g)+4H2O(l) △H=
即△H = 2△H2—△H1 = - 1135.2kJ/mol
(1)
(2)
(3)
依题意可知:(3) = (2) x 2 - (1)
得:2 N2H4(g)+ 2NO2(g)== 3N2(g)+4H2O(l) △H=-1135.2kJ/mol
已知:
1. 下列关于盖斯定律描述不正确的是( )
A.化学反应的反应热不仅与反应体系的始态和终态有关,也与反应的途径有关
B.盖斯定律遵守能量守恒定律
C.利用盖斯定律可间接计算通过实验难测定的反应的反应热
D.利用盖斯定律可以计算有副反应发生的反应的反应热
A
【随堂练习】
2.已知: H2(g)+1/2O2(g) = H2O (g) △H1=-241.8kJ/mol
H2O(g) = H2O (l) △H2=-44 kJ/mol
则:H2(g)+1/2O2(g) = H2O (l) △H= .
3.已知胆矾溶于水时溶液温度降低,胆矾分解的热化学方程式为:
CuSO4 5H2O(s) = CuSO4(s)+5H2O(l) △H=+Q1kJ/mol
室温下,若将1mol无水硫酸铜溶解为溶液时放热Q2kJ,则( )
A.Q1>Q2 B.Q1=Q2 C.Q1
②
③
③ ==① + ②
-285.8kJ/mol
胆矾溶于水时是吸热过程,它包括以下步骤:
① CuSO4 5H2O(s) = CuSO4(s)+5H2O(l) △H=+Q1kJ/mol
② CuSO4(s)== Cu2+(aq) + SO42—(aq) △H= —Q2kJ/mol
吸热大于放热
A
【随堂练习】
4.已知 1mol白磷转化为红磷时放出 18.39 kJ的热量。在下列两个反应中:
4P(白、s)+ 5O2(g)=2P2O5(s);ΔH = - a kJ/mol(a > 0)
4P(红、s)+ 5O2(g)=2P2O5(s);ΔH = - b kJ/mol(b> 0),
a 和 b 的关系为 ( )
A .a < b B.a = b C.a > b D .无法确定
C
【练习】
5、一定条件下,充分燃烧一定量的丁烷放出热量为QkJ(Q>0),经测定完全吸收生成的CO2需消耗 5mol·L-1的KOH溶液100ml,恰好生成正盐,则此条件下反应:
C4H10(g)+13/2O2(g)== 4 CO2(g)+ 5H2O(g)的△H为 ( )
A.+8Q kJ B.+16Q kJ C.-8Q kJ D.-16Q kJ
CO2 + 2 KOH = K2CO3 + H2O
0.5mol
QkJ
0.25mol
C4H10(g)+13/2O2(g)==4CO2(g)+ 5H2O(g) △H== -16QkJ/mol
D
即:一定量的丁烷充分燃烧生成1molCO2放出热量为4QkJ
6、以NA代表阿伏加德罗常数,则关于热化学方程式:
C2H2(g)+5/2 O2=2CO2(g)+H2O(l);△H =-1300kJ/mol的说法中,正确的是( )
A.有10NA个电子转移时,该反应放出1300kJ的能量
B.有NA个水分子生成且为液体时,吸收1300kJ的能量
C.有2NA个碳氧共用电子对生成时,放出1300kJ的能量
D.有8NA个碳氧共用电子对生成时,放出1300kJ的能量
AD
7、已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H1 ,
2H2(g)+O2(g)=2H2O(g) △H2, 2H2(g)+O2(g)=2H2O(l) △H3。
常温下取体积比为4:1的甲烷和氢气的混合气体11.2L(已折合成标准状况),经完全燃烧后恢复至常温,则放出热量为( )
A.0.4△H1+ 0.05△H3 B. 0.4△H1 + 0.05△H2
C.0.4△H1 + 0.1△H3 D. 0.4△H1 + 0.2△H3 ]
A
8、磷在氧气中燃烧,可能生成两种固态氧化物P2O3和P2O5。3.1g单质磷(P)在3.2g O2中燃烧,至反应物耗尽,并放出X kJ热量。
(1)通过计算确定反应产物的组成及其相应的物质的量(用化学式表示)____。
0.025molP2O3、0.025mol P2O5
8、磷在氧气中燃烧,可能生成两种固态氧化物P2O3和P2O5。3.1g单质磷(P)在3.2g O2中燃烧,至反应物耗尽,并放出X kJ热量。
(1)通过计算确定反应产物的组成及其相应的物质的量(用化学式表示)____。
(2)已知单质磷的燃烧热为Y kJ·mol-1 ,则1 mol P与O2反应生成P2O3的反应热________。
P(s)+3/4O2(g) =1/2P2O3(g) △H1= - (20X—Y) KJ·mol—1
0.025molP2O3、0.025mol P2O5
