化学人教版(2019)选择性必修1 1.1.反应热(共39张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 1.1.反应热(共39张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-17 17:40:00 | ||
图片预览








文档简介
(共39张PPT)
第一章 化学反应的热效应
反应热
第一章 第一节
学习目标
1、能辨识化学反应中的能量转化形式,能解释化学反应中能量变化的本质。
2、知道反应热、中和热的概念及测定方法。
3、能进行反应焓变的简单计算。
有新物质生成
原子重新组合的过程
旧键的断裂和新键的形成
从物质的角度:
从微粒的角度:
从化学键的角度:
从能量的角度:
释放或贮存能量的过程
化学反应的本质:
旧知巩固
破坏1mol化学键所吸收的能量
1.内能:
2.键能:
3. 能量越 ,物质越稳定(“高”或“低”)
键能越 ,物质越稳定(“大”或“小”)
知识回顾
任何一种物质都具有一定的能量,这种能量称为内能。
低
大
(或形成1mol化学键所放出的能量)。
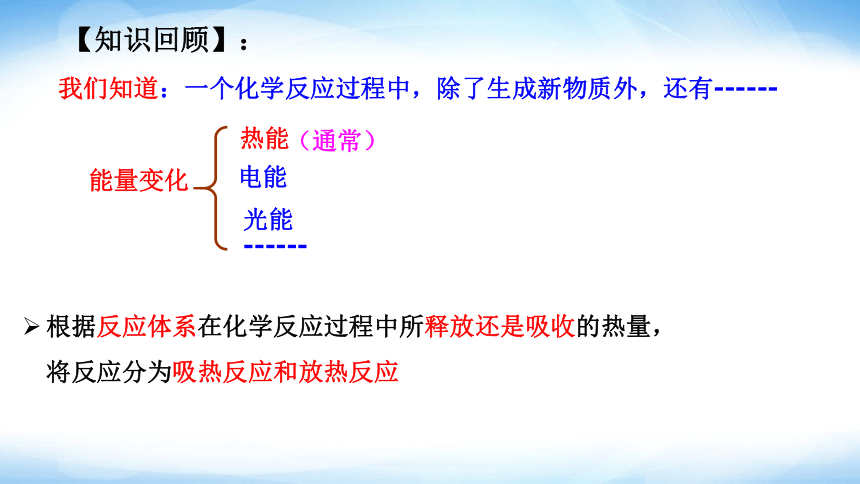
热能
电能
光能
------
我们知道:一个化学反应过程中,除了生成新物质外,还有------
能量变化
(通常)
【知识回顾】:
根据反应体系在化学反应过程中所释放还是吸收的热量,将反应分为吸热反应和放热反应
回顾
1、你所知道的化学反应中有哪些是放热反应?
2、你所知道的化学反应中有哪些是吸热反应?
回顾
燃料的燃烧 (包括物质的自燃和缓慢氧化);
中和反应 ;
金属与水、酸或碱的反应 ;
铝热反应
大多数化合反应
Ba(OH)2.8H2O + NH4Cl ;
C、H2、CO作还原剂的一些反应(需要持续加热或高温的反应);
固态铵盐与碱
碳酸氢钠与盐酸溶液的反应
大多数分解反应
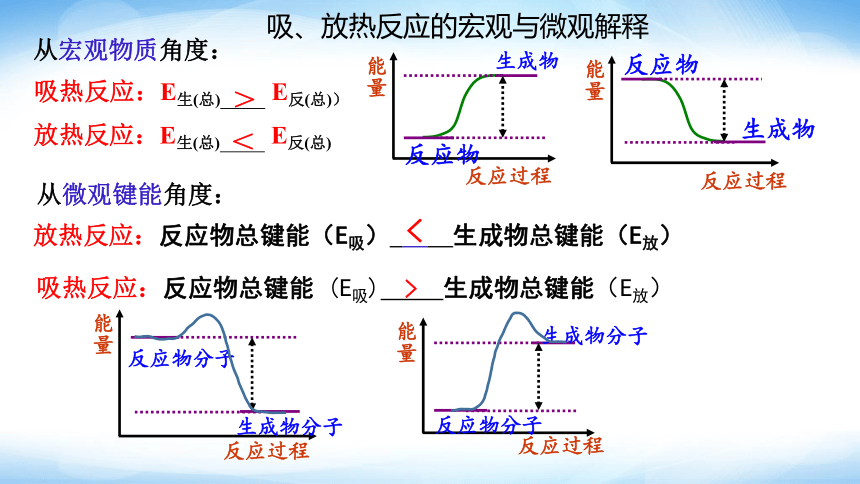
吸热反应:E生(总) E反(总))
放热反应:E生(总) E反(总)
从宏观物质角度:
从微观键能角度:
放热反应:反应物总键能(E吸) 生成物总键能(E放)
吸热反应:反应物总键能 (E吸) 生成物总键能(E放)
>
<
<
>
反应物
生成物
能量
反应过程
反应物
生成物
能量
反应过程
反应物分子
生成物分子
能量
反应过程
反应物分子
生成物分子
能量
反应过程
吸、放热反应的宏观与微观解释
利用化学反应中热量的释放或吸收有利于改善我们的生活环境,提高我们的生产效率。
即热饭盒能让我们随时吃到热的饭菜。
【思考】目前市面上的“即热饭盒”,其原理是在饭盒底部有两层,一层存放水,另一层存放镁和铁的混合物(发热包)。使用时打开隔离层,即发生以下反应:Mg+2H2O═Mg(OH)2+H2↑ 。发热包中成份的含量是否需要控制,为什么?
发热包中有效成份含量过少,放热不足,含量过多占用空间,且有安全隐患。
那么,在实际应用中,该如何控制发热包成份的含量?人们在研究化学反应的能量时,该如何定量地描述化学反应过程中释放或吸收的热量呢
反应热 焓变
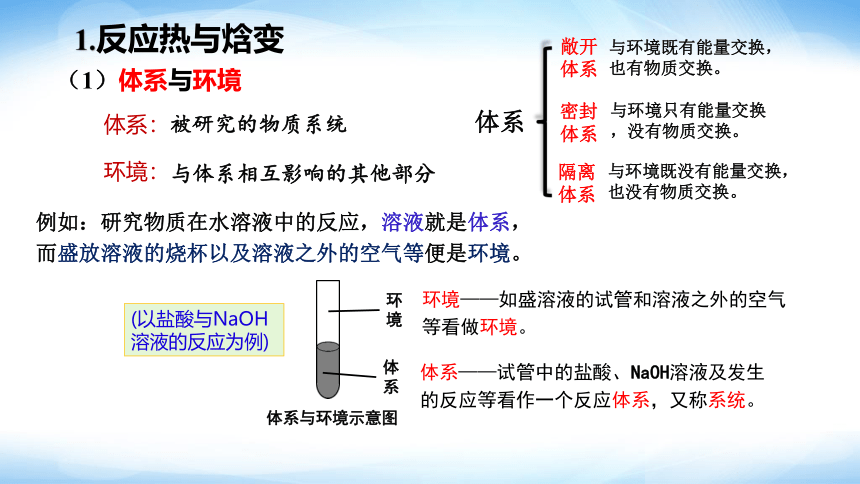
1.反应热与焓变
(1)体系与环境
被研究的物质系统
与体系相互影响的其他部分
体系:
环境:
例如:研究物质在水溶液中的反应,溶液就是体系,而盛放溶液的烧杯以及溶液之外的空气等便是环境。
体系
敞开体系
密封体系
隔离体系
与环境既有能量交换,也有物质交换。
与环境只有能量交换,没有物质交换。
与环境既没有能量交换,也没有物质交换。
(以盐酸与NaOH溶液的反应为例)
环境
体系
体系与环境示意图
环境——如盛溶液的试管和溶液之外的空气等看做环境。
体系——试管中的盐酸、NaOH溶液及发生的反应等看作一个反应体系,又称系统。
(2)体系与环境的热量交换——反应热
①热量:因温度不同而在体系与环境之间交换或传递的能量。
②反应热:在等温条件下,化学反应体系向环境释放或从环境吸收的热量,称为化学反应的热效应,简称反应热。
指化学反应发生后,使反应体系的温度恢复到反应前体系的温度,即反应前后体系的温度相等。P4
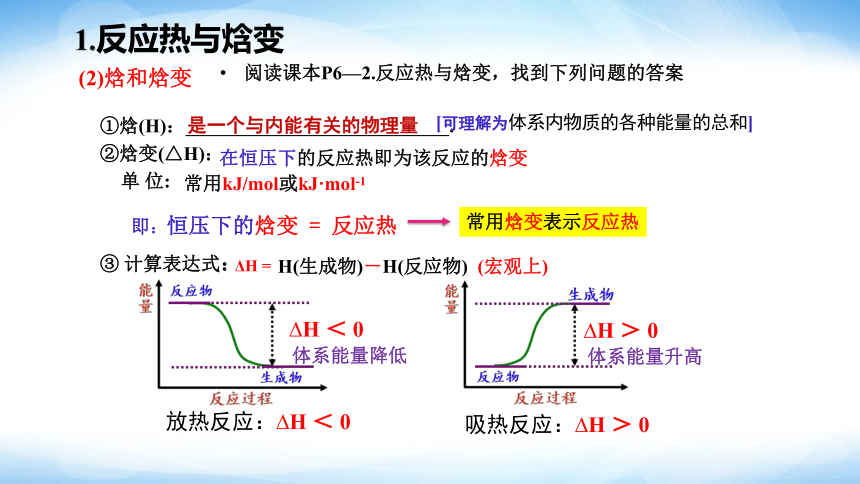
1.反应热与焓变
①焓(H): .
②焓变(△H):
单 位:
是一个与内能有关的物理量
③ 计算表达式:
ΔH =
即:恒压下的焓变 = 反应热
常用焓变表示反应热
[可理解为体系内物质的各种能量的总和]
在恒压下的反应热即为该反应的焓变
常用kJ/mol或kJ·mol-1
阅读课本P6—2.反应热与焓变,找到下列问题的答案
H(生成物)-H(反应物) (宏观上)
1.反应热与焓变
(2)焓和焓变
体系能量降低
H < 0
H > 0
体系能量升高
放热反应: H < 0
吸热反应: H > 0
旧键断裂 — 吸收能量
新键形成 — 放出能量
=
=
=679kJ/mol
=862 kJ/mol
H =
679kJ/mol - 862kJ/mol = -183kJ/mol
反应物的键能总和
生成物的键能总和
请观察P7页图1-5
ΔH =
436kJ/mol +243kJ/mol
431kJ/mol ×2
或,ΔH = E吸收-E放出
以 H2(g)+Cl2(g)===2HCl(g) 为例,从微观角度理解焓变的实质
④反应热的计算
或,ΔH = E吸收-E放出
宏观
微观
即,ΔH = E生成物-E反应物
ⅰ.Δ H=生成物的总能量-反应物的总能量
ⅱ.Δ H=反应物键能总和-生成物键能总和
生成物
反应物
生成物
反应物
1.反应热与焓变
(2)焓和焓变
小 结
①反应热:在等温条件下,化学反应体系向环境释放或从环境吸收的热量。
③恒压下的焓变 = 反应热
一、反应热 焓变
④反应热(焓变)的表示方法
——△H为
“ + ”
或 ΔH>0
放热反应
吸热反应
反应体系温度升高
反应体系温度降低
“- ”
——△H为
或 ΔH<0
⑤反应热的计算
ΔH = E吸收-E放出
宏观
微观
ΔH = E生成物-E反应物
(Δ H=反应物键能总和-生成物键能总和)
②焓:与内能有关的物理量
1. 下列说法正确的是
A. 吸热反应使环境的温度升高
B. 当反应放热时ΔH>0,反应吸热时ΔH<0
C. 当反应物的总能量大于生成物的总能量时,反应放热,ΔH<0
D. 需要加热才能发生的反应一定是吸热反应
趁热打铁
√
2. CO(g)与H2O(g)反应的能量变化如图所示,下列有关两者反应的说法正确的是
A. 该反应为吸热反应
B. 1 mol CO(g)和1 mol H2O(g)具有的总能量大于
1 mol CO2(g)和1 mol H2(g)具有的总能量
C. 该反应不需要加热就能进行
D. 1 mol CO2(g)和1 mol H2(g)反应生成1 mol CO(g)和1 mol H2O(g)要放出41 kJ热量
√
趁热打铁
3、1molC与1molH2O(g)反应生成1molCO(g)和1molH2(g),需吸收131.5kJ的热量,该反应的反应热为△H= kJ/mol。
4、拆开1mol H—H键、1mol N—H键、1mol N≡N键分别需要的能量是436kJ、391kJ、946kJ,则1molN2生成NH3的反应热为: ,1mol H2生成NH3的反应热为: 。
+131.5
-92kJ/mol
-30.67kJ/mol
△H=436×3+946×1-391×6=-92kJ/mol
△H`=-92kJ/mol×1/3 = -30.67kJ/mol
趁热打铁
(提示1: 3H2+N2 2NH3)
(提示2: H2+1/3N2 2/3NH3)
5. 已知:298K时,相关物质的相对能量如图所示,请计算下列反应的焓变△H
C2H6(g) +2CO2(g) 4CO(g) + 3H2(g)
4H2(g) + 2CO(g) C2H4(g) + 2H2O (g)
趁热打铁
H= (-110)×4 + 3×0 - [-84+2× (-393)] = +430KJ/mol
ΔH = E生成物-E反应物
H= (-242)×2 + 52 - [0+2× (-110)] = -212KJ/mol
6、已知:1mol硅晶体中含有2molSi-Si键,1molSiO2晶体中含有4molSi-O键,试计算2molSi完全燃烧时的 H= 。
化学键 Si-Si Si-O O=O N-H H-H
键能(KJ/mol) 176.0 460.0 494.0 390.8 436.0
-1988.0KJ/mol
Si + O2 == SiO2
H= 176.0×2 + 494.0 — 4×460.0== —994KJ/mol
趁热打铁
7. 某试管中盛有Al粉和稀盐酸,下列有关说法不正确的是 ( )
A、试管、Al粉、稀盐酸及发生的反应可看作一个体系
B、除反应物、生成物及相关反应外,其他均看作环境
C、Al与稀盐酸反应, 反应体系向环境中释放热量,ΔH<0
D、Al与稀盐酸反应的反应热可以通过量热计测量
A
×
√
趁热打铁
测量仪器
量热计
2.反应热及其测定
在反应前后,如果环境的温度没有变化,则反应放出的热量就会使体系的温度升高,这时可以根据测得的体系的温度变化和有关物质的比热容等来计算反应热。
哪些数据可以帮助我们测出反应热呢?我们怎样将这些数据转化为热量的变化呢?
下面我们以中和反应的反应热测定来了解反应热数据的获得。
思考与讨论
【温馨提示】Q=cm△t
Q:反应放出的热量。
C:反应混合液的比热容,为常数。
m:反应混合物液的总质量
△t:反应前后溶液温度的差值。
【实验探究】:中和反应反应热的测定
1.实验原理:
Q = mcΔt
m: 体系总质量; c: 体系比热容; Δt: 反应前后体系温差
使反应物混合均匀,充分接触
(操作:上下移动)
减少热量的散失
减少热量的散失
思考:该实验中,玻璃搅拌器换成铁制或者铜制的搅拌器行不行?
用简易量热计测量盐酸与NaOH溶液反应前后的温度Δt。
测量反应前后体系温度
反应容器
起保温作用
2.实验装置:
P5-6
不行
在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过,以达到保温、隔热、减少实验过程中热量损失的目的。该实验也可在保温杯中进行。
【简易量热计】
老教材
?
3.实验步骤:
量取50 mL 0.50 mol·L-1盐酸,倒入内筒,盖上杯盖,测温并记录;洗净温度计并擦干,备用
① 测盐酸溶液初始温度:
② 测氢氧化钠溶液初始温度:
另取一量筒,量取50 mL 0.55mol·L-1氢氧化钠,测温并记录;
③ 取两次温度的平均值记为反应前体系温度t1
(1)反应物温度的测量(t1)
(2)反应后体系温度的测量(t2)
将酸碱溶液迅速混合,用玻璃搅拌器轻轻搅动溶液,准确读取混合溶液的最高温度 ,记为t2
(3)重复以上步骤2次
【实验探究】:中和反应反应热的测定
问题一:能否更换温度计?
不能,会存在仪器误差
问题二:能否测完酸后直接测量碱的温度?
不能,残留的酸与碱反应,造成酸碱消耗,热量损失
问题三:为什么碱的浓度稍大于酸?
碱过量,保证酸完全反应
4.数据处理:P5-6
温度 实验 次数 起始温度t1/℃ 终止温度t2/℃ 温度差平均值 (t2-t1)/℃
盐酸 NaOH 平均值
温差 平均值
1 25.0 25.2 ____ 28.5 ____ ____
2 24.9 25.1 ____ 28.3 ____
3 25.6 25.4 ____ 29.0 ____
25.1
25.0
25.5
3.4
3.3
3.5
3.4
假设中和后溶液密度近似为1 g·cm-3,中和后溶液的比热容c=4.18 J·g-1·℃-1,
则根据公式和实验数据可计算出:该反应放出的热量 Q =mcΔt ≈ kJ,
1.42
则,生成 1 mol H2O时放出的热量为 kJ。
56.8
【实验探究】:中和反应反应热的测定
ΔH=
-
Q
0.025
kJ/mol
(50+50)
×4.18×10-3
×3.4
4.数据处理:
温度 实验 次数 起始温度t1/℃ 终止温度t2/℃ 温度差平均值 (t2-t1)/℃
盐酸 NaOH 平均值
温差 平均值
1 25.0 25.2 ____ 28.5 ____ ____
2 24.9 25.1 ____ 28.3 ____
3 25.6 25.4 ____ ____
25.1
25.0
25.5
3.4
3.3
【实验探究】:中和反应反应热的测定
29.8
4.3
若有数据偏差太大,
应舍弃该数据
3.35
大量实验测得,在25℃和101kPa下,强酸、强碱稀溶液发生中和反应生成1mol H2O(l)时,放出57.3kJ热量。
你知道吗
深度思考
(1)实验中为何选用的是0.55 mol·L-1NaOH溶液?
(2)若用0.55 mol·L-1 KOH溶液代替,对结果会产生影响吗?
碱过量,保证酸完全反应
无影响。因为强酸强碱的稀溶液反应生成1 mol H2O(l)时放出的热量是相同的,与用KOH溶液还是NaOH 溶液无关。
(3)酸、碱混合时,为何要把量筒中的NaOH溶液一次倒入小烧杯而不能缓缓倒入?
【提示】减少热量损失
(4)用浓硫酸代替盐酸对结果会产生什么影响?
用醋酸代替盐酸对结果会产生什么影响?
用稀硫酸和稀Ba(OH)2溶液测定,对结果会产生什么影响?
浓硫酸稀释放热,数值偏大
醋酸电离吸热,数值偏小
生成BaSO4沉淀,会多放出部分热量,数值偏大
深度思考
(4)若反应过程中有其他物质生成(沉淀、难电离物质等),这部分反应热不属于中和热。
(3)特别地,强酸、强碱的稀溶液:H+(aq)+OH- (aq)=H2O(l) △H = -57.3 kJ/mol
(1) 必须是稀溶液,如浓硫酸稀释或NaOH固体溶解时放热;
(2)以生成1mol H2O(l)为标准
记住
一般地,酸、碱浓度:C(H+)≤ 1mol/L或C(OH—)≤ 1mol/L
中和热
稀溶液中,酸与碱反应生成1mol 液态H2O(l)时释放的热量称中和热。
归纳总结
提高中和反应反应热的测定准确度的措施
①酸、碱溶液选用强酸、强碱的稀溶液;
②为保证盐酸被完全中和,碱的浓度应稍大。
①酸碱溶液混合要迅速,防止热量散失
②在测量反应混合液的温度时,记录最高温度值
(1)原理方面:
(2)操作方面:
(3)仪器方面:
①不可将温度计当搅拌器使用;玻璃搅拌器应上下移动。
②应使用玻璃搅拌器,不能用金属质搅拌器代替。
友情提示
对于定量实验,均需重复实验步骤,取2~3次实验数据的平均值
反应热测定实验中,温度数据至少要测量、记录6次(一次实验测3个数据,至少重复2次)
选用数据进行计算时,相差太大的数据应舍弃
环形玻璃搅拌棒仅在反应热测定这一实验中出现和使用
趁热打铁
1.在测定中和反应反应热的实验中,下列说法正确的是
A. 使用玻璃搅拌器是为了使反应物混合均匀,减小实验误差
B. 为了准确测定反应混合溶液的温度,实验中温度计水银球应与容器底部接触
C. 用50 mL 0.55 mol·L-1的NaOH溶液与50 mL 0.50 mol·L-1的盐酸反应,
测得的反应热数值偏大
D. 在测定中和反应反应热的实验中需要使用的仪器有天平、量筒、烧杯、滴定管、温度计
√
2、50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”
“偏小”“无影响”)。
(4)实验中改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”“不相等”),
所求中和热 (填“相等”“不相等”),
简述理由: 。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”“偏小”“无影响”)若所用NaOH溶液因吸收CO2已少量变质,则该NaOH溶液耗酸量 (填“改变”“不变”),对中和热的测定有无影响?
玻璃搅拌器
减少实验过程中的热量损失
偏小
不等
相等
因为中和热是指酸跟碱发生中和反应生成1molH2O所放出的能量,与酸碱的用量无关
偏小
不变
有影响
3.某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1 NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体 g。
(2)从上图中选择称量NaOH固体所需要的仪器是(填字母): 。
5.0
a b e
0.25L× 0.50 mol·L-1 ×40 g/mol==5.0g
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如右图所示。
取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
温度 实验次数 起始温度t1/℃ 终止温度t2/℃ 温度差
平均值[
(t2-t1)/℃
H2SO4 NaOH 平均值
1 26.2 26.0 26.1 30.1
2 27.0 27.4 27.2 31.1
3 25.9 25.9 25.9 31.8
4 26.4 26.2 26.3 30.4
②近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·(g·℃)-1。则中和热ΔH= (取小数点后一位)。
③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差 b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
4.0
3.9
5.9
4.1
—53.5KJ/mol
a c d
若有数据偏差太大,
应舍弃该数据
ΔH= -
80×0.00418(t2—t1)KJ
0.025mol
= —53.5KJ/mol
第一章 化学反应的热效应
反应热
第一章 第一节
学习目标
1、能辨识化学反应中的能量转化形式,能解释化学反应中能量变化的本质。
2、知道反应热、中和热的概念及测定方法。
3、能进行反应焓变的简单计算。
有新物质生成
原子重新组合的过程
旧键的断裂和新键的形成
从物质的角度:
从微粒的角度:
从化学键的角度:
从能量的角度:
释放或贮存能量的过程
化学反应的本质:
旧知巩固
破坏1mol化学键所吸收的能量
1.内能:
2.键能:
3. 能量越 ,物质越稳定(“高”或“低”)
键能越 ,物质越稳定(“大”或“小”)
知识回顾
任何一种物质都具有一定的能量,这种能量称为内能。
低
大
(或形成1mol化学键所放出的能量)。
热能
电能
光能
------
我们知道:一个化学反应过程中,除了生成新物质外,还有------
能量变化
(通常)
【知识回顾】:
根据反应体系在化学反应过程中所释放还是吸收的热量,将反应分为吸热反应和放热反应
回顾
1、你所知道的化学反应中有哪些是放热反应?
2、你所知道的化学反应中有哪些是吸热反应?
回顾
燃料的燃烧 (包括物质的自燃和缓慢氧化);
中和反应 ;
金属与水、酸或碱的反应 ;
铝热反应
大多数化合反应
Ba(OH)2.8H2O + NH4Cl ;
C、H2、CO作还原剂的一些反应(需要持续加热或高温的反应);
固态铵盐与碱
碳酸氢钠与盐酸溶液的反应
大多数分解反应
吸热反应:E生(总) E反(总))
放热反应:E生(总) E反(总)
从宏观物质角度:
从微观键能角度:
放热反应:反应物总键能(E吸) 生成物总键能(E放)
吸热反应:反应物总键能 (E吸) 生成物总键能(E放)
>
<
<
>
反应物
生成物
能量
反应过程
反应物
生成物
能量
反应过程
反应物分子
生成物分子
能量
反应过程
反应物分子
生成物分子
能量
反应过程
吸、放热反应的宏观与微观解释
利用化学反应中热量的释放或吸收有利于改善我们的生活环境,提高我们的生产效率。
即热饭盒能让我们随时吃到热的饭菜。
【思考】目前市面上的“即热饭盒”,其原理是在饭盒底部有两层,一层存放水,另一层存放镁和铁的混合物(发热包)。使用时打开隔离层,即发生以下反应:Mg+2H2O═Mg(OH)2+H2↑ 。发热包中成份的含量是否需要控制,为什么?
发热包中有效成份含量过少,放热不足,含量过多占用空间,且有安全隐患。
那么,在实际应用中,该如何控制发热包成份的含量?人们在研究化学反应的能量时,该如何定量地描述化学反应过程中释放或吸收的热量呢
反应热 焓变
1.反应热与焓变
(1)体系与环境
被研究的物质系统
与体系相互影响的其他部分
体系:
环境:
例如:研究物质在水溶液中的反应,溶液就是体系,而盛放溶液的烧杯以及溶液之外的空气等便是环境。
体系
敞开体系
密封体系
隔离体系
与环境既有能量交换,也有物质交换。
与环境只有能量交换,没有物质交换。
与环境既没有能量交换,也没有物质交换。
(以盐酸与NaOH溶液的反应为例)
环境
体系
体系与环境示意图
环境——如盛溶液的试管和溶液之外的空气等看做环境。
体系——试管中的盐酸、NaOH溶液及发生的反应等看作一个反应体系,又称系统。
(2)体系与环境的热量交换——反应热
①热量:因温度不同而在体系与环境之间交换或传递的能量。
②反应热:在等温条件下,化学反应体系向环境释放或从环境吸收的热量,称为化学反应的热效应,简称反应热。
指化学反应发生后,使反应体系的温度恢复到反应前体系的温度,即反应前后体系的温度相等。P4
1.反应热与焓变
①焓(H): .
②焓变(△H):
单 位:
是一个与内能有关的物理量
③ 计算表达式:
ΔH =
即:恒压下的焓变 = 反应热
常用焓变表示反应热
[可理解为体系内物质的各种能量的总和]
在恒压下的反应热即为该反应的焓变
常用kJ/mol或kJ·mol-1
阅读课本P6—2.反应热与焓变,找到下列问题的答案
H(生成物)-H(反应物) (宏观上)
1.反应热与焓变
(2)焓和焓变
体系能量降低
H < 0
H > 0
体系能量升高
放热反应: H < 0
吸热反应: H > 0
旧键断裂 — 吸收能量
新键形成 — 放出能量
=
=
=679kJ/mol
=862 kJ/mol
H =
679kJ/mol - 862kJ/mol = -183kJ/mol
反应物的键能总和
生成物的键能总和
请观察P7页图1-5
ΔH =
436kJ/mol +243kJ/mol
431kJ/mol ×2
或,ΔH = E吸收-E放出
以 H2(g)+Cl2(g)===2HCl(g) 为例,从微观角度理解焓变的实质
④反应热的计算
或,ΔH = E吸收-E放出
宏观
微观
即,ΔH = E生成物-E反应物
ⅰ.Δ H=生成物的总能量-反应物的总能量
ⅱ.Δ H=反应物键能总和-生成物键能总和
生成物
反应物
生成物
反应物
1.反应热与焓变
(2)焓和焓变
小 结
①反应热:在等温条件下,化学反应体系向环境释放或从环境吸收的热量。
③恒压下的焓变 = 反应热
一、反应热 焓变
④反应热(焓变)的表示方法
——△H为
“ + ”
或 ΔH>0
放热反应
吸热反应
反应体系温度升高
反应体系温度降低
“- ”
——△H为
或 ΔH<0
⑤反应热的计算
ΔH = E吸收-E放出
宏观
微观
ΔH = E生成物-E反应物
(Δ H=反应物键能总和-生成物键能总和)
②焓:与内能有关的物理量
1. 下列说法正确的是
A. 吸热反应使环境的温度升高
B. 当反应放热时ΔH>0,反应吸热时ΔH<0
C. 当反应物的总能量大于生成物的总能量时,反应放热,ΔH<0
D. 需要加热才能发生的反应一定是吸热反应
趁热打铁
√
2. CO(g)与H2O(g)反应的能量变化如图所示,下列有关两者反应的说法正确的是
A. 该反应为吸热反应
B. 1 mol CO(g)和1 mol H2O(g)具有的总能量大于
1 mol CO2(g)和1 mol H2(g)具有的总能量
C. 该反应不需要加热就能进行
D. 1 mol CO2(g)和1 mol H2(g)反应生成1 mol CO(g)和1 mol H2O(g)要放出41 kJ热量
√
趁热打铁
3、1molC与1molH2O(g)反应生成1molCO(g)和1molH2(g),需吸收131.5kJ的热量,该反应的反应热为△H= kJ/mol。
4、拆开1mol H—H键、1mol N—H键、1mol N≡N键分别需要的能量是436kJ、391kJ、946kJ,则1molN2生成NH3的反应热为: ,1mol H2生成NH3的反应热为: 。
+131.5
-92kJ/mol
-30.67kJ/mol
△H=436×3+946×1-391×6=-92kJ/mol
△H`=-92kJ/mol×1/3 = -30.67kJ/mol
趁热打铁
(提示1: 3H2+N2 2NH3)
(提示2: H2+1/3N2 2/3NH3)
5. 已知:298K时,相关物质的相对能量如图所示,请计算下列反应的焓变△H
C2H6(g) +2CO2(g) 4CO(g) + 3H2(g)
4H2(g) + 2CO(g) C2H4(g) + 2H2O (g)
趁热打铁
H= (-110)×4 + 3×0 - [-84+2× (-393)] = +430KJ/mol
ΔH = E生成物-E反应物
H= (-242)×2 + 52 - [0+2× (-110)] = -212KJ/mol
6、已知:1mol硅晶体中含有2molSi-Si键,1molSiO2晶体中含有4molSi-O键,试计算2molSi完全燃烧时的 H= 。
化学键 Si-Si Si-O O=O N-H H-H
键能(KJ/mol) 176.0 460.0 494.0 390.8 436.0
-1988.0KJ/mol
Si + O2 == SiO2
H= 176.0×2 + 494.0 — 4×460.0== —994KJ/mol
趁热打铁
7. 某试管中盛有Al粉和稀盐酸,下列有关说法不正确的是 ( )
A、试管、Al粉、稀盐酸及发生的反应可看作一个体系
B、除反应物、生成物及相关反应外,其他均看作环境
C、Al与稀盐酸反应, 反应体系向环境中释放热量,ΔH<0
D、Al与稀盐酸反应的反应热可以通过量热计测量
A
×
√
趁热打铁
测量仪器
量热计
2.反应热及其测定
在反应前后,如果环境的温度没有变化,则反应放出的热量就会使体系的温度升高,这时可以根据测得的体系的温度变化和有关物质的比热容等来计算反应热。
哪些数据可以帮助我们测出反应热呢?我们怎样将这些数据转化为热量的变化呢?
下面我们以中和反应的反应热测定来了解反应热数据的获得。
思考与讨论
【温馨提示】Q=cm△t
Q:反应放出的热量。
C:反应混合液的比热容,为常数。
m:反应混合物液的总质量
△t:反应前后溶液温度的差值。
【实验探究】:中和反应反应热的测定
1.实验原理:
Q = mcΔt
m: 体系总质量; c: 体系比热容; Δt: 反应前后体系温差
使反应物混合均匀,充分接触
(操作:上下移动)
减少热量的散失
减少热量的散失
思考:该实验中,玻璃搅拌器换成铁制或者铜制的搅拌器行不行?
用简易量热计测量盐酸与NaOH溶液反应前后的温度Δt。
测量反应前后体系温度
反应容器
起保温作用
2.实验装置:
P5-6
不行
在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过,以达到保温、隔热、减少实验过程中热量损失的目的。该实验也可在保温杯中进行。
【简易量热计】
老教材
?
3.实验步骤:
量取50 mL 0.50 mol·L-1盐酸,倒入内筒,盖上杯盖,测温并记录;洗净温度计并擦干,备用
① 测盐酸溶液初始温度:
② 测氢氧化钠溶液初始温度:
另取一量筒,量取50 mL 0.55mol·L-1氢氧化钠,测温并记录;
③ 取两次温度的平均值记为反应前体系温度t1
(1)反应物温度的测量(t1)
(2)反应后体系温度的测量(t2)
将酸碱溶液迅速混合,用玻璃搅拌器轻轻搅动溶液,准确读取混合溶液的最高温度 ,记为t2
(3)重复以上步骤2次
【实验探究】:中和反应反应热的测定
问题一:能否更换温度计?
不能,会存在仪器误差
问题二:能否测完酸后直接测量碱的温度?
不能,残留的酸与碱反应,造成酸碱消耗,热量损失
问题三:为什么碱的浓度稍大于酸?
碱过量,保证酸完全反应
4.数据处理:P5-6
温度 实验 次数 起始温度t1/℃ 终止温度t2/℃ 温度差平均值 (t2-t1)/℃
盐酸 NaOH 平均值
温差 平均值
1 25.0 25.2 ____ 28.5 ____ ____
2 24.9 25.1 ____ 28.3 ____
3 25.6 25.4 ____ 29.0 ____
25.1
25.0
25.5
3.4
3.3
3.5
3.4
假设中和后溶液密度近似为1 g·cm-3,中和后溶液的比热容c=4.18 J·g-1·℃-1,
则根据公式和实验数据可计算出:该反应放出的热量 Q =mcΔt ≈ kJ,
1.42
则,生成 1 mol H2O时放出的热量为 kJ。
56.8
【实验探究】:中和反应反应热的测定
ΔH=
-
Q
0.025
kJ/mol
(50+50)
×4.18×10-3
×3.4
4.数据处理:
温度 实验 次数 起始温度t1/℃ 终止温度t2/℃ 温度差平均值 (t2-t1)/℃
盐酸 NaOH 平均值
温差 平均值
1 25.0 25.2 ____ 28.5 ____ ____
2 24.9 25.1 ____ 28.3 ____
3 25.6 25.4 ____ ____
25.1
25.0
25.5
3.4
3.3
【实验探究】:中和反应反应热的测定
29.8
4.3
若有数据偏差太大,
应舍弃该数据
3.35
大量实验测得,在25℃和101kPa下,强酸、强碱稀溶液发生中和反应生成1mol H2O(l)时,放出57.3kJ热量。
你知道吗
深度思考
(1)实验中为何选用的是0.55 mol·L-1NaOH溶液?
(2)若用0.55 mol·L-1 KOH溶液代替,对结果会产生影响吗?
碱过量,保证酸完全反应
无影响。因为强酸强碱的稀溶液反应生成1 mol H2O(l)时放出的热量是相同的,与用KOH溶液还是NaOH 溶液无关。
(3)酸、碱混合时,为何要把量筒中的NaOH溶液一次倒入小烧杯而不能缓缓倒入?
【提示】减少热量损失
(4)用浓硫酸代替盐酸对结果会产生什么影响?
用醋酸代替盐酸对结果会产生什么影响?
用稀硫酸和稀Ba(OH)2溶液测定,对结果会产生什么影响?
浓硫酸稀释放热,数值偏大
醋酸电离吸热,数值偏小
生成BaSO4沉淀,会多放出部分热量,数值偏大
深度思考
(4)若反应过程中有其他物质生成(沉淀、难电离物质等),这部分反应热不属于中和热。
(3)特别地,强酸、强碱的稀溶液:H+(aq)+OH- (aq)=H2O(l) △H = -57.3 kJ/mol
(1) 必须是稀溶液,如浓硫酸稀释或NaOH固体溶解时放热;
(2)以生成1mol H2O(l)为标准
记住
一般地,酸、碱浓度:C(H+)≤ 1mol/L或C(OH—)≤ 1mol/L
中和热
稀溶液中,酸与碱反应生成1mol 液态H2O(l)时释放的热量称中和热。
归纳总结
提高中和反应反应热的测定准确度的措施
①酸、碱溶液选用强酸、强碱的稀溶液;
②为保证盐酸被完全中和,碱的浓度应稍大。
①酸碱溶液混合要迅速,防止热量散失
②在测量反应混合液的温度时,记录最高温度值
(1)原理方面:
(2)操作方面:
(3)仪器方面:
①不可将温度计当搅拌器使用;玻璃搅拌器应上下移动。
②应使用玻璃搅拌器,不能用金属质搅拌器代替。
友情提示
对于定量实验,均需重复实验步骤,取2~3次实验数据的平均值
反应热测定实验中,温度数据至少要测量、记录6次(一次实验测3个数据,至少重复2次)
选用数据进行计算时,相差太大的数据应舍弃
环形玻璃搅拌棒仅在反应热测定这一实验中出现和使用
趁热打铁
1.在测定中和反应反应热的实验中,下列说法正确的是
A. 使用玻璃搅拌器是为了使反应物混合均匀,减小实验误差
B. 为了准确测定反应混合溶液的温度,实验中温度计水银球应与容器底部接触
C. 用50 mL 0.55 mol·L-1的NaOH溶液与50 mL 0.50 mol·L-1的盐酸反应,
测得的反应热数值偏大
D. 在测定中和反应反应热的实验中需要使用的仪器有天平、量筒、烧杯、滴定管、温度计
√
2、50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”
“偏小”“无影响”)。
(4)实验中改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”“不相等”),
所求中和热 (填“相等”“不相等”),
简述理由: 。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”“偏小”“无影响”)若所用NaOH溶液因吸收CO2已少量变质,则该NaOH溶液耗酸量 (填“改变”“不变”),对中和热的测定有无影响?
玻璃搅拌器
减少实验过程中的热量损失
偏小
不等
相等
因为中和热是指酸跟碱发生中和反应生成1molH2O所放出的能量,与酸碱的用量无关
偏小
不变
有影响
3.某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1 NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体 g。
(2)从上图中选择称量NaOH固体所需要的仪器是(填字母): 。
5.0
a b e
0.25L× 0.50 mol·L-1 ×40 g/mol==5.0g
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如右图所示。
取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
温度 实验次数 起始温度t1/℃ 终止温度t2/℃ 温度差
平均值[
(t2-t1)/℃
H2SO4 NaOH 平均值
1 26.2 26.0 26.1 30.1
2 27.0 27.4 27.2 31.1
3 25.9 25.9 25.9 31.8
4 26.4 26.2 26.3 30.4
②近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·(g·℃)-1。则中和热ΔH= (取小数点后一位)。
③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差 b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
4.0
3.9
5.9
4.1
—53.5KJ/mol
a c d
若有数据偏差太大,
应舍弃该数据
ΔH= -
80×0.00418(t2—t1)KJ
0.025mol
= —53.5KJ/mol
