化学人教版(2019)选择性必修2 3.2.2共价晶体(共17张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 3.2.2共价晶体(共17张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 3.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-17 17:41:37 | ||
图片预览


文档简介
(共17张PPT)
第三章 晶体结构与性质
第二节 分子晶体与共价晶体
第2课时
导入新课
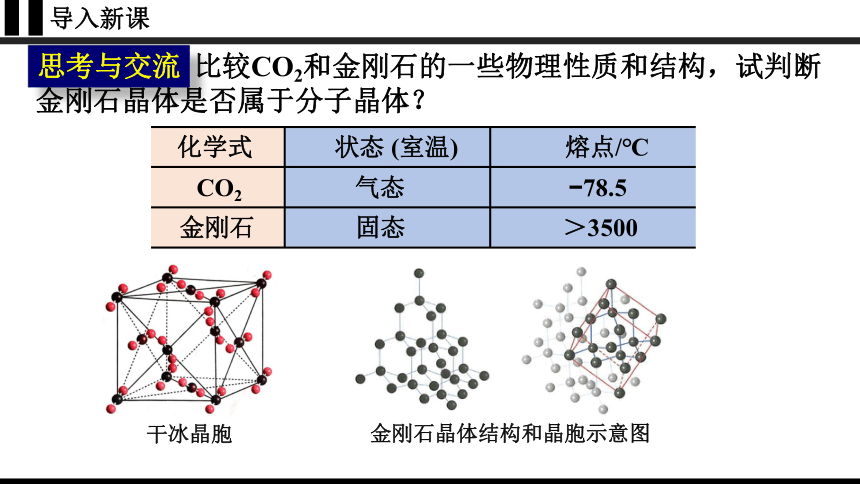
思考与交流
比较CO2和金刚石的一些物理性质和结构,试判断金刚石晶体是否属于分子晶体?
化学式 状态 (室温) 熔点/℃
CO2 气态 78.5
金刚石 固态 >3500
干冰晶胞
金刚石晶体结构和晶胞示意图
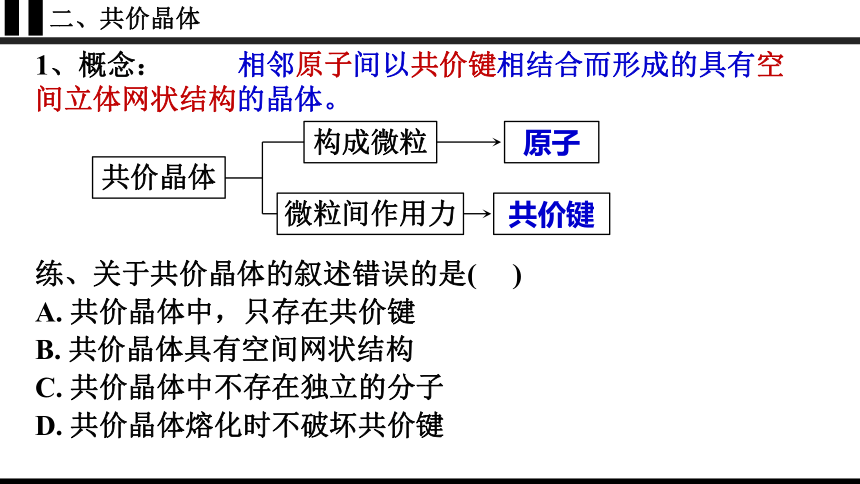
二、共价晶体
1、概念:
相邻原子间以共价键相结合而形成的具有空间立体网状结构的晶体。
共价晶体
构成微粒
微粒间作用力
原子
共价键
练、关于共价晶体的叙述错误的是( )
A. 共价晶体中,只存在共价键
B. 共价晶体具有空间网状结构
C. 共价晶体中不存在独立的分子
D. 共价晶体熔化时不破坏共价键
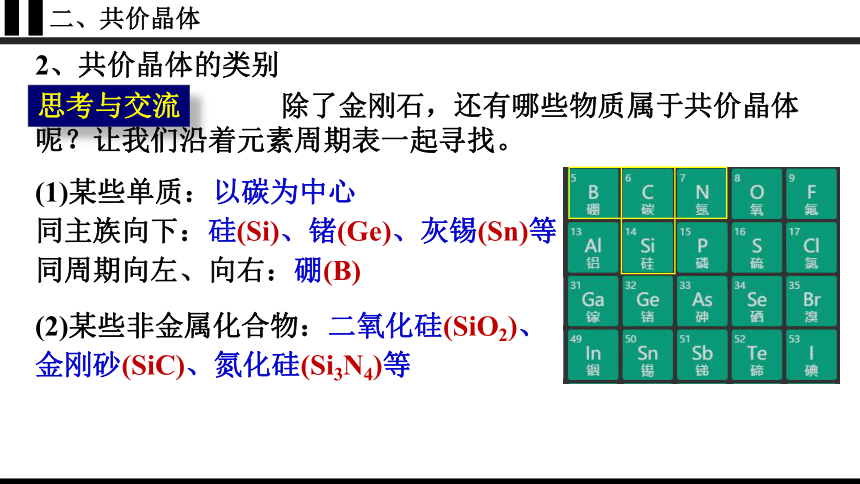
二、共价晶体
2、共价晶体的类别
思考与交流
除了金刚石,还有哪些物质属于共价晶体呢?让我们沿着元素周期表一起寻找。
(1)某些单质:以碳为中心
同主族向下:硅(Si)、锗(Ge)、灰锡(Sn)等
同周期向左、向右:硼(B)
(2)某些非金属化合物:二氧化硅(SiO2)、
金刚砂(SiC)、氮化硅(Si3N4)等
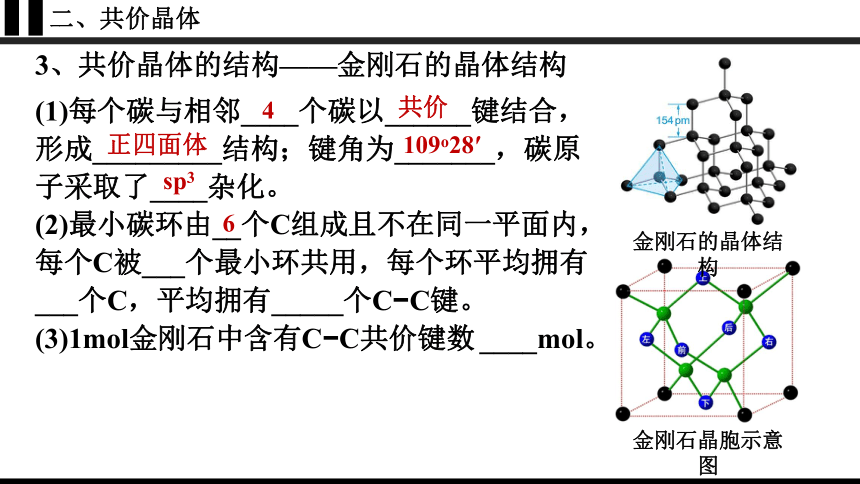
二、共价晶体
3、共价晶体的结构——金刚石的晶体结构
二、共价晶体
3、共价晶体的结构——金刚石的晶体结构
金刚石晶胞示意图
金刚石的晶体结构
(1)每个碳与相邻____个碳以______键结合,
形成_________结构;键角为_______,碳原子采取了____杂化。
(2)最小碳环由__个C组成且不在同一平面内,
每个C被___个最小环共用,每个环平均拥有___个C,平均拥有_____个C C键。
(3)1mol金刚石中含有C C共价键数 ____mol。
4
共价
正四面体
109o28′
sp3
6
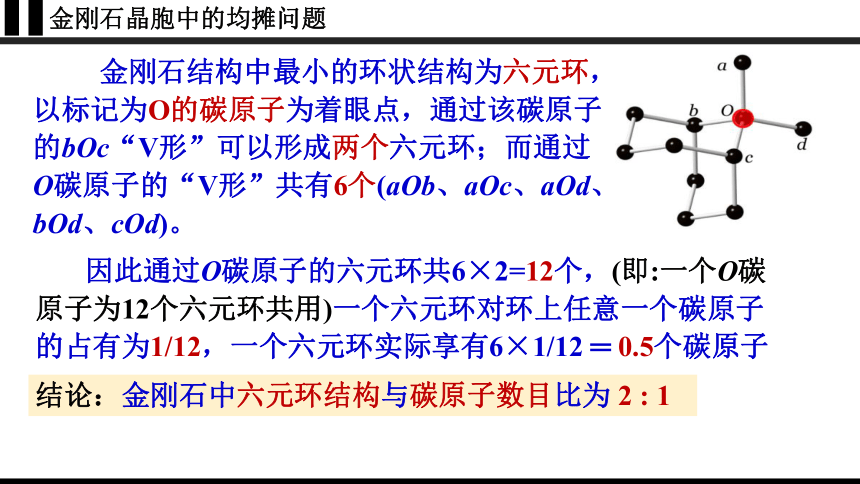
金刚石晶胞中的均摊问题
金刚石结构中最小的环状结构为六元环,以标记为O的碳原子为着眼点,通过该碳原子的bOc“V形”可以形成两个六元环;而通过O碳原子的“V形”共有6个(aOb、aOc、aOd、 bOd、cOd)。
结论:金刚石中六元环结构与碳原子数目比为 2 : 1
因此通过O碳原子的六元环共6×2=12个,(即:一个O碳原子为12个六元环共用)一个六元环对环上任意一个碳原子的占有为1/12,一个六元环实际享有6×1/12 ═ 0.5个碳原子
金刚石晶胞中的均摊问题
以标记为aO的C C为着眼点,通过该C C的“V形”共有3个(aOb、aOc、aOd)。
因此通过aOC-C键的六元环共3×2=6个,(即:一根aOC-C键为6个六元环共用)一个六元环对环上任意一根C C键的占有为1/6,一个六元环实际享有6×1/6 =1根C C键
结论:金刚石中六元环结构与C C键数目比为 1 : 1
在金刚石晶胞中:
六元环结构 : 碳原子数目 : C C键数目=2 : 1 : 2
归纳总结
二、共价晶体
3、共价晶体的结构——金刚石的晶体结构
金刚石的晶体结构
(1)每个碳与相邻____个碳以______键结合,
形成_________结构;键角为_______,碳原子采取了____杂化。
(2)最小碳环由__个C组成且不在同一平面内,
每个C被___个最小环共用;每个环平均拥有_____个C,每个环平均拥有____个C C键。
(3)1mol金刚石中含有C C共价键数 ____mol。
4
共价
正四面体
109o28′
sp3
6
12
1/2
1
2
在金刚石晶胞中:
六元环结构 : 碳原子数目 : C C键数目=2 : 1 : 2
归纳总结
金刚石模型的演变(等电子体原理)
1、与碳同族单质(如Si、Ge)都具有与金刚石相似的结构
2、第ⅣA族相邻元素间也可形成相似结构的晶体(如SiC)
3、与第ⅣA族同周期的元素间根据等电子体原理,如:BN、GaAs等也可形成与金刚石结构相似的晶体。
金刚石 晶体硅 SiC GaAs
金刚石模型的衍生(方石英SiO2)
晶体硅的晶胞中,在Si Si键之间插入O原子,即得到方石英的晶胞(最常见的SiO2晶胞)。
二、共价晶体
3、共价晶体的结构——二氧化硅的晶体结构
(1)晶体中每个硅原子与____个氧原子以共价键结合,形成 ________结构;每个正四面体占有____个Si,___个O。故该晶体中硅、氧原子个数比为______。
(2)最小环上有 ___个原子(__个Si和__个O) 1 mol SiO2晶体中含____ mol Si O键
4
正四面体
1
2
1 : 2
12
6
6
4
在金刚石晶胞中:
六元环结构 : 碳原子数目 : C C键数目=2 : 1 : 2
归纳总结
二、共价晶体
练、下列说法正确的是( )
A.124 g P4含有的P P键的个数为6NA
B.12 g 石墨中含有的C C键的个数为2NA
C.12 g 金刚石中含有的C C键的个数为1.5NA
D.60 g SiO2中含Si O键的个数为2NA
A
二、共价晶体
表3 3 某些共价晶体的熔点和硬度
原子晶体 金刚石 氮化硼 碳化硅 石英 硅 锗
熔点/oC >3550 3000 2700 1710 1410 1211
硬 度 10 9.5 9.5 7 6.5 6.0
4、共价晶体的性质
(1)熔点高:
原子间以较强的共价键相结合,要使物质熔化需要克服共价键,需要很高的能量。
结论:结构相似的共价晶体,原子半径越小,键长越短,键能越大,晶体的熔点越高。
(2)硬度大、一般不导电,但晶体硅、锗是半导体
高考真题中的晶体沸点问题
[2021浙江卷] 已知3种共价晶体的熔点数据如下表:金刚石熔点比晶体硅熔点高的原因是 。
金刚石 碳化硅 晶体硅
熔点/℃ >3550 2600 1415
二者均为共价晶体,金刚石的C C键长短,键能大
分子晶体和共价晶体的判断方法
1、依据构成晶体的微粒和微粒间的作用力判断
晶体 构成粒子 粒子间作用力
分子晶体
共价晶体
分子(稀有气体为原子)
原子
分子间作用力
共价键
2、依据物理性质判断
分子晶体 共价晶体
熔、沸点
挥发性
硬度
低(常在几百摄氏度以下)
部分有
高(一般高于1000℃)
无
小而脆
大
分子晶体和共价晶体的判断方法
3、依据物质的分类判断
分子晶体 共价晶体
所有非金属氢化物
部分非金属单质
部分非金属氧化物
几乎所有的酸
绝大多数有机物
B、Si、Ge、金刚石等单质
SiC、SiO2、BN、 AlN、Si3N4等化合物
第三章 晶体结构与性质
第二节 分子晶体与共价晶体
第2课时
导入新课
思考与交流
比较CO2和金刚石的一些物理性质和结构,试判断金刚石晶体是否属于分子晶体?
化学式 状态 (室温) 熔点/℃
CO2 气态 78.5
金刚石 固态 >3500
干冰晶胞
金刚石晶体结构和晶胞示意图
二、共价晶体
1、概念:
相邻原子间以共价键相结合而形成的具有空间立体网状结构的晶体。
共价晶体
构成微粒
微粒间作用力
原子
共价键
练、关于共价晶体的叙述错误的是( )
A. 共价晶体中,只存在共价键
B. 共价晶体具有空间网状结构
C. 共价晶体中不存在独立的分子
D. 共价晶体熔化时不破坏共价键
二、共价晶体
2、共价晶体的类别
思考与交流
除了金刚石,还有哪些物质属于共价晶体呢?让我们沿着元素周期表一起寻找。
(1)某些单质:以碳为中心
同主族向下:硅(Si)、锗(Ge)、灰锡(Sn)等
同周期向左、向右:硼(B)
(2)某些非金属化合物:二氧化硅(SiO2)、
金刚砂(SiC)、氮化硅(Si3N4)等
二、共价晶体
3、共价晶体的结构——金刚石的晶体结构
二、共价晶体
3、共价晶体的结构——金刚石的晶体结构
金刚石晶胞示意图
金刚石的晶体结构
(1)每个碳与相邻____个碳以______键结合,
形成_________结构;键角为_______,碳原子采取了____杂化。
(2)最小碳环由__个C组成且不在同一平面内,
每个C被___个最小环共用,每个环平均拥有___个C,平均拥有_____个C C键。
(3)1mol金刚石中含有C C共价键数 ____mol。
4
共价
正四面体
109o28′
sp3
6
金刚石晶胞中的均摊问题
金刚石结构中最小的环状结构为六元环,以标记为O的碳原子为着眼点,通过该碳原子的bOc“V形”可以形成两个六元环;而通过O碳原子的“V形”共有6个(aOb、aOc、aOd、 bOd、cOd)。
结论:金刚石中六元环结构与碳原子数目比为 2 : 1
因此通过O碳原子的六元环共6×2=12个,(即:一个O碳原子为12个六元环共用)一个六元环对环上任意一个碳原子的占有为1/12,一个六元环实际享有6×1/12 ═ 0.5个碳原子
金刚石晶胞中的均摊问题
以标记为aO的C C为着眼点,通过该C C的“V形”共有3个(aOb、aOc、aOd)。
因此通过aOC-C键的六元环共3×2=6个,(即:一根aOC-C键为6个六元环共用)一个六元环对环上任意一根C C键的占有为1/6,一个六元环实际享有6×1/6 =1根C C键
结论:金刚石中六元环结构与C C键数目比为 1 : 1
在金刚石晶胞中:
六元环结构 : 碳原子数目 : C C键数目=2 : 1 : 2
归纳总结
二、共价晶体
3、共价晶体的结构——金刚石的晶体结构
金刚石的晶体结构
(1)每个碳与相邻____个碳以______键结合,
形成_________结构;键角为_______,碳原子采取了____杂化。
(2)最小碳环由__个C组成且不在同一平面内,
每个C被___个最小环共用;每个环平均拥有_____个C,每个环平均拥有____个C C键。
(3)1mol金刚石中含有C C共价键数 ____mol。
4
共价
正四面体
109o28′
sp3
6
12
1/2
1
2
在金刚石晶胞中:
六元环结构 : 碳原子数目 : C C键数目=2 : 1 : 2
归纳总结
金刚石模型的演变(等电子体原理)
1、与碳同族单质(如Si、Ge)都具有与金刚石相似的结构
2、第ⅣA族相邻元素间也可形成相似结构的晶体(如SiC)
3、与第ⅣA族同周期的元素间根据等电子体原理,如:BN、GaAs等也可形成与金刚石结构相似的晶体。
金刚石 晶体硅 SiC GaAs
金刚石模型的衍生(方石英SiO2)
晶体硅的晶胞中,在Si Si键之间插入O原子,即得到方石英的晶胞(最常见的SiO2晶胞)。
二、共价晶体
3、共价晶体的结构——二氧化硅的晶体结构
(1)晶体中每个硅原子与____个氧原子以共价键结合,形成 ________结构;每个正四面体占有____个Si,___个O。故该晶体中硅、氧原子个数比为______。
(2)最小环上有 ___个原子(__个Si和__个O) 1 mol SiO2晶体中含____ mol Si O键
4
正四面体
1
2
1 : 2
12
6
6
4
在金刚石晶胞中:
六元环结构 : 碳原子数目 : C C键数目=2 : 1 : 2
归纳总结
二、共价晶体
练、下列说法正确的是( )
A.124 g P4含有的P P键的个数为6NA
B.12 g 石墨中含有的C C键的个数为2NA
C.12 g 金刚石中含有的C C键的个数为1.5NA
D.60 g SiO2中含Si O键的个数为2NA
A
二、共价晶体
表3 3 某些共价晶体的熔点和硬度
原子晶体 金刚石 氮化硼 碳化硅 石英 硅 锗
熔点/oC >3550 3000 2700 1710 1410 1211
硬 度 10 9.5 9.5 7 6.5 6.0
4、共价晶体的性质
(1)熔点高:
原子间以较强的共价键相结合,要使物质熔化需要克服共价键,需要很高的能量。
结论:结构相似的共价晶体,原子半径越小,键长越短,键能越大,晶体的熔点越高。
(2)硬度大、一般不导电,但晶体硅、锗是半导体
高考真题中的晶体沸点问题
[2021浙江卷] 已知3种共价晶体的熔点数据如下表:金刚石熔点比晶体硅熔点高的原因是 。
金刚石 碳化硅 晶体硅
熔点/℃ >3550 2600 1415
二者均为共价晶体,金刚石的C C键长短,键能大
分子晶体和共价晶体的判断方法
1、依据构成晶体的微粒和微粒间的作用力判断
晶体 构成粒子 粒子间作用力
分子晶体
共价晶体
分子(稀有气体为原子)
原子
分子间作用力
共价键
2、依据物理性质判断
分子晶体 共价晶体
熔、沸点
挥发性
硬度
低(常在几百摄氏度以下)
部分有
高(一般高于1000℃)
无
小而脆
大
分子晶体和共价晶体的判断方法
3、依据物质的分类判断
分子晶体 共价晶体
所有非金属氢化物
部分非金属单质
部分非金属氧化物
几乎所有的酸
绝大多数有机物
B、Si、Ge、金刚石等单质
SiC、SiO2、BN、 AlN、Si3N4等化合物
