化学人教版(2019)选择性必修2 3.2.1分子晶体(共27张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 3.2.1分子晶体(共27张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 5.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-17 17:42:58 | ||
图片预览





文档简介
(共27张PPT)
第三章 晶体结构与性质
第二节 分子晶体与共价晶体
第1课时
教学目标
1、教学目标
1) 知道分子晶体的结构特点,能借助分子晶体模型说明分子晶体中的粒子及粒子间的相互作用,以及范德华力与氢键对分子晶体结构与性质的影响。
2) 知道共价晶体的结构特点,认识金刚石晶体中碳原子的三维骨架结构,能借助共价晶体模型说明共价晶体中粒子间的相互作用。
3) 能结合具体实例,说出分子晶体、共价晶体的粒子间相互作用与其性质(熔点、硬度等)的关系。
教学目标
2、教学重点和难点
1) 重点:分子晶体、共价晶体的结构特点与性质之间的关系,氢键对分子晶体结构与性质的影响。
2) 难点:分子晶体、共价晶体的结构特点,氢键对冰的结构和性质的影响。
温故知新
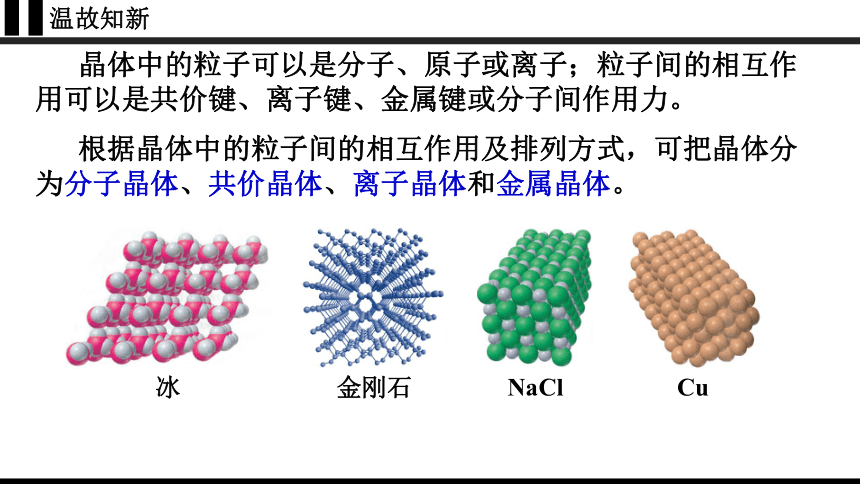
晶体中的粒子可以是分子、原子或离子;粒子间的相互作用可以是共价键、离子键、金属键或分子间作用力。
根据晶体中的粒子间的相互作用及排列方式,可把晶体分为分子晶体、共价晶体、离子晶体和金属晶体。
NaCl
Cu
金刚石
冰
一、分子晶体
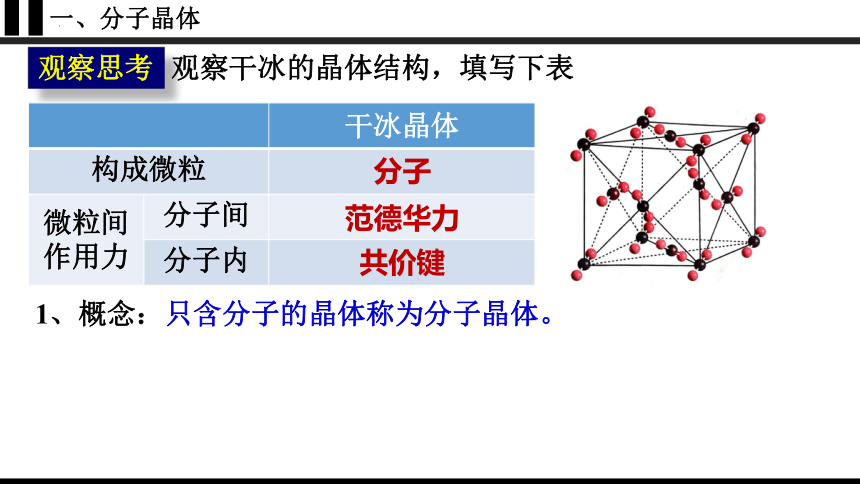
观察干冰的晶体结构,填写下表
观察思考
干冰晶体
构成微粒
微粒间作用力 分子间
分子内
分子
范德华力
共价键
1、概念:只含分子的晶体称为分子晶体。
一、分子晶体
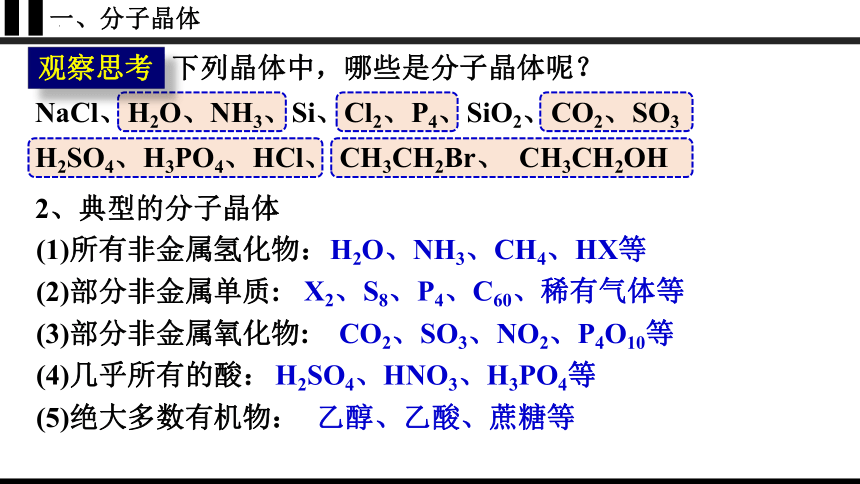
下列晶体中,哪些是分子晶体呢?
观察思考
NaCl、H2O、NH3、Si、Cl2、P4、SiO2、CO2、SO3
H2SO4、H3PO4、HCl、 CH3CH2Br、 CH3CH2OH
2、典型的分子晶体
(1)所有非金属氢化物:
H2O、NH3、CH4、HX等
(2)部分非金属单质:
X2、S8、P4、C60、稀有气体等
(3)部分非金属氧化物:
CO2、SO3、NO2、P4O10等
(4)几乎所有的酸:
H2SO4、HNO3、H3PO4等
(5)绝大多数有机物:
乙醇、乙酸、蔗糖等
一、分子晶体
观察思考
1、所有的分子晶体内部都只有范德华力吗?
2、稀有气体的晶体是否含有共价键?
1、有的分子晶体分子间还存在氢键(如冰晶体)
2、稀有气体是单原子分子,不存在共价键
一、分子晶体
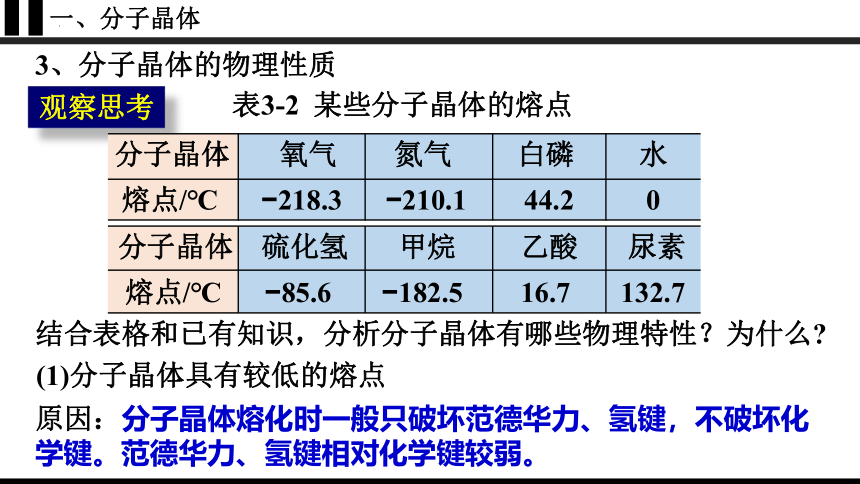
3、分子晶体的物理性质
观察思考
表3-2 某些分子晶体的熔点
分子晶体 氧气 氮气 白磷 水
熔点/℃ 218.3 210.1 44.2 0
分子晶体 硫化氢 甲烷 乙酸 尿素
熔点/℃ 85.6 182.5 16.7 132.7
结合表格和已有知识,分析分子晶体有哪些物理特性?为什么
(1)分子晶体具有较低的熔点
原因:分子晶体熔化时一般只破坏范德华力、氢键,不破坏化学键。范德华力、氢键相对化学键较弱。
一、分子晶体
3、分子晶体的物理性质
(1)分子晶体具有较低的熔点
(2)分子晶体硬度小
(分子间作用力较弱,容易被克服)
(3)分子晶体不导电:构成分子晶体的微粒都是分子,在熔融状态下没有产生自由移动的离子。
(4)分子晶体的溶解性一般符合“相似相溶”规律
一、分子晶体
4、分子晶体的微粒堆积方式——干冰晶体
干冰晶胞
观察思考
1、每个干冰晶胞中有____个CO2分子
2、每个CO2分子周围等距紧邻的CO2分子有____个
4
拓展:等径圆球的堆积模型
将晶体中的微粒(分子、原子、离子)看作刚性小球,在空间中由于相互作用(范德华力、氢键、共价结合、离子性结合等)而进行堆积。
等径圆球的二维模型
等径圆球的三维模型
拓展:等径圆球的堆积模型
非密置层放置
密置层放置
配位数:
配位数:
1
2
3
4
4
1
2
3
4
5
6
6
等径圆球的二维模型
拓展:等径圆球的堆积模型
等径圆球的三维模型 (非密置层堆积)
简单立方堆积
晶胞
配位数:
6
1
2
3
4
5
6
拓展:等径圆球的堆积模型
等径圆球的三维模型 (非密置层堆积)
体心立方
晶胞
配位数:
8
拓展:等径圆球的堆积模型
等径圆球的三维模型 (密置层堆积)
密置层中小球围成两种空穴( 和 )
拓展:等径圆球的堆积模型
A层密置层中小球围
成两种空穴 ( 和 )
B层密置层只能盖住其
中一种空穴 ( 和 )
B层盖住 空穴(露出 空穴)
B层盖住 空穴 (露出 空穴)
拓展:等径圆球的堆积模型
选择B层盖住 空穴(露出 空穴)的AB层继续讨论
第三层与A层对齐,
仍露出 空穴。
得到…ABA…堆积
第三层盖住A层的
露出 空穴。
得到…ABC…堆积
A
B
A
C
B
A
配位数:12
一、分子晶体
一、分子晶体
4、分子晶体的微粒堆积方式——干冰晶体
干冰晶胞
观察思考
1、每个干冰晶胞中有____个CO2分子
2、每个CO2分子周围等距紧邻的CO2分子有____个
4
12
分子密堆积
一、分子晶体
4、分子晶体的微粒堆积方式
密堆积
微粒间作用力
空间 特点
举例
范德华力
通常每个分子周围
最多有12个紧邻的分子
如:C60、干冰 、I2、O2
C60的晶胞
一、分子晶体
冰晶体中,每个水分子周围有多少个紧邻的水分子?和干冰晶体一样吗?若不一样,可能的原因是什么?
观察思考
冰的结构
1
2
3
4
(1)每个H2O周围只有4个紧邻的H2O
(2)因为水分子间存在氢键,氢键具有方向性,每个H2O都与4个相邻的H2O相互吸引,构成四面体,属于非密堆积。
一、分子晶体
4、分子晶体的微粒堆积方式
非密堆积 密堆积
微粒间作用力
空间 特点
举例
范德华力
通常每个分子周围
最多有12个紧邻的分子
如:C60、干冰 、I2、O2
范德华力、氢键
每个分子周围紧邻的分子数小于12
如:HF 、NH3、冰
一、分子晶体
冰晶体中1 mol H2O最多有______mol 氢键
观察思考
冰的结构
1
2
3
4
2
一、分子晶体
4、分子晶体的微粒堆积方式——冰晶体 (非密堆积)
观察思考
冬季河水结冰后,冰块往往浮在水面,为什么冰的密度比水小呢?
冰的结构
冰融化,分子间的空隙减小
由于氢键的方向性,使冰晶体中每个H2O与四面体顶角方向的4个相邻H2O相互吸引,形成空隙较大的网状体。冰融化后,分子间的空隙减小。所以冰的密度比水小,冰会浮在水面上。
一、分子晶体
4、分子晶体的微粒堆积方式——冰晶体 (非密堆积)
观察思考
为什么水在4℃时的密度最大?
大量氢键
非密堆积
空隙大
密度小
氢键减少
部分解体
空隙减小
密度增大
热运动加剧
分子间距加大
密度减小
冰 水约 4 ℃ 水超过 4 ℃
一、分子晶体
思考讨论
硫化氢和水分子结构相似,但硫化氢晶体中,一个硫化氢分子周围有12个紧邻分子,而冰中一个水分子周围只有4个紧邻分子,为什么?
硫化氢晶体中分子之间只有范德华力,范德华力无饱和性与方向性,能够形成分子密堆积。因此,一个硫化氢分子周围有12分紧邻分子。
而冰晶体中水分子间存在氢键,氢键具有方向性,这迫使在四面体中心的每个水分子与四面体顶角方向的四个相邻水分子形成氢键。因此,冰中一个水分子周围只有4个紧邻分子。
课堂检测
练、一种甲烷水合物晶体中,平均每46个分子构成8个水分子笼,每个水分子笼可容纳1个甲烷分子或水分子,若这8个分子笼中有6个容纳的是甲烷分子,另外2个被水分子填充,这种可燃冰的平均分子组成是( )
A. CH4·5H2O B. CH4·6H2O
C. CH4·7H2O D. CH4·8H2O
第三章 晶体结构与性质
第二节 分子晶体与共价晶体
第1课时
教学目标
1、教学目标
1) 知道分子晶体的结构特点,能借助分子晶体模型说明分子晶体中的粒子及粒子间的相互作用,以及范德华力与氢键对分子晶体结构与性质的影响。
2) 知道共价晶体的结构特点,认识金刚石晶体中碳原子的三维骨架结构,能借助共价晶体模型说明共价晶体中粒子间的相互作用。
3) 能结合具体实例,说出分子晶体、共价晶体的粒子间相互作用与其性质(熔点、硬度等)的关系。
教学目标
2、教学重点和难点
1) 重点:分子晶体、共价晶体的结构特点与性质之间的关系,氢键对分子晶体结构与性质的影响。
2) 难点:分子晶体、共价晶体的结构特点,氢键对冰的结构和性质的影响。
温故知新
晶体中的粒子可以是分子、原子或离子;粒子间的相互作用可以是共价键、离子键、金属键或分子间作用力。
根据晶体中的粒子间的相互作用及排列方式,可把晶体分为分子晶体、共价晶体、离子晶体和金属晶体。
NaCl
Cu
金刚石
冰
一、分子晶体
观察干冰的晶体结构,填写下表
观察思考
干冰晶体
构成微粒
微粒间作用力 分子间
分子内
分子
范德华力
共价键
1、概念:只含分子的晶体称为分子晶体。
一、分子晶体
下列晶体中,哪些是分子晶体呢?
观察思考
NaCl、H2O、NH3、Si、Cl2、P4、SiO2、CO2、SO3
H2SO4、H3PO4、HCl、 CH3CH2Br、 CH3CH2OH
2、典型的分子晶体
(1)所有非金属氢化物:
H2O、NH3、CH4、HX等
(2)部分非金属单质:
X2、S8、P4、C60、稀有气体等
(3)部分非金属氧化物:
CO2、SO3、NO2、P4O10等
(4)几乎所有的酸:
H2SO4、HNO3、H3PO4等
(5)绝大多数有机物:
乙醇、乙酸、蔗糖等
一、分子晶体
观察思考
1、所有的分子晶体内部都只有范德华力吗?
2、稀有气体的晶体是否含有共价键?
1、有的分子晶体分子间还存在氢键(如冰晶体)
2、稀有气体是单原子分子,不存在共价键
一、分子晶体
3、分子晶体的物理性质
观察思考
表3-2 某些分子晶体的熔点
分子晶体 氧气 氮气 白磷 水
熔点/℃ 218.3 210.1 44.2 0
分子晶体 硫化氢 甲烷 乙酸 尿素
熔点/℃ 85.6 182.5 16.7 132.7
结合表格和已有知识,分析分子晶体有哪些物理特性?为什么
(1)分子晶体具有较低的熔点
原因:分子晶体熔化时一般只破坏范德华力、氢键,不破坏化学键。范德华力、氢键相对化学键较弱。
一、分子晶体
3、分子晶体的物理性质
(1)分子晶体具有较低的熔点
(2)分子晶体硬度小
(分子间作用力较弱,容易被克服)
(3)分子晶体不导电:构成分子晶体的微粒都是分子,在熔融状态下没有产生自由移动的离子。
(4)分子晶体的溶解性一般符合“相似相溶”规律
一、分子晶体
4、分子晶体的微粒堆积方式——干冰晶体
干冰晶胞
观察思考
1、每个干冰晶胞中有____个CO2分子
2、每个CO2分子周围等距紧邻的CO2分子有____个
4
拓展:等径圆球的堆积模型
将晶体中的微粒(分子、原子、离子)看作刚性小球,在空间中由于相互作用(范德华力、氢键、共价结合、离子性结合等)而进行堆积。
等径圆球的二维模型
等径圆球的三维模型
拓展:等径圆球的堆积模型
非密置层放置
密置层放置
配位数:
配位数:
1
2
3
4
4
1
2
3
4
5
6
6
等径圆球的二维模型
拓展:等径圆球的堆积模型
等径圆球的三维模型 (非密置层堆积)
简单立方堆积
晶胞
配位数:
6
1
2
3
4
5
6
拓展:等径圆球的堆积模型
等径圆球的三维模型 (非密置层堆积)
体心立方
晶胞
配位数:
8
拓展:等径圆球的堆积模型
等径圆球的三维模型 (密置层堆积)
密置层中小球围成两种空穴( 和 )
拓展:等径圆球的堆积模型
A层密置层中小球围
成两种空穴 ( 和 )
B层密置层只能盖住其
中一种空穴 ( 和 )
B层盖住 空穴(露出 空穴)
B层盖住 空穴 (露出 空穴)
拓展:等径圆球的堆积模型
选择B层盖住 空穴(露出 空穴)的AB层继续讨论
第三层与A层对齐,
仍露出 空穴。
得到…ABA…堆积
第三层盖住A层的
露出 空穴。
得到…ABC…堆积
A
B
A
C
B
A
配位数:12
一、分子晶体
一、分子晶体
4、分子晶体的微粒堆积方式——干冰晶体
干冰晶胞
观察思考
1、每个干冰晶胞中有____个CO2分子
2、每个CO2分子周围等距紧邻的CO2分子有____个
4
12
分子密堆积
一、分子晶体
4、分子晶体的微粒堆积方式
密堆积
微粒间作用力
空间 特点
举例
范德华力
通常每个分子周围
最多有12个紧邻的分子
如:C60、干冰 、I2、O2
C60的晶胞
一、分子晶体
冰晶体中,每个水分子周围有多少个紧邻的水分子?和干冰晶体一样吗?若不一样,可能的原因是什么?
观察思考
冰的结构
1
2
3
4
(1)每个H2O周围只有4个紧邻的H2O
(2)因为水分子间存在氢键,氢键具有方向性,每个H2O都与4个相邻的H2O相互吸引,构成四面体,属于非密堆积。
一、分子晶体
4、分子晶体的微粒堆积方式
非密堆积 密堆积
微粒间作用力
空间 特点
举例
范德华力
通常每个分子周围
最多有12个紧邻的分子
如:C60、干冰 、I2、O2
范德华力、氢键
每个分子周围紧邻的分子数小于12
如:HF 、NH3、冰
一、分子晶体
冰晶体中1 mol H2O最多有______mol 氢键
观察思考
冰的结构
1
2
3
4
2
一、分子晶体
4、分子晶体的微粒堆积方式——冰晶体 (非密堆积)
观察思考
冬季河水结冰后,冰块往往浮在水面,为什么冰的密度比水小呢?
冰的结构
冰融化,分子间的空隙减小
由于氢键的方向性,使冰晶体中每个H2O与四面体顶角方向的4个相邻H2O相互吸引,形成空隙较大的网状体。冰融化后,分子间的空隙减小。所以冰的密度比水小,冰会浮在水面上。
一、分子晶体
4、分子晶体的微粒堆积方式——冰晶体 (非密堆积)
观察思考
为什么水在4℃时的密度最大?
大量氢键
非密堆积
空隙大
密度小
氢键减少
部分解体
空隙减小
密度增大
热运动加剧
分子间距加大
密度减小
冰 水约 4 ℃ 水超过 4 ℃
一、分子晶体
思考讨论
硫化氢和水分子结构相似,但硫化氢晶体中,一个硫化氢分子周围有12个紧邻分子,而冰中一个水分子周围只有4个紧邻分子,为什么?
硫化氢晶体中分子之间只有范德华力,范德华力无饱和性与方向性,能够形成分子密堆积。因此,一个硫化氢分子周围有12分紧邻分子。
而冰晶体中水分子间存在氢键,氢键具有方向性,这迫使在四面体中心的每个水分子与四面体顶角方向的四个相邻水分子形成氢键。因此,冰中一个水分子周围只有4个紧邻分子。
课堂检测
练、一种甲烷水合物晶体中,平均每46个分子构成8个水分子笼,每个水分子笼可容纳1个甲烷分子或水分子,若这8个分子笼中有6个容纳的是甲烷分子,另外2个被水分子填充,这种可燃冰的平均分子组成是( )
A. CH4·5H2O B. CH4·6H2O
C. CH4·7H2O D. CH4·8H2O
