化学人教版(2019)必修第二册5.2.1氮及其化合物(共33张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册5.2.1氮及其化合物(共33张ppt) | 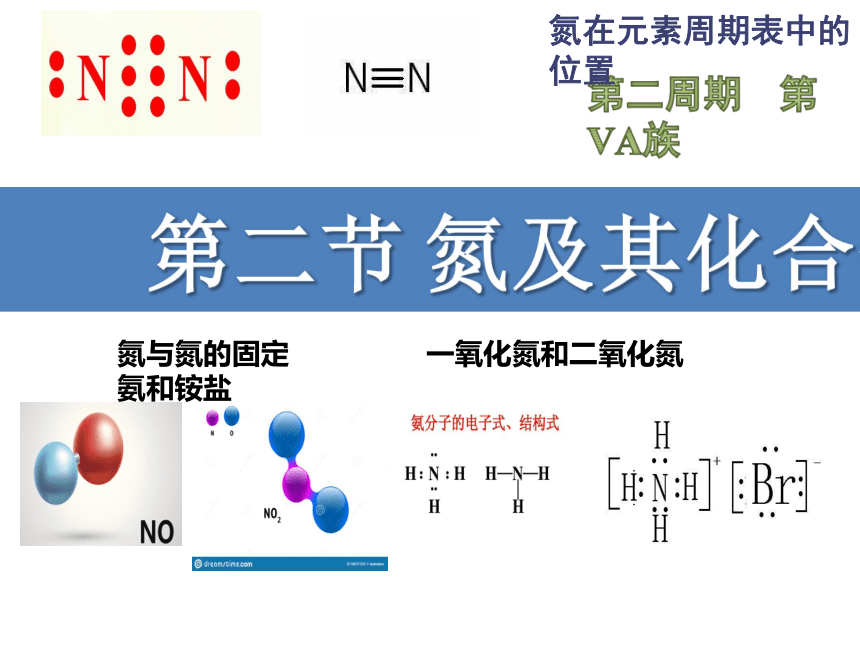 | |
| 格式 | pptx | ||
| 文件大小 | 239.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-17 17:46:12 | ||
图片预览









文档简介
第二节 氮及其化合物
第二周期 第 ⅤA族
氮在元素周期表中的位置
氮与氮的固定 一氧化氮和二氧化氮 氨和铵盐
在我们空气中含量最多的就是氮气,
为何大多数农作物不能直接利用吸收氮气而需要施氮肥?
无色、无味难溶于水的气体
(1)氮分子内两个氮原子间以 结合,断开该化学键
需要 的能量,所以氮气的化学性质很 ,通常情况下 与其他物质发生化学反应。因此无法被大多数生物体直接吸收。
共价三键(N≡N)
吸收较多
稳定
很难
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}电子式
结构式
氮氮三键
稳定
很难
镁在氮气中燃烧
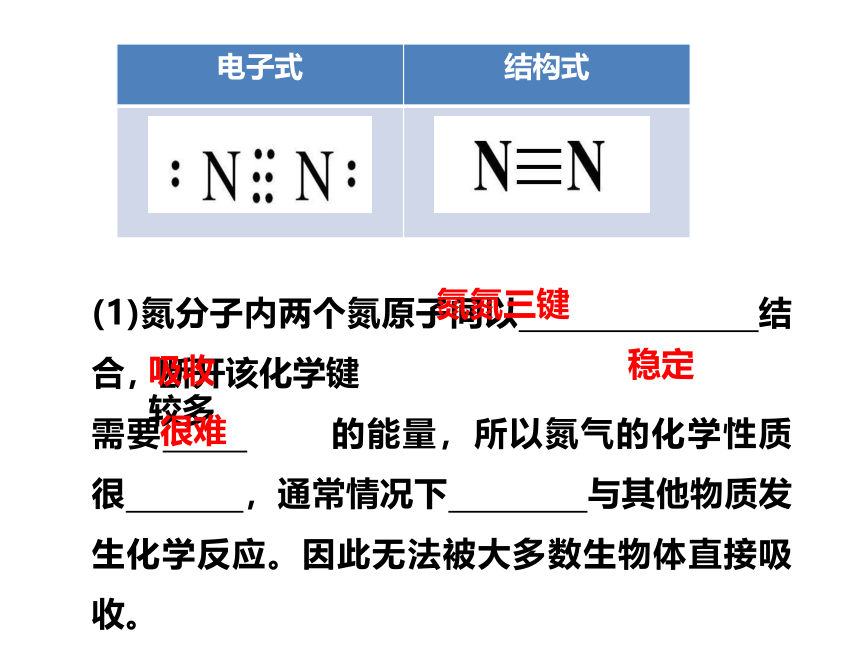
氮的固定: 将大气中_______的氮转化为___________的过程叫做氮的固定。
游离态
含氮化合物
以上反应中,氮气表现什么性?
自 然 固 氮
二、氮的固定
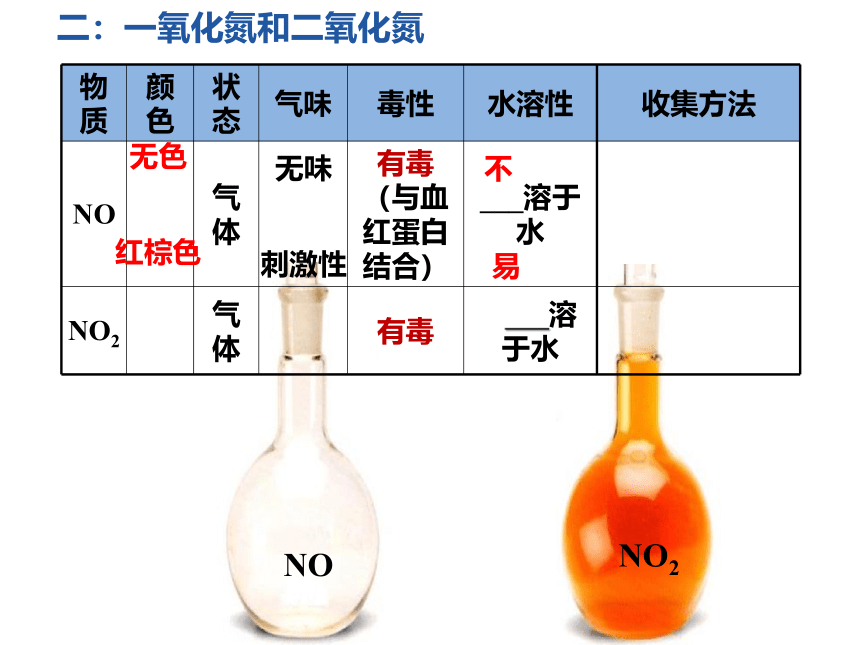
{5940675A-B579-460E-94D1-54222C63F5DA}物质
颜色
状态
气味
毒性
水溶性
收集方法
NO
气体
有毒(与血红蛋白结合)
___溶于水
NO2
气体
有毒
溶于水
二:一氧化氮和二氧化氮
无色
无味
不
红棕色
刺激性
易
NO
NO2
NO化学性质
2NO+O2===2NO2
3NO2+H2O===2HNO3+NO
NO2化学性质
3.2 一氧化氮与二氧化氮的化学性质
NO2尽可能被水吸收实验
NO化学性质
2NO+O2===2NO2
3NO2+H2O===2HNO3+NO
NO2化学性质
3.2 一氧化氮与二氧化氮的化学性质
4 NO2+O2+2H2O=4HNO3
4NO + 3O2 + 2H2O = 4HNO3
NO与NO2的尾气处理
(1)碱液吸收法: NO2 + NaOH =
NO2+NO+ NaOH =
(2)催化转化:
在催化剂、加热条件下,氨将氮氧化物转化为可参与大气循环的气体
或NOx与CO在一定温度下催化转化为可参与大气循环的气体。一般适用汽车尾气的处理。
NaNO3+NaNO2+H2O
2
2
2NaNO2+H2O
2
6NO+4NH3 5N2+6H2O
一定条件
2NO+2CO 2CO2+2N2
催化剂
1. 反应 ,是汽车尾气造成空气污染的主要原因之一。( )
2. 一定温度下,向某容器中充入1molN2和3molH2,反应一段时间后,生成2molNH3。
3.NO2是红棕色气体,易溶于水,属于酸性氧化物。( )
4.NO2可由N2和O2直接化合得到。( )
5.氮的氧化物对应的水化物是强酸。( )
6. 可以用排空气法收集NO。( )
7. 可以用排水法收集NO2。( )
8. 对于NO2与水的反应,氧化剂与还原剂的质量比为1:2。( )
9.对于NO2与水的反应,若有6molNO2参与反应,转移的电子数为8NA。( )
判断正误
×
√
×
×
×
×
×
√
×
下列是氮及其化合物的价类二维图,请写出①-⑦的化学方程式或离子方程式
①
②
③ 2NO+O2===2NO2
④ 4NO + 3O2 + 2H2O === 4HNO3
⑤ NO2+NO+2NaOH === 2NaNO2+H2O
⑥ 3NO2+H2O===2HNO3+NO
⑦ 2NO2 + 2 NaOH === NaNO3+NaNO2+H2O
NO2+NO+2OH— === 2NO2—+H2O
2NO2 + 2OH— === NO3—+NO2—+H2O
在新疆与青海交界处有一山谷, 每当牧民与牧畜进入后,风和日丽的 晴天顷刻间电闪雷鸣,狂风暴雨,把 人畜击毙。人称“魔鬼谷”。然而谷内确是牧草茂盛,四季常青。 老话即雷雨发庄稼
德国化学家,第一个从空气中制造出氨的科学家,使人类从此摆脱了依靠天然氮肥的被动局面,加速了世界农业的发展,因此获得1918年诺贝尔化学奖。
弗里茨·哈伯——合成氨之父
“他是天使,为人类带来丰收和喜悦,
是用空气制造面包的圣人”。
N2+3H2 2NH3
高温、高压
催化剂
无色
有刺激性气味
易液化
极易溶于水
密度比空气小
一、氨(NH3)的物理性质
液氨
制冷剂
氨气易液化变为液氨,液氨汽化时会吸收大量的热,使周围温度急剧降低
(常温下,1体积水大约可溶解
700体积氨气)
氨水:氨的水溶液
实验验证:喷泉实验
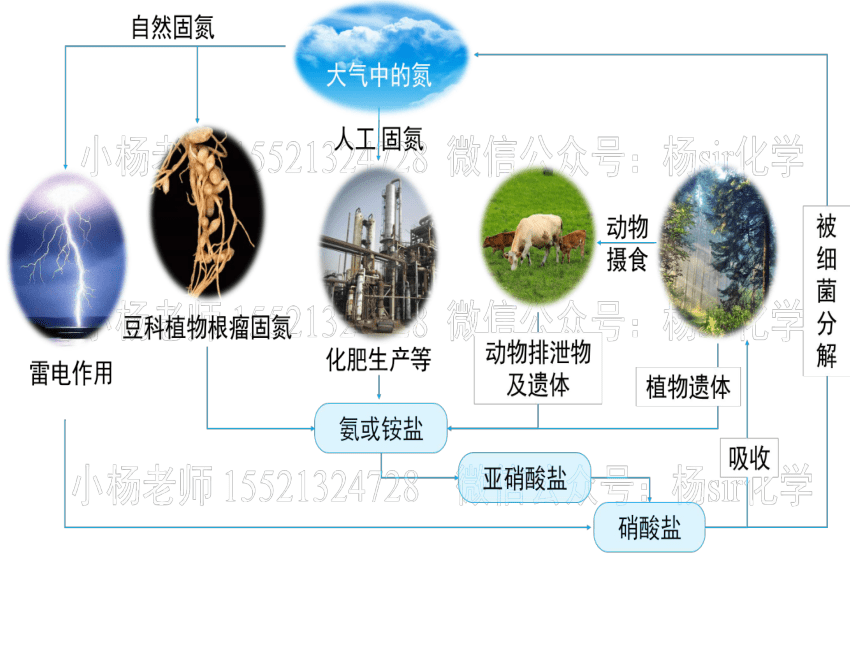
氨的电子式为____________,结构式为___________。
NH3的收集方法:
向下排空气法
【实验5-6】喷泉实验
二、氨的化学性质
1、与水反应
液氨
氨水
一水合氨
物质成分
纯净物(电解质)
粒子种类
NH3·H2O
主要性质
还原性
(不显碱性)
碱性,易挥发
碱性,易分解
纯净物(非电解质)
混合物(既不是电解质也不是非电解质)
NH3分子
H2O、NH3﹑NH3·H2O(主要)
NH4+﹑OH-﹑H+ (3分3离)
NH3·H2O不稳定,易分解
NH3·H2O = NH3↑+H2O
过量氨水与AlCl3溶液反应:
Al3++3NH3·H2O = Al(OH)3↓+3NH4+
NH3+H2O
NH3·H2O
NH4++OH-
补充:常见能形成喷泉的物质组合
气体
HCl
NH3
CO2、SO2、Cl2
NO2/NO2+O2
吸收剂
水或碱溶液
水或酸溶液
碱溶液
水或碱溶液
2、氨气与酸的反应
NH3+HCl=NH4Cl(白烟)
NH3+HNO3=NH4NO3(白烟)
2NH3+H2SO4=(NH4)2SO4
NH3 不能用浓硫酸干燥
此反应可检验NH3
与挥发性酸反应有白烟
“魔棒“生烟
2、氨气与酸的反应
3.氨的还原性
(工业制硝酸的基础)
①催化氧化:
4NH3 + 3O2 === 2N2+ 6H2O
点燃
②氨气在纯氧中燃烧:
③与氯气反应:
2NH3 + 3Cl2 === N2+ 6HCl
8NH3 + 3Cl2 === N2+ 6NH4Cl
④与CuO反应:
2NH3 + 3CuO === N2+ 3H2O+3Cu
(氨气少量,无白烟)
(氨气足量,有白烟)
用浓氨水检验氯气管道是否泄漏
生成可参与大气循环的气体
黑色固体变为红色,
生成气体无毒
氨的用途
制硝酸
制纯碱
制尿素
致冷剂
制炸药
制化肥
情境:如图所示,碳酸铵、碳酸氢铵在太阳下放置,怎么越来越少?碳酸铵、碳酸氢铵不耐热是怎么回事?
铵盐
铵盐:
由铵根离子和酸根离子构成的盐。
NH4Cl、(NH4)2CO3、NH4NO3、(NH4)2SO4等
1、物理性质:
白色晶体、大多数都易溶于水
2、化学性质:
(1)受热易分解:
NH4Cl == NH3↑+HCl↑
△
NH4HCO3 = NH3↑ + CO2↑+ H2O
△
(NH4)2CO3 =
△
2NH3↑+H2O ↑+CO2 ↑
(2)铵盐与碱共热
NH4NO3 + NaOH = NaNO3 + NH3↑ + H2O
Δ
NH4Cl + NaOH = NaCl + NH3↑ + H2O
Δ
(NH4)2SO4 + 2NaOH =
Δ
反应实质:
浓溶液或加热:NH4+ + OH- = NH3↑ + H2O
(2)铵盐与碱共热
Δ
稀溶液:NH4+ + OH- = NH3·H2O
铵盐(NH4+)
刺激性气味
(NH3)
试纸变蓝
蘸有浓盐酸
的玻璃棒
产生白烟
Na2SO4 + 2NH3↑ + 2H2O
湿润的酚酞试纸
试纸变红
Δ
1.判断正误
(1)NH3溶于水溶液呈弱碱性故NH3为弱碱。( )
(2)氨的喷泉实验说明NH3易溶于水。 ( )
(3)氨气遇到浓盐酸会产生白雾。( )
(4)NH3的催化氧化反应中还原产物只有H2O。( )
(5)碘易升华,可用加热升华法除去NH4Cl中混有的I2。( )
(6)氨的水溶液(俗称氨水)显弱碱性,能使酚酞溶液变红或使红色石蕊试纸变蓝。( )
(7)向某溶液中加入稀NaOH溶液,湿润的红色石蕊试纸不变蓝,则原溶液中一定无 NH4+
( )
(8)NH4Cl受热分解,所以可用加热的方法分离NH4Cl和NaCl。( )
(9)氨水与FeCl3溶液反应的离子方程式为:Fe3++3OH— = Fe(OH)3↓
2.农业生产实践中我们发现铵态氮肥与草木灰(主要成分为K2CO3)混合使用时释放出有刺激气味的氨气,同时肥效减弱.据此可以初步推断草木灰显 性,写出NH4Cl和K2CO3反应的化学方程式; 。
×
√
×
×
×
√
×
√
×
碱
2NH4Cl + K2CO3 = 2KCl+2NH3↑ +CO2↑+H2O
加热NH4Cl和Ca(OH)2制取氨气
2NH4Cl + Ca(OH)2 CaCl2 + 2H2O + 2NH3↑
△
1.实验室制备NH3 原理:
试管口略向下倾斜
用碱石灰干燥
向下排空气法收集
防倒吸
验满方法:湿润的红色石蕊试纸变蓝,则收集满
2.制取NH3的其他常见方法
②浓氨水
除了实验室制法,氨还有工业制法(工业合成氨)
N2 + 3H2 2NH3
①加热浓氨水:
NH3·H2O===NH3↑+H2O
NaOH固体
NH3
浓氨水
生石灰
NH3
浓氨水
碱石灰
NH3
Δ
判断正误:
1.实验室用氯化铵和熟石灰加热制NH3的离子方程式:NH4+ + OH— NH3↑+ H2O。( )
△
2.实验室可用以下装置制取NH3 ( )
3.氨可以用浓硫酸来进行干燥。 ( )
4.检验氨可用湿润的蓝色石蕊试纸靠近试管口,观察试纸颜色的变化。( )
×
×
×
×
第二周期 第 ⅤA族
氮在元素周期表中的位置
氮与氮的固定 一氧化氮和二氧化氮 氨和铵盐
在我们空气中含量最多的就是氮气,
为何大多数农作物不能直接利用吸收氮气而需要施氮肥?
无色、无味难溶于水的气体
(1)氮分子内两个氮原子间以 结合,断开该化学键
需要 的能量,所以氮气的化学性质很 ,通常情况下 与其他物质发生化学反应。因此无法被大多数生物体直接吸收。
共价三键(N≡N)
吸收较多
稳定
很难
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}电子式
结构式
氮氮三键
稳定
很难
镁在氮气中燃烧
氮的固定: 将大气中_______的氮转化为___________的过程叫做氮的固定。
游离态
含氮化合物
以上反应中,氮气表现什么性?
自 然 固 氮
二、氮的固定
{5940675A-B579-460E-94D1-54222C63F5DA}物质
颜色
状态
气味
毒性
水溶性
收集方法
NO
气体
有毒(与血红蛋白结合)
___溶于水
NO2
气体
有毒
溶于水
二:一氧化氮和二氧化氮
无色
无味
不
红棕色
刺激性
易
NO
NO2
NO化学性质
2NO+O2===2NO2
3NO2+H2O===2HNO3+NO
NO2化学性质
3.2 一氧化氮与二氧化氮的化学性质
NO2尽可能被水吸收实验
NO化学性质
2NO+O2===2NO2
3NO2+H2O===2HNO3+NO
NO2化学性质
3.2 一氧化氮与二氧化氮的化学性质
4 NO2+O2+2H2O=4HNO3
4NO + 3O2 + 2H2O = 4HNO3
NO与NO2的尾气处理
(1)碱液吸收法: NO2 + NaOH =
NO2+NO+ NaOH =
(2)催化转化:
在催化剂、加热条件下,氨将氮氧化物转化为可参与大气循环的气体
或NOx与CO在一定温度下催化转化为可参与大气循环的气体。一般适用汽车尾气的处理。
NaNO3+NaNO2+H2O
2
2
2NaNO2+H2O
2
6NO+4NH3 5N2+6H2O
一定条件
2NO+2CO 2CO2+2N2
催化剂
1. 反应 ,是汽车尾气造成空气污染的主要原因之一。( )
2. 一定温度下,向某容器中充入1molN2和3molH2,反应一段时间后,生成2molNH3。
3.NO2是红棕色气体,易溶于水,属于酸性氧化物。( )
4.NO2可由N2和O2直接化合得到。( )
5.氮的氧化物对应的水化物是强酸。( )
6. 可以用排空气法收集NO。( )
7. 可以用排水法收集NO2。( )
8. 对于NO2与水的反应,氧化剂与还原剂的质量比为1:2。( )
9.对于NO2与水的反应,若有6molNO2参与反应,转移的电子数为8NA。( )
判断正误
×
√
×
×
×
×
×
√
×
下列是氮及其化合物的价类二维图,请写出①-⑦的化学方程式或离子方程式
①
②
③ 2NO+O2===2NO2
④ 4NO + 3O2 + 2H2O === 4HNO3
⑤ NO2+NO+2NaOH === 2NaNO2+H2O
⑥ 3NO2+H2O===2HNO3+NO
⑦ 2NO2 + 2 NaOH === NaNO3+NaNO2+H2O
NO2+NO+2OH— === 2NO2—+H2O
2NO2 + 2OH— === NO3—+NO2—+H2O
在新疆与青海交界处有一山谷, 每当牧民与牧畜进入后,风和日丽的 晴天顷刻间电闪雷鸣,狂风暴雨,把 人畜击毙。人称“魔鬼谷”。然而谷内确是牧草茂盛,四季常青。 老话即雷雨发庄稼
德国化学家,第一个从空气中制造出氨的科学家,使人类从此摆脱了依靠天然氮肥的被动局面,加速了世界农业的发展,因此获得1918年诺贝尔化学奖。
弗里茨·哈伯——合成氨之父
“他是天使,为人类带来丰收和喜悦,
是用空气制造面包的圣人”。
N2+3H2 2NH3
高温、高压
催化剂
无色
有刺激性气味
易液化
极易溶于水
密度比空气小
一、氨(NH3)的物理性质
液氨
制冷剂
氨气易液化变为液氨,液氨汽化时会吸收大量的热,使周围温度急剧降低
(常温下,1体积水大约可溶解
700体积氨气)
氨水:氨的水溶液
实验验证:喷泉实验
氨的电子式为____________,结构式为___________。
NH3的收集方法:
向下排空气法
【实验5-6】喷泉实验
二、氨的化学性质
1、与水反应
液氨
氨水
一水合氨
物质成分
纯净物(电解质)
粒子种类
NH3·H2O
主要性质
还原性
(不显碱性)
碱性,易挥发
碱性,易分解
纯净物(非电解质)
混合物(既不是电解质也不是非电解质)
NH3分子
H2O、NH3﹑NH3·H2O(主要)
NH4+﹑OH-﹑H+ (3分3离)
NH3·H2O不稳定,易分解
NH3·H2O = NH3↑+H2O
过量氨水与AlCl3溶液反应:
Al3++3NH3·H2O = Al(OH)3↓+3NH4+
NH3+H2O
NH3·H2O
NH4++OH-
补充:常见能形成喷泉的物质组合
气体
HCl
NH3
CO2、SO2、Cl2
NO2/NO2+O2
吸收剂
水或碱溶液
水或酸溶液
碱溶液
水或碱溶液
2、氨气与酸的反应
NH3+HCl=NH4Cl(白烟)
NH3+HNO3=NH4NO3(白烟)
2NH3+H2SO4=(NH4)2SO4
NH3 不能用浓硫酸干燥
此反应可检验NH3
与挥发性酸反应有白烟
“魔棒“生烟
2、氨气与酸的反应
3.氨的还原性
(工业制硝酸的基础)
①催化氧化:
4NH3 + 3O2 === 2N2+ 6H2O
点燃
②氨气在纯氧中燃烧:
③与氯气反应:
2NH3 + 3Cl2 === N2+ 6HCl
8NH3 + 3Cl2 === N2+ 6NH4Cl
④与CuO反应:
2NH3 + 3CuO === N2+ 3H2O+3Cu
(氨气少量,无白烟)
(氨气足量,有白烟)
用浓氨水检验氯气管道是否泄漏
生成可参与大气循环的气体
黑色固体变为红色,
生成气体无毒
氨的用途
制硝酸
制纯碱
制尿素
致冷剂
制炸药
制化肥
情境:如图所示,碳酸铵、碳酸氢铵在太阳下放置,怎么越来越少?碳酸铵、碳酸氢铵不耐热是怎么回事?
铵盐
铵盐:
由铵根离子和酸根离子构成的盐。
NH4Cl、(NH4)2CO3、NH4NO3、(NH4)2SO4等
1、物理性质:
白色晶体、大多数都易溶于水
2、化学性质:
(1)受热易分解:
NH4Cl == NH3↑+HCl↑
△
NH4HCO3 = NH3↑ + CO2↑+ H2O
△
(NH4)2CO3 =
△
2NH3↑+H2O ↑+CO2 ↑
(2)铵盐与碱共热
NH4NO3 + NaOH = NaNO3 + NH3↑ + H2O
Δ
NH4Cl + NaOH = NaCl + NH3↑ + H2O
Δ
(NH4)2SO4 + 2NaOH =
Δ
反应实质:
浓溶液或加热:NH4+ + OH- = NH3↑ + H2O
(2)铵盐与碱共热
Δ
稀溶液:NH4+ + OH- = NH3·H2O
铵盐(NH4+)
刺激性气味
(NH3)
试纸变蓝
蘸有浓盐酸
的玻璃棒
产生白烟
Na2SO4 + 2NH3↑ + 2H2O
湿润的酚酞试纸
试纸变红
Δ
1.判断正误
(1)NH3溶于水溶液呈弱碱性故NH3为弱碱。( )
(2)氨的喷泉实验说明NH3易溶于水。 ( )
(3)氨气遇到浓盐酸会产生白雾。( )
(4)NH3的催化氧化反应中还原产物只有H2O。( )
(5)碘易升华,可用加热升华法除去NH4Cl中混有的I2。( )
(6)氨的水溶液(俗称氨水)显弱碱性,能使酚酞溶液变红或使红色石蕊试纸变蓝。( )
(7)向某溶液中加入稀NaOH溶液,湿润的红色石蕊试纸不变蓝,则原溶液中一定无 NH4+
( )
(8)NH4Cl受热分解,所以可用加热的方法分离NH4Cl和NaCl。( )
(9)氨水与FeCl3溶液反应的离子方程式为:Fe3++3OH— = Fe(OH)3↓
2.农业生产实践中我们发现铵态氮肥与草木灰(主要成分为K2CO3)混合使用时释放出有刺激气味的氨气,同时肥效减弱.据此可以初步推断草木灰显 性,写出NH4Cl和K2CO3反应的化学方程式; 。
×
√
×
×
×
√
×
√
×
碱
2NH4Cl + K2CO3 = 2KCl+2NH3↑ +CO2↑+H2O
加热NH4Cl和Ca(OH)2制取氨气
2NH4Cl + Ca(OH)2 CaCl2 + 2H2O + 2NH3↑
△
1.实验室制备NH3 原理:
试管口略向下倾斜
用碱石灰干燥
向下排空气法收集
防倒吸
验满方法:湿润的红色石蕊试纸变蓝,则收集满
2.制取NH3的其他常见方法
②浓氨水
除了实验室制法,氨还有工业制法(工业合成氨)
N2 + 3H2 2NH3
①加热浓氨水:
NH3·H2O===NH3↑+H2O
NaOH固体
NH3
浓氨水
生石灰
NH3
浓氨水
碱石灰
NH3
Δ
判断正误:
1.实验室用氯化铵和熟石灰加热制NH3的离子方程式:NH4+ + OH— NH3↑+ H2O。( )
△
2.实验室可用以下装置制取NH3 ( )
3.氨可以用浓硫酸来进行干燥。 ( )
4.检验氨可用湿润的蓝色石蕊试纸靠近试管口,观察试纸颜色的变化。( )
×
×
×
×
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
