课题3 溶液的浓度(33张ppt)
文档属性
| 名称 | 课题3 溶液的浓度(33张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-02-28 00:00:00 | ||
图片预览






文档简介
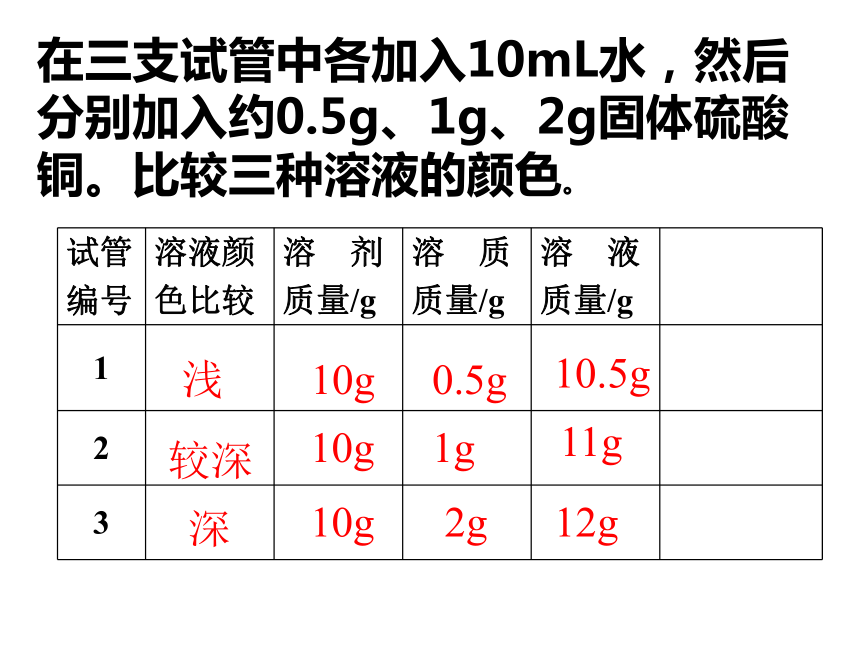
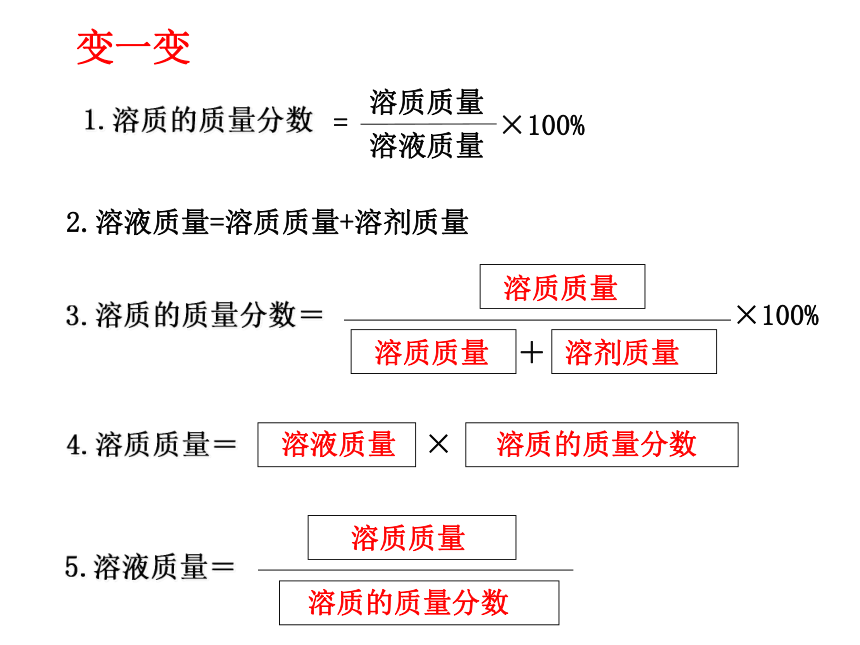
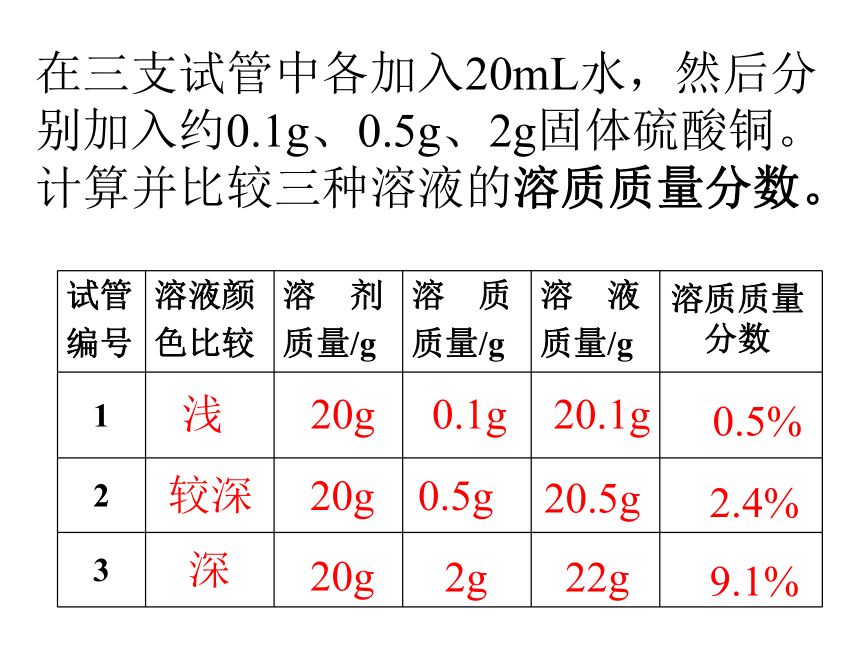
课件33张PPT。课题3 溶液的浓度人为什么可以漂在水面上?是否在所有的水面上都可以? “张裕”葡萄酒庄园在种植解百纳优质葡萄,根据受病虫害程液作低毒高效的杀菌剂,农技师配制三种不同浓度的硫酸铜溶度不同,需要配制波尔多液:如何配呢?我们来当一下农技师。实验9-7颜色:淡蓝 蓝色 深蓝在三支试管中各加入10mL水,然后分别加入约0.5g、1g、2g固体硫酸铜。比较三种溶液的颜色。浅较深深10g10g10g0.5g1g2g10.5g11g12g飞机喷洒农药喷洒药水药液太稀不能杀死害虫和病菌,但药液太浓又会毒害农作物或树木.一、溶质质量分数1、定义:是溶质质量和溶液质量之比 。2、公式:溶质质量溶液质量×100% 溶质质量分数=2.溶液质量=溶质质量+溶剂质量变一变:变一变在三支试管中各加入20mL水,然后分别加入约0.1g、0.5g、2g固体硫酸铜。计算并比较三种溶液的溶质质量分数。
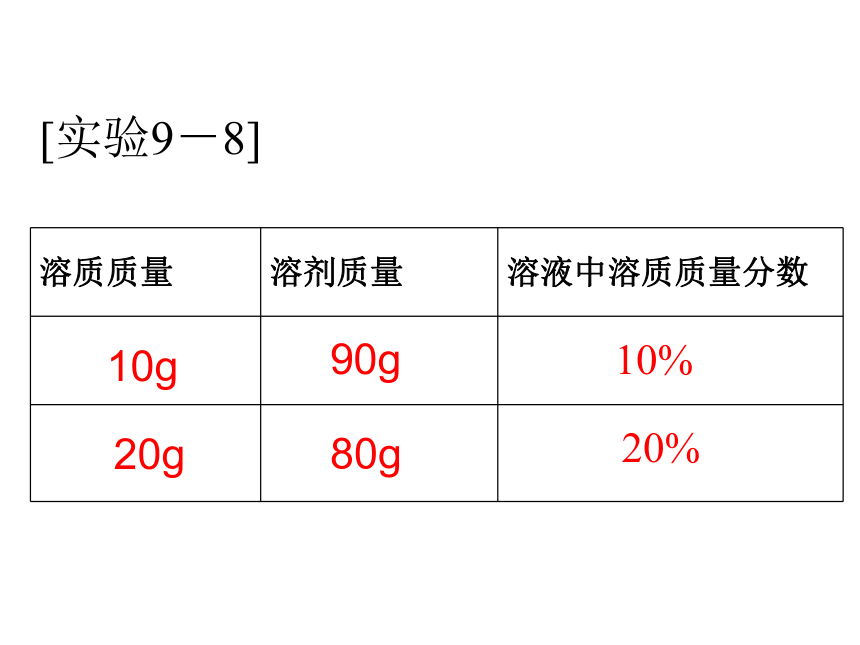
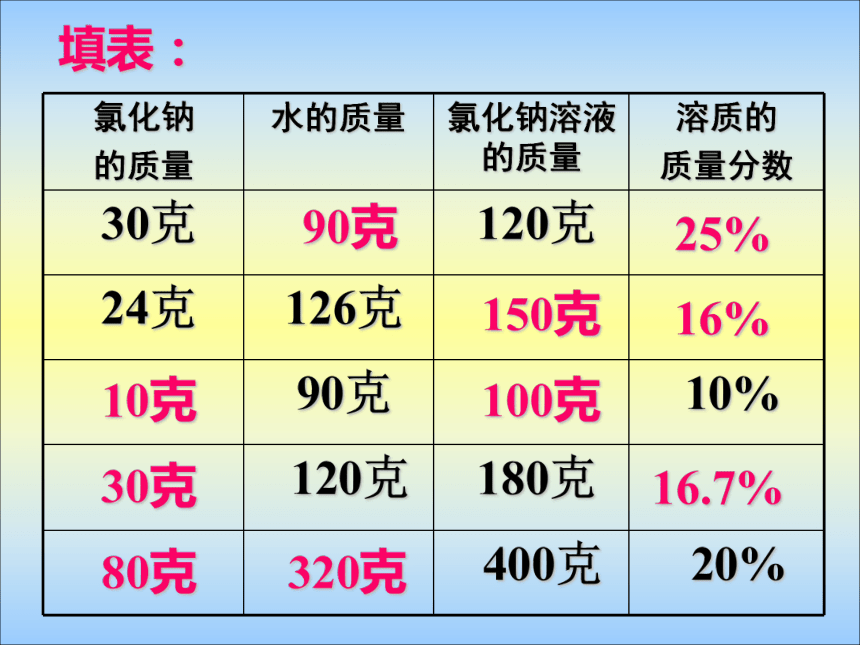
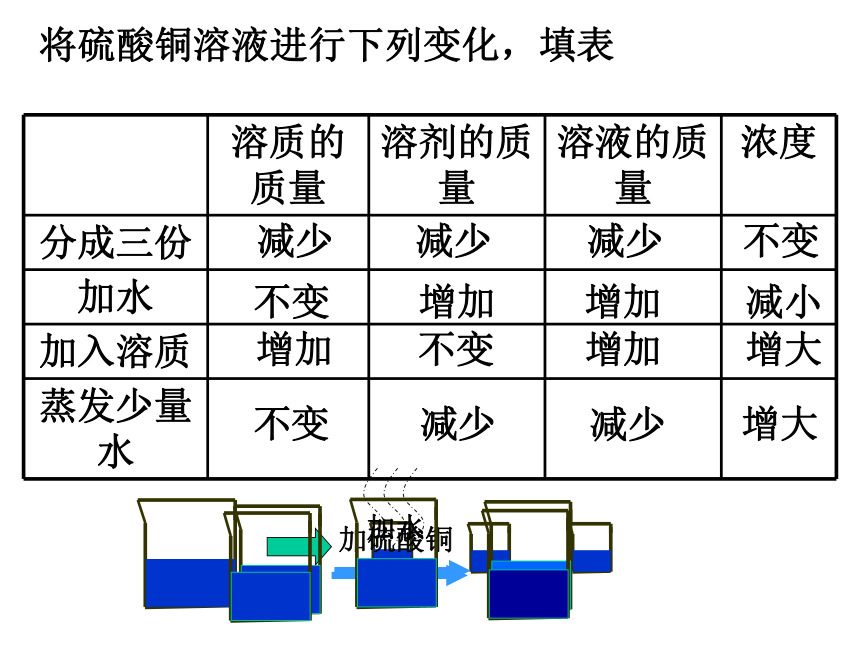
浅较深深20g20g20g0.1g0.5g2g20.1g20.5g22g0.5%2.4%9.1%溶质质量分数[实验9-8]10g20g90g80g10%20%填表:90克25%150克16%10克100克30克16.7%80克320克减少减少减少不变不变增加增加减小增加不变增加增大不变减少减少增大将硫酸铜溶液进行下列变化,填表
① 溶质的质量分数表示溶质质量与溶液质量之比,并不是溶质质量与溶剂质量之比。 ②溶质的质量分数一般用百分数表示。 ③溶质的质量分数计算式中溶质质量与溶液质量的单位必须统一。 ④计算式中溶质质量是指被溶解的那部分溶质的质量,没有被溶解的那部分溶质质量不能计算在内。
注意 [题型一] :有关溶质、溶剂和溶液之间的换算 二、有关溶质质量分数的计算溶质质量溶液质量×100% 溶质质量分数=溶液质量 = 溶质质量 + 溶剂质量计算的依据 :例题1:在农业生产上,常需要用质量分数为16%
的氯化钠溶液来选种。现要配制150kg这种溶液,
需要氯化钠和水的质量各多少?解:所需氯化钠的质量为:
150kg × 16% = 24kg需要水的质量为:150kg - 24kg = 126kg答:配150kg质量分数为16%的氯化钠溶液
需24kg 氯化钠和126kg水练习1、20g 10%的盐水中放入 2g水或2g食盐,求:所得溶液的溶质质量分数。练习2、20g 10%的盐水中倒出一半,求:剩余溶液的溶质的质量分数。剩余溶液的溶质质量分数不变,仍是 10 % 溶质质量分数 计 算解:20g X10%加水:20g +2g=9.1%加盐:20g X10%+2g20g +2g=18.2% 从上述解题过程中,你得到什么规律?求溶质的质量分数的关键是什么? 关键是找出溶质和溶液或溶质的质量
⑴50克硝酸钾完全溶解在100克水中,所得溶液中溶质的质量分数为50%;
⑵ 20升无水酒精溶解在80升水中,所得溶液中溶质的质量分数为20%;
⑶20克氯化钠完全溶解在80千克水中,所得溶液中溶质的质量分数为20%;
⑷20℃时,NaCl的溶解度为36g,则在20℃时,40克NaCl溶解在100克水中所得溶液中溶质质量为40克,溶液质量为140克。判断下列说法是否正确,如果不对的你能说出理由吗?[讨论] :200C时,氯化钠溶解度为36克, (1)若将32克氯化钠溶于100克水里,所得溶液中溶质的质量分数是多少?
(2)若将36克氯化钠溶于100克水里,所得溶液中溶质的质量分数是多少?
(3)若将38克氯化钠溶于100克水里,所得溶液中溶质的质量分数是多少? 从上面例题中你得到什么启示?说明什么问题? 饱和溶液的溶质质量分数= 溶解度100g+溶解度溶质的质量分数36% 是指:
溶质T0C时溶解度36g是指:溶质质量分数与溶解度的比较在一定温度下的饱和溶液是最浓的溶液。100g溶液中含有36g溶质。在T0C 时,100g水最多溶解该溶质36g。一定温度下某物质的浓度与溶解度的比较表示溶液中溶质
质量的多少表示物质
溶解性的强弱 不一定一 定 不一定 不一定100克单位为1,省略不写必须饱和质量单位(克)[题型二]:饱和溶液中溶质的质量分数计算 计算的依据 :饱和溶液的溶质质量分数= 溶解度100g+溶解度注意:必须强调在一定的温度下 例2、已知20℃时食盐的溶解度为36g,求20℃时食盐饱和溶液的溶质质量分数。 解:20℃时食盐饱和溶液的溶质质量分数为=26.5%36g100g+36g答:20℃时食盐饱和溶液的溶质质量分数为26.5%
向20%的某浓溶液中加水后溶液、溶质和溶剂的质量如何变化? 如何解决有关溶液稀释的计算? ? [题型三] :有关溶液稀释或浓缩的计算计算的依据 : 稀释前溶质质量 = 稀释后溶质质量 浓缩前溶质质量 = 浓缩后溶质质量例题3:化学实验室现有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液需要多少克水?解:设稀释后溶液的质量为x50g × 98% = X × 20%X = 答:需要水的质量195g需要水的质量= 245 g– 50g = 195g练习:配制10%硫酸98g,要98%硫酸(密度为1.84g/m L )多少mL ?解:设需要98%硫酸的体积为V V × 1.84g/mL × 98% = 98g × 10%V = 答:要98%硫酸5.4mL
小试牛刀:1、配制100mL密度为1.1g/mL的20%的NaCl溶液
需要多少gNaCl和多少g水?2、配制500m L20%的硫酸溶液(密度为1.14g/mL)
需要98%硫酸溶液(密度为1.84g / mL )多少mL ?解:所需NaCl的质量为:100mL×1.1g/mL×20% = 22g所需水的质量为:100mL× 1.1g/mL – 22g = 88g答:略解:设需要98%硫酸的体积为V500mL× 1.14g/mL×20%= V× 1.84g/mL ×98%V=答:略 实验室用100g稀硫酸和多少克锌恰好完全反应可制得0.8g氢气。H2SO4 + Zn = ZnSO4 + H298 65100g X答:略A解:设所需锌的质量为 XX=66.3gH2SO4 + Zn = ZnSO4 + H265 2X 0.8gB解:设所需锌的质量为 XX=26g下面哪种解法正确?注意点:溶液是混合物,溶液的质量不能直接代入
化学方程式中计算,必须换算成溶质的质量。例题4:100g 9.8%硫酸跟多少克锌反应?同时生成多少克氢气?解:100g9.8%硫酸中含纯硫酸的质量为:100g×9.8%=9.8g设参加反应的锌质量为X ,生成氢气的质量为YZn + H2SO4 = ZnSO4 + H2↑65 98 2X 9.8g YX=6.5g Y=0.2g答:略[题型四]: 有关化学方程式的计算 练习:实验室用100g稀硫酸和一定量的锌完全反应
在,制得0.8g氢气。求该稀硫酸溶质的质量分数。解:设稀硫酸溶质的质量分数为x%H2SO4 + Zn = ZnSO4 + H2 ↑98 2100g × x% 0.8gX%==39.2%答:略10%葡萄糖注射液的浓度0.9%生理盐水中NaCl的含量生产生活中的常见溶液(标签)9%(v/v)8%(v/v)52%(v/v)酒类的酒精度白醋的浓度再见!
① 溶质的质量分数表示溶质质量与溶液质量之比,并不是溶质质量与溶剂质量之比。 ②溶质的质量分数一般用百分数表示。 ③溶质的质量分数计算式中溶质质量与溶液质量的单位必须统一。 ④计算式中溶质质量是指被溶解的那部分溶质的质量,没有被溶解的那部分溶质质量不能计算在内。
注意 [题型一] :有关溶质、溶剂和溶液之间的换算 二、有关溶质质量分数的计算溶质质量溶液质量×100% 溶质质量分数=溶液质量 = 溶质质量 + 溶剂质量计算的依据 :例题1:在农业生产上,常需要用质量分数为16%
的氯化钠溶液来选种。现要配制150kg这种溶液,
需要氯化钠和水的质量各多少?解:所需氯化钠的质量为:
150kg × 16% = 24kg需要水的质量为:150kg - 24kg = 126kg答:配150kg质量分数为16%的氯化钠溶液
需24kg 氯化钠和126kg水练习1、20g 10%的盐水中放入 2g水或2g食盐,求:所得溶液的溶质质量分数。练习2、20g 10%的盐水中倒出一半,求:剩余溶液的溶质的质量分数。剩余溶液的溶质质量分数不变,仍是 10 % 溶质质量分数 计 算解:20g X10%加水:20g +2g=9.1%加盐:20g X10%+2g20g +2g=18.2% 从上述解题过程中,你得到什么规律?求溶质的质量分数的关键是什么? 关键是找出溶质和溶液或溶质的质量
⑴50克硝酸钾完全溶解在100克水中,所得溶液中溶质的质量分数为50%;
⑵ 20升无水酒精溶解在80升水中,所得溶液中溶质的质量分数为20%;
⑶20克氯化钠完全溶解在80千克水中,所得溶液中溶质的质量分数为20%;
⑷20℃时,NaCl的溶解度为36g,则在20℃时,40克NaCl溶解在100克水中所得溶液中溶质质量为40克,溶液质量为140克。判断下列说法是否正确,如果不对的你能说出理由吗?[讨论] :200C时,氯化钠溶解度为36克, (1)若将32克氯化钠溶于100克水里,所得溶液中溶质的质量分数是多少?
(2)若将36克氯化钠溶于100克水里,所得溶液中溶质的质量分数是多少?
(3)若将38克氯化钠溶于100克水里,所得溶液中溶质的质量分数是多少? 从上面例题中你得到什么启示?说明什么问题? 饱和溶液的溶质质量分数= 溶解度100g+溶解度溶质的质量分数36% 是指:
溶质T0C时溶解度36g是指:溶质质量分数与溶解度的比较在一定温度下的饱和溶液是最浓的溶液。100g溶液中含有36g溶质。在T0C 时,100g水最多溶解该溶质36g。一定温度下某物质的浓度与溶解度的比较表示溶液中溶质
质量的多少表示物质
溶解性的强弱 不一定一 定 不一定 不一定100克单位为1,省略不写必须饱和质量单位(克)[题型二]:饱和溶液中溶质的质量分数计算 计算的依据 :饱和溶液的溶质质量分数= 溶解度100g+溶解度注意:必须强调在一定的温度下 例2、已知20℃时食盐的溶解度为36g,求20℃时食盐饱和溶液的溶质质量分数。 解:20℃时食盐饱和溶液的溶质质量分数为=26.5%36g100g+36g答:20℃时食盐饱和溶液的溶质质量分数为26.5%
向20%的某浓溶液中加水后溶液、溶质和溶剂的质量如何变化? 如何解决有关溶液稀释的计算? ? [题型三] :有关溶液稀释或浓缩的计算计算的依据 : 稀释前溶质质量 = 稀释后溶质质量 浓缩前溶质质量 = 浓缩后溶质质量例题3:化学实验室现有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液需要多少克水?解:设稀释后溶液的质量为x50g × 98% = X × 20%X = 答:需要水的质量195g需要水的质量= 245 g– 50g = 195g练习:配制10%硫酸98g,要98%硫酸(密度为1.84g/m L )多少mL ?解:设需要98%硫酸的体积为V V × 1.84g/mL × 98% = 98g × 10%V = 答:要98%硫酸5.4mL
小试牛刀:1、配制100mL密度为1.1g/mL的20%的NaCl溶液
需要多少gNaCl和多少g水?2、配制500m L20%的硫酸溶液(密度为1.14g/mL)
需要98%硫酸溶液(密度为1.84g / mL )多少mL ?解:所需NaCl的质量为:100mL×1.1g/mL×20% = 22g所需水的质量为:100mL× 1.1g/mL – 22g = 88g答:略解:设需要98%硫酸的体积为V500mL× 1.14g/mL×20%= V× 1.84g/mL ×98%V=答:略 实验室用100g稀硫酸和多少克锌恰好完全反应可制得0.8g氢气。H2SO4 + Zn = ZnSO4 + H298 65100g X答:略A解:设所需锌的质量为 XX=66.3gH2SO4 + Zn = ZnSO4 + H265 2X 0.8gB解:设所需锌的质量为 XX=26g下面哪种解法正确?注意点:溶液是混合物,溶液的质量不能直接代入
化学方程式中计算,必须换算成溶质的质量。例题4:100g 9.8%硫酸跟多少克锌反应?同时生成多少克氢气?解:100g9.8%硫酸中含纯硫酸的质量为:100g×9.8%=9.8g设参加反应的锌质量为X ,生成氢气的质量为YZn + H2SO4 = ZnSO4 + H2↑65 98 2X 9.8g YX=6.5g Y=0.2g答:略[题型四]: 有关化学方程式的计算 练习:实验室用100g稀硫酸和一定量的锌完全反应
在,制得0.8g氢气。求该稀硫酸溶质的质量分数。解:设稀硫酸溶质的质量分数为x%H2SO4 + Zn = ZnSO4 + H2 ↑98 2100g × x% 0.8gX%==39.2%答:略10%葡萄糖注射液的浓度0.9%生理盐水中NaCl的含量生产生活中的常见溶液(标签)9%(v/v)8%(v/v)52%(v/v)酒类的酒精度白醋的浓度再见!
同课章节目录
