化学人教版九下:11.1 生活中常见的盐(第2课时)课后作业(含答案)
文档属性
| 名称 | 化学人教版九下:11.1 生活中常见的盐(第2课时)课后作业(含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 465.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-17 21:43:14 | ||
图片预览


文档简介
11.1 生活中常见的盐(第2课时)
一、单选题
下列关于碳酸钠与碳酸氢钠的说法错误的是( )
A. 溶液呈碱性 B. 固体难溶于水
C. “纯碱”是碳酸钠的俗名 D. 可用于烘焙糕点
下列物质能治疗胃酸过多的是( )
A. B. C. D. 2
下列说法不正确的是( )
A. 小苏打是碳酸氢钠的俗称,是发酵粉的主要成分之一,还可以治疗胃酸过多症
B. 纯碱属于碱类,可用于玻璃、造纸、纺织、洗涤剂的生产
C. 大理石、石灰石的主要成分相同,都是重要的建筑材料
D. 胃酸中含有适量的盐酸,帮助消化,增加食欲
利用反应可以测定发酵粉中碳酸氢钠的含量。现取一定量的发酵粉,向其中逐滴加入稀盐酸假设发酵粉中的其他物质都不与盐酸发生反应。下列曲线所表示的变化趋势不正确的是( )
A. B.
C. D.
化学与生活息息相关。下列说法中,不合理的是( )
A. 干冰可用作环保制冷剂
B. 医用酒精可用于杀菌消毒
C. 小苏打可用于治疗胃酸过多
D. 室内洒水可防止煤气中毒
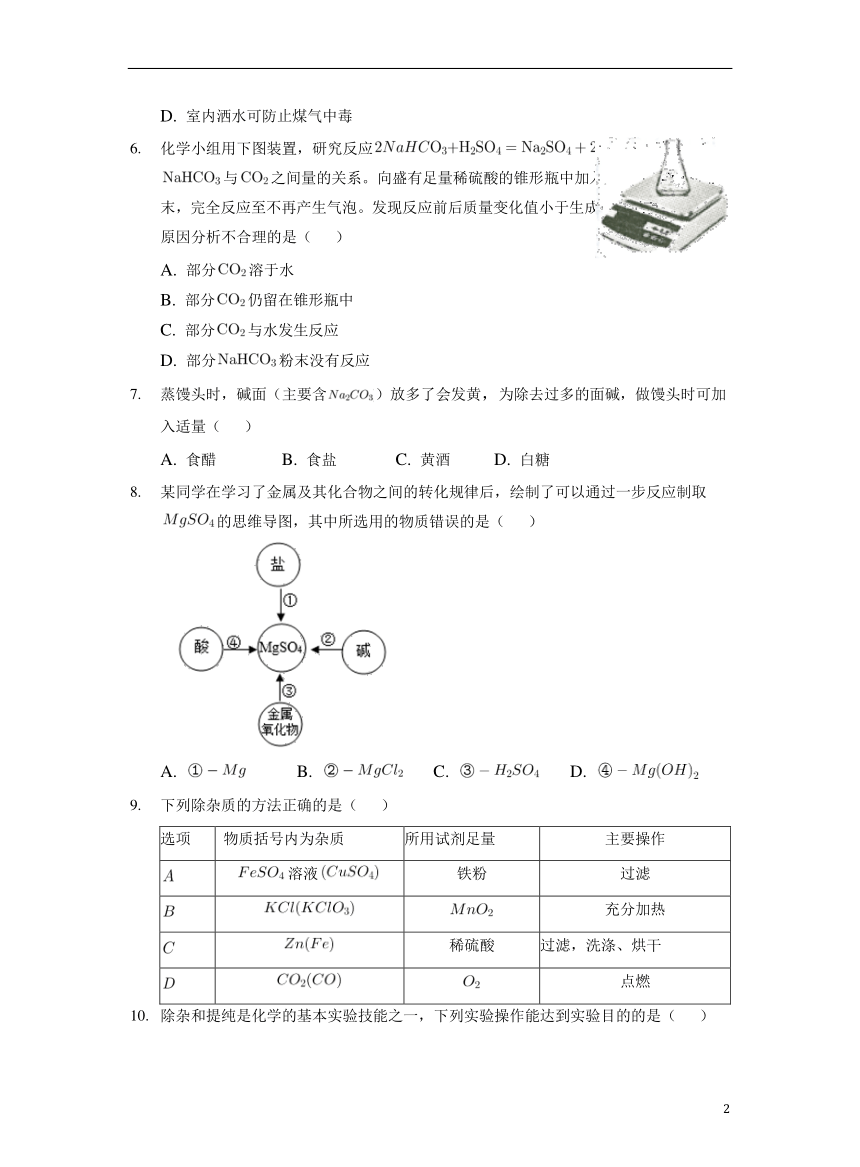
化学小组用下图装置,研究反应中与之间量的关系。向盛有足量稀硫酸的锥形瓶中加入粉末,完全反应至不再产生气泡。发现反应前后质量变化值小于生成质量的理论值,原因分析不合理的是( )
A. 部分溶于水
B. 部分仍留在锥形瓶中
C. 部分与水发生反应
D. 部分粉末没有反应
蒸馒头时,碱面(主要含)放多了会发黄,为除去过多的面碱,做馒头时可加入适量( )
A. 食醋 B. 食盐 C. 黄酒 D. 白糖
某同学在学习了金属及其化合物之间的转化规律后,绘制了可以通过一步反应制取的思维导图,其中所选用的物质错误的是( )
A. B. C. D.
下列除杂质的方法正确的是( )
选项 物质括号内为杂质 所用试剂足量 主要操作
溶液 铁粉 过滤
充分加热
稀硫酸 过滤,洗涤、烘干
点燃
除杂和提纯是化学的基本实验技能之一,下列实验操作能达到实验目的的是( )
选项 物质 所含杂质 加入的试剂和操作
点燃
灼热的铜网
溶液 加入适量铁粉,过滤
适量的稀盐酸
下列物质的转化均能一步实现的是( )
A. B.
C. D.
下列实验操作能达到实验目的是( )
选项 实验目的 实验操作
鉴别木炭粉和铁粉 加稀盐酸,观察有无气泡产生
鉴别氮气和二氧化碳 将燃着的木条分别伸入盛气体的集气瓶中
除去一氧化碳中的氧气 将气体缓慢通过灼热的铜网
除去溶液中少量的 加入足量锌粉,充分反应后过滤
将足量和依次通入饱和食盐水,发生反应:
;
。
下列说法正确的是( )
A. 总的化学方程式为
B. 上述反应过程中观察不到明显现象
C. 反应是有沉淀生成的复分解反应
D. 上述反应中有元素化合价发生变化
现有盐酸和的混合溶液,向其中逐滴加入过量的某物质,溶液的随滴入的量的变化关系如图所示,则可能是( )
A. 水
B. 纯碱
C. 澄清石灰水
D. 稀盐酸
二、实验题
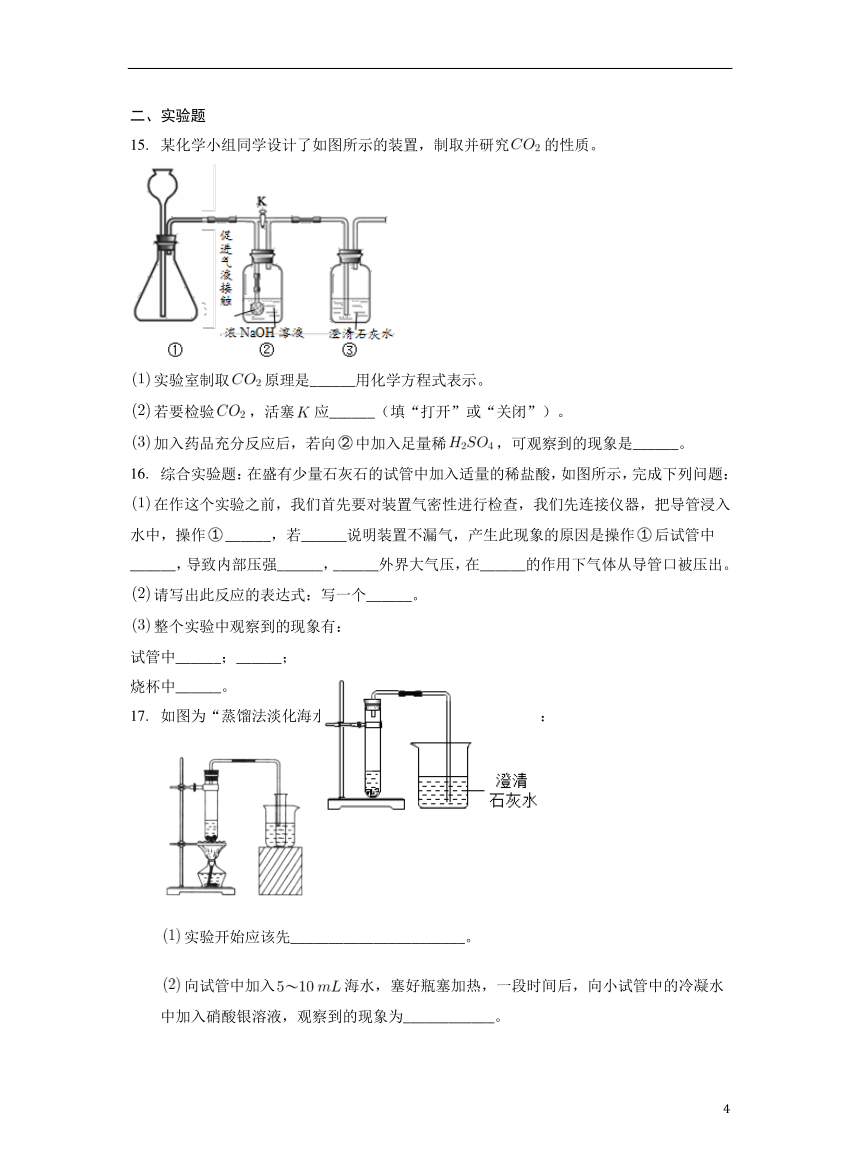
某化学小组同学设计了如图所示的装置,制取并研究的性质。
实验室制取原理是______用化学方程式表示。
若要检验,活塞应______(填“打开”或“关闭”)。
加入药品充分反应后,若向中加入足量稀,可观察到的现象是______。
综合实验题:在盛有少量石灰石的试管中加入适量的稀盐酸,如图所示,完成下列问题:
在作这个实验之前,我们首先要对装置气密性进行检查,我们先连接仪器,把导管浸入水中,操作______,若______说明装置不漏气,产生此现象的原因是操作后试管中______,导致内部压强______,______外界大气压,在______的作用下气体从导管口被压出。
请写出此反应的表达式:写一个______。
整个实验中观察到的现象有:
试管中______;______;
烧杯中______。
如图为“蒸馏法淡化海水”的实验装置,请回答下列问题:
实验开始应该先_______________________。
向试管中加入海水,塞好瓶塞加热,一段时间后,向小试管中的冷凝水中加入硝酸银溶液,观察到的现象为____________。
下列哪种方法冷凝效果最好?________。
A.玻璃管加长 B.在烧杯内加冰块 C.使用冷凝器
实验结束时应该先________填“撤导管”或“熄灭酒精灯”,这样做的目的是____________________。
某同学向海水中加入硝酸银溶液做对比实验,发现有白色沉淀产生,该反应的化学方程式为_______________。
二氧化碳在生活中有广泛的用途,下图是甲组同学利用大理石粉末含杂质,杂质不溶于水,也不与酸反应和稀盐酸,进行实验室制取及其性质的探究实验。
图中仪器的名称是_____________。
装置中放有干燥和湿润的试纸各一张,当通入一段时间后,湿润的试纸显示的_______填“”、“”或“”。
实验进行一段时间后,装置中观察到的实验现象是______________________。
根据装置中的现象,推测在生活中的用途:________________________。
实验结束后,乙组同学又检验了装置中所得溶液的溶质成分,设计了如下方案:
他们将其过滤,得到无色透明的溶液,实验中,玻璃棒的作用是_________。
然后从中取出溶液,逐滴滴入溶液,生成沉淀的质量与滴入溶液质量关系如图甲所示;反应过程中溶液的与滴入溶液质量关系如图乙所示。
请根据坐标图像,分析装置所得溶液中溶质的成分为_________________。
请将图乙的坐标图像补充完整。
请根据实验数据,计算反应后装置溶液中氯化钙的质量分数。
甲、乙两位同学在学完酸的化学性质后,在老师指导下进行了如下实验:
实验结束,甲先将废液缓慢倒入废液缸中;随后乙也将废液缓慢倒入到同一废液缸中。
【观察与分析】乙同学观察到废液缸中先有气泡产生,然后又出现了白色沉淀。产生的气体是________;白色沉淀是溶液与________溶液反应产生的。
【提出问题】最终废液中含有什么溶质
【猜想与假设】猜想:废液中含有、两种溶质;
猜想二:废液中含有、两种溶质;
猜想三:废液中含有、两种溶质。
【实验设计与探究】
实验方案 实验现象 结论
甲 取少量废液于试管中,向其 中滴加溶液 无明显现象 猜想一、三不成立, 猜想二成立
乙 取少量废液于试管中,向其 中滴加溶液 出现白色沉淀 猜想一、三不成立, 猜想二成立
【反思与评价】
【猜想与假设】中,猜想________是不合理的。猜想也不完整,请补充:猜想四:________。
老师认为甲同学的【实验设计与探究】结论实际上是不合理的,理由是________。
若猜想四成立,则所得溶液中溶质的质量为________。
利用下图所示装置研究以下问题。
利用图研究燃烧的条件:
水槽中放一定量热水,水面下处放一小块白磷,观察到白磷不燃烧。在乙中放入二氧化锰和过氧化氢溶液,立即将甲倒扣在乙上,观察到甲中水面下降,白磷露出水面,______通过对比实验研究了燃烧的一个条件,它是______。
利用图研究二氧化碳与氢氧化钠能反应,并检验反应后所得溶液中溶质的成分。
已知:氯化钙溶液呈中性,能与碳酸钠溶液发生复分解反应。
溶液是______。
为达到上述实验目的,应进行的操作是:先打开______通过观察现象,得出结论。
参考答案
1.【答案】B
2.【答案】C
3.【答案】B
4.【答案】D
5.【答案】D
6.【答案】D
7.【答案】A
8.【答案】B
9.【答案】A
10.【答案】B
11.【答案】A
12.【答案】A
13.【答案】C
14.【答案】B
15.【答案】
打开
产生大量气泡
16.【答案】用手紧握试管 导管口有气泡冒出 温度升高 增大 大于 压力 固体表面产生气泡 固体逐渐减少 澄清的石灰水变浑浊
17.【答案】检查装置气密性
无白色沉淀产生
撤导管;防止水倒吸
18.【答案】长颈漏斗
澄清石灰水变浑浊
做灭火剂
引流; 、 ;
解:设反应后装置溶液中的质量为
则氯化钙的质量分数
答:反应后装置溶液中氯化钙的质量分数为。
19.【答案】【观察与分析】
;
【反思与评价】
三;废液中只含有一种溶质
该实验只能说明废液中无氯化钙,,无法确定是否有碳酸钠或废液中只含有氯化钠也无明显现象,无法确定猜想二成立。叙述合理即可
20.【答案】白磷燃烧,产生白烟;燃烧需要氧气
含酚酞的氢氧化钠溶液;,滴入一定量的溶液,关闭,充分反应后打开,滴入过量的氯化钙溶液,关闭。
2
1
一、单选题
下列关于碳酸钠与碳酸氢钠的说法错误的是( )
A. 溶液呈碱性 B. 固体难溶于水
C. “纯碱”是碳酸钠的俗名 D. 可用于烘焙糕点
下列物质能治疗胃酸过多的是( )
A. B. C. D. 2
下列说法不正确的是( )
A. 小苏打是碳酸氢钠的俗称,是发酵粉的主要成分之一,还可以治疗胃酸过多症
B. 纯碱属于碱类,可用于玻璃、造纸、纺织、洗涤剂的生产
C. 大理石、石灰石的主要成分相同,都是重要的建筑材料
D. 胃酸中含有适量的盐酸,帮助消化,增加食欲
利用反应可以测定发酵粉中碳酸氢钠的含量。现取一定量的发酵粉,向其中逐滴加入稀盐酸假设发酵粉中的其他物质都不与盐酸发生反应。下列曲线所表示的变化趋势不正确的是( )
A. B.
C. D.
化学与生活息息相关。下列说法中,不合理的是( )
A. 干冰可用作环保制冷剂
B. 医用酒精可用于杀菌消毒
C. 小苏打可用于治疗胃酸过多
D. 室内洒水可防止煤气中毒
化学小组用下图装置,研究反应中与之间量的关系。向盛有足量稀硫酸的锥形瓶中加入粉末,完全反应至不再产生气泡。发现反应前后质量变化值小于生成质量的理论值,原因分析不合理的是( )
A. 部分溶于水
B. 部分仍留在锥形瓶中
C. 部分与水发生反应
D. 部分粉末没有反应
蒸馒头时,碱面(主要含)放多了会发黄,为除去过多的面碱,做馒头时可加入适量( )
A. 食醋 B. 食盐 C. 黄酒 D. 白糖
某同学在学习了金属及其化合物之间的转化规律后,绘制了可以通过一步反应制取的思维导图,其中所选用的物质错误的是( )
A. B. C. D.
下列除杂质的方法正确的是( )
选项 物质括号内为杂质 所用试剂足量 主要操作
溶液 铁粉 过滤
充分加热
稀硫酸 过滤,洗涤、烘干
点燃
除杂和提纯是化学的基本实验技能之一,下列实验操作能达到实验目的的是( )
选项 物质 所含杂质 加入的试剂和操作
点燃
灼热的铜网
溶液 加入适量铁粉,过滤
适量的稀盐酸
下列物质的转化均能一步实现的是( )
A. B.
C. D.
下列实验操作能达到实验目的是( )
选项 实验目的 实验操作
鉴别木炭粉和铁粉 加稀盐酸,观察有无气泡产生
鉴别氮气和二氧化碳 将燃着的木条分别伸入盛气体的集气瓶中
除去一氧化碳中的氧气 将气体缓慢通过灼热的铜网
除去溶液中少量的 加入足量锌粉,充分反应后过滤
将足量和依次通入饱和食盐水,发生反应:
;
。
下列说法正确的是( )
A. 总的化学方程式为
B. 上述反应过程中观察不到明显现象
C. 反应是有沉淀生成的复分解反应
D. 上述反应中有元素化合价发生变化
现有盐酸和的混合溶液,向其中逐滴加入过量的某物质,溶液的随滴入的量的变化关系如图所示,则可能是( )
A. 水
B. 纯碱
C. 澄清石灰水
D. 稀盐酸
二、实验题
某化学小组同学设计了如图所示的装置,制取并研究的性质。
实验室制取原理是______用化学方程式表示。
若要检验,活塞应______(填“打开”或“关闭”)。
加入药品充分反应后,若向中加入足量稀,可观察到的现象是______。
综合实验题:在盛有少量石灰石的试管中加入适量的稀盐酸,如图所示,完成下列问题:
在作这个实验之前,我们首先要对装置气密性进行检查,我们先连接仪器,把导管浸入水中,操作______,若______说明装置不漏气,产生此现象的原因是操作后试管中______,导致内部压强______,______外界大气压,在______的作用下气体从导管口被压出。
请写出此反应的表达式:写一个______。
整个实验中观察到的现象有:
试管中______;______;
烧杯中______。
如图为“蒸馏法淡化海水”的实验装置,请回答下列问题:
实验开始应该先_______________________。
向试管中加入海水,塞好瓶塞加热,一段时间后,向小试管中的冷凝水中加入硝酸银溶液,观察到的现象为____________。
下列哪种方法冷凝效果最好?________。
A.玻璃管加长 B.在烧杯内加冰块 C.使用冷凝器
实验结束时应该先________填“撤导管”或“熄灭酒精灯”,这样做的目的是____________________。
某同学向海水中加入硝酸银溶液做对比实验,发现有白色沉淀产生,该反应的化学方程式为_______________。
二氧化碳在生活中有广泛的用途,下图是甲组同学利用大理石粉末含杂质,杂质不溶于水,也不与酸反应和稀盐酸,进行实验室制取及其性质的探究实验。
图中仪器的名称是_____________。
装置中放有干燥和湿润的试纸各一张,当通入一段时间后,湿润的试纸显示的_______填“”、“”或“”。
实验进行一段时间后,装置中观察到的实验现象是______________________。
根据装置中的现象,推测在生活中的用途:________________________。
实验结束后,乙组同学又检验了装置中所得溶液的溶质成分,设计了如下方案:
他们将其过滤,得到无色透明的溶液,实验中,玻璃棒的作用是_________。
然后从中取出溶液,逐滴滴入溶液,生成沉淀的质量与滴入溶液质量关系如图甲所示;反应过程中溶液的与滴入溶液质量关系如图乙所示。
请根据坐标图像,分析装置所得溶液中溶质的成分为_________________。
请将图乙的坐标图像补充完整。
请根据实验数据,计算反应后装置溶液中氯化钙的质量分数。
甲、乙两位同学在学完酸的化学性质后,在老师指导下进行了如下实验:
实验结束,甲先将废液缓慢倒入废液缸中;随后乙也将废液缓慢倒入到同一废液缸中。
【观察与分析】乙同学观察到废液缸中先有气泡产生,然后又出现了白色沉淀。产生的气体是________;白色沉淀是溶液与________溶液反应产生的。
【提出问题】最终废液中含有什么溶质
【猜想与假设】猜想:废液中含有、两种溶质;
猜想二:废液中含有、两种溶质;
猜想三:废液中含有、两种溶质。
【实验设计与探究】
实验方案 实验现象 结论
甲 取少量废液于试管中,向其 中滴加溶液 无明显现象 猜想一、三不成立, 猜想二成立
乙 取少量废液于试管中,向其 中滴加溶液 出现白色沉淀 猜想一、三不成立, 猜想二成立
【反思与评价】
【猜想与假设】中,猜想________是不合理的。猜想也不完整,请补充:猜想四:________。
老师认为甲同学的【实验设计与探究】结论实际上是不合理的,理由是________。
若猜想四成立,则所得溶液中溶质的质量为________。
利用下图所示装置研究以下问题。
利用图研究燃烧的条件:
水槽中放一定量热水,水面下处放一小块白磷,观察到白磷不燃烧。在乙中放入二氧化锰和过氧化氢溶液,立即将甲倒扣在乙上,观察到甲中水面下降,白磷露出水面,______通过对比实验研究了燃烧的一个条件,它是______。
利用图研究二氧化碳与氢氧化钠能反应,并检验反应后所得溶液中溶质的成分。
已知:氯化钙溶液呈中性,能与碳酸钠溶液发生复分解反应。
溶液是______。
为达到上述实验目的,应进行的操作是:先打开______通过观察现象,得出结论。
参考答案
1.【答案】B
2.【答案】C
3.【答案】B
4.【答案】D
5.【答案】D
6.【答案】D
7.【答案】A
8.【答案】B
9.【答案】A
10.【答案】B
11.【答案】A
12.【答案】A
13.【答案】C
14.【答案】B
15.【答案】
打开
产生大量气泡
16.【答案】用手紧握试管 导管口有气泡冒出 温度升高 增大 大于 压力 固体表面产生气泡 固体逐渐减少 澄清的石灰水变浑浊
17.【答案】检查装置气密性
无白色沉淀产生
撤导管;防止水倒吸
18.【答案】长颈漏斗
澄清石灰水变浑浊
做灭火剂
引流; 、 ;
解:设反应后装置溶液中的质量为
则氯化钙的质量分数
答:反应后装置溶液中氯化钙的质量分数为。
19.【答案】【观察与分析】
;
【反思与评价】
三;废液中只含有一种溶质
该实验只能说明废液中无氯化钙,,无法确定是否有碳酸钠或废液中只含有氯化钠也无明显现象,无法确定猜想二成立。叙述合理即可
20.【答案】白磷燃烧,产生白烟;燃烧需要氧气
含酚酞的氢氧化钠溶液;,滴入一定量的溶液,关闭,充分反应后打开,滴入过量的氯化钙溶液,关闭。
2
1
同课章节目录
