2023届高考化学三轮冲刺 第6题 新型电源、电解应用与金属腐蚀 课件(共95张PPT)
文档属性
| 名称 | 2023届高考化学三轮冲刺 第6题 新型电源、电解应用与金属腐蚀 课件(共95张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 6.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-17 22:01:01 | ||
图片预览








文档简介
(共95张PPT)
第6题 新型电源、电解
第一篇 选择题突破
应用与金属腐蚀
复习建议:3课时(题型突破2课时 习题1课时)
悟真题·明考向
析题型·固双基
目
录
CONTENTS
///////
///////
题型特训
///////
练模拟·验效果
///////
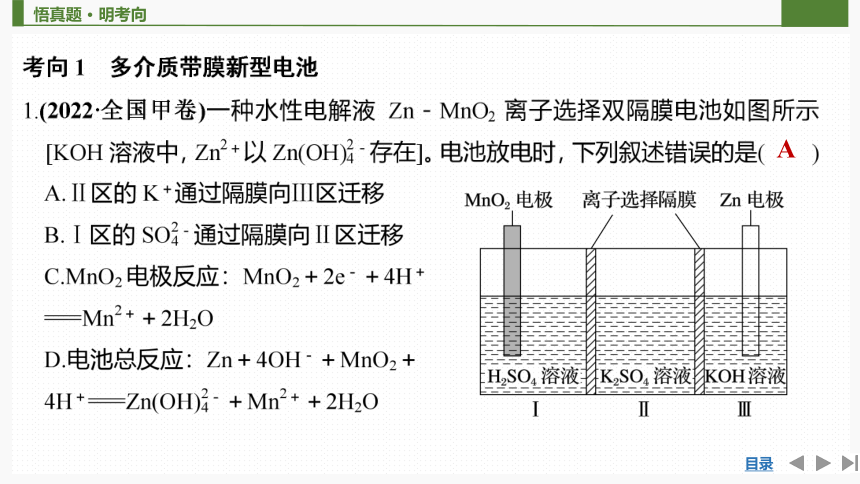
A
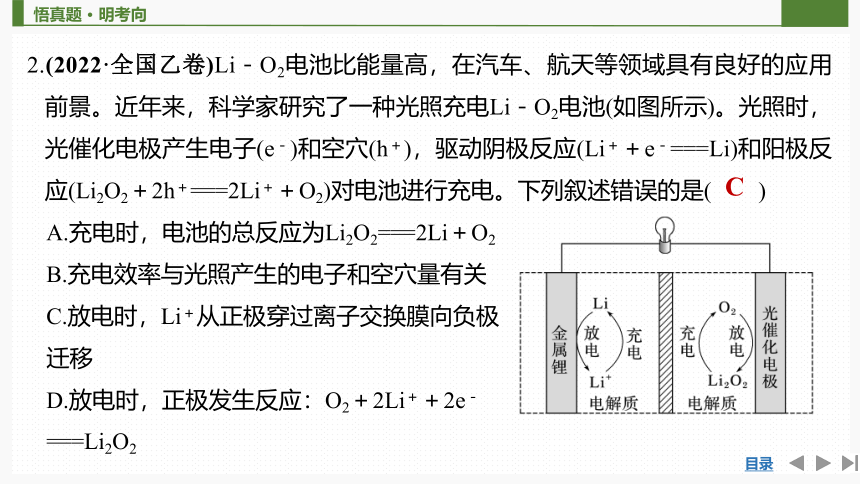
2.(2022·全国乙卷)Li-O2电池比能量高,在汽车、航天等领域具有良好的应用前景。近年来,科学家研究了一种光照充电Li-O2电池(如图所示)。光照时,光催化电极产生电子(e-)和空穴(h+),驱动阴极反应(Li++e-===Li)和阳极反应(Li2O2+2h+===2Li++O2)对电池进行充电。下列叙述错误的是( )
A.充电时,电池的总反应为Li2O2===2Li+O2
B.充电效率与光照产生的电子和空穴量有关
C.放电时,Li+从正极穿过离子交换膜向负极
迁移
D.放电时,正极发生反应:O2+2Li++2e-
===Li2O2
C
解析 充电时光照光催化电极产生电子和空穴,驱动阴极反应(Li++e-===Li)和阳极反应(Li2O2+2h+===2Li++O2),则充电时总反应为Li2O2===2Li+O2,A正确;充电时,光照光催化电极产生电子和空穴,阴极反应与电子有关,阳极反应与空穴有关,故充电效率与光照产生的电子和空穴量有关,B正确;放电时,金属Li电极为负极,光催化电极为正极,Li+从负极穿过离子交换膜向正极迁移,C错误;放电时总反应为2Li+O2===Li2O2,则正极反应为O2+2Li++2e-===Li2O2,D正确。
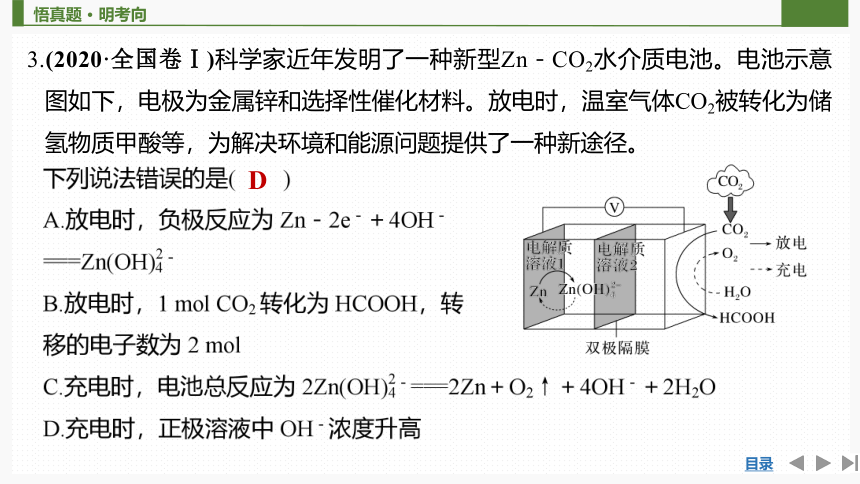
3.(2020·全国卷Ⅰ)科学家近年发明了一种新型Zn-CO2水介质电池。电池示意图如下,电极为金属锌和选择性催化材料。放电时,温室气体CO2被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。
D
考向2 电解原理在工农业生产中的多维应用
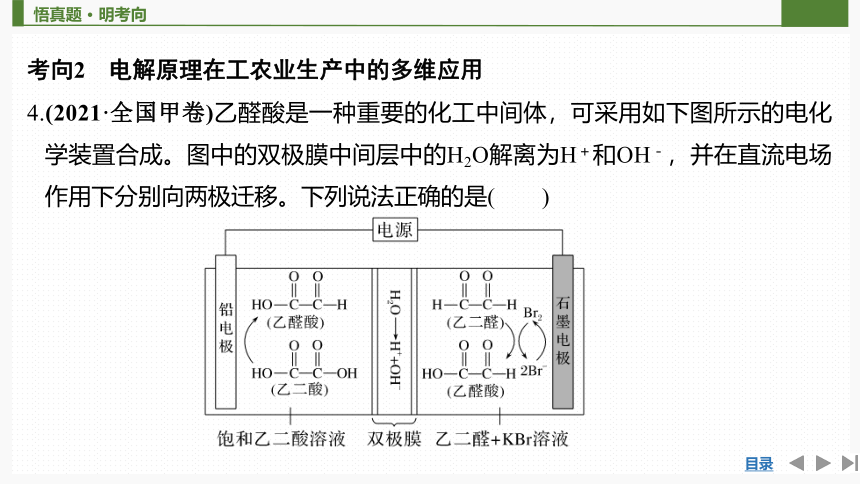
4.(2021·全国甲卷)乙醛酸是一种重要的化工中间体,可采用如下图所示的电化学装置合成。图中的双极膜中间层中的H2O解离为H+和OH-,并在直流电场作用下分别向两极迁移。下列说法正确的是( )
答案 D
5.(2021·全国乙卷)沿海电厂采用海水为冷却水,但在排水管中生物的附着和滋生会阻碍冷却水排放并降低冷却效率。为解决这一问题,通常在管道口设置一对惰性电极(如图所示),通入一定的电流。下列叙述错误的是( )
A.阳极发生将海水中的Cl-氧化生成Cl2的反应
B.管道中可以生成氧化灭杀附着生物的NaClO
C.阴极生成的H2应及时通风稀释安全地排入大气
D.阳极表面形成的Mg(OH)2等积垢需要定期清理
D
解析 海水中存在大量的Cl-,在阳极Cl-放电生成Cl2,A叙述正确;阴极H2O放电生成H2和OH-,OH-与Cl2反应生成ClO-,因此管道中存在一定量的NaClO,B叙述正确;因为H2为可燃性气体,所以阴极生成的H2应及时通风稀释,安全地排入大气,C叙述正确;阴极产生OH-,因此会在阴极表面形成Mg(OH)2等积垢,需定期清理以保持良好的导电性,D叙述错误。
考情预测:预测在2023高考中,以二次电池以及含有离子交换膜的电解池为背景的命题仍为热点题型,因为二次电池不仅实现电极材料循环使用,符合“低耗高效”的时代需求,而且命题角度丰富,便于同时考查原电池和电解池工作原理;含有离子交换膜的电解池设问空间大,便于考查考生的探究能力,也体现了学以致用的命题方向。
微题型2 电解原理在工农业生产中的应用
微题型1 新型化学电源
微题型3 金属的腐蚀与防护
微题型1 新型化学电源
A
[精练1] [储能电池](2022·辽宁卷)某储能电池原理如图。下列说法正确的是( )
A.放电时负极反应:Na3Ti2(PO4)3-
2e-===NaTi2(PO4)3+2Na+
B.放电时Cl-透过多孔活性炭电极
向CCl4中迁移
C.放电时每转移1 mol电子,理论上CCl4吸收0.5 mol Cl2
D.充电过程中,NaCl溶液浓度增大
解析 A.放电时负极失电子,发生氧化反应,电极反应:Na3Ti2(PO4)3-2e-===NaTi2(PO4)3+2Na+,正确;B.放电时,阴离子移向负极,放电时Cl-透过多孔活性炭电极向NaCl中迁移,错误;C.放电时每转移1 mol电子,正极:Cl2+2e-===2Cl-,理论上CCl4释放0.5 mol Cl2,错误;D.充电过程中,阳极:2Cl--2e-===Cl2,消耗氯离子,NaCl溶液浓度减小,错误。
[精练2] [氯流电池](2022·广东卷)科学家基于Cl2易溶于CCl4的性质,发展了一种无需离子交换膜的新型氯流电池,可作储能设备(如图)。充电时电极a的反应为NaTi2(PO4)3+2Na++2e-===Na3Ti2(PO4)3。下列说法正确的是( )
A.充电时电极b是阴极
B.放电时NaCl溶液的pH减小
C.放电时NaCl溶液的浓度增大
D.每生成1 mol Cl2,电极a质量理论上增加23 g
C
解析 由充电时电极a的反应可知,充电时电极a发生还原反应,所以电极a是阴极,则电极b是阳极,故A错误;放电时电极反应和充电时相反,则放电时电极a的反应为Na3Ti2(PO4)3-2e-===NaTi2(PO4)3+2Na+,NaCl溶液的pH不变,故B错误;放电时负极反应为Na3Ti2(PO4)3-2e-===NaTi2(PO4)3+2Na+,正极反应为Cl2+2e-===2Cl-,反应后Na+和Cl-浓度都增大,则放电时NaCl溶液的浓度增大,故C正确;充电时阳极反应为2Cl--2e-===Cl2↑,阴极反应为NaTi2(PO4)3+2Na++2e-===Na3Ti2(PO4)3,由得失电子守恒可知,每生成1 mol Cl2,电极a质量理论上增加23 g·mol-1×2 mol=46 g,故D错误。
[精练3] [燃料电池](2022·河南名校联考)一种利用金属氟化物的HF溶液作电解质的氢氧燃料电池装置如图所示:
装置工作时,下列说法错误的是( )
A.化学能转变为电能
B.负极电极反应式为H2-2e-===2H+
C.理论上消耗n(H2)∶n(O2)=2∶1
D.正极电极反应式为O2+4e-+12[(HF)3F]-===16[(HF)2F]-+2H2O
B
解析 如图所示氢氧燃料电池装置是将化学能转变为电能的装置,氢气在负极通入,失去电子后与[(HF)2F]-结合生成[(HF)3F]-;电池的正极通入氧气,氧气得电子后与[(HF)3F]-释放出来的H+结合生成水,同时[(HF)3F]-转化成[(HF)2F]-并循环参与反应。A.氢氧燃料电池是将化学能转变为电能的装置,A正确;B.负极电极反应式为H2-2e-+8[(HF)2F]-===6[(HF)3F]-,B错误;C.根据体系内得失电子总数相等,理论上消耗n(H2)∶n(O2)=2∶1,C正确;D.正极电极反应式为O2+4e-+12[(HF)3F]-===16[(HF)2F]-+2H2O,D正确。
1.构建两大模型
(1)原电池基础模型
(2)可逆电池解题模型
2.抓住一个重点——原电池电极方程式的书写
(1)燃料电池(以CH3OH燃料电池为例,体会不同介质对电极反应的影响)
质子交换膜 (酸性) H+ 总反应:2CH3OH+3O2===2CO2+4H2O 正极 O2+4e-+4H+===2H2O
负极 CH3OH-6e-+H2O===CO2↑+6H+
(2)充电(可逆)电池
微题型2 电解原理在工农业生产中的应用
[精练4] [电解制备](2022·浙江6月选考)通过电解废旧锂电池中的LiMn2O4可获得难溶性的Li2CO3和MnO2,电解示意图如下(其中滤布的作用是阻挡固体颗粒,但离子可自由通过。电解过程中溶液的体积变化忽略不计)。下列说法不正确的是( )
A.电极A为阴极,发生还原反应
B.电极B的电极反应:2H2O+Mn2+-2e-===
MnO2+4H+
C.电解一段时间后溶液中Mn2+浓度保持不变
D.电解结束,可通过调节pH除去Mn2+,再加入Na2CO3溶液以获得Li2CO3
C
A.a为电源负极
B.溶液中Q的物质的量保持不变
C.CO2在M极被还原
D.分离出的CO2从出口2排出
C
[精练6] [原理分析](2021·天津卷)如下所示电解装置中,通电后石墨电极Ⅱ上有O2生成,Fe2O3逐渐溶解,下列判断错误的是( )
A.a是电源的负极
B.通电一段时间后,向石墨电极Ⅱ附近滴加石蕊溶液,出现红色
C.随着电解的进行,CuCl2溶液浓度变大
D.当0.01 mol Fe2O3完全溶解时,至少产生气体336 mL(折合成标准状况下)
C
1.两大模型
(1)电解池基础模型(惰性电极电解CuCl2溶液)
(2)多室电解池解题模型(以三室电渗析法处理Na2SO4废水为例)
关系图示
解题模型 第一步:判断电极有外接电源→电解池;n→阳极,m→阴极
第二步:根据电极判断离子的移动方向和交换膜的种类
第三步:根据放电顺序写出电极反应式
第四步:根据电极反应式和离子移动方向确定电极反应物
2.抓住一个重点——电解反应方程式的书写
(1)基本电极反应式的书写
(2)提取“信息”书写电极反应式
(3)多膜电解池方程式书写[双膜三室吸收液(吸收了烟气中的SO2)]
微题型3 金属的腐蚀与防护
[精练7] (2022·福州三中质检)利用物质由高浓度向低浓度自发扩散的能量可制成浓差电池。在海水中的不锈钢制品,缝隙处氧浓度比海水低,易形成浓差电池而发生缝隙腐蚀。缝隙处腐蚀机理如图所示。
下列说法不正确的是( )
A.金属缝隙内表面为负极,外自由表面为正极
B.缝隙内溶液pH增大,加快了缝隙内腐蚀速率
C.为了维持电中性,海水中大量Cl-进入缝隙
D.正极的电极反应为O2+2H2O+4e-===4OH-
B
解析 A.根据氧气得电子发生还原反应生成氢氧根离子,所以金属缝隙外自由表面为正极,金属缝隙内表面为负极,A正确;B.金属缝隙外自由表面为正极,生成氢氧根离子,缝隙外溶液pH增大,加快了缝隙内腐蚀速率,B错误;C.阴离子由正极向负极移动,所以大量Cl-进入缝隙维持电中性,C正确;D.正极为氧气得电子发生还原反应生成氢氧根离子,电极反应为O2+2H2O+4e-===4OH-,D正确。
两种防护
解题模型 首先判断防护类型
其次根据原电池原理和电解池原理分析防腐原理
结合生活实际对选项做出合理判断
1.(2022·抚州质监)含可钝化金属的工业管道或反应器,由于会被内部溶液腐蚀,通过外接电源而钝化,称之为阳极保护法。下图是某金属外接电势与电流密度的变化关系,有关说法正确的是( )
A.阳极保护法中受保护的金属外接电源的负极
B.电流密度越大,金属受保护程度越好
C.CFD区,金属受到保护
D.外接电势越高,对金属保护性越有效
C
解析 A.金属通过外接电源而钝化的阳极保护法,指的是使受保护的金属作为阳极,通过外加电流使阳极钝化,腐蚀速率大幅度降低,所以,阳极保护法中受保护的金属外接电源的正极,错误;B.IM代表的是金属钝化的难易程度,即开始的时候电流密度越大,此时金属溶解,表示金属越难钝化,所以并非电流密度越大,金属受保护程度越好,错误;C.当外接电势超过EB后,金属开始钝化,从EC到ED都是金属钝化较稳定的范围,所以CFD区,金属受到保护,正确;D.外接电势超过ED后,电流密度又持续增加了,腐蚀速度又加快了,所以并非外接电势越高,对金属保护越有效,错误。
2.(2022·黑龙江四校联考)锌—空气电池(原理如图)适宜用作城市电动车的动力电源,该电池放电时Zn转化为ZnO。该电池工作时下列说法不正确的是( )
A.多孔板的目的是增大与空气的接触面积
B.该电池的正极反应为O2+4e-+2H2O===4OH-
C.该电池放电时K+向石墨电极移动
D.外电路电子由Zn电极流向石墨电极再通过电
解质溶液流回Zn电极
D
解析 A.石墨电极作为正极,多孔板可以增大与空气的接触面积,A正确;B.正极上氧气被还原,电解质显碱性,所以正极电极反应式为O2+4e-+2H2O===4OH-,B正确;C.石墨电极为正极,原电池中阳离子移向正极,即K+向石墨电极移动,C正确;D.电子不能在电解质溶液中流动,D错误。
3.(2022·四省八校模拟)利用生物质来制取氢气是实现生物质清洁利用的一个重要途径。KIO3催化电解葡萄糖(C6H12O6)制氢实验的装置(如下图所示),电极两侧的电解液在蠕动泵的作用下在电解液储槽和电极间不断循环。下列说法不正确的是( )
D
4.(2022·攀枝花统考)有一种清洁、无膜的氯碱工艺,它利用含有保护层的电极(Na0.44MnO2/Na0.44-xMnO2)中的Na+的脱除和嵌入机理,分两步电解得到氯碱工业产品,其原理如图所示。下列说法正确的是( )
A.电解时产生的X气体是O2,Y气体是Cl2
B.b是直流电源的正极,c是直流电源的负极
C.钠离子嵌入时的电极反应式为:
Na0.44MnO2- xe-===Na0.44-xMnO2+xNa+
D.第一步电解后,Na0.44MnO2/Na0.44-xMnO2
电极不经清洗可直接用于第二步电解
B
解析 与b相连的电极上脱掉Na+,Mn元素失电子被氧化,则电极b为直流电源的正极,与c相连的电极上嵌入Na+,Mn元素得电子被还原,则电极c为直流电源的负极。A.a相连的电极为阴极,发生2H2O+2e-===2OH-+H2↑,电解时产生的X气体是H2,d相连的电极为阳极,发生2Cl--2e-===Cl2↑,Y气体是Cl2,错误;B.由分析知:b是直流电源的正极,c是直流电源的负极,正确;C.钠离子的嵌入时,Na0.44-xMnO2中Mn元素得电子化合价降低被还原,则钠离子的嵌入反应是还原反应,电极反应为:Na0.44-xMnO2+xNa++xe-===Na0.44MnO2,错误;D.第1步结束后,Na0.44-xMnO2/Na0.44MnO2电极上附着氢氧根离子,第2步反应中电解生成氯气,氢氧根离子能与氯气反应,所以第1步结束后,Na0.44-xMnO2/Na0.44MnO2电极必须用水洗涤干净后,再用于第2步,错误。
5.(2022·西安四区一模)中科院研制出了双碳双离子电池,以石墨(Cn)和中间相炭微粒球(MCMB)为电极,电解质溶液为含有KPF6的有机溶液,其充电示意图如图所示。其反应机理为:充电时,电解液中的钾离子运动到中间相碳微粒球负极表面,并嵌入至石墨层中,同时六氟磷酸根阴离子插层到正极石墨中;放电时,钾离子从负极石墨层中脱出,同时正极石墨中的六氟磷酸根脱嵌回到电解液中。下列说法正确的是( )
C
题型特训2 电解应用及金属腐蚀与防护
题型特训1 新型化学电源
题型特训1 新型化学电源
1.(2021·广东卷)火星大气中含有大量CO2,一种有CO2参加反应的新型全固态电池有望为火星探测器供电。该电池以金属钠为负极,碳纳米管为正极,放电时( )
A.负极上发生还原反应 B.CO2在正极上得电子
C.阳离子由正极移向负极 D.将电能转化为化学能
解析 金属钠为负极,负极上发生失电子的氧化反应,A错误;碳纳米管为正极,CO2在正极上得电子,发生还原反应,B正确;放电时,阳离子由负极移向正极,C错误;原电池是将化学能转化为电能的装置,D错误。
B
2.(2022·河南联考)我国科学家开发了一款高压无阳极配置可充电钠电池,其充电过程的原理如图所示。下列说法正确的是( )
A.放电时,电子由b极经3A沸石分子筛
膜流向a极
B.放电时,a极的电极反应式为Na++e-===Na
C.充电时,b极为阳极,发生还原反应
D.充电时,电路中每迁移2 mol电子,理论上a极净增重46 g
D
解析 由图可知,放电时,a极为负极,电极反应式为Na-e-===Na+,b极为正极,电极反应式为Na++e-===Na;充电时,b极为阳极,电极反应式为Na-e-===Na+,a极为阴极,电极反应式为Na++e-===Na,据此作答。A.放电时,电子不经过电解质,错误;B.放电时,a极为负极,电极反应式为Na-e-===Na+,错误;C.充电时,b极为阳极,阳极失去电子发生氧化反应,错误;D.充电时,a极为阴极,电极反应式为Na++e-===Na,电路中每迁移2 mol电子,理论上a极净增重46 g,正确。
3.(2022·湘豫名校联考)微生物燃料电池(MFCs)技术以污水中的有机物为电子供体,在微生物的参与下将蕴含在污水中的化学能直接转化为电能,可在常温下运行,且污泥产率远低于活性污泥法,是一种集污水净化和能源转化于一体的新型污水处理与能源回收技术,为有机污水的低成本处理提供了一条新路径。关于MFCs说法错误的是( )
答案 D
4.(2022·张家口期末)下图为一种一氧化碳气体传感器的结构示意图,它与报警器配套使用,是一氧化碳气体报警器中的核心检测元件。当一氧化碳气体扩散到传感器时,其输出端产生电流输出,通过外接信号采集电路和相应的转换、输出电路,就能够对一氧化碳气体实现检测和监控。下列关于这种一氧化碳气体传感器的说法中正确的是( )
A.该传感器将电能转化为化学能
B.传感器中的对电极为负极,电解液中H+
向对电极移动
C.一氧化碳气体在工作电极上的反应式为:CO+H2O+2e-===CO2+2H+
D.该传感器产生输出电流大小与一氧化碳气体的浓度成正比
D
解析 A.根据题意该传感器吸收一氧化碳向外界传出电流,故为原电池装置,将化学能转化为电能,A项错误;B.对电极为氧气进入的一极,氧气得电子结合H+生成H2O,在该极发生还原反应,是原电池的正极,电解液中H+向正极(对电极)移动,B项错误;C.一氧化碳气体在工作电极上失电子被氧化,反应式为:CO+H2O-2e-===CO2+2H+,C项错误;D.该传感器用于监测空气中一氧化碳含量,所产生输出电流与参加反应气体量相关,其大小与一氧化碳气体的浓度成正比,D项正确。
5.(2022·内江一模)新型镁-锂双离子二次电池的工作原理如图。下列关于该电池的说法正确的是( )
A.放电时,Li+通过离子交换膜向左移动
B.充电时,x与电源正极相连
C.放电时,正极的电极反应式为:
Li1-xFePO4+xLi+-xe-===LiFePO4
D.充电时,导线上每通过0.4 mol e-,左
室中溶液的质量减少2 g
D
解析 A.放电时,左边为负极,右边为正极,根据“同性相吸”原理,Li+通过离子交换膜向正极即向右移动,故A错误;B.放电时Mg为负极,充电时,x与电源负极相连,故B错误;C.放电时,正极的电极反应式为:Li1-xFePO4+xLi++xe-===LiFePO4,故C错误;D.充电时,Mg为阴极,阴极是Mg2++2e-===Mg,溶液中Li+向阴极即左室移动,导线上每通过0.4 mol e-,则有0.2 mol Mg2+消耗,有0.4 mol Li+移向左室,左室中溶液的质量减少0.2 mol×24 g·mol-1-0.4 mol×7 g·mol-1=2 g,故D正确。
6.(2023·安阳名校调研)中国科学院施剑林院士团队报道了一种新型的自供能电化学共催化体系,该系统以Zn-H2O原电池结构为根基,中性磷酸盐缓冲溶液(PBS)为电解液,无需外界供能的条件下在两电极同时获得高附加值化学品H2和固态NaZnPO4。下列说法正确的是( )
D
7.(2022·河南名校适应性检测)中国科学技术大学陈维教授团队结合其前期工作基础,开发了一种高性能的水系锰基锌电池。其工作原理如图所示,已知该装置工作一段时间后,K2SO4溶液的浓度增大,下列说法正确的是( )
A.负极的电极反应式为MnO2+2e-+4H+===
Mn2++2H2O
B.装置工作一段时间后,正极区溶液的pH降低
C.a膜为阴离子交换膜,b膜为阳离子交换膜
D.电子流向:Zn电极→b膜→a膜→MnO2电极
→负载→Zn电极
C
A.该电池工作时,负极的电极反应式为:LiM1-xFexPO4-e-===M1-xFexPO4+Li+
B.该电池中的聚合物隔膜是阳离子交换膜,在充电时,阳离子由左向右移动
C.该电池充电时阴极的电极反应式为:C6Li1-x+xLi++xe-===C6Li
D.刀片电池可以搭载在新能源汽车上,作为动力来源
答案 A
解析 根据电池装置图知,石墨为负极,反应式为LiC6-e-===Li++6C,磷酸铁锂为正极,反应式为M1-xFexPO4+e-+Li+===LiM1-xFexPO4,充电时,阴极、阳极反应式与负极、正极反应式正好相反,据此分析解题。A.由分析可知,该电池工作时,负极的电极反应式为:LiC6-e-===Li++6C,A错误;B.由分析可知,充电时石墨电极与电源负极相连,作为阴极,电极反应为:Li++6C+e-===LiC6,需结合Li+,阳极电极反应为:LiM1-xFexPO4-e-===M1-xFexPO4+Li+,释放出Li+,该电池中的聚合物隔膜是阳离子交换膜,在充电时,阳离子由阳极移向阴极即由左向右移动,B正确;C.由分析可知,该电池充电时阴极的电极反应式即为放电时负极反应的逆过程,故为:C6Li1-x+xLi++xe-===C6Li,C正确;D.由题干信息可知,刀片电池是一种新型的可充电电池,故可以搭载在新能源汽车上,作为动力来源,D正确。
A.放电时,内电路中电流由KSn合金经酯基电解质流向羧基化碳纳米管
B.电池的正极反应式为4K++3CO2+4e-===2K2CO3+C
C.羧基化碳纳米管中引入的羧基可促进电子的转移
D.充电时,电路中通过1 mol电子,多壁碳纳米管减重36 g
答案 D
解析 A.放电时为原电池装置,内电路中电流是由负极流向正极,即放电时,内电路中电流由KSn合金经酯基电解质流向羧基化碳纳米管,A正确;B.根据总反应式可知,负极反应式为:KSn-e-===Sn+K+,电池的正极反应式为4K++3CO2+4e-===2K2CO3+C,B正确;C.电极材料为KSn和羧基化碳纳米管,KSn与水反应,—COOH与KOH反应,可促进电子的转移,C正确;D.充电时阳极反应为:C-4e-+2K2CO3===3CO2↑+4K+,碳纳米管及附着的碳酸钾会减少,电路中通过1 mol电子,多壁碳纳米管减重3 g,碳酸钾减少30 g,D错误。
题型特训2 电解应用及金属腐蚀与防护
1.(2022·沈阳期末)2022年,中国第二艘国产003型10万吨级航母即将下水,船体的防腐处理非常重要,有盐分的海水和空气会对船体造成腐蚀。下列关于金属腐蚀和防腐的说法不正确的是( )
A.可以在船舶外壳装上锌块,用牺牲阳极的阴极保护法防止金属腐蚀
B.海上舰艇的腐蚀主要为金属的吸氧腐蚀
C.刷防锈漆,使金属与空气、水等物质隔离,可防止金属被腐蚀
D.外加电流将被保护的钢铁做阴极,硅钢铸铁做阳极起不到保护金属的作用
D
解析 A.锌的活泼性大于铁,在船舶外壳装上锌块,用牺牲阳极的阴极保护法防止金属腐蚀,故A正确;B.海上舰艇的腐蚀主要为金属的吸氧腐蚀,故B正确;C.铁在潮湿的空气中易腐蚀,刷防锈漆使金属与空气、水等物质隔离,可防止金属被腐蚀,故C正确;D.外加电流将被保护的钢铁做阴极,硅钢铸铁做阳极,属于外加电流阴极保护法,故D 错误。
2.(2022·浙江六校联盟联考)2024年的奥运会将在巴黎举行,沙滩排球比赛场地将设在埃菲尔铁塔前的战神广场,埃菲尔铁塔为钢铁结构,使用了250万个铆钉和近两万块铁片,以下说法不正确的是( )
A.连接铁片的铆钉应该用铜质的
B.为了减缓钢铁生锈,工人们在铁塔表面涂上一层特制的油漆
C.巴黎的气候比较潮湿,比干燥的环境更易引起钢铁的生锈
D.可以在铁塔上镶嵌锌片,减慢钢铁的腐蚀速率
A
解析 A.连接铁片的铆钉若用铜质的,由于铁比铜活泼,铜作原电池正极,铁作原电池负极,会导致铁制品本身被腐蚀,故A错误;B.在铁塔表面涂上一层特制的油漆,可以隔绝空气中的氧气,能有效保护金属,故B正确;C.铁在水和氧气并存时易生锈,所以潮湿环境比干燥的环境更易引起钢铁的生锈,故C正确;D.在铁塔上镶嵌锌片,利用的是牺牲阳极的阴极保护法,铁作原电池正极,锌作原电池负极,铁受到保护,能减慢钢铁的腐蚀速率,故D正确。
3.(2022·苏北四市调研)H2O2是常用的绿色氧化剂,可用如图所示装置电解H2O和O2制备H2O2。下列说法不正确的是( )
A.H+移向a电极
B.装置工作过程中a极消耗的O2大于b极生成
的O2
C.b电极的电极反应式:2H2O-4e-===O2↑
+4H+
D.电解生成1 mol H2O2时,电子转移的数目为4×6.02×1023
D
解析 由图可知,b极水失电子生成氧气和氢离子,b极为阳极,氢离子向a极即阴极移动,A正确;a极电极反应式为:O2+2e-+2H+===H2O2,b极电极反应式为:2H2O-4e-===O2↑+4H+,当转移4 mol电子时,a极消耗2 mol氧气,b极产生1 mol氧气,B正确,C正确;a极每生成1 mol H2O2时,转移2 mol电子,转移电子数目为2×6.02×1023,D错误。
B
5.(2022·河南名校三模)科学家近年发明了一种将二氧化碳电化学还原为甲醇的方法,装置示意图如下,电解质溶液1为由KHCO3、吡啶和HCl组成的CO2饱和水溶液,电极为选择性Cu2O/CuO薄膜材料和Pt电极。该装置工作时,下列叙述正确的是( )
A.阳极区溶液中c(H+)减小
B.KHCO3可维持电解质溶液1中CO2浓度变化不大
C.阴极反应为CO2+6H+-6e-===CH3OH+H2O
D.电解总反应为CO2+3H2===CH3OH+H2O
B
6.(2022·长春学程考试)天津大学研究团队以KOH溶液为电解质,CoP和Ni2P纳米片为催化电极材料,电催化合成偶氮化合物的装置如图所示(R代表烃基)下列说法正确的是( )
A.电源b为正极
B.合成1 mol偶氮化合物转移电子8 mol
C.离子交换膜是阳离子交换膜
D.Ni2P电极反应式为RCH2NH2+4e-+
4OH-===RCN+4H2O
B
7.(2022·江西智学联盟联考)金属锂化学性质活泼,广泛应用于冶金工业上制备各种合金。如图是一种制备金属锂的装置。下列说法错误的是( )
A.与电极B相连的是电源的正极
B.电极C上的电极反应式为Li++e-===Li
C.设计A区的主要原因是碳酸锂导电能力差
D.A区反应的方程式为2Cl2+2Li2CO3===4LiCl+2CO2+O2
C
8.(2022·南昌一模)科学家利用金(Au)催化电解法在常温常压下实现合成氨,工作时某极区的微观示意图如下,其中电解液为溶解有三氟甲磺酸锂(LiCF3SO3)和乙醇的有机溶液。下列说法正确是( )
A.金(Au)为催化剂不参与反应
B.三氟甲磺酸锂和乙醇的有机溶液
不能导电
C.该电极方程式为:N2+6e-+
6CH3CH2OH===2NH3+6CH3CH2O-
D.选择性透过膜只允许N2、NH3和H2O通过,其它离子不可通过
C
解析 A.金(Au)虽然为催化剂,但是会参与反应,在整个过程不断被消耗、生成,总量不变,A错误;B.该装置为电解池,电解液必须导电,即三氟甲磺酸锂和乙醇的有机溶液导电,B错误;C.据图可知,N2得电子后,和乙醇反应生成氨气和CH3CH2O-,根据电子守恒和元素守恒可得电极反应为N2+6e-+6CH3CH2OH===2NH3+6CH3CH2O-,C正确;D.据图可知,水分子不能透过选择性透过膜,D错误。
A.装置工作时,3-氯-1,2-丙二醇被氧化
B.通电前后,电渗析室内溶液的pH几乎不变
C.膜M为阴离子交换膜
D.装置工作时,阴极上发生的电极反应:
2H++2e-===H2↑
A
Thanks!
本讲内容结束
第6题 新型电源、电解
第一篇 选择题突破
应用与金属腐蚀
复习建议:3课时(题型突破2课时 习题1课时)
悟真题·明考向
析题型·固双基
目
录
CONTENTS
///////
///////
题型特训
///////
练模拟·验效果
///////
A
2.(2022·全国乙卷)Li-O2电池比能量高,在汽车、航天等领域具有良好的应用前景。近年来,科学家研究了一种光照充电Li-O2电池(如图所示)。光照时,光催化电极产生电子(e-)和空穴(h+),驱动阴极反应(Li++e-===Li)和阳极反应(Li2O2+2h+===2Li++O2)对电池进行充电。下列叙述错误的是( )
A.充电时,电池的总反应为Li2O2===2Li+O2
B.充电效率与光照产生的电子和空穴量有关
C.放电时,Li+从正极穿过离子交换膜向负极
迁移
D.放电时,正极发生反应:O2+2Li++2e-
===Li2O2
C
解析 充电时光照光催化电极产生电子和空穴,驱动阴极反应(Li++e-===Li)和阳极反应(Li2O2+2h+===2Li++O2),则充电时总反应为Li2O2===2Li+O2,A正确;充电时,光照光催化电极产生电子和空穴,阴极反应与电子有关,阳极反应与空穴有关,故充电效率与光照产生的电子和空穴量有关,B正确;放电时,金属Li电极为负极,光催化电极为正极,Li+从负极穿过离子交换膜向正极迁移,C错误;放电时总反应为2Li+O2===Li2O2,则正极反应为O2+2Li++2e-===Li2O2,D正确。
3.(2020·全国卷Ⅰ)科学家近年发明了一种新型Zn-CO2水介质电池。电池示意图如下,电极为金属锌和选择性催化材料。放电时,温室气体CO2被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。
D
考向2 电解原理在工农业生产中的多维应用
4.(2021·全国甲卷)乙醛酸是一种重要的化工中间体,可采用如下图所示的电化学装置合成。图中的双极膜中间层中的H2O解离为H+和OH-,并在直流电场作用下分别向两极迁移。下列说法正确的是( )
答案 D
5.(2021·全国乙卷)沿海电厂采用海水为冷却水,但在排水管中生物的附着和滋生会阻碍冷却水排放并降低冷却效率。为解决这一问题,通常在管道口设置一对惰性电极(如图所示),通入一定的电流。下列叙述错误的是( )
A.阳极发生将海水中的Cl-氧化生成Cl2的反应
B.管道中可以生成氧化灭杀附着生物的NaClO
C.阴极生成的H2应及时通风稀释安全地排入大气
D.阳极表面形成的Mg(OH)2等积垢需要定期清理
D
解析 海水中存在大量的Cl-,在阳极Cl-放电生成Cl2,A叙述正确;阴极H2O放电生成H2和OH-,OH-与Cl2反应生成ClO-,因此管道中存在一定量的NaClO,B叙述正确;因为H2为可燃性气体,所以阴极生成的H2应及时通风稀释,安全地排入大气,C叙述正确;阴极产生OH-,因此会在阴极表面形成Mg(OH)2等积垢,需定期清理以保持良好的导电性,D叙述错误。
考情预测:预测在2023高考中,以二次电池以及含有离子交换膜的电解池为背景的命题仍为热点题型,因为二次电池不仅实现电极材料循环使用,符合“低耗高效”的时代需求,而且命题角度丰富,便于同时考查原电池和电解池工作原理;含有离子交换膜的电解池设问空间大,便于考查考生的探究能力,也体现了学以致用的命题方向。
微题型2 电解原理在工农业生产中的应用
微题型1 新型化学电源
微题型3 金属的腐蚀与防护
微题型1 新型化学电源
A
[精练1] [储能电池](2022·辽宁卷)某储能电池原理如图。下列说法正确的是( )
A.放电时负极反应:Na3Ti2(PO4)3-
2e-===NaTi2(PO4)3+2Na+
B.放电时Cl-透过多孔活性炭电极
向CCl4中迁移
C.放电时每转移1 mol电子,理论上CCl4吸收0.5 mol Cl2
D.充电过程中,NaCl溶液浓度增大
解析 A.放电时负极失电子,发生氧化反应,电极反应:Na3Ti2(PO4)3-2e-===NaTi2(PO4)3+2Na+,正确;B.放电时,阴离子移向负极,放电时Cl-透过多孔活性炭电极向NaCl中迁移,错误;C.放电时每转移1 mol电子,正极:Cl2+2e-===2Cl-,理论上CCl4释放0.5 mol Cl2,错误;D.充电过程中,阳极:2Cl--2e-===Cl2,消耗氯离子,NaCl溶液浓度减小,错误。
[精练2] [氯流电池](2022·广东卷)科学家基于Cl2易溶于CCl4的性质,发展了一种无需离子交换膜的新型氯流电池,可作储能设备(如图)。充电时电极a的反应为NaTi2(PO4)3+2Na++2e-===Na3Ti2(PO4)3。下列说法正确的是( )
A.充电时电极b是阴极
B.放电时NaCl溶液的pH减小
C.放电时NaCl溶液的浓度增大
D.每生成1 mol Cl2,电极a质量理论上增加23 g
C
解析 由充电时电极a的反应可知,充电时电极a发生还原反应,所以电极a是阴极,则电极b是阳极,故A错误;放电时电极反应和充电时相反,则放电时电极a的反应为Na3Ti2(PO4)3-2e-===NaTi2(PO4)3+2Na+,NaCl溶液的pH不变,故B错误;放电时负极反应为Na3Ti2(PO4)3-2e-===NaTi2(PO4)3+2Na+,正极反应为Cl2+2e-===2Cl-,反应后Na+和Cl-浓度都增大,则放电时NaCl溶液的浓度增大,故C正确;充电时阳极反应为2Cl--2e-===Cl2↑,阴极反应为NaTi2(PO4)3+2Na++2e-===Na3Ti2(PO4)3,由得失电子守恒可知,每生成1 mol Cl2,电极a质量理论上增加23 g·mol-1×2 mol=46 g,故D错误。
[精练3] [燃料电池](2022·河南名校联考)一种利用金属氟化物的HF溶液作电解质的氢氧燃料电池装置如图所示:
装置工作时,下列说法错误的是( )
A.化学能转变为电能
B.负极电极反应式为H2-2e-===2H+
C.理论上消耗n(H2)∶n(O2)=2∶1
D.正极电极反应式为O2+4e-+12[(HF)3F]-===16[(HF)2F]-+2H2O
B
解析 如图所示氢氧燃料电池装置是将化学能转变为电能的装置,氢气在负极通入,失去电子后与[(HF)2F]-结合生成[(HF)3F]-;电池的正极通入氧气,氧气得电子后与[(HF)3F]-释放出来的H+结合生成水,同时[(HF)3F]-转化成[(HF)2F]-并循环参与反应。A.氢氧燃料电池是将化学能转变为电能的装置,A正确;B.负极电极反应式为H2-2e-+8[(HF)2F]-===6[(HF)3F]-,B错误;C.根据体系内得失电子总数相等,理论上消耗n(H2)∶n(O2)=2∶1,C正确;D.正极电极反应式为O2+4e-+12[(HF)3F]-===16[(HF)2F]-+2H2O,D正确。
1.构建两大模型
(1)原电池基础模型
(2)可逆电池解题模型
2.抓住一个重点——原电池电极方程式的书写
(1)燃料电池(以CH3OH燃料电池为例,体会不同介质对电极反应的影响)
质子交换膜 (酸性) H+ 总反应:2CH3OH+3O2===2CO2+4H2O 正极 O2+4e-+4H+===2H2O
负极 CH3OH-6e-+H2O===CO2↑+6H+
(2)充电(可逆)电池
微题型2 电解原理在工农业生产中的应用
[精练4] [电解制备](2022·浙江6月选考)通过电解废旧锂电池中的LiMn2O4可获得难溶性的Li2CO3和MnO2,电解示意图如下(其中滤布的作用是阻挡固体颗粒,但离子可自由通过。电解过程中溶液的体积变化忽略不计)。下列说法不正确的是( )
A.电极A为阴极,发生还原反应
B.电极B的电极反应:2H2O+Mn2+-2e-===
MnO2+4H+
C.电解一段时间后溶液中Mn2+浓度保持不变
D.电解结束,可通过调节pH除去Mn2+,再加入Na2CO3溶液以获得Li2CO3
C
A.a为电源负极
B.溶液中Q的物质的量保持不变
C.CO2在M极被还原
D.分离出的CO2从出口2排出
C
[精练6] [原理分析](2021·天津卷)如下所示电解装置中,通电后石墨电极Ⅱ上有O2生成,Fe2O3逐渐溶解,下列判断错误的是( )
A.a是电源的负极
B.通电一段时间后,向石墨电极Ⅱ附近滴加石蕊溶液,出现红色
C.随着电解的进行,CuCl2溶液浓度变大
D.当0.01 mol Fe2O3完全溶解时,至少产生气体336 mL(折合成标准状况下)
C
1.两大模型
(1)电解池基础模型(惰性电极电解CuCl2溶液)
(2)多室电解池解题模型(以三室电渗析法处理Na2SO4废水为例)
关系图示
解题模型 第一步:判断电极有外接电源→电解池;n→阳极,m→阴极
第二步:根据电极判断离子的移动方向和交换膜的种类
第三步:根据放电顺序写出电极反应式
第四步:根据电极反应式和离子移动方向确定电极反应物
2.抓住一个重点——电解反应方程式的书写
(1)基本电极反应式的书写
(2)提取“信息”书写电极反应式
(3)多膜电解池方程式书写[双膜三室吸收液(吸收了烟气中的SO2)]
微题型3 金属的腐蚀与防护
[精练7] (2022·福州三中质检)利用物质由高浓度向低浓度自发扩散的能量可制成浓差电池。在海水中的不锈钢制品,缝隙处氧浓度比海水低,易形成浓差电池而发生缝隙腐蚀。缝隙处腐蚀机理如图所示。
下列说法不正确的是( )
A.金属缝隙内表面为负极,外自由表面为正极
B.缝隙内溶液pH增大,加快了缝隙内腐蚀速率
C.为了维持电中性,海水中大量Cl-进入缝隙
D.正极的电极反应为O2+2H2O+4e-===4OH-
B
解析 A.根据氧气得电子发生还原反应生成氢氧根离子,所以金属缝隙外自由表面为正极,金属缝隙内表面为负极,A正确;B.金属缝隙外自由表面为正极,生成氢氧根离子,缝隙外溶液pH增大,加快了缝隙内腐蚀速率,B错误;C.阴离子由正极向负极移动,所以大量Cl-进入缝隙维持电中性,C正确;D.正极为氧气得电子发生还原反应生成氢氧根离子,电极反应为O2+2H2O+4e-===4OH-,D正确。
两种防护
解题模型 首先判断防护类型
其次根据原电池原理和电解池原理分析防腐原理
结合生活实际对选项做出合理判断
1.(2022·抚州质监)含可钝化金属的工业管道或反应器,由于会被内部溶液腐蚀,通过外接电源而钝化,称之为阳极保护法。下图是某金属外接电势与电流密度的变化关系,有关说法正确的是( )
A.阳极保护法中受保护的金属外接电源的负极
B.电流密度越大,金属受保护程度越好
C.CFD区,金属受到保护
D.外接电势越高,对金属保护性越有效
C
解析 A.金属通过外接电源而钝化的阳极保护法,指的是使受保护的金属作为阳极,通过外加电流使阳极钝化,腐蚀速率大幅度降低,所以,阳极保护法中受保护的金属外接电源的正极,错误;B.IM代表的是金属钝化的难易程度,即开始的时候电流密度越大,此时金属溶解,表示金属越难钝化,所以并非电流密度越大,金属受保护程度越好,错误;C.当外接电势超过EB后,金属开始钝化,从EC到ED都是金属钝化较稳定的范围,所以CFD区,金属受到保护,正确;D.外接电势超过ED后,电流密度又持续增加了,腐蚀速度又加快了,所以并非外接电势越高,对金属保护越有效,错误。
2.(2022·黑龙江四校联考)锌—空气电池(原理如图)适宜用作城市电动车的动力电源,该电池放电时Zn转化为ZnO。该电池工作时下列说法不正确的是( )
A.多孔板的目的是增大与空气的接触面积
B.该电池的正极反应为O2+4e-+2H2O===4OH-
C.该电池放电时K+向石墨电极移动
D.外电路电子由Zn电极流向石墨电极再通过电
解质溶液流回Zn电极
D
解析 A.石墨电极作为正极,多孔板可以增大与空气的接触面积,A正确;B.正极上氧气被还原,电解质显碱性,所以正极电极反应式为O2+4e-+2H2O===4OH-,B正确;C.石墨电极为正极,原电池中阳离子移向正极,即K+向石墨电极移动,C正确;D.电子不能在电解质溶液中流动,D错误。
3.(2022·四省八校模拟)利用生物质来制取氢气是实现生物质清洁利用的一个重要途径。KIO3催化电解葡萄糖(C6H12O6)制氢实验的装置(如下图所示),电极两侧的电解液在蠕动泵的作用下在电解液储槽和电极间不断循环。下列说法不正确的是( )
D
4.(2022·攀枝花统考)有一种清洁、无膜的氯碱工艺,它利用含有保护层的电极(Na0.44MnO2/Na0.44-xMnO2)中的Na+的脱除和嵌入机理,分两步电解得到氯碱工业产品,其原理如图所示。下列说法正确的是( )
A.电解时产生的X气体是O2,Y气体是Cl2
B.b是直流电源的正极,c是直流电源的负极
C.钠离子嵌入时的电极反应式为:
Na0.44MnO2- xe-===Na0.44-xMnO2+xNa+
D.第一步电解后,Na0.44MnO2/Na0.44-xMnO2
电极不经清洗可直接用于第二步电解
B
解析 与b相连的电极上脱掉Na+,Mn元素失电子被氧化,则电极b为直流电源的正极,与c相连的电极上嵌入Na+,Mn元素得电子被还原,则电极c为直流电源的负极。A.a相连的电极为阴极,发生2H2O+2e-===2OH-+H2↑,电解时产生的X气体是H2,d相连的电极为阳极,发生2Cl--2e-===Cl2↑,Y气体是Cl2,错误;B.由分析知:b是直流电源的正极,c是直流电源的负极,正确;C.钠离子的嵌入时,Na0.44-xMnO2中Mn元素得电子化合价降低被还原,则钠离子的嵌入反应是还原反应,电极反应为:Na0.44-xMnO2+xNa++xe-===Na0.44MnO2,错误;D.第1步结束后,Na0.44-xMnO2/Na0.44MnO2电极上附着氢氧根离子,第2步反应中电解生成氯气,氢氧根离子能与氯气反应,所以第1步结束后,Na0.44-xMnO2/Na0.44MnO2电极必须用水洗涤干净后,再用于第2步,错误。
5.(2022·西安四区一模)中科院研制出了双碳双离子电池,以石墨(Cn)和中间相炭微粒球(MCMB)为电极,电解质溶液为含有KPF6的有机溶液,其充电示意图如图所示。其反应机理为:充电时,电解液中的钾离子运动到中间相碳微粒球负极表面,并嵌入至石墨层中,同时六氟磷酸根阴离子插层到正极石墨中;放电时,钾离子从负极石墨层中脱出,同时正极石墨中的六氟磷酸根脱嵌回到电解液中。下列说法正确的是( )
C
题型特训2 电解应用及金属腐蚀与防护
题型特训1 新型化学电源
题型特训1 新型化学电源
1.(2021·广东卷)火星大气中含有大量CO2,一种有CO2参加反应的新型全固态电池有望为火星探测器供电。该电池以金属钠为负极,碳纳米管为正极,放电时( )
A.负极上发生还原反应 B.CO2在正极上得电子
C.阳离子由正极移向负极 D.将电能转化为化学能
解析 金属钠为负极,负极上发生失电子的氧化反应,A错误;碳纳米管为正极,CO2在正极上得电子,发生还原反应,B正确;放电时,阳离子由负极移向正极,C错误;原电池是将化学能转化为电能的装置,D错误。
B
2.(2022·河南联考)我国科学家开发了一款高压无阳极配置可充电钠电池,其充电过程的原理如图所示。下列说法正确的是( )
A.放电时,电子由b极经3A沸石分子筛
膜流向a极
B.放电时,a极的电极反应式为Na++e-===Na
C.充电时,b极为阳极,发生还原反应
D.充电时,电路中每迁移2 mol电子,理论上a极净增重46 g
D
解析 由图可知,放电时,a极为负极,电极反应式为Na-e-===Na+,b极为正极,电极反应式为Na++e-===Na;充电时,b极为阳极,电极反应式为Na-e-===Na+,a极为阴极,电极反应式为Na++e-===Na,据此作答。A.放电时,电子不经过电解质,错误;B.放电时,a极为负极,电极反应式为Na-e-===Na+,错误;C.充电时,b极为阳极,阳极失去电子发生氧化反应,错误;D.充电时,a极为阴极,电极反应式为Na++e-===Na,电路中每迁移2 mol电子,理论上a极净增重46 g,正确。
3.(2022·湘豫名校联考)微生物燃料电池(MFCs)技术以污水中的有机物为电子供体,在微生物的参与下将蕴含在污水中的化学能直接转化为电能,可在常温下运行,且污泥产率远低于活性污泥法,是一种集污水净化和能源转化于一体的新型污水处理与能源回收技术,为有机污水的低成本处理提供了一条新路径。关于MFCs说法错误的是( )
答案 D
4.(2022·张家口期末)下图为一种一氧化碳气体传感器的结构示意图,它与报警器配套使用,是一氧化碳气体报警器中的核心检测元件。当一氧化碳气体扩散到传感器时,其输出端产生电流输出,通过外接信号采集电路和相应的转换、输出电路,就能够对一氧化碳气体实现检测和监控。下列关于这种一氧化碳气体传感器的说法中正确的是( )
A.该传感器将电能转化为化学能
B.传感器中的对电极为负极,电解液中H+
向对电极移动
C.一氧化碳气体在工作电极上的反应式为:CO+H2O+2e-===CO2+2H+
D.该传感器产生输出电流大小与一氧化碳气体的浓度成正比
D
解析 A.根据题意该传感器吸收一氧化碳向外界传出电流,故为原电池装置,将化学能转化为电能,A项错误;B.对电极为氧气进入的一极,氧气得电子结合H+生成H2O,在该极发生还原反应,是原电池的正极,电解液中H+向正极(对电极)移动,B项错误;C.一氧化碳气体在工作电极上失电子被氧化,反应式为:CO+H2O-2e-===CO2+2H+,C项错误;D.该传感器用于监测空气中一氧化碳含量,所产生输出电流与参加反应气体量相关,其大小与一氧化碳气体的浓度成正比,D项正确。
5.(2022·内江一模)新型镁-锂双离子二次电池的工作原理如图。下列关于该电池的说法正确的是( )
A.放电时,Li+通过离子交换膜向左移动
B.充电时,x与电源正极相连
C.放电时,正极的电极反应式为:
Li1-xFePO4+xLi+-xe-===LiFePO4
D.充电时,导线上每通过0.4 mol e-,左
室中溶液的质量减少2 g
D
解析 A.放电时,左边为负极,右边为正极,根据“同性相吸”原理,Li+通过离子交换膜向正极即向右移动,故A错误;B.放电时Mg为负极,充电时,x与电源负极相连,故B错误;C.放电时,正极的电极反应式为:Li1-xFePO4+xLi++xe-===LiFePO4,故C错误;D.充电时,Mg为阴极,阴极是Mg2++2e-===Mg,溶液中Li+向阴极即左室移动,导线上每通过0.4 mol e-,则有0.2 mol Mg2+消耗,有0.4 mol Li+移向左室,左室中溶液的质量减少0.2 mol×24 g·mol-1-0.4 mol×7 g·mol-1=2 g,故D正确。
6.(2023·安阳名校调研)中国科学院施剑林院士团队报道了一种新型的自供能电化学共催化体系,该系统以Zn-H2O原电池结构为根基,中性磷酸盐缓冲溶液(PBS)为电解液,无需外界供能的条件下在两电极同时获得高附加值化学品H2和固态NaZnPO4。下列说法正确的是( )
D
7.(2022·河南名校适应性检测)中国科学技术大学陈维教授团队结合其前期工作基础,开发了一种高性能的水系锰基锌电池。其工作原理如图所示,已知该装置工作一段时间后,K2SO4溶液的浓度增大,下列说法正确的是( )
A.负极的电极反应式为MnO2+2e-+4H+===
Mn2++2H2O
B.装置工作一段时间后,正极区溶液的pH降低
C.a膜为阴离子交换膜,b膜为阳离子交换膜
D.电子流向:Zn电极→b膜→a膜→MnO2电极
→负载→Zn电极
C
A.该电池工作时,负极的电极反应式为:LiM1-xFexPO4-e-===M1-xFexPO4+Li+
B.该电池中的聚合物隔膜是阳离子交换膜,在充电时,阳离子由左向右移动
C.该电池充电时阴极的电极反应式为:C6Li1-x+xLi++xe-===C6Li
D.刀片电池可以搭载在新能源汽车上,作为动力来源
答案 A
解析 根据电池装置图知,石墨为负极,反应式为LiC6-e-===Li++6C,磷酸铁锂为正极,反应式为M1-xFexPO4+e-+Li+===LiM1-xFexPO4,充电时,阴极、阳极反应式与负极、正极反应式正好相反,据此分析解题。A.由分析可知,该电池工作时,负极的电极反应式为:LiC6-e-===Li++6C,A错误;B.由分析可知,充电时石墨电极与电源负极相连,作为阴极,电极反应为:Li++6C+e-===LiC6,需结合Li+,阳极电极反应为:LiM1-xFexPO4-e-===M1-xFexPO4+Li+,释放出Li+,该电池中的聚合物隔膜是阳离子交换膜,在充电时,阳离子由阳极移向阴极即由左向右移动,B正确;C.由分析可知,该电池充电时阴极的电极反应式即为放电时负极反应的逆过程,故为:C6Li1-x+xLi++xe-===C6Li,C正确;D.由题干信息可知,刀片电池是一种新型的可充电电池,故可以搭载在新能源汽车上,作为动力来源,D正确。
A.放电时,内电路中电流由KSn合金经酯基电解质流向羧基化碳纳米管
B.电池的正极反应式为4K++3CO2+4e-===2K2CO3+C
C.羧基化碳纳米管中引入的羧基可促进电子的转移
D.充电时,电路中通过1 mol电子,多壁碳纳米管减重36 g
答案 D
解析 A.放电时为原电池装置,内电路中电流是由负极流向正极,即放电时,内电路中电流由KSn合金经酯基电解质流向羧基化碳纳米管,A正确;B.根据总反应式可知,负极反应式为:KSn-e-===Sn+K+,电池的正极反应式为4K++3CO2+4e-===2K2CO3+C,B正确;C.电极材料为KSn和羧基化碳纳米管,KSn与水反应,—COOH与KOH反应,可促进电子的转移,C正确;D.充电时阳极反应为:C-4e-+2K2CO3===3CO2↑+4K+,碳纳米管及附着的碳酸钾会减少,电路中通过1 mol电子,多壁碳纳米管减重3 g,碳酸钾减少30 g,D错误。
题型特训2 电解应用及金属腐蚀与防护
1.(2022·沈阳期末)2022年,中国第二艘国产003型10万吨级航母即将下水,船体的防腐处理非常重要,有盐分的海水和空气会对船体造成腐蚀。下列关于金属腐蚀和防腐的说法不正确的是( )
A.可以在船舶外壳装上锌块,用牺牲阳极的阴极保护法防止金属腐蚀
B.海上舰艇的腐蚀主要为金属的吸氧腐蚀
C.刷防锈漆,使金属与空气、水等物质隔离,可防止金属被腐蚀
D.外加电流将被保护的钢铁做阴极,硅钢铸铁做阳极起不到保护金属的作用
D
解析 A.锌的活泼性大于铁,在船舶外壳装上锌块,用牺牲阳极的阴极保护法防止金属腐蚀,故A正确;B.海上舰艇的腐蚀主要为金属的吸氧腐蚀,故B正确;C.铁在潮湿的空气中易腐蚀,刷防锈漆使金属与空气、水等物质隔离,可防止金属被腐蚀,故C正确;D.外加电流将被保护的钢铁做阴极,硅钢铸铁做阳极,属于外加电流阴极保护法,故D 错误。
2.(2022·浙江六校联盟联考)2024年的奥运会将在巴黎举行,沙滩排球比赛场地将设在埃菲尔铁塔前的战神广场,埃菲尔铁塔为钢铁结构,使用了250万个铆钉和近两万块铁片,以下说法不正确的是( )
A.连接铁片的铆钉应该用铜质的
B.为了减缓钢铁生锈,工人们在铁塔表面涂上一层特制的油漆
C.巴黎的气候比较潮湿,比干燥的环境更易引起钢铁的生锈
D.可以在铁塔上镶嵌锌片,减慢钢铁的腐蚀速率
A
解析 A.连接铁片的铆钉若用铜质的,由于铁比铜活泼,铜作原电池正极,铁作原电池负极,会导致铁制品本身被腐蚀,故A错误;B.在铁塔表面涂上一层特制的油漆,可以隔绝空气中的氧气,能有效保护金属,故B正确;C.铁在水和氧气并存时易生锈,所以潮湿环境比干燥的环境更易引起钢铁的生锈,故C正确;D.在铁塔上镶嵌锌片,利用的是牺牲阳极的阴极保护法,铁作原电池正极,锌作原电池负极,铁受到保护,能减慢钢铁的腐蚀速率,故D正确。
3.(2022·苏北四市调研)H2O2是常用的绿色氧化剂,可用如图所示装置电解H2O和O2制备H2O2。下列说法不正确的是( )
A.H+移向a电极
B.装置工作过程中a极消耗的O2大于b极生成
的O2
C.b电极的电极反应式:2H2O-4e-===O2↑
+4H+
D.电解生成1 mol H2O2时,电子转移的数目为4×6.02×1023
D
解析 由图可知,b极水失电子生成氧气和氢离子,b极为阳极,氢离子向a极即阴极移动,A正确;a极电极反应式为:O2+2e-+2H+===H2O2,b极电极反应式为:2H2O-4e-===O2↑+4H+,当转移4 mol电子时,a极消耗2 mol氧气,b极产生1 mol氧气,B正确,C正确;a极每生成1 mol H2O2时,转移2 mol电子,转移电子数目为2×6.02×1023,D错误。
B
5.(2022·河南名校三模)科学家近年发明了一种将二氧化碳电化学还原为甲醇的方法,装置示意图如下,电解质溶液1为由KHCO3、吡啶和HCl组成的CO2饱和水溶液,电极为选择性Cu2O/CuO薄膜材料和Pt电极。该装置工作时,下列叙述正确的是( )
A.阳极区溶液中c(H+)减小
B.KHCO3可维持电解质溶液1中CO2浓度变化不大
C.阴极反应为CO2+6H+-6e-===CH3OH+H2O
D.电解总反应为CO2+3H2===CH3OH+H2O
B
6.(2022·长春学程考试)天津大学研究团队以KOH溶液为电解质,CoP和Ni2P纳米片为催化电极材料,电催化合成偶氮化合物的装置如图所示(R代表烃基)下列说法正确的是( )
A.电源b为正极
B.合成1 mol偶氮化合物转移电子8 mol
C.离子交换膜是阳离子交换膜
D.Ni2P电极反应式为RCH2NH2+4e-+
4OH-===RCN+4H2O
B
7.(2022·江西智学联盟联考)金属锂化学性质活泼,广泛应用于冶金工业上制备各种合金。如图是一种制备金属锂的装置。下列说法错误的是( )
A.与电极B相连的是电源的正极
B.电极C上的电极反应式为Li++e-===Li
C.设计A区的主要原因是碳酸锂导电能力差
D.A区反应的方程式为2Cl2+2Li2CO3===4LiCl+2CO2+O2
C
8.(2022·南昌一模)科学家利用金(Au)催化电解法在常温常压下实现合成氨,工作时某极区的微观示意图如下,其中电解液为溶解有三氟甲磺酸锂(LiCF3SO3)和乙醇的有机溶液。下列说法正确是( )
A.金(Au)为催化剂不参与反应
B.三氟甲磺酸锂和乙醇的有机溶液
不能导电
C.该电极方程式为:N2+6e-+
6CH3CH2OH===2NH3+6CH3CH2O-
D.选择性透过膜只允许N2、NH3和H2O通过,其它离子不可通过
C
解析 A.金(Au)虽然为催化剂,但是会参与反应,在整个过程不断被消耗、生成,总量不变,A错误;B.该装置为电解池,电解液必须导电,即三氟甲磺酸锂和乙醇的有机溶液导电,B错误;C.据图可知,N2得电子后,和乙醇反应生成氨气和CH3CH2O-,根据电子守恒和元素守恒可得电极反应为N2+6e-+6CH3CH2OH===2NH3+6CH3CH2O-,C正确;D.据图可知,水分子不能透过选择性透过膜,D错误。
A.装置工作时,3-氯-1,2-丙二醇被氧化
B.通电前后,电渗析室内溶液的pH几乎不变
C.膜M为阴离子交换膜
D.装置工作时,阴极上发生的电极反应:
2H++2e-===H2↑
A
Thanks!
本讲内容结束
同课章节目录
