2023届高考化学三轮冲刺 第7题 电解质溶液中微粒关系及图像 课件(共112张PPT)
文档属性
| 名称 | 2023届高考化学三轮冲刺 第7题 电解质溶液中微粒关系及图像 课件(共112张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 6.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-17 22:01:39 | ||
图片预览










文档简介
(共112张PPT)
第7题 电解质溶液中微
第一篇 选择题突破
粒关系及图像
复习建议:3课时(题型突破2课时 习题1课时)
悟真题·明考向
析题型·固双基
目
录
CONTENTS
///////
///////
题型特训
///////
练模拟·验效果
///////
考向1 电解质溶液中微粒关系
1.(2022·全国乙卷)常温下,一元酸HA的Ka(HA)=1.0×10-3。在某体系中,H+与A-不能穿过隔膜,未电离的HA可自由穿过该膜(如图所示)。
B
B
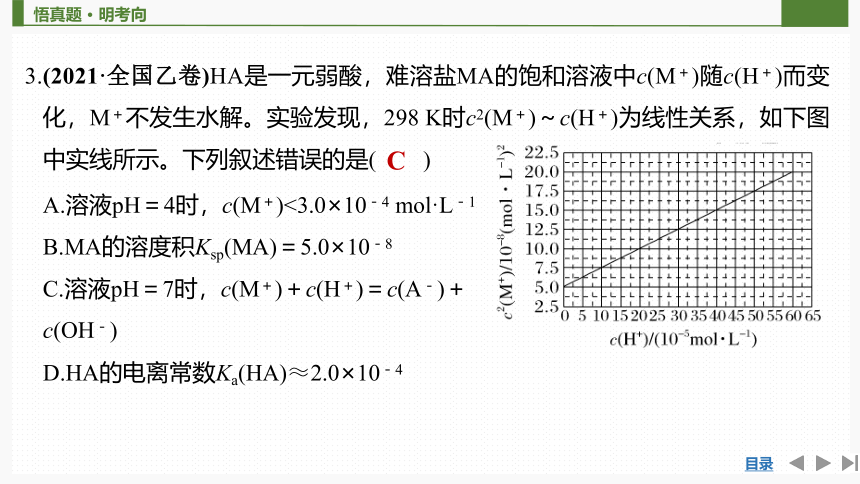
3.(2021·全国乙卷)HA是一元弱酸,难溶盐MA的饱和溶液中c(M+)随c(H+)而变化,M+不发生水解。实验发现,298 K时c2(M+)~c(H+)为线性关系,如下图中实线所示。下列叙述错误的是( )
A.溶液pH=4时,c(M+)<3.0×10-4 mol·L-1
B.MA的溶度积Ksp(MA)=5.0×10-8
C.溶液pH=7时,c(M+)+c(H+)=c(A-)+
c(OH-)
D.HA的电离常数Ka(HA)≈2.0×10-4
C
考向3 滴定曲线
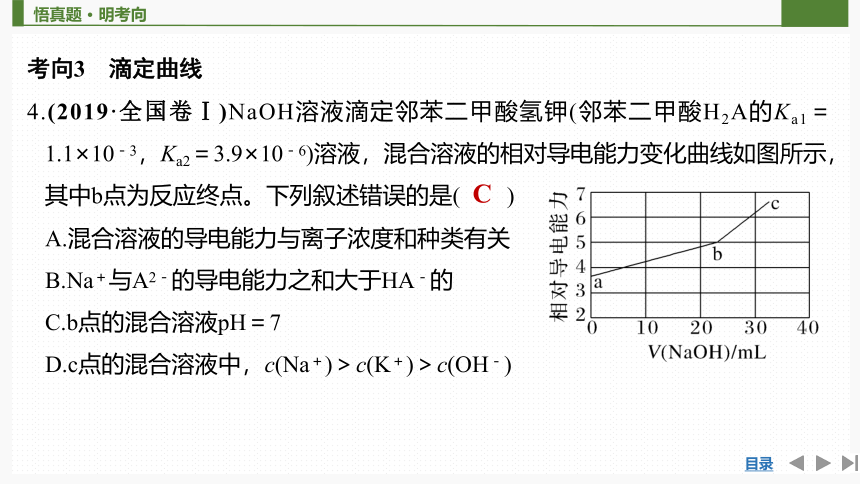
4.(2019·全国卷Ⅰ)NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的Ka1=1.1×10-3,Ka2=3.9×10-6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是( )
A.混合溶液的导电能力与离子浓度和种类有关
B.Na+与A2-的导电能力之和大于HA-的
C.b点的混合溶液pH=7
D.c点的混合溶液中,c(Na+)>c(K+)>c(OH-)
C
考向4 分布系(分)数曲线
5.(2020·全国卷Ⅰ)以酚酞为指示剂,用0.100 0 mol·L-1的NaOH溶液滴定20.00 mL未知浓度的二元酸H2A溶液。溶液中,pH、分布系数δ随滴加NaOH溶液体积VNaOH的变化关系如图所示。
下列叙述正确的是( )
A.曲线①代表δ(H2A),曲线②代表δ(HA-)
B.H2A溶液的浓度为0.200 0 mol·L-1
C.HA-的电离常数Ka=1.0×10-2
D.滴定终点时,溶液中c(Na+)<2c(A2-)+c(HA-)
C
考情预测:预计在2023年高考中,仍会以图像的形式综合考查外界条件对电离平衡的影响,以及借助图像数据计算电离平衡常数;离子积常数和影响水电离平衡的因素,特别是酸、碱反应过程中水的电离程度的变化;盐类水解原理,特别是特殊点的粒子浓度大小关系;溶度积和溶度积曲线的理解等,强调用动态平衡的观点看待和分析微粒变化的过程。
微题型2 平衡常数曲线(Kw、Ka、Kh、Ksp)
微题型1 离子浓度关系
微题型3 滴定曲线
微题型4 分布系(分)数曲线
微题型1 离子浓度关系
C
[精练1] (2022·浙江6月选考)25 ℃时,苯酚(C6H5OH)的Ka=1.0×10-10,下列说法正确的是( )
A.相同温度下,等pH的C6H5ONa和CH3COONa溶液中,c(C6H5O-)>c(CH3COO-)
B.将浓度均为0.10 mol·L-1的C6H5ONa和NaOH溶液加热,两种溶液的pH均变大
C.25 ℃时,C6H5OH溶液与NaOH溶液混合,测得pH=10.00,则此时溶液中c(C6H5O-)=c(C6H5OH)
D.25 ℃时,0.10 mol·L-1的C6H5OH溶液中加少量C6H5ONa固体,水的电离程度变小
[精练2] (2022·湖南卷)室温时,用0.100 mol·L-1的标准AgNO3溶液滴定15.00 mL浓度相等的Cl-、Br-和I-混合溶液,通过电位滴定法获得lgc(Ag+)与V(AgNO3)的关系曲线如图所示(忽略沉淀对离子的吸附作用。若溶液中离子浓度小于1.0×10-5 mol·L-1时,认为该离子沉淀完全。Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=5.4×10-13,Ksp(AgI)=8.5×10-17)。下列说法正确的是( )
A.a点:有白色沉淀生成
B.原溶液中I-的浓度为0.100 mol·L-1
C.当Br-沉淀完全时,已经有部分Cl-沉淀
D.b点:c(Cl-)>c(Br-)>c(I-)>c(Ag+)
C
1.电解质溶液中的“三守恒”
2.质子守恒关系式的推出
质子守恒可以用电荷守恒与物料守恒推出,也可以用图示法推出。如:
(1)Na2CO3溶液:
微题型2 平衡常数曲线(Kw、Ka、Kh、 Ksp)
[精练3] (2022·江西重点中学联考)常温下,向20 mL 1 mol·L-1 CuCl2溶液中滴加2 mol·L-1 Na2S溶液的滴定曲线如图所示。已知:pCu=-lg c(Cu2+),lg 2.5=0.4,常温下Ksp(FeS)=6.3×10-18;Ka1(H2S)=1.2×10-7,Ka2(H2S)=7.1×10-15。下列说法中正确的是( )
A.常温下,S2-的水解常数Kh(S2-)约为8.3×10-8
B.E→F→G的过程中,水的电离度一直在减小
C.向1 mol·L-1 FeSO4(aq)中加入足量CuS固体,产生FeS沉淀
D.25 ℃时,Cu2++H2S===CuS↓+2H+的K约为1.36×1014
D
1.Kw[不同温度下水溶液中c(H+)与c(OH-)的变化曲线]
图示
解读 ①A、C、B三点均为中性,温度依次升高,Kw依次增大
②D点为酸性溶液,E点为碱性溶液,Kw=1×10-14
③AB直线的左上方均为碱性溶液,任意一点:c(H+)<c(OH-)
2.Ksp曲线
(1)常温下,CaSO4在水中的沉淀溶解平衡曲线(Ksp=9×10-6)
(2)直线型(pM-pR曲线)[pM为阳离子浓度的负对数,pR为阴离子浓度的负对数]
微题型3 滴定曲线
[精练4] (2022·浙江1月选考)某同学在两个相同的特制容器中分别加入20 mL 0.4 mol·L-1 Na2CO3溶液和40 mL 0.2 mol·L-1 NaHCO3溶液,再分别用0.4 mol·L-1盐酸滴定,利用pH计和压力传感器检测,得到如下曲线:
C
[精练5] (2022·西安四区一模)已知:25 ℃时,Ka(CH3COOH)=1.7×10-5,Kb(NH3·H2O)=1.7 ×10-5。用0.01 mol·L-1的CH3COOH溶液滴定20 mL由浓度均为0.01 mol·L-1的NaOH溶液和氨水组成的混合溶液,溶液的相对导电能力随加入CH3COOH溶液体积的变化趋势如图所示。下列叙述错误的是( )
A
滴定曲线特殊点的分析
(1)实例
常温下,用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1 CH3COOH溶液所得滴定曲线如图:
(2)pH—V图
①各特殊点粒子大小关系及变化趋势
点 溶质 离子浓度大小比较
A CH3COOH c(H+)>c(CH3COO-)>c(OH-)
B(1∶1) CH3COOH、CH3COONa c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C(pH=7) CH3COOH、CH3COONa c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
D CH3COONa c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
E(2∶1) CH3COONa、NaOH c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
F(1∶1) CH3COONa、NaOH c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
②各特殊点对水电离程度的影响
点 溶质 水的电离情况
A CH3COOH 抑制
B CH3COOH、CH3COONa 抑制
C CH3COOH、CH3COONa 正常电离
D CH3COONa 只促进
E CH3COONa、NaOH 抑制
F CH3COONa、NaOH 抑制
结论:水的电离程度大小顺序为:D>C>B>A>E>F 微题型4 分布系(分)数曲线
[精练6] (2022·安徽江南十校一模)H3A是一种多元酸,25 ℃时,向1 mol·L-1 H3A溶液中逐滴加入NaOH稀溶液至过量,滴加过程中各种含A微粒的物质的量分数随溶液pH的变化曲线如图所示。下列叙述正确的是( )
A.1 mol·L-1的H3A溶液中存在:c(H+)=c(OH-)+c(H2A-)+2c(HA2-)+3c(A3-)
B.25 ℃时H3A的第一级电离平衡常数数量级为10-3
C.1 mol·L-1的NaH2A溶液中存在:c(Na+)>c(OH-)>c(H2A-)>c(HA2-)
D.NaH2A溶液中存在:c(H3A)+c(H+)=c(OH-)+c(HA2-)
答案 D
[精练7] (2021·辽宁卷)用0.100 0 mol·L-1盐酸滴定20.00 mL Na2A溶液,溶液中H2A、HA-、A2-的分布分数δ随pH变化曲线及滴定曲线如图。下列说法正确的是( )
A.H2A的Ka1为10-10.25
B.c点:c(HA-)>c(A2-)>c(H2A)
C.第一次突变,可选酚酞作指示剂
D.c(Na2A)=0.200 0 mol·L-1
C
分布系(分)数曲线
分布系数图及分析[分布曲线是指以pH为横坐标、分布系数(即组分的平衡浓度占总浓度的分数)为纵坐标的关系曲线]
1.(2022·玉林、贵港联考)草酸(H2C2O4)常温时的电离平衡常数K1=5.0×10-2,K2=5.4×10-5。常温下,用0.2 mol/L的NaOH溶液滴定25 mL 0.2 mol/L的H2C2O4溶液的滴定曲线如图所示。下列说法正确的是( )
B
B
A
4.(2022·安徽江淮十校联考)氨基酸分子中含有—NH2和—COOH两种官能团,当调节溶液的pH使氨基酸所带正负电荷正好相等时,氨基酸所带的净电荷为零,在电场中不发生移动现象,此时溶液的pH叫等电点。常温下,0.001 mol·L-1的甘氨酸(H2NCH2COOH)溶液中各物种浓度对数值与pH的关系如图所示,下列说法正确的是( )
答案 A
5.(2022·临川一中模拟)25 ℃时,向不同浓度硝酸中加入CH3COOAg固体,溶解过程中-lg c(Ag+)与溶液pH的关系如图所示。下列说法正确的是( )
A.CH3COOAg的Ksp的数量级为10-3
B.温度一定时,c越大,CH3COOAg的溶解度越小
C.温度和pH一定时,c越大,CH3COOAg的Ksp越大
D.a点溶液满足:c(CH3COOH)+c(H+)=0.1 mol·L-1
A
题型特训2 滴定曲线
题型特训1 电解质溶液中四大平衡常数曲线
题型特训3 分布系(分)数及对数曲线
D
D
3.(2022·天津河西区摸底)某实验测得0.1 mol·L-1 NaHCO3溶液在升温过程中(不考虑水挥发)的pH变化曲线如图所示。下列说法正确的是( )
A
4.(2022·安徽十八校联盟模拟)H2R是一种二元弱酸,常温下某水体中c(H2R)由于空气中的某种成分的存在而保持不变,又知该水体-lg c(X)(X为H2R、HR-、R2-、M2+)与pH的关系如图所示、Ksp(MR)=3.0×10-9,下列说法错误的是( )
A.Ka1(H2R)=1×10-6.3
B.0.1 mol·L-1的KHR的溶液:c(K+)>c(HR-)>
c(R2-)>c(OH-)
C.曲线④表示水体中c(M2+)随着pH的变化情况
D.当pH=10.3时,水体中c(M2+)等于3.0×10-7.9 mol·L-1
B
A.n点溶液c(OH-)>c(H+)
B.p点溶液中存在c(OH-)=c(HR-)+2c(H2R)+c(H+)
C.n点到p点过程中水的电离程度变小
D.NaHR溶液中HR-的电离平衡常数小于其水解平衡常数
答案 B
6.(2022·成都树德中学阶段测试)用双硫腙(H2Dz,二元弱酸)~CCl4络合萃取法可从工业废水中提取金属离子:H2Dz先将金属离子络合成电中性的物质[如Cu(HDz)2等],再用CCl4萃取此络合物。下图是用上述方法处理含有Hg2+、Bi3+、Zn2+的废水时的酸度曲线(E%表示金属离子以络合物形式被萃取分离的百分率)。
C
题型特训2 滴定曲线
1.(2022·广西“韬智杯”大联考)室温时,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,溶液的pH随NaOH溶液体积的变化如图所示。下列说法正确的是( )
B
2.(2022·许昌二模)常温下,体积均为25.00 mL的磷酸、硫酸及草酸(H2C2O4)分别用0.100 0 mol·L-1 NaOH溶液滴定,其滴定曲线如下:
B
3.(2022·南昌一模)室温下,用0.1 mol/L的盐酸滴定0.1 mol/L溴化肼(N2H5Br)的25 mL溶液,已知肼(N2H4)是二元弱碱(与NH3类似),滴定过程中混合溶液的相对导电能力变化曲线如图所示。下列叙述错误的是( )
C
4.(2022·甘肃名校第二次诊断)已知Ka(CH3COOH)=1.7×10-5,Kb(NH3·H2O)=1.7×10-5。常温下,用0.01 mol·L-1氨水滴定20 mL浓度均为0.01 mol·L-1的HCl和CH3COOH混合溶液,相对导电能力随加入氨水体积变化曲线如图所示。下列叙述正确的是( )
A
答案 C
下列说法错误的是( )
A.HA电离常数的数量级为10-5
B.b点溶液中存在c(A-)+c(OH-)=c(HA)+c(H+)
C.c点溶液中粒子浓度的大小关系为c(A-)>c(HA)>c(H+)>c(OH-)
D.若将HA改为等体积等浓度的HCN,则pH随NaOH溶液体积的变化曲线竖直上移
B
A.曲线a表示的是HA的分布系数变化曲线
B.HA的电离平衡常数的数量级为10-6
C.p点对应的溶液中,c(A-)<3c(HA)
D.p、n、q中,水的电离程度最大的是q点
C
题型特训3 分布系(分)数及对数曲线
2.(2022·浙江百校联盟检测)三元酸(用H3A表示),溶液中H3A、H2A-、HA2-、A3-的百分含量随pH的变化曲线如图所示,下列说法中不正确的是( )
A.曲线c表示HA2-的变化曲线
B.H3A的第二步电离常数Ka2和第三步电离常数Ka3
的比值约为101.2
C.Na2HA溶液中水的电离受到抑制
D.pH=4时,c(H+)=c(H2A-)+2c(HA2-)+c(OH-)
D
C
4.(2022·西安中学模拟)常温下,已知弱酸H3RO3溶液中含R物种的浓度之和为0.1 mol·L-1,溶液中所有含R物种的lg c-pOH的关系如图所示,下列说法错误的是( )
答案 D
5.(2022·东北师大附中摸底)25 ℃时,用HCl调节Na3R溶液的pH,混合溶液的pH与离子浓度的关系如图所示。下列说法正确的是( )
D
6.(2022·成都名校联盟联考)常温下,向一定浓度的H2X溶液中滴加NaOH溶液,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是( )
C
C
Thanks!
本讲内容结束
第7题 电解质溶液中微
第一篇 选择题突破
粒关系及图像
复习建议:3课时(题型突破2课时 习题1课时)
悟真题·明考向
析题型·固双基
目
录
CONTENTS
///////
///////
题型特训
///////
练模拟·验效果
///////
考向1 电解质溶液中微粒关系
1.(2022·全国乙卷)常温下,一元酸HA的Ka(HA)=1.0×10-3。在某体系中,H+与A-不能穿过隔膜,未电离的HA可自由穿过该膜(如图所示)。
B
B
3.(2021·全国乙卷)HA是一元弱酸,难溶盐MA的饱和溶液中c(M+)随c(H+)而变化,M+不发生水解。实验发现,298 K时c2(M+)~c(H+)为线性关系,如下图中实线所示。下列叙述错误的是( )
A.溶液pH=4时,c(M+)<3.0×10-4 mol·L-1
B.MA的溶度积Ksp(MA)=5.0×10-8
C.溶液pH=7时,c(M+)+c(H+)=c(A-)+
c(OH-)
D.HA的电离常数Ka(HA)≈2.0×10-4
C
考向3 滴定曲线
4.(2019·全国卷Ⅰ)NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的Ka1=1.1×10-3,Ka2=3.9×10-6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是( )
A.混合溶液的导电能力与离子浓度和种类有关
B.Na+与A2-的导电能力之和大于HA-的
C.b点的混合溶液pH=7
D.c点的混合溶液中,c(Na+)>c(K+)>c(OH-)
C
考向4 分布系(分)数曲线
5.(2020·全国卷Ⅰ)以酚酞为指示剂,用0.100 0 mol·L-1的NaOH溶液滴定20.00 mL未知浓度的二元酸H2A溶液。溶液中,pH、分布系数δ随滴加NaOH溶液体积VNaOH的变化关系如图所示。
下列叙述正确的是( )
A.曲线①代表δ(H2A),曲线②代表δ(HA-)
B.H2A溶液的浓度为0.200 0 mol·L-1
C.HA-的电离常数Ka=1.0×10-2
D.滴定终点时,溶液中c(Na+)<2c(A2-)+c(HA-)
C
考情预测:预计在2023年高考中,仍会以图像的形式综合考查外界条件对电离平衡的影响,以及借助图像数据计算电离平衡常数;离子积常数和影响水电离平衡的因素,特别是酸、碱反应过程中水的电离程度的变化;盐类水解原理,特别是特殊点的粒子浓度大小关系;溶度积和溶度积曲线的理解等,强调用动态平衡的观点看待和分析微粒变化的过程。
微题型2 平衡常数曲线(Kw、Ka、Kh、Ksp)
微题型1 离子浓度关系
微题型3 滴定曲线
微题型4 分布系(分)数曲线
微题型1 离子浓度关系
C
[精练1] (2022·浙江6月选考)25 ℃时,苯酚(C6H5OH)的Ka=1.0×10-10,下列说法正确的是( )
A.相同温度下,等pH的C6H5ONa和CH3COONa溶液中,c(C6H5O-)>c(CH3COO-)
B.将浓度均为0.10 mol·L-1的C6H5ONa和NaOH溶液加热,两种溶液的pH均变大
C.25 ℃时,C6H5OH溶液与NaOH溶液混合,测得pH=10.00,则此时溶液中c(C6H5O-)=c(C6H5OH)
D.25 ℃时,0.10 mol·L-1的C6H5OH溶液中加少量C6H5ONa固体,水的电离程度变小
[精练2] (2022·湖南卷)室温时,用0.100 mol·L-1的标准AgNO3溶液滴定15.00 mL浓度相等的Cl-、Br-和I-混合溶液,通过电位滴定法获得lgc(Ag+)与V(AgNO3)的关系曲线如图所示(忽略沉淀对离子的吸附作用。若溶液中离子浓度小于1.0×10-5 mol·L-1时,认为该离子沉淀完全。Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=5.4×10-13,Ksp(AgI)=8.5×10-17)。下列说法正确的是( )
A.a点:有白色沉淀生成
B.原溶液中I-的浓度为0.100 mol·L-1
C.当Br-沉淀完全时,已经有部分Cl-沉淀
D.b点:c(Cl-)>c(Br-)>c(I-)>c(Ag+)
C
1.电解质溶液中的“三守恒”
2.质子守恒关系式的推出
质子守恒可以用电荷守恒与物料守恒推出,也可以用图示法推出。如:
(1)Na2CO3溶液:
微题型2 平衡常数曲线(Kw、Ka、Kh、 Ksp)
[精练3] (2022·江西重点中学联考)常温下,向20 mL 1 mol·L-1 CuCl2溶液中滴加2 mol·L-1 Na2S溶液的滴定曲线如图所示。已知:pCu=-lg c(Cu2+),lg 2.5=0.4,常温下Ksp(FeS)=6.3×10-18;Ka1(H2S)=1.2×10-7,Ka2(H2S)=7.1×10-15。下列说法中正确的是( )
A.常温下,S2-的水解常数Kh(S2-)约为8.3×10-8
B.E→F→G的过程中,水的电离度一直在减小
C.向1 mol·L-1 FeSO4(aq)中加入足量CuS固体,产生FeS沉淀
D.25 ℃时,Cu2++H2S===CuS↓+2H+的K约为1.36×1014
D
1.Kw[不同温度下水溶液中c(H+)与c(OH-)的变化曲线]
图示
解读 ①A、C、B三点均为中性,温度依次升高,Kw依次增大
②D点为酸性溶液,E点为碱性溶液,Kw=1×10-14
③AB直线的左上方均为碱性溶液,任意一点:c(H+)<c(OH-)
2.Ksp曲线
(1)常温下,CaSO4在水中的沉淀溶解平衡曲线(Ksp=9×10-6)
(2)直线型(pM-pR曲线)[pM为阳离子浓度的负对数,pR为阴离子浓度的负对数]
微题型3 滴定曲线
[精练4] (2022·浙江1月选考)某同学在两个相同的特制容器中分别加入20 mL 0.4 mol·L-1 Na2CO3溶液和40 mL 0.2 mol·L-1 NaHCO3溶液,再分别用0.4 mol·L-1盐酸滴定,利用pH计和压力传感器检测,得到如下曲线:
C
[精练5] (2022·西安四区一模)已知:25 ℃时,Ka(CH3COOH)=1.7×10-5,Kb(NH3·H2O)=1.7 ×10-5。用0.01 mol·L-1的CH3COOH溶液滴定20 mL由浓度均为0.01 mol·L-1的NaOH溶液和氨水组成的混合溶液,溶液的相对导电能力随加入CH3COOH溶液体积的变化趋势如图所示。下列叙述错误的是( )
A
滴定曲线特殊点的分析
(1)实例
常温下,用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1 CH3COOH溶液所得滴定曲线如图:
(2)pH—V图
①各特殊点粒子大小关系及变化趋势
点 溶质 离子浓度大小比较
A CH3COOH c(H+)>c(CH3COO-)>c(OH-)
B(1∶1) CH3COOH、CH3COONa c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C(pH=7) CH3COOH、CH3COONa c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
D CH3COONa c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
E(2∶1) CH3COONa、NaOH c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
F(1∶1) CH3COONa、NaOH c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
②各特殊点对水电离程度的影响
点 溶质 水的电离情况
A CH3COOH 抑制
B CH3COOH、CH3COONa 抑制
C CH3COOH、CH3COONa 正常电离
D CH3COONa 只促进
E CH3COONa、NaOH 抑制
F CH3COONa、NaOH 抑制
结论:水的电离程度大小顺序为:D>C>B>A>E>F 微题型4 分布系(分)数曲线
[精练6] (2022·安徽江南十校一模)H3A是一种多元酸,25 ℃时,向1 mol·L-1 H3A溶液中逐滴加入NaOH稀溶液至过量,滴加过程中各种含A微粒的物质的量分数随溶液pH的变化曲线如图所示。下列叙述正确的是( )
A.1 mol·L-1的H3A溶液中存在:c(H+)=c(OH-)+c(H2A-)+2c(HA2-)+3c(A3-)
B.25 ℃时H3A的第一级电离平衡常数数量级为10-3
C.1 mol·L-1的NaH2A溶液中存在:c(Na+)>c(OH-)>c(H2A-)>c(HA2-)
D.NaH2A溶液中存在:c(H3A)+c(H+)=c(OH-)+c(HA2-)
答案 D
[精练7] (2021·辽宁卷)用0.100 0 mol·L-1盐酸滴定20.00 mL Na2A溶液,溶液中H2A、HA-、A2-的分布分数δ随pH变化曲线及滴定曲线如图。下列说法正确的是( )
A.H2A的Ka1为10-10.25
B.c点:c(HA-)>c(A2-)>c(H2A)
C.第一次突变,可选酚酞作指示剂
D.c(Na2A)=0.200 0 mol·L-1
C
分布系(分)数曲线
分布系数图及分析[分布曲线是指以pH为横坐标、分布系数(即组分的平衡浓度占总浓度的分数)为纵坐标的关系曲线]
1.(2022·玉林、贵港联考)草酸(H2C2O4)常温时的电离平衡常数K1=5.0×10-2,K2=5.4×10-5。常温下,用0.2 mol/L的NaOH溶液滴定25 mL 0.2 mol/L的H2C2O4溶液的滴定曲线如图所示。下列说法正确的是( )
B
B
A
4.(2022·安徽江淮十校联考)氨基酸分子中含有—NH2和—COOH两种官能团,当调节溶液的pH使氨基酸所带正负电荷正好相等时,氨基酸所带的净电荷为零,在电场中不发生移动现象,此时溶液的pH叫等电点。常温下,0.001 mol·L-1的甘氨酸(H2NCH2COOH)溶液中各物种浓度对数值与pH的关系如图所示,下列说法正确的是( )
答案 A
5.(2022·临川一中模拟)25 ℃时,向不同浓度硝酸中加入CH3COOAg固体,溶解过程中-lg c(Ag+)与溶液pH的关系如图所示。下列说法正确的是( )
A.CH3COOAg的Ksp的数量级为10-3
B.温度一定时,c越大,CH3COOAg的溶解度越小
C.温度和pH一定时,c越大,CH3COOAg的Ksp越大
D.a点溶液满足:c(CH3COOH)+c(H+)=0.1 mol·L-1
A
题型特训2 滴定曲线
题型特训1 电解质溶液中四大平衡常数曲线
题型特训3 分布系(分)数及对数曲线
D
D
3.(2022·天津河西区摸底)某实验测得0.1 mol·L-1 NaHCO3溶液在升温过程中(不考虑水挥发)的pH变化曲线如图所示。下列说法正确的是( )
A
4.(2022·安徽十八校联盟模拟)H2R是一种二元弱酸,常温下某水体中c(H2R)由于空气中的某种成分的存在而保持不变,又知该水体-lg c(X)(X为H2R、HR-、R2-、M2+)与pH的关系如图所示、Ksp(MR)=3.0×10-9,下列说法错误的是( )
A.Ka1(H2R)=1×10-6.3
B.0.1 mol·L-1的KHR的溶液:c(K+)>c(HR-)>
c(R2-)>c(OH-)
C.曲线④表示水体中c(M2+)随着pH的变化情况
D.当pH=10.3时,水体中c(M2+)等于3.0×10-7.9 mol·L-1
B
A.n点溶液c(OH-)>c(H+)
B.p点溶液中存在c(OH-)=c(HR-)+2c(H2R)+c(H+)
C.n点到p点过程中水的电离程度变小
D.NaHR溶液中HR-的电离平衡常数小于其水解平衡常数
答案 B
6.(2022·成都树德中学阶段测试)用双硫腙(H2Dz,二元弱酸)~CCl4络合萃取法可从工业废水中提取金属离子:H2Dz先将金属离子络合成电中性的物质[如Cu(HDz)2等],再用CCl4萃取此络合物。下图是用上述方法处理含有Hg2+、Bi3+、Zn2+的废水时的酸度曲线(E%表示金属离子以络合物形式被萃取分离的百分率)。
C
题型特训2 滴定曲线
1.(2022·广西“韬智杯”大联考)室温时,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,溶液的pH随NaOH溶液体积的变化如图所示。下列说法正确的是( )
B
2.(2022·许昌二模)常温下,体积均为25.00 mL的磷酸、硫酸及草酸(H2C2O4)分别用0.100 0 mol·L-1 NaOH溶液滴定,其滴定曲线如下:
B
3.(2022·南昌一模)室温下,用0.1 mol/L的盐酸滴定0.1 mol/L溴化肼(N2H5Br)的25 mL溶液,已知肼(N2H4)是二元弱碱(与NH3类似),滴定过程中混合溶液的相对导电能力变化曲线如图所示。下列叙述错误的是( )
C
4.(2022·甘肃名校第二次诊断)已知Ka(CH3COOH)=1.7×10-5,Kb(NH3·H2O)=1.7×10-5。常温下,用0.01 mol·L-1氨水滴定20 mL浓度均为0.01 mol·L-1的HCl和CH3COOH混合溶液,相对导电能力随加入氨水体积变化曲线如图所示。下列叙述正确的是( )
A
答案 C
下列说法错误的是( )
A.HA电离常数的数量级为10-5
B.b点溶液中存在c(A-)+c(OH-)=c(HA)+c(H+)
C.c点溶液中粒子浓度的大小关系为c(A-)>c(HA)>c(H+)>c(OH-)
D.若将HA改为等体积等浓度的HCN,则pH随NaOH溶液体积的变化曲线竖直上移
B
A.曲线a表示的是HA的分布系数变化曲线
B.HA的电离平衡常数的数量级为10-6
C.p点对应的溶液中,c(A-)<3c(HA)
D.p、n、q中,水的电离程度最大的是q点
C
题型特训3 分布系(分)数及对数曲线
2.(2022·浙江百校联盟检测)三元酸(用H3A表示),溶液中H3A、H2A-、HA2-、A3-的百分含量随pH的变化曲线如图所示,下列说法中不正确的是( )
A.曲线c表示HA2-的变化曲线
B.H3A的第二步电离常数Ka2和第三步电离常数Ka3
的比值约为101.2
C.Na2HA溶液中水的电离受到抑制
D.pH=4时,c(H+)=c(H2A-)+2c(HA2-)+c(OH-)
D
C
4.(2022·西安中学模拟)常温下,已知弱酸H3RO3溶液中含R物种的浓度之和为0.1 mol·L-1,溶液中所有含R物种的lg c-pOH的关系如图所示,下列说法错误的是( )
答案 D
5.(2022·东北师大附中摸底)25 ℃时,用HCl调节Na3R溶液的pH,混合溶液的pH与离子浓度的关系如图所示。下列说法正确的是( )
D
6.(2022·成都名校联盟联考)常温下,向一定浓度的H2X溶液中滴加NaOH溶液,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是( )
C
C
Thanks!
本讲内容结束
同课章节目录
