2023浙江中考科学一轮复习(基础版)第28讲 构成物质的粒子 元素(课件 36张ppt)
文档属性
| 名称 | 2023浙江中考科学一轮复习(基础版)第28讲 构成物质的粒子 元素(课件 36张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 847.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-01-18 09:10:24 | ||
图片预览










文档简介
(共36张PPT)
2023浙江中考科学一轮复习(基础版)
第28讲 构成物质的粒子 元素
构成物质的微粒(八下教材P40)
1.构成物质的微粒有_____、_____和_____。由分子构成的物质,_____是保持物质化学性质的一种微粒;_____是化学变化中的最小微粒;_____是得失电子的原子或原子团。
(1)由分子构成的物质:大多数物质由分子构成。如H2O、CO2、CH4等化合物,H2、O2、Cl2等气态单质。
(2)由原子构成的物质:①所有的金属单质;②一些非金属单
质,如C、Si等;③稀有气体,如:He、Ne、Ar等。
(3)由离子构成的物质:酸、碱、盐等。
分子
原子
离子
分子
原子
离子
2.分子的性质
(1)分子的体积和质量都很小。
(2)构成物质的分子都在不停地做无规则运动(热运动),______越高,分子无规则运动越剧烈。宏观表现为扩散现象,固体、液体、气体都存在扩散现象。
(3)分子之间存在_____,如一定体积的酒精和水混合,混合后的体积小于两者的体积之和。
(4)构成物质的分子之间虽然彼此相互隔开,却存在着相互作用的______。固体和液体的体积很难被压缩,因为分子间存在着______。
温度
空隙
引力
斥力
1.(2022,临沂)从分子的角度分析,下列解释不合理的是( )
A.品红在水中扩散,说明分子在不断运动
B.水受热变为水蒸气体积变大,说明分子的大小随温度的升高而增大
C.将氧气压缩贮存于钢瓶中,说明分子之间有间隔
D.H2在Cl2中燃烧生成HCl,说明化学变化中分子发生改变
B
原子的构成(八下教材P43)
在原子结构中,需要注意:
(1)质子数(核电荷数)=____________,因而原子_______电性。
(2)原子核中质子数不一定等于中子数,如氢原子的原子核内_________。
中子
质子
核外电子数
不显
无中子
(3)原子核在整个原子中所占体积很小,但原子的质量主要集中在__________上。
(4)原子核内__________决定了元素种类,同种元素的原子和离子具有相同的__________。
原子核
质子数
质子数
2.(2021,杭州)有一种人造氢原子(可表示为 H)的原子核中有3个中子,它可以结合成 H2分子。一个 H2分子中,下列微粒的个数不等于2的是( )
A.原子
B.质子
C.中子
D.电子
C
原子结构模型的发展过程(八下教材P43)
1.道尔顿——实心球模型——首先提出原子论。
2.汤姆生——枣糕模型(西瓜模型)——发现电子。
3.卢瑟福——______结构模型——α粒子散射实验,原子核。
4.玻尔——______模型。
5.现代——电子云模型。
从原子结构模型建立的过程中,我们可以发现建立模型往往需要有一个不断完善、不断修正的过程,使模型更接近事物的本质。
核式
分层
3.英国科学家卢瑟福用带正电的α粒子轰击金属箔,这就是著名的α粒子散射实验。该实验不能证明的是( )
A.原子核体积很小
B.原子不是实心球体,大部分空间是空的
C.原子核是由质子和中子组成
D.原子核质量比较大
C
元素及元素符号(八下教材P50)
1.元素
(1)定义:元素是具有相同__________(质子数)的同一类原子的总称。
(2)元素与同位素的关系:原子核内的_________相同、_________不同的同类原子互为同位素原子。元素是互为同位素原子的
总称。
核电荷数
质子数
中子数
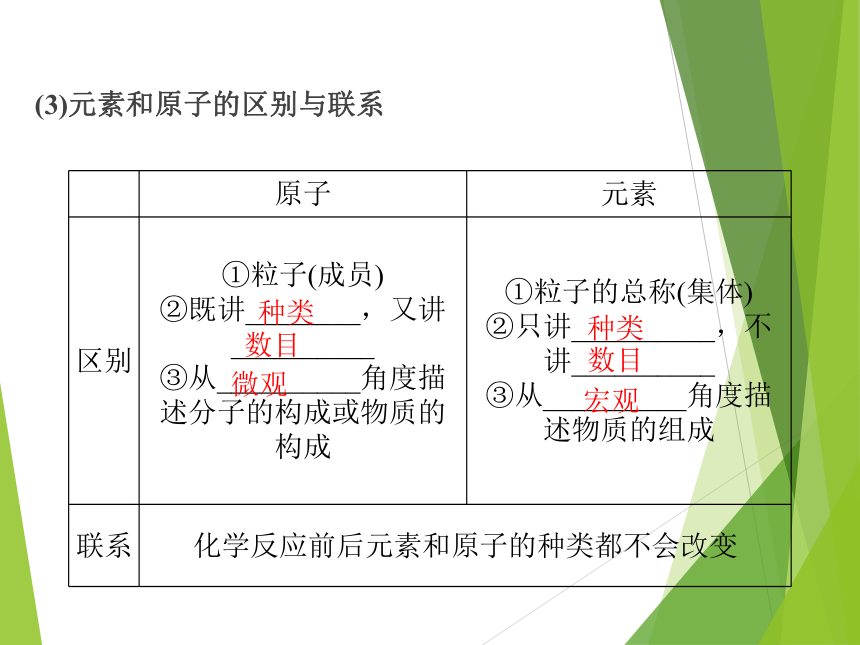
(3)元素和原子的区别与联系
原子 元素
区别 ①粒子(成员)
②既讲________,又讲__________
③从__________角度描述分子的构成或物质的构成 ①粒子的总称(集体)
②只讲__________,不讲__________
③从__________角度描述物质的组成
联系 化学反应前后元素和原子的种类都不会改变
种类
数目
微观
种类
数目
宏观
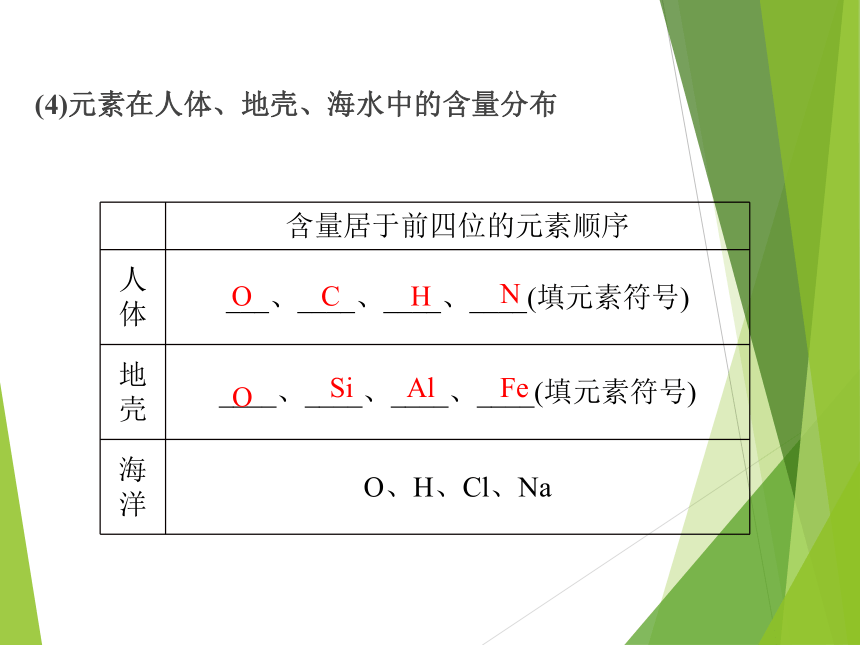
(4)元素在人体、地壳、海水中的含量分布
O
含量居于前四位的元素顺序
人体 ___、____、____、____(填元素符号)
地壳 ____、____、____、____(填元素符号)
海洋 O、H、Cl、Na
C
H
N
O
Si
Al
Fe
2.元素符号
(1)元素符号的表示方法:用该元素拉丁文的第一个大写字母来表示,若有重复则取前面两个字母,第二个字母小写。
(2)元素符号表示的意义
宏观:①表示一种______;②表示金属、固态非金属及稀有气体等单质。
微观:表示这种元素的一个________。
【注意】当元素符号前面加上_______时,就只具有微观意义。如“2H”只表示两个氢原子。
元素
原子
数字
4.下列有关元素、原子、分子和离子的说法正确的是( )
A.决定元素种类的是原子的核电荷数
B.原子可以构成分子,不能直接构成物质
C.分子是化学变化中最小的微粒
D.由同一种元素组成的物质一定是单质
A
5.疫情防控期间学校每周对教室进行消毒,84消毒液是一种以次氯酸钠为主要成分的含氯消毒剂,可以为环境消毒也可以为物体表面消毒,这里氯是指( )
A.单质
B.原子
C.离子
D.元素
D
6.地壳中的元素分布如图,其中区域②代表的元素是( )
A.氧 B.硅 C.铝 D.铁
B
元素周期表(八下教材P55)
1.元素周期表的编排三原则:
(1)按照原子序数递增的顺序从左到右、从上到下排列。
(2)横行(周期):元素周期表每一个周期(除第一周期外)开头都是______元素,结尾都是________元素。从左到右元素的核电荷数逐渐______,电子层数______。
(3)纵列(族):从上到下元素的电子层数逐渐______,最外层电子数______,______性质相似。
2.质子数、中子数及核外电子数的相关计算
(1)在原子中,原子序数=核电荷数=____________=质子数
(2)相对原子质量≈________+________
金属
非金属
增加
相同
增加
相同
化学
核外电子数
质子数
中子数
7.(2022,北京)我国北斗导航卫星系统使用了星载氢原子钟。氢在元素周期表中的信息如图,下列有关氢元素的说法不正确的是( )
A.元素符号为H
B.原子序数为1
C.相对原子质量为1.008 g
D.原子中核外电子数为1
C
构成物质的微粒
分子、原子和离子是构成物质的基本微粒,在化学变化中分子可分而原子不可分,在由分子构成的物质中,分子是保持物质化学性质的最小微粒,原子是化学变化中的最小微粒,分子不一定比原子大,但比构成该分子的原子大。原子得失电子后变成离子,因此离子是带电的微粒。
【例1】 如图为物质、元素及构成微粒的相互关系图,下列说法中不正确的是( )
A.图中a为分子,b为元素,c为离子
B.由图可知,分子、原子、离子都是构成物质的一种微粒
C.原子得到电子形成阳离子,原子失去电子形成阴离子
D.不同种元素的原子,质子数不同
C
1.(2021,赤峰)构成物质的粒子有分子、原子、离子等。下列叙述不正确的是( )
A.从分子的角度看,糖水和水的本质区别在于前者含有多种分子,后者只含一种分子
B.金刚石、石墨、C60都是由碳元素组成的单质,保持它们化学性质的最小粒子都是碳原子
C.氧气和臭氧都是由氧元素组成的,但是二者化学性质差异很大,是由于构成它们的分子不同
D.二氧化硫、液氧、液氮都是由分子构成的,氦气、铁水都是由原子构成的,碳酸钙则是由离子构成的
B
2.已知某两种物质在光照条件下能发生反应,其微观模型示意图如下,图中相同小球代表同种原子,原子间的短线代表原子的结合。下列从图示获得的信息中错误的是( )
A.图示中共有4种分子
B.说明化学反应中分子种类一定改变
C.该化学反应说明分子可以再分
D.说明化学反应中原子也可以再分
D
原子的结构模型发展
原子结构模型的发展中重要的实验——α粒子散射实验。α粒子散射实验的现象包括如下三个方面:第一,绝大多数α粒子穿过金箔后几乎沿原方向前进;第二,少数α粒子穿过金箔后发生了较大偏转;第三,极少数α粒子击中金箔后几乎沿原方向返回。α粒子散射实验的结论是帮助科学家否定了长期以来的“枣糕状”原子模型,建立了原子的核式结构模型。即:原子中心有个很小的核,叫原子核,原子的全部正电荷和几乎全部质量都集中在原子核内,带负电的电子绕核做高速的圆周运动。
【例2】 (2020,衢州)用高能粒子轰击原子核是研究微观粒子的一种方法。
1934年,意大利科学家费米用中子轰击铀原子(质子数为92,元素符号为U),得到了一种质量增加的原子。他公开宣布发现了93号元素,被科学界认可,从而获得了诺贝尔物理学奖。
1938年,德国科学家哈恩在重复费米的实验后,发现费米实验中得到的是56号钡元素,并用图示模型来定义这一变化。费米知道后,立即重复哈恩的实验,结果证实自己错了,费米坦率地检讨并纠正了错误。
(1)费米用中子轰击铀原子,不可能增加铀原子的________数,所以得不到93号元素。
(2)结合材料分析,以下观点正确的是_______。
A.面对前人的观点要敢于质疑
B.科学结论的得出要依据客观事实
C.对科学的认识是一个不断修正、完善的过程
质子
ABC
3.如图是卢瑟福将带正电的α粒子流轰击在金箔上出现散射的实验示意图。以下是根据该实验现象作出的推断,不合理的是( )
A.少数α粒子向两侧偏转,说明原
子中心的“核”带正电
B.少数α粒子偏转的角度很大,说
明原子“核”外有带负电的电子
C.绝大多数α粒子仍沿原来方向穿
过,说明原子中绝大部分是“空”的
D.绝少数α粒子被反弹回来,说明原子中心有一个体积小而质量大的“核”
B
原子的构成
原子核在整个原子中所占的体积很小,但原子的质量主要集中在原子核上。在原子内,核电荷数=质子数=核外电子数。
【例3】 如图为某原子结构模型的示意图,其中a、b、c是构成该原子的三种不同粒子,下列说法正确的是( )
A.决定该原子种类的粒子是b
B.原子的质量集中在a和c上
C.原子中b与c的数目一定相同
D.原子中a与c的数目一定相同
D
4.我们考试填涂答题卡专用的2B铅笔如图甲,其笔芯主要成分是石墨和黏合剂,石墨由碳原子直接构成,碳原子结构模型如图乙所示,下列有关说法正确的是( )
A.电子在离核远近不同的区域中运动
B.所有原子中,质子数=中子数=核外电子数
C.质子和中子由更小的、不能再分的夸克构成
D.中子的质量相对于带电的质子和电子,可以忽略
A
元素、同位素
元素是具有相同核电荷数(即质子数)的一类原子的总称。质子数决定元素的种类。元素用元素符号表示,元素是宏观概念,讲“种”数,不讲“个”数。元素符号要熟记,会正确规范书写。
化合价是正确书写化学式的工具,因此要熟记常见元素和原子团的化合价。熟练应用“化合物中各元素化合价代数和为零”求未知元素的化合价和书写化学式。
【例4】 (2021,绍兴)2021年3月,四川三星堆遗址进行了新一轮考古发掘。至今三星堆已出土了黄金面具、青铜纵目面具等一批珍贵文物,如图。
(1)出土的黄金面具仍金光灿灿,而青铜纵目面具已锈迹斑斑,这说明金的活动性比铜_____(填“强”或“弱”)。
弱
(2)古代制作青铜器的铜来源于铜矿,如黄铜矿。黄铜矿的主要成分为二硫化亚铁铜(CuFeS2),其中铁元素和铜元素均为+2价,则硫元素的化合价为______。
(3)应用碳-14测出三星堆遗址距今3000年左右,碳-12和
碳-14是碳元素的两种同位素原子,它们的主要区别是原
子核中_____数不同。
-2
中子
5.(2021,嘉兴)氕、氘、氚是氢的三种同位素原子,它们的原子结构模型如图所示,相关信息如表。试回答
(1)原子结构模型中的“ ”表示的粒子是______。
(2)超重水有一定的放射性。一个超重水分子由两个氚原子和一个氧原子构成,其化学式可表示为T2O,T2O中T的化合价为____。
中子
名称 符号 相对原子质量
氕 H 1
氘 D 2
氚 T 3
+1
(3)重水是由氘和氧组成的化合物,化学式可表示为D2O,重水和普通水化学性质相似。在海水中重水的质量约占0.02%,则100 t海水中所含氘的质量是多少?
【例】 (2022,温州)“原子—分子”学说的建立经历了曲折的过程。
材料一:1803年,道尔顿在原子论中提出:元素由微小的不可分的原子组成;不同元素的原子以简单数目比例形成不可再分的原子——“复杂原子”。
材料二:1809年,盖·吕萨克认同道尔顿的原子论,并提出自己的假说:在同温同压下,相同体积的不同气体中含有相同数目的原子(包括“复杂原子”)。道尔顿反对盖·吕萨克的假说,他认为若该假说成立,解释化学反应时,有些反应会推导出“半个原子”,与原子论矛盾。
材料三:1811年,阿伏加德罗提出分子学说,解决了道尔顿和盖·吕萨克的矛盾。随后科学家们确立并逐步完善了“原子——分子”学说。
(1)1897年,汤姆生发现原子内有带负电的______,否定了“原子不可再分”的观点。
(2)道尔顿原子论中“复杂原子”构成的物质,按现在物质的组成分类,属于纯净物中的_________。
电子
化合物
(3)依据道尔顿的原子论和盖·吕萨克的假说,下列反应能推导出“半个原子”的是_______。(可多选)
A.1升氢气和1升氯气化合成2升氯化氢气体
B.2升氢气和1升氧气化合成2升水蒸气
C.木炭与1升氧气化合成1升二氧化碳
D. 木炭与1升二氧化碳化合成2升一氧化碳
E.硫与1升氢气化合成1升硫化氢气体
ABD
2023浙江中考科学一轮复习(基础版)
第28讲 构成物质的粒子 元素
构成物质的微粒(八下教材P40)
1.构成物质的微粒有_____、_____和_____。由分子构成的物质,_____是保持物质化学性质的一种微粒;_____是化学变化中的最小微粒;_____是得失电子的原子或原子团。
(1)由分子构成的物质:大多数物质由分子构成。如H2O、CO2、CH4等化合物,H2、O2、Cl2等气态单质。
(2)由原子构成的物质:①所有的金属单质;②一些非金属单
质,如C、Si等;③稀有气体,如:He、Ne、Ar等。
(3)由离子构成的物质:酸、碱、盐等。
分子
原子
离子
分子
原子
离子
2.分子的性质
(1)分子的体积和质量都很小。
(2)构成物质的分子都在不停地做无规则运动(热运动),______越高,分子无规则运动越剧烈。宏观表现为扩散现象,固体、液体、气体都存在扩散现象。
(3)分子之间存在_____,如一定体积的酒精和水混合,混合后的体积小于两者的体积之和。
(4)构成物质的分子之间虽然彼此相互隔开,却存在着相互作用的______。固体和液体的体积很难被压缩,因为分子间存在着______。
温度
空隙
引力
斥力
1.(2022,临沂)从分子的角度分析,下列解释不合理的是( )
A.品红在水中扩散,说明分子在不断运动
B.水受热变为水蒸气体积变大,说明分子的大小随温度的升高而增大
C.将氧气压缩贮存于钢瓶中,说明分子之间有间隔
D.H2在Cl2中燃烧生成HCl,说明化学变化中分子发生改变
B
原子的构成(八下教材P43)
在原子结构中,需要注意:
(1)质子数(核电荷数)=____________,因而原子_______电性。
(2)原子核中质子数不一定等于中子数,如氢原子的原子核内_________。
中子
质子
核外电子数
不显
无中子
(3)原子核在整个原子中所占体积很小,但原子的质量主要集中在__________上。
(4)原子核内__________决定了元素种类,同种元素的原子和离子具有相同的__________。
原子核
质子数
质子数
2.(2021,杭州)有一种人造氢原子(可表示为 H)的原子核中有3个中子,它可以结合成 H2分子。一个 H2分子中,下列微粒的个数不等于2的是( )
A.原子
B.质子
C.中子
D.电子
C
原子结构模型的发展过程(八下教材P43)
1.道尔顿——实心球模型——首先提出原子论。
2.汤姆生——枣糕模型(西瓜模型)——发现电子。
3.卢瑟福——______结构模型——α粒子散射实验,原子核。
4.玻尔——______模型。
5.现代——电子云模型。
从原子结构模型建立的过程中,我们可以发现建立模型往往需要有一个不断完善、不断修正的过程,使模型更接近事物的本质。
核式
分层
3.英国科学家卢瑟福用带正电的α粒子轰击金属箔,这就是著名的α粒子散射实验。该实验不能证明的是( )
A.原子核体积很小
B.原子不是实心球体,大部分空间是空的
C.原子核是由质子和中子组成
D.原子核质量比较大
C
元素及元素符号(八下教材P50)
1.元素
(1)定义:元素是具有相同__________(质子数)的同一类原子的总称。
(2)元素与同位素的关系:原子核内的_________相同、_________不同的同类原子互为同位素原子。元素是互为同位素原子的
总称。
核电荷数
质子数
中子数
(3)元素和原子的区别与联系
原子 元素
区别 ①粒子(成员)
②既讲________,又讲__________
③从__________角度描述分子的构成或物质的构成 ①粒子的总称(集体)
②只讲__________,不讲__________
③从__________角度描述物质的组成
联系 化学反应前后元素和原子的种类都不会改变
种类
数目
微观
种类
数目
宏观
(4)元素在人体、地壳、海水中的含量分布
O
含量居于前四位的元素顺序
人体 ___、____、____、____(填元素符号)
地壳 ____、____、____、____(填元素符号)
海洋 O、H、Cl、Na
C
H
N
O
Si
Al
Fe
2.元素符号
(1)元素符号的表示方法:用该元素拉丁文的第一个大写字母来表示,若有重复则取前面两个字母,第二个字母小写。
(2)元素符号表示的意义
宏观:①表示一种______;②表示金属、固态非金属及稀有气体等单质。
微观:表示这种元素的一个________。
【注意】当元素符号前面加上_______时,就只具有微观意义。如“2H”只表示两个氢原子。
元素
原子
数字
4.下列有关元素、原子、分子和离子的说法正确的是( )
A.决定元素种类的是原子的核电荷数
B.原子可以构成分子,不能直接构成物质
C.分子是化学变化中最小的微粒
D.由同一种元素组成的物质一定是单质
A
5.疫情防控期间学校每周对教室进行消毒,84消毒液是一种以次氯酸钠为主要成分的含氯消毒剂,可以为环境消毒也可以为物体表面消毒,这里氯是指( )
A.单质
B.原子
C.离子
D.元素
D
6.地壳中的元素分布如图,其中区域②代表的元素是( )
A.氧 B.硅 C.铝 D.铁
B
元素周期表(八下教材P55)
1.元素周期表的编排三原则:
(1)按照原子序数递增的顺序从左到右、从上到下排列。
(2)横行(周期):元素周期表每一个周期(除第一周期外)开头都是______元素,结尾都是________元素。从左到右元素的核电荷数逐渐______,电子层数______。
(3)纵列(族):从上到下元素的电子层数逐渐______,最外层电子数______,______性质相似。
2.质子数、中子数及核外电子数的相关计算
(1)在原子中,原子序数=核电荷数=____________=质子数
(2)相对原子质量≈________+________
金属
非金属
增加
相同
增加
相同
化学
核外电子数
质子数
中子数
7.(2022,北京)我国北斗导航卫星系统使用了星载氢原子钟。氢在元素周期表中的信息如图,下列有关氢元素的说法不正确的是( )
A.元素符号为H
B.原子序数为1
C.相对原子质量为1.008 g
D.原子中核外电子数为1
C
构成物质的微粒
分子、原子和离子是构成物质的基本微粒,在化学变化中分子可分而原子不可分,在由分子构成的物质中,分子是保持物质化学性质的最小微粒,原子是化学变化中的最小微粒,分子不一定比原子大,但比构成该分子的原子大。原子得失电子后变成离子,因此离子是带电的微粒。
【例1】 如图为物质、元素及构成微粒的相互关系图,下列说法中不正确的是( )
A.图中a为分子,b为元素,c为离子
B.由图可知,分子、原子、离子都是构成物质的一种微粒
C.原子得到电子形成阳离子,原子失去电子形成阴离子
D.不同种元素的原子,质子数不同
C
1.(2021,赤峰)构成物质的粒子有分子、原子、离子等。下列叙述不正确的是( )
A.从分子的角度看,糖水和水的本质区别在于前者含有多种分子,后者只含一种分子
B.金刚石、石墨、C60都是由碳元素组成的单质,保持它们化学性质的最小粒子都是碳原子
C.氧气和臭氧都是由氧元素组成的,但是二者化学性质差异很大,是由于构成它们的分子不同
D.二氧化硫、液氧、液氮都是由分子构成的,氦气、铁水都是由原子构成的,碳酸钙则是由离子构成的
B
2.已知某两种物质在光照条件下能发生反应,其微观模型示意图如下,图中相同小球代表同种原子,原子间的短线代表原子的结合。下列从图示获得的信息中错误的是( )
A.图示中共有4种分子
B.说明化学反应中分子种类一定改变
C.该化学反应说明分子可以再分
D.说明化学反应中原子也可以再分
D
原子的结构模型发展
原子结构模型的发展中重要的实验——α粒子散射实验。α粒子散射实验的现象包括如下三个方面:第一,绝大多数α粒子穿过金箔后几乎沿原方向前进;第二,少数α粒子穿过金箔后发生了较大偏转;第三,极少数α粒子击中金箔后几乎沿原方向返回。α粒子散射实验的结论是帮助科学家否定了长期以来的“枣糕状”原子模型,建立了原子的核式结构模型。即:原子中心有个很小的核,叫原子核,原子的全部正电荷和几乎全部质量都集中在原子核内,带负电的电子绕核做高速的圆周运动。
【例2】 (2020,衢州)用高能粒子轰击原子核是研究微观粒子的一种方法。
1934年,意大利科学家费米用中子轰击铀原子(质子数为92,元素符号为U),得到了一种质量增加的原子。他公开宣布发现了93号元素,被科学界认可,从而获得了诺贝尔物理学奖。
1938年,德国科学家哈恩在重复费米的实验后,发现费米实验中得到的是56号钡元素,并用图示模型来定义这一变化。费米知道后,立即重复哈恩的实验,结果证实自己错了,费米坦率地检讨并纠正了错误。
(1)费米用中子轰击铀原子,不可能增加铀原子的________数,所以得不到93号元素。
(2)结合材料分析,以下观点正确的是_______。
A.面对前人的观点要敢于质疑
B.科学结论的得出要依据客观事实
C.对科学的认识是一个不断修正、完善的过程
质子
ABC
3.如图是卢瑟福将带正电的α粒子流轰击在金箔上出现散射的实验示意图。以下是根据该实验现象作出的推断,不合理的是( )
A.少数α粒子向两侧偏转,说明原
子中心的“核”带正电
B.少数α粒子偏转的角度很大,说
明原子“核”外有带负电的电子
C.绝大多数α粒子仍沿原来方向穿
过,说明原子中绝大部分是“空”的
D.绝少数α粒子被反弹回来,说明原子中心有一个体积小而质量大的“核”
B
原子的构成
原子核在整个原子中所占的体积很小,但原子的质量主要集中在原子核上。在原子内,核电荷数=质子数=核外电子数。
【例3】 如图为某原子结构模型的示意图,其中a、b、c是构成该原子的三种不同粒子,下列说法正确的是( )
A.决定该原子种类的粒子是b
B.原子的质量集中在a和c上
C.原子中b与c的数目一定相同
D.原子中a与c的数目一定相同
D
4.我们考试填涂答题卡专用的2B铅笔如图甲,其笔芯主要成分是石墨和黏合剂,石墨由碳原子直接构成,碳原子结构模型如图乙所示,下列有关说法正确的是( )
A.电子在离核远近不同的区域中运动
B.所有原子中,质子数=中子数=核外电子数
C.质子和中子由更小的、不能再分的夸克构成
D.中子的质量相对于带电的质子和电子,可以忽略
A
元素、同位素
元素是具有相同核电荷数(即质子数)的一类原子的总称。质子数决定元素的种类。元素用元素符号表示,元素是宏观概念,讲“种”数,不讲“个”数。元素符号要熟记,会正确规范书写。
化合价是正确书写化学式的工具,因此要熟记常见元素和原子团的化合价。熟练应用“化合物中各元素化合价代数和为零”求未知元素的化合价和书写化学式。
【例4】 (2021,绍兴)2021年3月,四川三星堆遗址进行了新一轮考古发掘。至今三星堆已出土了黄金面具、青铜纵目面具等一批珍贵文物,如图。
(1)出土的黄金面具仍金光灿灿,而青铜纵目面具已锈迹斑斑,这说明金的活动性比铜_____(填“强”或“弱”)。
弱
(2)古代制作青铜器的铜来源于铜矿,如黄铜矿。黄铜矿的主要成分为二硫化亚铁铜(CuFeS2),其中铁元素和铜元素均为+2价,则硫元素的化合价为______。
(3)应用碳-14测出三星堆遗址距今3000年左右,碳-12和
碳-14是碳元素的两种同位素原子,它们的主要区别是原
子核中_____数不同。
-2
中子
5.(2021,嘉兴)氕、氘、氚是氢的三种同位素原子,它们的原子结构模型如图所示,相关信息如表。试回答
(1)原子结构模型中的“ ”表示的粒子是______。
(2)超重水有一定的放射性。一个超重水分子由两个氚原子和一个氧原子构成,其化学式可表示为T2O,T2O中T的化合价为____。
中子
名称 符号 相对原子质量
氕 H 1
氘 D 2
氚 T 3
+1
(3)重水是由氘和氧组成的化合物,化学式可表示为D2O,重水和普通水化学性质相似。在海水中重水的质量约占0.02%,则100 t海水中所含氘的质量是多少?
【例】 (2022,温州)“原子—分子”学说的建立经历了曲折的过程。
材料一:1803年,道尔顿在原子论中提出:元素由微小的不可分的原子组成;不同元素的原子以简单数目比例形成不可再分的原子——“复杂原子”。
材料二:1809年,盖·吕萨克认同道尔顿的原子论,并提出自己的假说:在同温同压下,相同体积的不同气体中含有相同数目的原子(包括“复杂原子”)。道尔顿反对盖·吕萨克的假说,他认为若该假说成立,解释化学反应时,有些反应会推导出“半个原子”,与原子论矛盾。
材料三:1811年,阿伏加德罗提出分子学说,解决了道尔顿和盖·吕萨克的矛盾。随后科学家们确立并逐步完善了“原子——分子”学说。
(1)1897年,汤姆生发现原子内有带负电的______,否定了“原子不可再分”的观点。
(2)道尔顿原子论中“复杂原子”构成的物质,按现在物质的组成分类,属于纯净物中的_________。
电子
化合物
(3)依据道尔顿的原子论和盖·吕萨克的假说,下列反应能推导出“半个原子”的是_______。(可多选)
A.1升氢气和1升氯气化合成2升氯化氢气体
B.2升氢气和1升氧气化合成2升水蒸气
C.木炭与1升氧气化合成1升二氧化碳
D. 木炭与1升二氧化碳化合成2升一氧化碳
E.硫与1升氢气化合成1升硫化氢气体
ABD
同课章节目录
