2023浙江中考科学一轮复习(基础版)第33讲 空气(2)(课件 30张ppt)
文档属性
| 名称 | 2023浙江中考科学一轮复习(基础版)第33讲 空气(2)(课件 30张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 625.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-01-18 09:12:28 | ||
图片预览









文档简介
(共30张PPT)
2023浙江中考科学一轮复习(基础版)
第33讲 空气(2)
二氧化碳的性质(八下教材P95)
1.物理性质
(1)在通常状态下,二氧化碳是一种_____、______的气体。
(2)密度为1.977 g/L,相同条件下,二氧化碳的密度约是空气密度的1.5倍,因此能像________那样从一个容器向另一个容器倾倒。
(3)能溶于水,通常1体积水中能溶解____体积的二氧化碳。
(4)在加压降温的情况下,二氧化碳能转变为无色液体,甚至变成雪状固体——干冰。
无色
无味
倒液体
1
2.化学性质:
(1)通常情况下,二氧化碳不能______,也不________。
(2)二氧化碳能跟水反应生成______:CO2+H2O===H2CO3,碳酸可以使紫色石蕊试液变成红色,但__________,见光、加热都会分解,使二氧化碳逸出。
(3)二氧化碳与碱溶液反应
①与澄清石灰水
a.化学方程式:__________________________________。
b.现象:____________________。
c.应用:检验CO2。
燃烧
支持燃烧
碳酸
碳酸不稳定
CO2+Ca(OH)2===CaCO3↓+H2O
澄清石灰水变浑浊
②与氢氧化钠溶液
a.化学方程式:_____________________________。
b.应用:实验室常用该反应吸收或除去未反应的二氧化碳。
CO2+2NaOH===Na2CO3+H2O
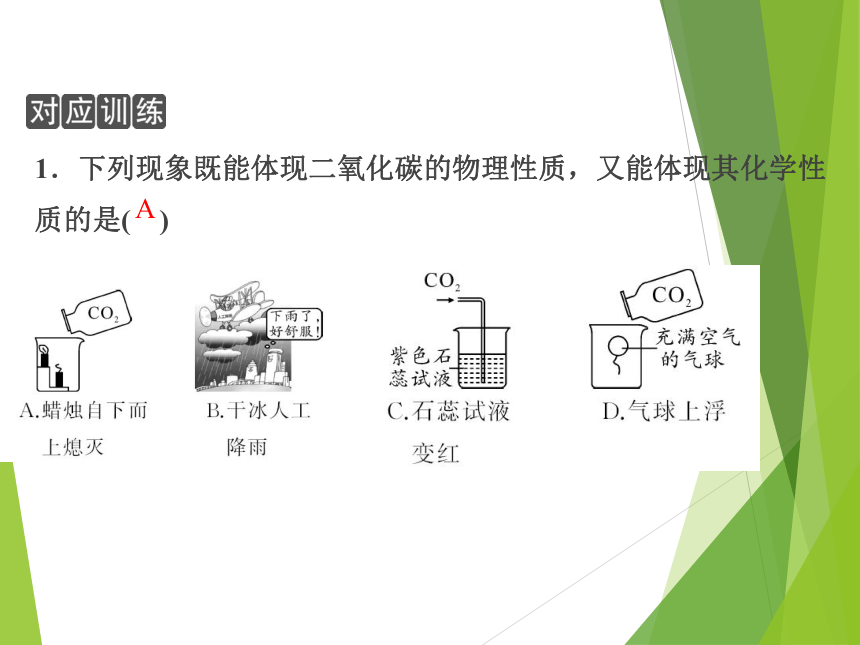
1.下列现象既能体现二氧化碳的物理性质,又能体现其化学性质的是( )
A
二氧化碳的实验室制备与检验方法
(八下教材P96)
1.工业制法:________________________。
2.实验室制法
(1)原理:______________________________________。
【注意】不能用浓盐酸,因为浓盐酸易挥发使CO2不纯;也不能用硫酸,因为反应产生的硫酸钙微溶于水,会阻止碳酸钙跟硫酸反应。
CaCO3+2HCl===CaCl2+H2O+CO2↑
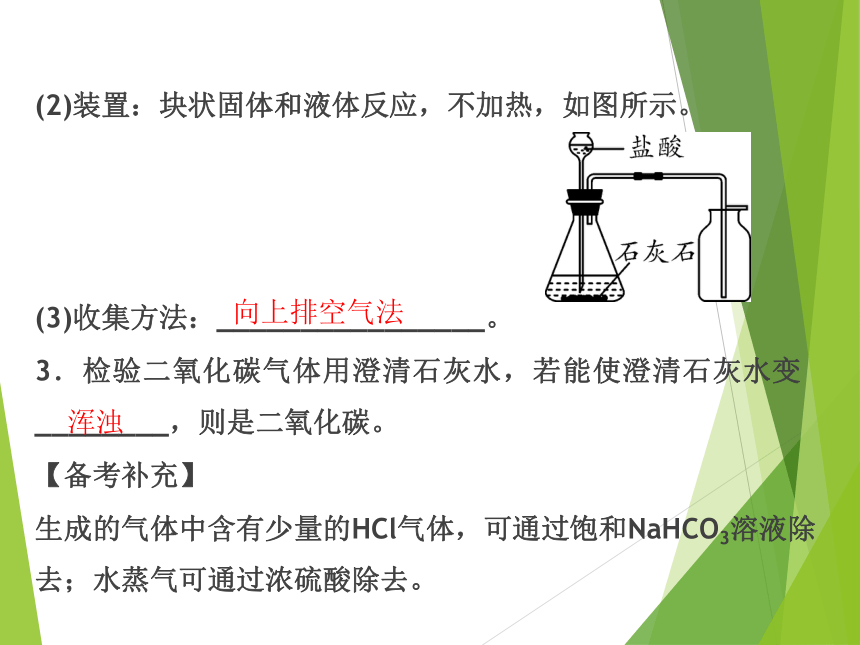
(2)装置:块状固体和液体反应,不加热,如图所示。
(3)收集方法:________________。
3.检验二氧化碳气体用澄清石灰水,若能使澄清石灰水变________,则是二氧化碳。
【备考补充】
生成的气体中含有少量的HCl气体,可通过饱和NaHCO3溶液除去;水蒸气可通过浓硫酸除去。
向上排空气法
浑浊
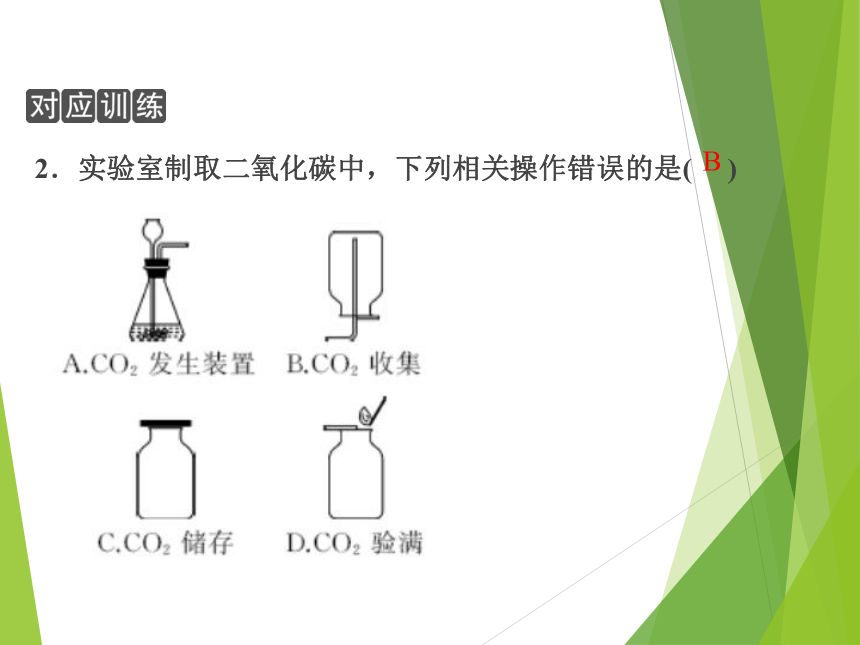
2.实验室制取二氧化碳中,下列相关操作错误的是( )
B
臭氧层、温室效应(八下教材P124)
1.臭氧层的作用
臭氧能杀死细菌和病毒,臭氧层可以把太阳辐射中的致命的________转化为热,从而阻止了高能紫外线直接射到地面上危害生命。
2.温室效应的成因
由于__________________等矿物燃料的大量使用,再加上森林面积因乱砍滥伐而急剧减少,使大气中__________的含量增加较快。
紫外线
煤、石油、天然气
二氧化碳
3.温室效应的利弊
温室效应是保证地球上的气温适于动植物生存的必要条件,适宜的温室效应对于人类和各种动物来说是非常有益的。但温室效应可使大气温度过高,引起气候反常,给人类带来灾难。
3.(2022,盘锦)“可燃冰”开采中,如果甲烷气体大量泄漏会引起的环境问题是( )
A.臭氧空洞
B.酸雨
C.温室效应增强
D.白色污染
C
空气污染(八下教材P120)
1.空气污染的主要来源:______________排放的废气和烟尘、工业废气、汽车尾气等。
2.防治空气污染的方法:______________,减少废气的排放,提倡使用无污染能源,加强空气质量预报,改善环境状况,积极植树造林等。
3.空气质量日报和预报的主要内容包括“空气质量指数”、“空气质量状况”、“首要污染物”等。
4.目前计入空气质量指数的项目暂定为:______、_______、NO2、O3、可吸入颗粒物等。
煤、石油燃烧
控制污染源
SO2
CO
4.(2021,营口)要提高全民的环境意识,保护我们的空气。下列不属于空气污染物的是( )
A.CO
B.O3
C.CO2
D.PM2.5
C
二氧化碳的性质
物质的性质决定物质的用途,物质的用途反映物质的性质。二氧化碳的主要性质:密度比空气大,易溶于水,能跟水、Ca(OH)2、NaOH反应等。二氧化碳的主要用途有:灭火、制汽水、人工降雨、植物光合作用、作制冷剂等。
【例1】 (2021,常州)如图为体现CO2性质的趣味实验装置。
(1)仪器a的名称为__________。
(2)准备相同的两套装置,锥形瓶内均预先集满CO2。
①向其中一套锥形瓶内加入30 mL水,搅拌一段时间后打开止水夹,观察到轻质塑料球向左移动一小段,移动原因是_________________________________________________,实验中b管的作用为平衡气压有利于液体顺利滴下和____________________________________________________。
铁架台
二氧化
碳溶于水(或与水反应)使锥形瓶内气压减小
防止加入液体的体积导
致锥形瓶内气体压强变化
②向另一套装置的锥形瓶内加入30 mL 6%的NaOH溶液,搅拌一段时间后打开止水夹,观察到轻质塑料球向左移动的距离比①中大得多,主要原因可用化学方程式表示为_________________________________,随后,向锥形瓶内加入足量稀盐酸搅拌,可观察到轻质塑料球_______(填“向左”“向右”或“不”)移动。
2NaOH+CO2===Na2CO3+H2O
向右
(3)已知实验所用锥形瓶的容积为500 mL,收集满一瓶二氧化碳(该实验条件下密度为2 g/L)至少需要多少克大理石(含CaCO3质量分数为80%)与足量盐酸反应?(写出计算过程)
1.某学习小组设计如下实验验证CO2的性质。
操作步骤:用3个250 mL的烧瓶收集满CO2进行实验。如图甲所示,同时迅速将注射器内液体全部注入各自烧瓶中,关闭活塞;一段时间后,同时振荡三个烧瓶。得到如图乙所示的烧瓶内压强与时间的关系曲线图。
回答下列问题:
(1)实验步骤中,曲线1、2、3中导致气压快速变小(如:cd段)的操作是__________。
(2)曲线2对应发生反应的化学方程式为___________________________________。
(3)根据图乙所示,可以得出的结论是________(填序号)。
A.1体积水中溶解CO2的量约为1体积
B.CO2能与水发生反应生成碳酸
C.CO2能与NaOH溶液发生反应
D.40%NaOH溶液比澄清石灰水更适合用于吸收CO2
振荡烧瓶
CO2+Ca(OH)2===CaCO3↓+H2O
ACD
二氧化碳的制取
二氧化碳是重要气体之一,二氧化碳有工业制法和实验室制法两种制取方法。实验室制法是中考命题的焦点。
【例2】 为了选择实验室制取二氧化碳的反应物,某实验小组的同学取等量的下列物质和足量等浓度的酸,设计了以下四种反应物组合进行探究实验,其结果如图所示。
实验①:碳酸钠粉末与稀盐酸
实验②:大理石粉末与稀盐酸
实验③:块状大理石与稀盐酸
实验④:块状大理石与稀硫酸
(1)根据实验结果,他们决定选择大理石与稀盐酸来制取二氧化碳,发生反应的化学方程式为______________________________________。他们不选择④的原因是_______________________________________________________________________。
(2)从图上可知,他们不选择①的原因是碳酸钠粉末与盐酸反应的速率太____(填“快”或“慢”),不易收集气体。
(3)由②和③两个实验可以说明,__________________会影响大理石与酸反应生成二氧化碳快慢。
CaCO3+2HCl===CaCl2+H2O
+CO2↑
碳酸钙与硫酸反应生成的
硫酸钙微溶,会覆盖在碳酸钙表面,阻止反应进行
快
反应物的接触面积
2.(2021,哈尔滨)实验室现有大理石、高锰酸钾、稀盐酸等药品及相关仪器和用品,请结合如图装置回答问题:
用大理石和稀盐酸制取二氧化碳:
(1)发生反应的化学方程式为__________________________________。
CaCO3+2HCl===CaCl2+H2O+CO2↑
(2)实验室通常选用的收集装置是____(填字母)。
(3)若制取较干燥的二氧化碳,需要在发生装置和收集装置之间连接E装置,气体应从____(填“b”或“c”)导管口进入。
(4)B装置中,当反应开始后,锥形瓶内气体增多,气压增大,大于外界大气压,导致长颈漏斗内液面______(填“高于”或“低于”)锥形瓶内液面。
C
b
高于
温室效应
【例3】 温室效应加剧是导致自然灾害持续肆虐全球的主要原因之一。
(1)图甲中的黑点表示从1880年到2000年间的一些年平均气温。
Ⅰ、Ⅱ、Ⅲ三条直线则分别表示了近120年来、60年来和20年来的平均气温变化趋势,通过比较这三条直线你可以得出的结论是________________________。
全球变暖的速率越来越快
(2)小安设计了如图乙所示的实验,在实验中若能观察到色拉油a侧液面______(填“低于”“等于”或“高于”)b侧液面,则说明甲烷也是产生温室效应的气体。
(3)汽油的主要成分是己烷(C6H14),它完全燃烧时也会产生二氧化碳,写出反应的化学方程式:________________________________________。
低于
3.环境问题一直是人类关注的焦点,下列相关叙述错误的是
( )
A.地球的资源和食物都是有限的,降低人类的出生率一定程度上有利于人类的持续发展
B.生物群落呼吸作用产生的CO2是导致温室效应形成的主要原因
C.防治酸雨的最有效方法是限制SO2的排放量,或者从燃料中去掉该物质
D.臭氧能吸收紫外线、X射线和γ射线,从而保护生物免受短波辐射的伤害
B
【例】 CO2发现之初被称为“固定空气”,是一种重要的资源。
Ⅰ.化学家布莱克研究白垩时发现了CO2的存在,发现CO2好像“固定”在白垩中一样,所以称之为“固定空气”。研究过程可表示如图1(三次实验使用的白垩质量相等,稀盐酸溶质质量分数相同)。
(1)写出“固定空气”固定到白垩中的化学方程式
_______________________________。
(2)产生的“固定空气”质量:实验②____(填“<”“=”或“>”)实验③;实验中消耗稀盐酸的质量:实验①____(填“<”“=”或“>”)实验③。
Ⅱ.化学家卡文迪许用排水银法收集了“固定空气”,并把它通入紫色石蕊试液中,发现变红。化学兴趣小组在实验室制取CO2并验证其性质。
CO2+Ca(OH)2===CaCO3↓+H2O
=
=
(3)仪器a的名称是________,写出A中发生反应的化学方程式____________________________________。
分液漏斗
2HCl+CaCO3===CaCl2+H2O+CO2↑
(4)实验室若改用装置F制取CO2,相对于A的优点是
____________________________。
(5)C中石蕊试液没有变为紫色,同学们猜想:可能是因为盐酸的浓度太大了。有同学提出解决方法:在装置A、B之间增加D和E的组合装置,验证了猜想,解决了上述问题。
①CO2气体应从____(填“b”或“c”)端通入,装置D的作用是______________________,装置E中的现象是_____________。
可控制反应的发生与停止
b
检验并除去CO2中的HCl
无明显现象
2023浙江中考科学一轮复习(基础版)
第33讲 空气(2)
二氧化碳的性质(八下教材P95)
1.物理性质
(1)在通常状态下,二氧化碳是一种_____、______的气体。
(2)密度为1.977 g/L,相同条件下,二氧化碳的密度约是空气密度的1.5倍,因此能像________那样从一个容器向另一个容器倾倒。
(3)能溶于水,通常1体积水中能溶解____体积的二氧化碳。
(4)在加压降温的情况下,二氧化碳能转变为无色液体,甚至变成雪状固体——干冰。
无色
无味
倒液体
1
2.化学性质:
(1)通常情况下,二氧化碳不能______,也不________。
(2)二氧化碳能跟水反应生成______:CO2+H2O===H2CO3,碳酸可以使紫色石蕊试液变成红色,但__________,见光、加热都会分解,使二氧化碳逸出。
(3)二氧化碳与碱溶液反应
①与澄清石灰水
a.化学方程式:__________________________________。
b.现象:____________________。
c.应用:检验CO2。
燃烧
支持燃烧
碳酸
碳酸不稳定
CO2+Ca(OH)2===CaCO3↓+H2O
澄清石灰水变浑浊
②与氢氧化钠溶液
a.化学方程式:_____________________________。
b.应用:实验室常用该反应吸收或除去未反应的二氧化碳。
CO2+2NaOH===Na2CO3+H2O
1.下列现象既能体现二氧化碳的物理性质,又能体现其化学性质的是( )
A
二氧化碳的实验室制备与检验方法
(八下教材P96)
1.工业制法:________________________。
2.实验室制法
(1)原理:______________________________________。
【注意】不能用浓盐酸,因为浓盐酸易挥发使CO2不纯;也不能用硫酸,因为反应产生的硫酸钙微溶于水,会阻止碳酸钙跟硫酸反应。
CaCO3+2HCl===CaCl2+H2O+CO2↑
(2)装置:块状固体和液体反应,不加热,如图所示。
(3)收集方法:________________。
3.检验二氧化碳气体用澄清石灰水,若能使澄清石灰水变________,则是二氧化碳。
【备考补充】
生成的气体中含有少量的HCl气体,可通过饱和NaHCO3溶液除去;水蒸气可通过浓硫酸除去。
向上排空气法
浑浊
2.实验室制取二氧化碳中,下列相关操作错误的是( )
B
臭氧层、温室效应(八下教材P124)
1.臭氧层的作用
臭氧能杀死细菌和病毒,臭氧层可以把太阳辐射中的致命的________转化为热,从而阻止了高能紫外线直接射到地面上危害生命。
2.温室效应的成因
由于__________________等矿物燃料的大量使用,再加上森林面积因乱砍滥伐而急剧减少,使大气中__________的含量增加较快。
紫外线
煤、石油、天然气
二氧化碳
3.温室效应的利弊
温室效应是保证地球上的气温适于动植物生存的必要条件,适宜的温室效应对于人类和各种动物来说是非常有益的。但温室效应可使大气温度过高,引起气候反常,给人类带来灾难。
3.(2022,盘锦)“可燃冰”开采中,如果甲烷气体大量泄漏会引起的环境问题是( )
A.臭氧空洞
B.酸雨
C.温室效应增强
D.白色污染
C
空气污染(八下教材P120)
1.空气污染的主要来源:______________排放的废气和烟尘、工业废气、汽车尾气等。
2.防治空气污染的方法:______________,减少废气的排放,提倡使用无污染能源,加强空气质量预报,改善环境状况,积极植树造林等。
3.空气质量日报和预报的主要内容包括“空气质量指数”、“空气质量状况”、“首要污染物”等。
4.目前计入空气质量指数的项目暂定为:______、_______、NO2、O3、可吸入颗粒物等。
煤、石油燃烧
控制污染源
SO2
CO
4.(2021,营口)要提高全民的环境意识,保护我们的空气。下列不属于空气污染物的是( )
A.CO
B.O3
C.CO2
D.PM2.5
C
二氧化碳的性质
物质的性质决定物质的用途,物质的用途反映物质的性质。二氧化碳的主要性质:密度比空气大,易溶于水,能跟水、Ca(OH)2、NaOH反应等。二氧化碳的主要用途有:灭火、制汽水、人工降雨、植物光合作用、作制冷剂等。
【例1】 (2021,常州)如图为体现CO2性质的趣味实验装置。
(1)仪器a的名称为__________。
(2)准备相同的两套装置,锥形瓶内均预先集满CO2。
①向其中一套锥形瓶内加入30 mL水,搅拌一段时间后打开止水夹,观察到轻质塑料球向左移动一小段,移动原因是_________________________________________________,实验中b管的作用为平衡气压有利于液体顺利滴下和____________________________________________________。
铁架台
二氧化
碳溶于水(或与水反应)使锥形瓶内气压减小
防止加入液体的体积导
致锥形瓶内气体压强变化
②向另一套装置的锥形瓶内加入30 mL 6%的NaOH溶液,搅拌一段时间后打开止水夹,观察到轻质塑料球向左移动的距离比①中大得多,主要原因可用化学方程式表示为_________________________________,随后,向锥形瓶内加入足量稀盐酸搅拌,可观察到轻质塑料球_______(填“向左”“向右”或“不”)移动。
2NaOH+CO2===Na2CO3+H2O
向右
(3)已知实验所用锥形瓶的容积为500 mL,收集满一瓶二氧化碳(该实验条件下密度为2 g/L)至少需要多少克大理石(含CaCO3质量分数为80%)与足量盐酸反应?(写出计算过程)
1.某学习小组设计如下实验验证CO2的性质。
操作步骤:用3个250 mL的烧瓶收集满CO2进行实验。如图甲所示,同时迅速将注射器内液体全部注入各自烧瓶中,关闭活塞;一段时间后,同时振荡三个烧瓶。得到如图乙所示的烧瓶内压强与时间的关系曲线图。
回答下列问题:
(1)实验步骤中,曲线1、2、3中导致气压快速变小(如:cd段)的操作是__________。
(2)曲线2对应发生反应的化学方程式为___________________________________。
(3)根据图乙所示,可以得出的结论是________(填序号)。
A.1体积水中溶解CO2的量约为1体积
B.CO2能与水发生反应生成碳酸
C.CO2能与NaOH溶液发生反应
D.40%NaOH溶液比澄清石灰水更适合用于吸收CO2
振荡烧瓶
CO2+Ca(OH)2===CaCO3↓+H2O
ACD
二氧化碳的制取
二氧化碳是重要气体之一,二氧化碳有工业制法和实验室制法两种制取方法。实验室制法是中考命题的焦点。
【例2】 为了选择实验室制取二氧化碳的反应物,某实验小组的同学取等量的下列物质和足量等浓度的酸,设计了以下四种反应物组合进行探究实验,其结果如图所示。
实验①:碳酸钠粉末与稀盐酸
实验②:大理石粉末与稀盐酸
实验③:块状大理石与稀盐酸
实验④:块状大理石与稀硫酸
(1)根据实验结果,他们决定选择大理石与稀盐酸来制取二氧化碳,发生反应的化学方程式为______________________________________。他们不选择④的原因是_______________________________________________________________________。
(2)从图上可知,他们不选择①的原因是碳酸钠粉末与盐酸反应的速率太____(填“快”或“慢”),不易收集气体。
(3)由②和③两个实验可以说明,__________________会影响大理石与酸反应生成二氧化碳快慢。
CaCO3+2HCl===CaCl2+H2O
+CO2↑
碳酸钙与硫酸反应生成的
硫酸钙微溶,会覆盖在碳酸钙表面,阻止反应进行
快
反应物的接触面积
2.(2021,哈尔滨)实验室现有大理石、高锰酸钾、稀盐酸等药品及相关仪器和用品,请结合如图装置回答问题:
用大理石和稀盐酸制取二氧化碳:
(1)发生反应的化学方程式为__________________________________。
CaCO3+2HCl===CaCl2+H2O+CO2↑
(2)实验室通常选用的收集装置是____(填字母)。
(3)若制取较干燥的二氧化碳,需要在发生装置和收集装置之间连接E装置,气体应从____(填“b”或“c”)导管口进入。
(4)B装置中,当反应开始后,锥形瓶内气体增多,气压增大,大于外界大气压,导致长颈漏斗内液面______(填“高于”或“低于”)锥形瓶内液面。
C
b
高于
温室效应
【例3】 温室效应加剧是导致自然灾害持续肆虐全球的主要原因之一。
(1)图甲中的黑点表示从1880年到2000年间的一些年平均气温。
Ⅰ、Ⅱ、Ⅲ三条直线则分别表示了近120年来、60年来和20年来的平均气温变化趋势,通过比较这三条直线你可以得出的结论是________________________。
全球变暖的速率越来越快
(2)小安设计了如图乙所示的实验,在实验中若能观察到色拉油a侧液面______(填“低于”“等于”或“高于”)b侧液面,则说明甲烷也是产生温室效应的气体。
(3)汽油的主要成分是己烷(C6H14),它完全燃烧时也会产生二氧化碳,写出反应的化学方程式:________________________________________。
低于
3.环境问题一直是人类关注的焦点,下列相关叙述错误的是
( )
A.地球的资源和食物都是有限的,降低人类的出生率一定程度上有利于人类的持续发展
B.生物群落呼吸作用产生的CO2是导致温室效应形成的主要原因
C.防治酸雨的最有效方法是限制SO2的排放量,或者从燃料中去掉该物质
D.臭氧能吸收紫外线、X射线和γ射线,从而保护生物免受短波辐射的伤害
B
【例】 CO2发现之初被称为“固定空气”,是一种重要的资源。
Ⅰ.化学家布莱克研究白垩时发现了CO2的存在,发现CO2好像“固定”在白垩中一样,所以称之为“固定空气”。研究过程可表示如图1(三次实验使用的白垩质量相等,稀盐酸溶质质量分数相同)。
(1)写出“固定空气”固定到白垩中的化学方程式
_______________________________。
(2)产生的“固定空气”质量:实验②____(填“<”“=”或“>”)实验③;实验中消耗稀盐酸的质量:实验①____(填“<”“=”或“>”)实验③。
Ⅱ.化学家卡文迪许用排水银法收集了“固定空气”,并把它通入紫色石蕊试液中,发现变红。化学兴趣小组在实验室制取CO2并验证其性质。
CO2+Ca(OH)2===CaCO3↓+H2O
=
=
(3)仪器a的名称是________,写出A中发生反应的化学方程式____________________________________。
分液漏斗
2HCl+CaCO3===CaCl2+H2O+CO2↑
(4)实验室若改用装置F制取CO2,相对于A的优点是
____________________________。
(5)C中石蕊试液没有变为紫色,同学们猜想:可能是因为盐酸的浓度太大了。有同学提出解决方法:在装置A、B之间增加D和E的组合装置,验证了猜想,解决了上述问题。
①CO2气体应从____(填“b”或“c”)端通入,装置D的作用是______________________,装置E中的现象是_____________。
可控制反应的发生与停止
b
检验并除去CO2中的HCl
无明显现象
同课章节目录
