2023浙江中考科学一轮复习(基础版)第34讲 水和溶液(课件 36张ppt)
文档属性
| 名称 | 2023浙江中考科学一轮复习(基础版)第34讲 水和溶液(课件 36张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 702.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-01-18 09:14:34 | ||
图片预览









文档简介
(共36张PPT)
2023浙江中考科学一轮复习
第34讲 水和溶液
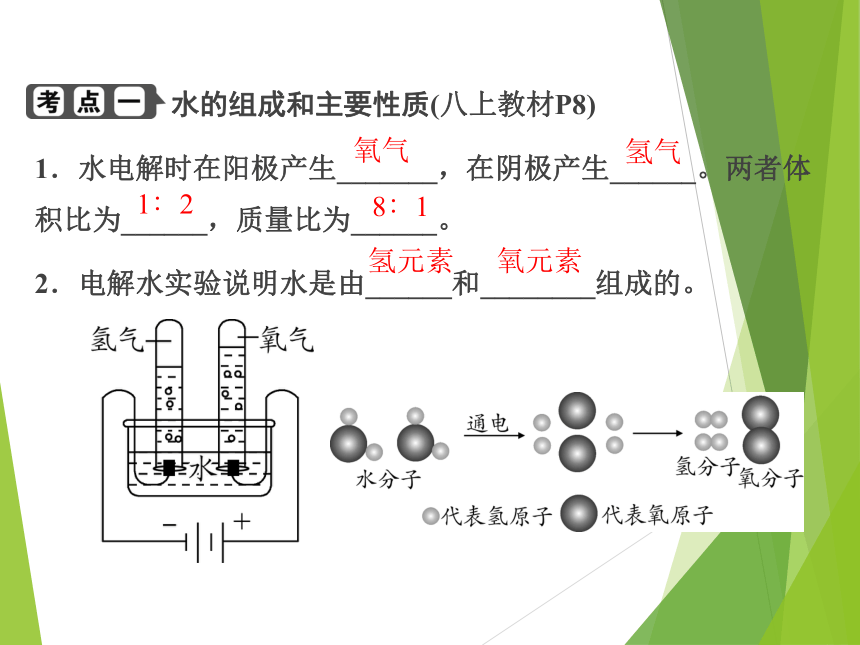
水的组成和主要性质(八上教材P8)
1.水电解时在阳极产生_______,在阴极产生______。两者体积比为______,质量比为______。
2.电解水实验说明水是由______和________组成的。
氧气
氢气
1∶2
8∶1
氢元素
氧元素
3.水的性质
2H2O 2H2↑
+O2↑
物理性质 化学性质
(1)色态味:无色、无味、液态(常温下)
(2)沸点:100 ℃(1个标准大气压下)
(3)熔点:0 ℃
(4)密度:4 ℃时密度最大,为1 g/cm3,结冰后密度
变小
(5)溶剂:能溶解很多物质,是重要的溶剂 (1)常温下化学性质稳定(2)在通电条件下分解:_________________________(3)非金属氧化物+水→酸:H2O+CO2===H2CO3,能与水反应生成酸的还有SO2、SO3等
(4)金属氧化物+水→可溶性碱:CaO+H2O===Ca(OH)2,能与水
反应生成碱的氧化物还有K2O、
Na2O、BaO(6)CuSO4+5H2O===
CuSO4·5H2O白色粉末变蓝色,
可用于检验水
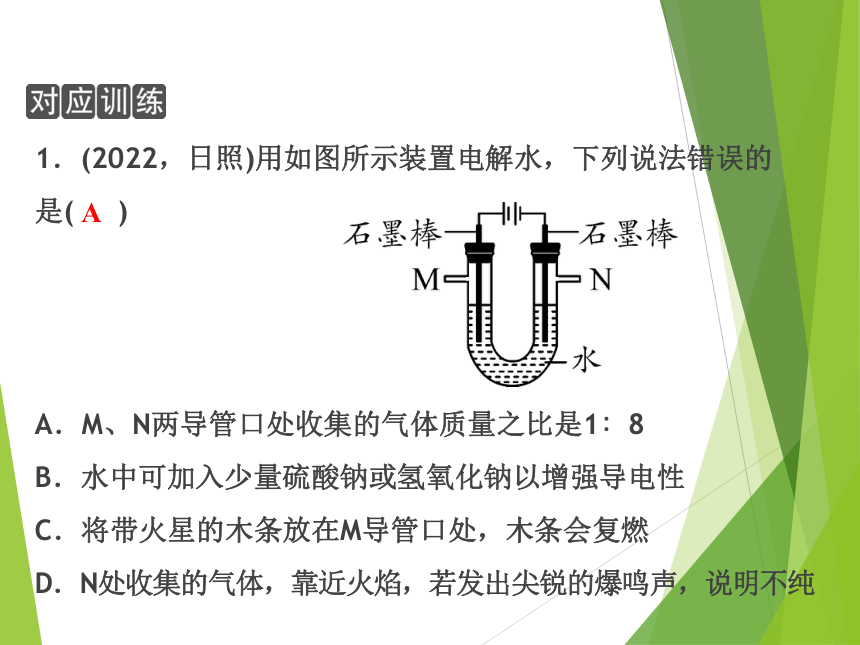
1.(2022,日照)用如图所示装置电解水,下列说法错误的
是( )
A.M、N两导管口处收集的气体质量之比是1∶8
B.水中可加入少量硫酸钠或氢氧化钠以增强导电性
C.将带火星的木条放在M导管口处,木条会复燃
D.N处收集的气体,靠近火焰,若发出尖锐的爆鸣声,说明不纯
A
溶液、悬浊液和乳浊液(八上教材P20)
1.溶液的组成
溶液由______和______组成。被溶解的物质称为溶质,能溶解其他物质的物质称为溶剂,如碘酒中碘是溶质,酒精是溶剂。
2.水是最常用的_______,除水外常用的溶剂还有______________等。
溶质
溶剂
溶剂
汽油、酒精
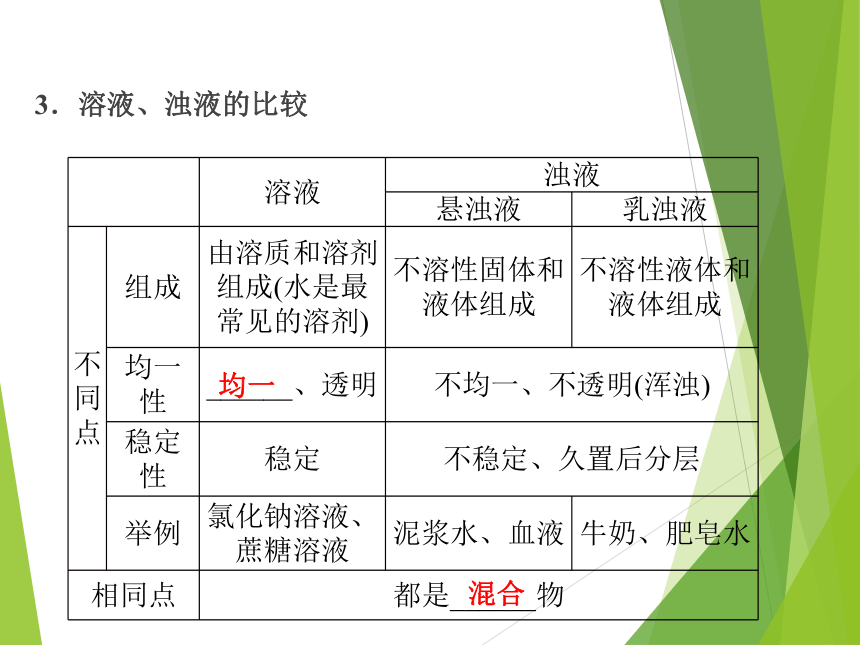
3.溶液、浊液的比较
均一
溶液 浊液
悬浊液 乳浊液
不同点 组成 由溶质和溶剂组成(水是最常见的溶剂) 不溶性固体和液体组成 不溶性液体和液体组成
均一性 ______、透明 不均一、不透明(浑浊)
稳定性 稳定 不稳定、久置后分层
举例 氯化钠溶液、蔗糖溶液 泥浆水、血液 牛奶、肥皂水
相同点 都是______物
混合
2.以下关于溶液的描述不正确的是( )
A.放置一段时间后无明显变化
B.溶液一定是混合物
C.溶液都是无色透明的
D.溶液中各部分的液体密度都相同
C
3.下列物质依次为悬浊液、乳浊液、溶液的一组是( )
A.牛奶、洁净的空气、白酒
B.矿泉水、自来水、汽油和水的混合物
C.新鲜的血液、肥皂水、碘酒
D.盐水、泥浆、汽水
C
饱和溶液与不饱和溶液(八上教材P27)
1.在一定温度下,在一定量的溶剂里,________________某种溶质的溶液称为这种溶质的__________,还能继续溶解某种溶质的溶液称为这种溶质的____________。
【注】只有指明“一定温度”和“一定溶剂”,“饱和”和
“不饱和”才有意义。
2.饱和溶液和不饱和溶液一般情况下可相互转化:
一般规律:对大多数溶解度随温度升高而增大的物质(如KNO3)
不能继续溶解
不饱和溶液
饱和溶液
饱和溶液 不饱和溶液
特殊情况:对极少数溶解度随温度升高而减小的物质如Ca(OH)2
饱和溶液 不饱和溶液
3.结晶
(1)蒸发结晶法:适用于溶解度受温度影响较小的物质,如氯化钠。
(2)降温结晶法(冷却热饱和溶液法):适用于溶解度随温度升高而增大,且溶解度受温度变化较大的物质,如硝酸钾。
4.概念图能清晰地反映概念之间的联系,如图表示溶液中部分概念的相互联系。请回答:
(1)图中“?”是指______。
(2)将5克食盐固体放入盛有20克蒸馏水的烧杯中,充分搅拌后完全溶解。你是如何确定食盐固体“完全溶解”的?
_______________________________。
溶剂
烧杯底部观察不到食盐固体颗粒
溶解度(八上教材P28)
1.溶解度的含义:在一定温度下,某物质在______水中达到
_______状态时所溶解的质量,就称作此温度下该物质在这种溶剂里的_______。
2.影响溶解度的因素:
(1)内因:溶质、溶剂自身的性质。
(2)______
(3)气体的溶解度还受_______的影响,气体的溶解度随压强的升高而增大。
100 g
饱和
溶解度
温度
压强
5.某兴趣小组分别用加溶质和恒温蒸发溶剂的方法,将一定质量氯化钾不饱和溶液转化为饱和溶液。实验过程中,氯化钾溶解度的变化情况分别是( )
A.变大 不变
B.变大 变小
C.不变 变大
D.不变 不变
D
溶质的质量分数(八上教材P29)
1.溶液组成的表达方式——溶质质量分数
(1)定义:溶液中溶质的质量分数=
(2)溶质、溶液的求法
2.溶液的稀释和浓缩
注:不能用V稀-V浓=V水。
3.配制一定溶质质量分数的溶液(详见实验突破)。
6.向盛有40克氯化铵的烧杯中加入40克水,充分溶解后,现象如图所示,此时溶液温度为20 ℃。下列说法正确的是( )
A.烧杯中的溶液溶质质量分数为50%
B.20 ℃时氯化铵的溶解度为40
C.若升温使烧杯中的固体全部溶解,则溶液的溶质质量分数可能不变
D.若加水使烧杯中的固体全部溶解,则溶液的溶质质量分数可能不变
D
水资源的保护与净水的方法(八上教材P41)
1.水资源的保护
(1)节约用水
①水的再循环,②减少水的使用,③水的回收和利用。
(2)水污染的主要来源:工业生产中的“三废”;生活污水的任意排放;农业生产中的农药、化肥的流失。
2.水净化的方法
不溶性
净水方法 原理及作用
沉淀 静置或者加入明矾,吸附水中的悬浮杂质,凝聚成较大的固体颗粒沉降到水底。
过滤 除去水中的________杂质
吸附 除去色素、异味和水中的一些溶解性杂质,常用________
蒸馏 把水加热至沸腾,产生的水蒸气经冷却形成液态水
活性炭
7.地表水仍需经过净化才能饮用。自来水厂的净水流程为:取水→沉降→过滤→活性炭吸附→含氯物质消毒杀菌。其中涉及化学反应的环节是( )
A.取水
B.过滤
C.活性炭吸附
D.含氯物质消毒杀菌
D
一定溶质质量分数的氯化钠溶液的配制
一、用氯化钠固体配制溶液
1.所需仪器及作用
(1)所用仪器:托盘天平(带砝码)、镊子、药匙、量筒、胶头滴管、烧杯、玻璃棒。
(2)仪器的作用:
a.玻璃棒的作用是_______,目的是加快固体或液体溶质的溶解速率。
b.量筒的作用是______一定体积的液体。
搅拌
量取
2.操作步骤
计算:计算所需溶质的______和水的______。
称量:用__________称取一定质量的固体。
量取:用______量取一定体积的水。
溶解:将固体倒入烧杯中,再将量取的水倒入烧杯中,用________不断搅拌直至固体完全溶解。
装瓶:将配制好的溶液转移到________中,并贴上标签。
质量
体积
托盘天平
量筒
玻璃棒
试剂瓶
【知识拓展】 实验误差分析
操作 误差分析 所配溶液的溶质质量分数
用天平称量固体药品质量时,固体药品和砝码放反了(在使用游码的情况下) 称量的固体药品的实际质量______ ________
量取水的体积时仰视读数 配制的溶液中水的实际体积______ ________
量取水的体积时俯视读数 配制的溶液中水的实际体积______ ______
偏小
偏小
偏大
偏小
偏小
偏大
偏大
烧杯内原来有少量的水 配制的溶液中水的质量______ ______
将固体药品倒入烧杯时撒在外面 配制的溶液中溶质的质量______ ______
固体药品中含有不溶性杂质 配制的溶液中溶质的质量______ ______
配制完成后,转移过程中有少量溶液洒出 配制的溶液中溶质的质量______ ______
偏小
偏小
偏小
偏小
偏小
偏小
不变
二、用浓溶液配制稀溶液
1.所需仪器:量筒、胶头滴管、烧杯、玻璃棒。
2.原理
3.操作步骤:
(1)计算:计算所需________的体积和所需水的体积。
(2)量取:用_____量取浓溶液和水(接近所需体积时改用__________)。
(3)混匀:将量取的浓溶液和水倒入烧杯中并用________不断
搅拌。
浓溶液
量筒
胶头滴管
玻璃棒
溶液和浊液
要熟练判断常见的溶液和浊液(悬浊液和乳浊液)。溶液和浊液的区别是前者均一、稳定,静置后不分层,后者不稳定,静置后会分层。浊液分为悬浊液和乳浊液,两者的区别是前者是固体小颗粒悬浮于液体中,后者是小液滴分散在另一种液体中。
【例1】 下列关于溶液、悬浊液、乳浊液的说法:①凡是均
一、稳定的液体都是溶液;②在科学实验中,水是最常见的溶剂;③饱和溶液不一定是浓溶液;④衣服上不慎沾有碘酒,可用汽油擦洗;⑤食盐水、硫酸铜溶液、冰水混合物都属于溶液;⑥影响物质溶解的因素有溶剂的质量和种类以及温度。其中正确的是( )
A.①②③
B.②③④
C.①④⑤
D.②③④⑥
B
1.下列关于溶液的说法中正确的是( )
A.溶液一定是混合物
B.溶液一定是无色透明的
C.溶液中只能含有一种溶质
D.常温下蔗糖的水溶液密封放置一段时间后会析出固体
A
溶解度
在理解溶解度的定义时,要抓住5个要点:①“在一定温度下”,溶解度是随着温度的变化而变化的,必须指明什么温度,溶解度才有意义;②“在100克溶剂里”,注意不是100克溶液里;③“达到饱和状态”,在一定温度下,100克溶剂中溶质的质量达到最大值;④单位是“克”;⑤点明溶剂,同一溶质在不同溶剂里溶解度不同。另外注意,初中阶段接触到的大多数固态物质溶解度随着温度升高而增大,但是氢氧化钙的溶解度随着温度的升高而降低。
【例2】 (2022,广东)根据下图,判断下列说法正确的是( )
A.t1℃时,50 g甲能完全溶于50 g水
B.乙的溶解度随温度升高而降低
C.t2 ℃时,丙和丁的溶解度相同
D.加压或升温能增加戊的溶解度
C
2.(2021,杭州)已知:(1)20 ℃时,溶解度在10克以上的物质称为易溶物质;溶解度在1~10克的物质为可溶物质;溶解度在0.01~1克为微溶物质;溶解度小于0.01克的物质为难溶物质。
(2)20 ℃时几种物质的溶解度如下
下列说法正确的是( )
A.20 ℃时氢氧化钙是难溶物质
B.20 ℃时可以配制出20%的硝酸钾溶液
C.20 ℃时氯酸钾是易溶物质
D.20 ℃时硝酸钾的溶解度比氯化钠大
物质
名称 氯化钠 氢氧
化钙 氯酸钾 硝酸钾
溶解
度(克) 36.0 0.165 7.4 31.6
B
饱和溶液和不饱和溶液
饱和溶液和不饱和溶液的区别是前者不可再溶解该种溶质,后者还可以溶解该种溶质。同种溶液两者是可以相互转化的,要熟练掌握两者转化的条件。当溶液是饱和溶液时,也可以用溶解度来计算其质量分数,即w=S/(100 g+S)×100%
【例3】 (2022,宁波)20 ℃时,将45 g氯化钠均分成五份,依次加入到盛有100 g水的烧杯中,充分溶解。实验数据如下表:
下列分析正确的是( )
A.实验③所得溶液的溶质质量分数最大
B.实验④所得溶液是氯化钠的不饱和溶液
C.20 ℃时,氯化钠的溶解度为36 g
D.将实验①所得溶液蒸发50 g水,冷却到20 ℃,溶液达到饱和
C
实验序号 ① ② ③ ④ ⑤
氯化钠质量/g 9 18 27 36 45
溶液质量/g 109 118 127 136 136
3.在20 ℃教室内,小陈对100 mL氯化钠饱和溶液进行图示实验,下列分析错误的是( )
A.实验1后,甲、乙中溶液的溶质质量分数相等
B. 实验2后,乙中溶液所含溶质质量比甲中大
C.实验2后,甲中溶液为氯化钠的不饱和溶液
D.实验2后,甲与乙中氯化钠的溶解度相等
B
【例】 (2021,温州)工业上常用碳酸镁矿石(主要成分是难溶于水的碳酸镁,杂质不溶于水也不与酸反应)与稀硫酸反应来制备硫酸镁。硫酸镁在不同温度时的溶解度如表所示。制备流程如图。
温度(℃) 60 80 90 100
硫酸镁溶解度(克) 54.6 55.8 52.9 50.4
(1)用150千克溶质质量分数为98%的浓硫酸配制9.8%的稀硫酸,需要水________千克。
(2)小明模拟工业制备硫酸镁晶体,将碳酸镁矿石和稀硫酸充分反应后过滤,发现滤液中含有硫酸。为了测定所得滤液中硫酸镁和硫酸的质量比,他取少量滤液倒入烧杯,将溶质质量分数为10%的氢氧化钠溶液逐渐加入。除要知道实验前氢氧化钠溶液质量外,实验中还要通过测量获取哪两个数据,才可计算硫酸镁与硫酸的质量比?______________________________________________________________________________________。(硫酸镁与氢氧化钠反应的化学方程式:MgSO4+2NaOH===
Mg(OH)2↓+Na2SO4)
1350
刚出现沉淀时剩余氢氧化钠溶液的质
量;不再出现沉淀时剩余氢氧化钠溶液的质量(合理即可)
(3)小明将除去杂质后的滤液加热至90 ℃,得到硫酸镁浓溶液,继续加热,观察到晶体快速析出。其原因可能是
_____________________________________________________。
继续加热,温度升高,硫酸镁溶解度减小,且溶剂快速蒸发
2023浙江中考科学一轮复习
第34讲 水和溶液
水的组成和主要性质(八上教材P8)
1.水电解时在阳极产生_______,在阴极产生______。两者体积比为______,质量比为______。
2.电解水实验说明水是由______和________组成的。
氧气
氢气
1∶2
8∶1
氢元素
氧元素
3.水的性质
2H2O 2H2↑
+O2↑
物理性质 化学性质
(1)色态味:无色、无味、液态(常温下)
(2)沸点:100 ℃(1个标准大气压下)
(3)熔点:0 ℃
(4)密度:4 ℃时密度最大,为1 g/cm3,结冰后密度
变小
(5)溶剂:能溶解很多物质,是重要的溶剂 (1)常温下化学性质稳定(2)在通电条件下分解:_________________________(3)非金属氧化物+水→酸:H2O+CO2===H2CO3,能与水反应生成酸的还有SO2、SO3等
(4)金属氧化物+水→可溶性碱:CaO+H2O===Ca(OH)2,能与水
反应生成碱的氧化物还有K2O、
Na2O、BaO(6)CuSO4+5H2O===
CuSO4·5H2O白色粉末变蓝色,
可用于检验水
1.(2022,日照)用如图所示装置电解水,下列说法错误的
是( )
A.M、N两导管口处收集的气体质量之比是1∶8
B.水中可加入少量硫酸钠或氢氧化钠以增强导电性
C.将带火星的木条放在M导管口处,木条会复燃
D.N处收集的气体,靠近火焰,若发出尖锐的爆鸣声,说明不纯
A
溶液、悬浊液和乳浊液(八上教材P20)
1.溶液的组成
溶液由______和______组成。被溶解的物质称为溶质,能溶解其他物质的物质称为溶剂,如碘酒中碘是溶质,酒精是溶剂。
2.水是最常用的_______,除水外常用的溶剂还有______________等。
溶质
溶剂
溶剂
汽油、酒精
3.溶液、浊液的比较
均一
溶液 浊液
悬浊液 乳浊液
不同点 组成 由溶质和溶剂组成(水是最常见的溶剂) 不溶性固体和液体组成 不溶性液体和液体组成
均一性 ______、透明 不均一、不透明(浑浊)
稳定性 稳定 不稳定、久置后分层
举例 氯化钠溶液、蔗糖溶液 泥浆水、血液 牛奶、肥皂水
相同点 都是______物
混合
2.以下关于溶液的描述不正确的是( )
A.放置一段时间后无明显变化
B.溶液一定是混合物
C.溶液都是无色透明的
D.溶液中各部分的液体密度都相同
C
3.下列物质依次为悬浊液、乳浊液、溶液的一组是( )
A.牛奶、洁净的空气、白酒
B.矿泉水、自来水、汽油和水的混合物
C.新鲜的血液、肥皂水、碘酒
D.盐水、泥浆、汽水
C
饱和溶液与不饱和溶液(八上教材P27)
1.在一定温度下,在一定量的溶剂里,________________某种溶质的溶液称为这种溶质的__________,还能继续溶解某种溶质的溶液称为这种溶质的____________。
【注】只有指明“一定温度”和“一定溶剂”,“饱和”和
“不饱和”才有意义。
2.饱和溶液和不饱和溶液一般情况下可相互转化:
一般规律:对大多数溶解度随温度升高而增大的物质(如KNO3)
不能继续溶解
不饱和溶液
饱和溶液
饱和溶液 不饱和溶液
特殊情况:对极少数溶解度随温度升高而减小的物质如Ca(OH)2
饱和溶液 不饱和溶液
3.结晶
(1)蒸发结晶法:适用于溶解度受温度影响较小的物质,如氯化钠。
(2)降温结晶法(冷却热饱和溶液法):适用于溶解度随温度升高而增大,且溶解度受温度变化较大的物质,如硝酸钾。
4.概念图能清晰地反映概念之间的联系,如图表示溶液中部分概念的相互联系。请回答:
(1)图中“?”是指______。
(2)将5克食盐固体放入盛有20克蒸馏水的烧杯中,充分搅拌后完全溶解。你是如何确定食盐固体“完全溶解”的?
_______________________________。
溶剂
烧杯底部观察不到食盐固体颗粒
溶解度(八上教材P28)
1.溶解度的含义:在一定温度下,某物质在______水中达到
_______状态时所溶解的质量,就称作此温度下该物质在这种溶剂里的_______。
2.影响溶解度的因素:
(1)内因:溶质、溶剂自身的性质。
(2)______
(3)气体的溶解度还受_______的影响,气体的溶解度随压强的升高而增大。
100 g
饱和
溶解度
温度
压强
5.某兴趣小组分别用加溶质和恒温蒸发溶剂的方法,将一定质量氯化钾不饱和溶液转化为饱和溶液。实验过程中,氯化钾溶解度的变化情况分别是( )
A.变大 不变
B.变大 变小
C.不变 变大
D.不变 不变
D
溶质的质量分数(八上教材P29)
1.溶液组成的表达方式——溶质质量分数
(1)定义:溶液中溶质的质量分数=
(2)溶质、溶液的求法
2.溶液的稀释和浓缩
注:不能用V稀-V浓=V水。
3.配制一定溶质质量分数的溶液(详见实验突破)。
6.向盛有40克氯化铵的烧杯中加入40克水,充分溶解后,现象如图所示,此时溶液温度为20 ℃。下列说法正确的是( )
A.烧杯中的溶液溶质质量分数为50%
B.20 ℃时氯化铵的溶解度为40
C.若升温使烧杯中的固体全部溶解,则溶液的溶质质量分数可能不变
D.若加水使烧杯中的固体全部溶解,则溶液的溶质质量分数可能不变
D
水资源的保护与净水的方法(八上教材P41)
1.水资源的保护
(1)节约用水
①水的再循环,②减少水的使用,③水的回收和利用。
(2)水污染的主要来源:工业生产中的“三废”;生活污水的任意排放;农业生产中的农药、化肥的流失。
2.水净化的方法
不溶性
净水方法 原理及作用
沉淀 静置或者加入明矾,吸附水中的悬浮杂质,凝聚成较大的固体颗粒沉降到水底。
过滤 除去水中的________杂质
吸附 除去色素、异味和水中的一些溶解性杂质,常用________
蒸馏 把水加热至沸腾,产生的水蒸气经冷却形成液态水
活性炭
7.地表水仍需经过净化才能饮用。自来水厂的净水流程为:取水→沉降→过滤→活性炭吸附→含氯物质消毒杀菌。其中涉及化学反应的环节是( )
A.取水
B.过滤
C.活性炭吸附
D.含氯物质消毒杀菌
D
一定溶质质量分数的氯化钠溶液的配制
一、用氯化钠固体配制溶液
1.所需仪器及作用
(1)所用仪器:托盘天平(带砝码)、镊子、药匙、量筒、胶头滴管、烧杯、玻璃棒。
(2)仪器的作用:
a.玻璃棒的作用是_______,目的是加快固体或液体溶质的溶解速率。
b.量筒的作用是______一定体积的液体。
搅拌
量取
2.操作步骤
计算:计算所需溶质的______和水的______。
称量:用__________称取一定质量的固体。
量取:用______量取一定体积的水。
溶解:将固体倒入烧杯中,再将量取的水倒入烧杯中,用________不断搅拌直至固体完全溶解。
装瓶:将配制好的溶液转移到________中,并贴上标签。
质量
体积
托盘天平
量筒
玻璃棒
试剂瓶
【知识拓展】 实验误差分析
操作 误差分析 所配溶液的溶质质量分数
用天平称量固体药品质量时,固体药品和砝码放反了(在使用游码的情况下) 称量的固体药品的实际质量______ ________
量取水的体积时仰视读数 配制的溶液中水的实际体积______ ________
量取水的体积时俯视读数 配制的溶液中水的实际体积______ ______
偏小
偏小
偏大
偏小
偏小
偏大
偏大
烧杯内原来有少量的水 配制的溶液中水的质量______ ______
将固体药品倒入烧杯时撒在外面 配制的溶液中溶质的质量______ ______
固体药品中含有不溶性杂质 配制的溶液中溶质的质量______ ______
配制完成后,转移过程中有少量溶液洒出 配制的溶液中溶质的质量______ ______
偏小
偏小
偏小
偏小
偏小
偏小
不变
二、用浓溶液配制稀溶液
1.所需仪器:量筒、胶头滴管、烧杯、玻璃棒。
2.原理
3.操作步骤:
(1)计算:计算所需________的体积和所需水的体积。
(2)量取:用_____量取浓溶液和水(接近所需体积时改用__________)。
(3)混匀:将量取的浓溶液和水倒入烧杯中并用________不断
搅拌。
浓溶液
量筒
胶头滴管
玻璃棒
溶液和浊液
要熟练判断常见的溶液和浊液(悬浊液和乳浊液)。溶液和浊液的区别是前者均一、稳定,静置后不分层,后者不稳定,静置后会分层。浊液分为悬浊液和乳浊液,两者的区别是前者是固体小颗粒悬浮于液体中,后者是小液滴分散在另一种液体中。
【例1】 下列关于溶液、悬浊液、乳浊液的说法:①凡是均
一、稳定的液体都是溶液;②在科学实验中,水是最常见的溶剂;③饱和溶液不一定是浓溶液;④衣服上不慎沾有碘酒,可用汽油擦洗;⑤食盐水、硫酸铜溶液、冰水混合物都属于溶液;⑥影响物质溶解的因素有溶剂的质量和种类以及温度。其中正确的是( )
A.①②③
B.②③④
C.①④⑤
D.②③④⑥
B
1.下列关于溶液的说法中正确的是( )
A.溶液一定是混合物
B.溶液一定是无色透明的
C.溶液中只能含有一种溶质
D.常温下蔗糖的水溶液密封放置一段时间后会析出固体
A
溶解度
在理解溶解度的定义时,要抓住5个要点:①“在一定温度下”,溶解度是随着温度的变化而变化的,必须指明什么温度,溶解度才有意义;②“在100克溶剂里”,注意不是100克溶液里;③“达到饱和状态”,在一定温度下,100克溶剂中溶质的质量达到最大值;④单位是“克”;⑤点明溶剂,同一溶质在不同溶剂里溶解度不同。另外注意,初中阶段接触到的大多数固态物质溶解度随着温度升高而增大,但是氢氧化钙的溶解度随着温度的升高而降低。
【例2】 (2022,广东)根据下图,判断下列说法正确的是( )
A.t1℃时,50 g甲能完全溶于50 g水
B.乙的溶解度随温度升高而降低
C.t2 ℃时,丙和丁的溶解度相同
D.加压或升温能增加戊的溶解度
C
2.(2021,杭州)已知:(1)20 ℃时,溶解度在10克以上的物质称为易溶物质;溶解度在1~10克的物质为可溶物质;溶解度在0.01~1克为微溶物质;溶解度小于0.01克的物质为难溶物质。
(2)20 ℃时几种物质的溶解度如下
下列说法正确的是( )
A.20 ℃时氢氧化钙是难溶物质
B.20 ℃时可以配制出20%的硝酸钾溶液
C.20 ℃时氯酸钾是易溶物质
D.20 ℃时硝酸钾的溶解度比氯化钠大
物质
名称 氯化钠 氢氧
化钙 氯酸钾 硝酸钾
溶解
度(克) 36.0 0.165 7.4 31.6
B
饱和溶液和不饱和溶液
饱和溶液和不饱和溶液的区别是前者不可再溶解该种溶质,后者还可以溶解该种溶质。同种溶液两者是可以相互转化的,要熟练掌握两者转化的条件。当溶液是饱和溶液时,也可以用溶解度来计算其质量分数,即w=S/(100 g+S)×100%
【例3】 (2022,宁波)20 ℃时,将45 g氯化钠均分成五份,依次加入到盛有100 g水的烧杯中,充分溶解。实验数据如下表:
下列分析正确的是( )
A.实验③所得溶液的溶质质量分数最大
B.实验④所得溶液是氯化钠的不饱和溶液
C.20 ℃时,氯化钠的溶解度为36 g
D.将实验①所得溶液蒸发50 g水,冷却到20 ℃,溶液达到饱和
C
实验序号 ① ② ③ ④ ⑤
氯化钠质量/g 9 18 27 36 45
溶液质量/g 109 118 127 136 136
3.在20 ℃教室内,小陈对100 mL氯化钠饱和溶液进行图示实验,下列分析错误的是( )
A.实验1后,甲、乙中溶液的溶质质量分数相等
B. 实验2后,乙中溶液所含溶质质量比甲中大
C.实验2后,甲中溶液为氯化钠的不饱和溶液
D.实验2后,甲与乙中氯化钠的溶解度相等
B
【例】 (2021,温州)工业上常用碳酸镁矿石(主要成分是难溶于水的碳酸镁,杂质不溶于水也不与酸反应)与稀硫酸反应来制备硫酸镁。硫酸镁在不同温度时的溶解度如表所示。制备流程如图。
温度(℃) 60 80 90 100
硫酸镁溶解度(克) 54.6 55.8 52.9 50.4
(1)用150千克溶质质量分数为98%的浓硫酸配制9.8%的稀硫酸,需要水________千克。
(2)小明模拟工业制备硫酸镁晶体,将碳酸镁矿石和稀硫酸充分反应后过滤,发现滤液中含有硫酸。为了测定所得滤液中硫酸镁和硫酸的质量比,他取少量滤液倒入烧杯,将溶质质量分数为10%的氢氧化钠溶液逐渐加入。除要知道实验前氢氧化钠溶液质量外,实验中还要通过测量获取哪两个数据,才可计算硫酸镁与硫酸的质量比?______________________________________________________________________________________。(硫酸镁与氢氧化钠反应的化学方程式:MgSO4+2NaOH===
Mg(OH)2↓+Na2SO4)
1350
刚出现沉淀时剩余氢氧化钠溶液的质
量;不再出现沉淀时剩余氢氧化钠溶液的质量(合理即可)
(3)小明将除去杂质后的滤液加热至90 ℃,得到硫酸镁浓溶液,继续加热,观察到晶体快速析出。其原因可能是
_____________________________________________________。
继续加热,温度升高,硫酸镁溶解度减小,且溶剂快速蒸发
同课章节目录
