2023浙江中考科学一轮复习(基础版)第38讲 常见的化学反应(课件 36张ppt)
文档属性
| 名称 | 2023浙江中考科学一轮复习(基础版)第38讲 常见的化学反应(课件 36张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 916.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-01-18 09:16:37 | ||
图片预览










文档简介
(共36张PPT)
2023浙江中考科学一轮复习
第38讲 常见的化学反应
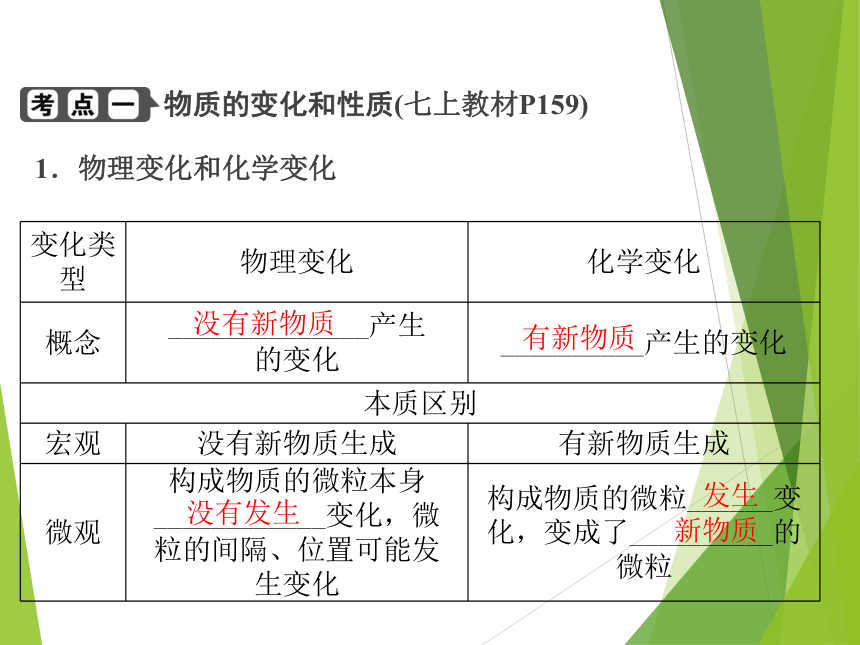
物质的变化和性质(七上教材P159)
1.物理变化和化学变化
没有新物质
变化类型 物理变化 化学变化
概念 ______________产生
的变化 __________产生的变化
本质区别
宏观 没有新物质生成 有新物质生成
微观 构成物质的微粒本身
____________变化,微
粒的间隔、位置可能发
生变化 构成物质的微粒______变化,变成了__________的微粒
有新物质
没有发生
发生
新物质
外观特征 多表现为状态、形状等的变化 常伴随变色、生成气体、产生沉淀等现象及吸热、放热、发光等能量变化
举例 冰雪融化、雕刻楠木、铁丝弯折、火腿切块等 食物霉变、燃放烟花、氢气燃烧、菜刀生锈、电解水等
判断依据 是否有新物质生成
联系 化学变化和物理变化往往同时发生,在化学变化的过程中同时发生物理变化,物理变化过程中不一定发生化学变化
2.物质的性质和用途
(1)物理性质
a.概念:物质不需要发生__________就能表现出来的性质。
b.举例:物质的颜色、气味、状态、沸点、硬度、熔点、密度等。
(2)化学性质
a.概念:物质在_________中才表现出来的性质。
b.举例:可燃性、助燃性、热稳定性、氧化性、酸碱性等。
(3)性质和用途的关系:
化学性质
化学性质
1.(2022,丽水)丽水市拥有众多地方特产,如龙泉青瓷、遂
昌竹炭、青田石雕、景宁山哈酒等。下列地方特产的制作过
程中,主要发生物理变化的是( )
A.煅烧青瓷 B.烧制竹炭
C.打磨石雕 D.酿山哈酒
C
2.下列物质的用途中既利用物理性质又利用化学性质的是( )
A.活性炭除异味
B.氢气作燃料
C.二氧化碳灭火
D.小苏打治疗胃酸过多
C
3.选用“物理变化、化学变化、物理性质、化学性质”之一填写在下列空格中:
(1)铜能在潮湿的空气中生成铜绿是__________。
(2)铜与氧气反应生成了氧化铜是__________。
(3)水蒸气遇冷变成水,水在0 ℃时结成冰是_________。
(4)水的凝固点是0 ℃,沸点为100 ℃,4 ℃时密度最大是
____________。
化学性质
化学变化
物理变化
物理性质
氧化性和还原性(八下教材P81)
1.氧化反应和还原反应
(1)物质_________的反应叫氧化反应,物质__________的反应叫还原反应。
(2)在 中,氢气得到氧化铜中的氧,被氧化,具有_________;氧化铜失去氧,被还原,具有_______。
2.氧化反应中________、具有氧化性的物质叫做________。氧气、氧化铜等是在反应中提供氧的物质,具有________,是常见的________。
得到氧
失去氧
还原性
氧化性
提供氧
氧化剂
氧化性
氧化剂
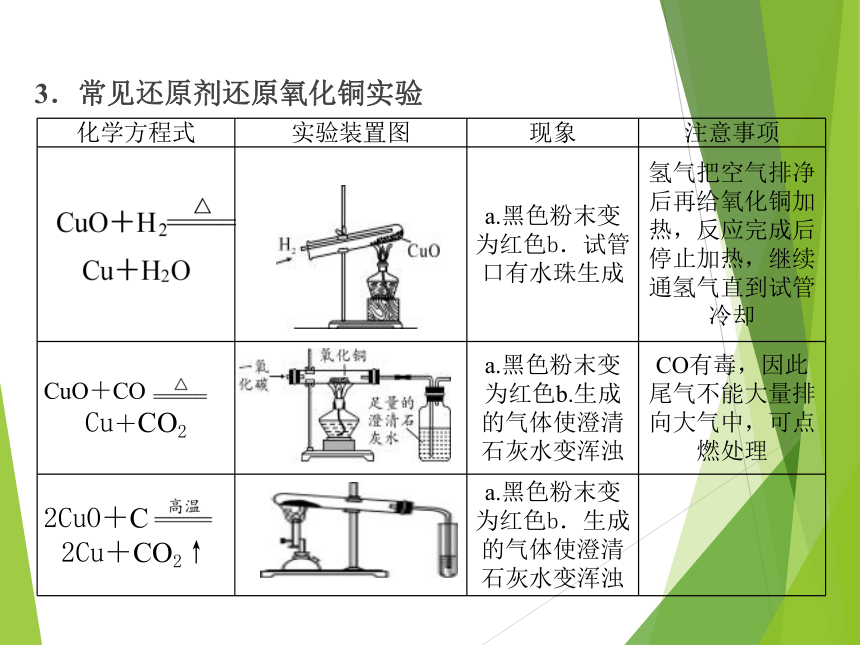
3.常见还原剂还原氧化铜实验
化学方程式 实验装置图 现象 注意事项
a.黑色粉末变为红色b.试管口有水珠生成 氢气把空气排净后再给氧化铜加热,反应完成后停止加热,继续通氢气直到试管冷却
CuO+CO
Cu+CO2 a.黑色粉末变为红色b.生成的气体使澄清石灰水变浑浊 CO有毒,因此尾气不能大量排向大气中,可点燃处理
2CuO+C
2Cu+CO2↑ a.黑色粉末变为红色b.生成的气体使澄清石灰水变浑浊
【注意】H2、CO等可燃性气体在使用前必须先_______,防止与空气混合受热时发生_______。H2的燃烧产物只有水,可用无水硫酸铜鉴别;CO的燃烧产物只有二氧化碳,可用澄清石灰水鉴别。
验纯
爆炸
4.(2022,重庆)工业炼铁原理为 ,其中CO体现还原性。下列化学反应中有物质体现还原性的是( )
A.SO3+H2O===H2SO4
B.H2+CuO Cu+H2O
C.CuSO4+BaCl2===BaSO4↓+CuCl2
D.H2SO4+2NaOH===Na2SO4+2H2O
B
5.对于H2、CO还原氧化铜的实验,下列说法错误的是( )
A.实验均需加热
B.反应类型都是置换反应
C.实验均有紫红色固体生成
D.H2和CO均体现出还原性
B
化学反应的基本类型
两种或两种以上
反应类型 概念 表达式
化合反应 由________________的物质生成另______物质的反应 A+B→AB(多变一)
分解反应 由一种物质生成
__________________其他物质的反应 AB→A+B(一变多)
置换反应 由一种单质跟一种
__________反应,生成______________和另一种化合物的反应 A+BC→B+AC
(一换一)
复分解反应 由两种化合物
________________,生成另外两种化合物的反应 AB+CD→AD+CB(相互交换)
一种
两种或两种以上
化合物
另一种单质
相互交换成分
复分解反应是发生在化合物之间的反应,反应前后各元素的化合价不改变,可简记为“两交换,价不变”。
6.(2022,温州)我国古代用火法炼硫,其主要反应的化学方程式是 。该反应属于( )
A.化合反应
B.分解反应
C.置换反应
D.复分解反应
B
化学反应中的能量变化(八下教材P85)
1.化学反应中往往伴随着______的变化。有热量放出的化学反应叫_________,吸收热量的化学反应叫________。
常见的放热反应:
①所有的燃烧反应、物质的缓慢氧化。
②生石灰溶于水 。
③金属跟酸的置换反应,如Mg+2HCl===MgCl2+H2↑。
④酸碱反应。
这些反应是化学能转化为______。
能量
放热反应
吸热反应
内能
常见吸热反应:
反应条件为高温或加热的反应大多数是吸热反应,内能转化为________。
2.光合作用太阳能转化为化学能;呼吸作用_______转化为其他形式的能;酸碱反应化学能转化为_____。
【注】物质溶解于水也会有吸热、放热现象,这是物理变化。氢氧化钠固体溶于水、浓硫酸溶于水放热;硝酸铵(NH4NO3)等铵盐溶于水吸热。溶于水既不吸热也不放热:氯化钠(NaCl)。所以利用固体溶于水是否放热可以用来鉴别物质。
化学能
化学能
内能
7.(2021,益阳)物质发生化学变化时伴随有能量变化。下列说法正确的是( )
A.化学反应过程中都会有放热现象
B.人类利用的能量都是通过化学反应获得的
C.化学能可转变成电能,如天然气燃料电池已被应用于城市客车的驱动电源
D.人体能维持恒定体温,主要是蛋白质在酶的催化下转变成CO2和H2O,放出热量
C
燃烧和缓慢氧化
1.缓慢氧化:速度缓慢、不易觉察、没有发光但有发热的一种氧化反应。如橡胶制品的老化、金属的生锈、生物呼吸、食物的腐败等。
2.剧烈的氧化现象
(1)燃烧是指可燃物与空气中的氧气发生发光、发热的剧烈的氧化反应。
(2)爆炸:在有限的空间内_________。如火药爆炸。
(3)自燃:可燃物缓慢氧化产生的热量聚集使温度达到______________________而引起的自发燃烧。
急速燃烧
可燃
物的着火点
【注意】爆炸不一定属于化学变化,如高压锅爆炸,轮胎爆炸。
3.可燃物燃烧的条件:①有可燃物;②可燃物与______(或空气)充分接触;③温度达到可燃物的________。(三者缺一不可)
4.灭火原理的方法:隔绝______、降低温度至_______________以下、撤离________。(破坏任何一个条件即可)
【注意】①着火点是物质的一种特性,不同可燃物的着火点不同,且一般不会改变,所以不能说“降低可燃物的着火点”。②助燃剂也不一定是氧气或者空气,如:镁在二氧化碳中燃烧,此时二氧化碳是助燃剂。
氧气
着火点
氧气
可燃物着火点
可燃物
5.火灾自救的一般方法
(1)浓烟密布时,应匍匐前进,并用湿毛巾掩盖口鼻。
(2)用湿毛巾等物品塞住门和窗缝隙。
(3)在窗前呼救。
8.(2021,广州)用如图所示实验探究燃烧的条件,下列说法正确的是( )
A.对比①③说明燃烧的条件之一是可燃物接触氧气
B.对比①④说明燃烧的条件之一是需要有可燃物
C.对比③④说明燃烧的条件之一是达到可燃物的着火点
D.本实验用盘成螺旋状的细铁丝替代白磷,能得到相同的实验结论
C
物质的变化和性质
化学变化和物理变化的区别是前者有新物质(分子)产生,物理性质和化学性质的区别是前者不需要发生化学变化就能表现出来。性质和变化最大的区别是前者表示一种可能性或趋势,常有“能”“会”等,而变化表示一种过程。
【例1】 (2022,威海)2022年2月,北京成功举办第24届冬奥会。大量创新技术的应用为“绿色奥运”增光添彩。下列过程中涉及化学变化的是( )
A.利用二氧化碳跨临界制冷技术为比赛场馆制冰
B.利用氢燃料电池为奥运村客车提供动力
C.利用加压技术将氢气液化储存在“飞扬”火炬中
D.利用模具压制“冰墩墩”硅胶外壳
B
1.(2022,成都)智能手表的部分信息如图,下列描述中相关性质属于化学性质的是( )
A. 玻璃透光性好作表镜
B.钛合金耐腐蚀作表框
C.不锈钢硬度大作表扣
D.橡胶弹性良好作表带
B
氢气和一氧化碳的性质
解答此类题目时,需要熟知一氧化碳和氢气的性质,掌握一氧化碳和氢气还原氧化物的实验原理和实验中的一些注意事项,作出正确分析和判断。
【例2】 (2022,绍兴)春秋初期,绍兴一带是南方的一个冶铁中心,其炼铁方法是在1000 ℃左右的温度下,使木炭和铁矿石(主要成分为Fe2O3)发生一系列的反应生成含较多杂质的海绵铁。其中主要化学反应为: 。下列说法正确的是( )
A.海绵铁是一种纯净物
B.Fe2O3中铁元素的化合价为+3价
C.上述反应中涉及的氧化物只有2种
D.炼铁过程中,木炭只是作为燃料使用
B
2.(2021,苏州)利用如图所示实验装置模拟工业炼铁。下列说法正确的是( )
A.实验时应先点燃酒精灯后通CO
B.充分加热,a处固体由黑色变为红色
C.b处可用澄清石灰水检验生成的CO2
D.可用NaOH溶液吸收尾气中的CO
C
四类基本反应的判断
化学反应划分为四大基本反应类型和是否是氧化还原反应是两种不同的分类方法,四大基本反应类型没有包含全部反应,如二氧化碳和氢氧化钠的反应、一氧化碳冶炼金属的反应等都不属于四大基本反应。
【例3】 在化学反应前后,物质所含元素化合价发生变化的反应属于氧化还原反应。氧化还原反应与四种基本化学反应类型间的关系如图所示,下列举例中错误的是( )
C
3.关于化学反应类型的说法正确的是( )
A.分解反应一定有单质生成
B.化合反应一定是两种物质生成另一种物质
C.置换反应一定有元素的化合价发生改变
D.两种化合物生成另外两种化合物的反应一定是复分解反应
C
燃烧和缓慢氧化
燃烧是初中科学中重要的化学现象,燃烧需要具备的条件中着火点是不可改变的。灭火措施和燃烧的条件具有对应关系。
【例4】 已知红磷、白磷的着火点分别为240 ℃、40 ℃。为探究燃烧的条件设计如图装置并将一定质量的白磷、红磷分别浸入80 ℃热水中。下列有关该实验的描述错误的是( )
A.实验开始时,白磷、红磷都不燃烧
B.升高右漏斗,红磷露出水面后,不会燃烧
C.升高左漏斗,白磷露出水面后,发生燃烧
D.调节左右漏斗高度,能观察到“白磷在水下燃烧”
D
4.(2021,北京)用如图实验验证可燃物燃烧的条件,已知:白磷的着火点为40 ℃。
(1)实验1,能验证可燃物燃烧需要O2的现象是
__________________________________。
(2)实验2,①中纸片燃烧,②中纸片未燃烧,②中纸片未燃烧的原因是___________________________________________。
①中白磷不燃烧,②中的白磷燃烧
水吸收了部分的热量,未达到纸片的着火点
【例】 (2022,绍兴)如图是人类对氧化还原反应的认识过程中的三个阶段。
【阶段Ⅰ】得失氧说:物质跟氧发生的反应叫氧化反应,含氧化合物中的氧被夺取的反应叫还原反应。
【阶段Ⅱ】化合价升降说:凡是出现元素化合价升降的化学反应都是氧化还原反应。化合价升高的反应叫氧化反应,化合价降低的反应叫还原反应。
【阶段Ⅲ】电子转移说:化合价升降的原因是电子的转移。凡有电子转移发生的化学反应都是氧化还原反应。失电子的反应叫氧化反应,得电子的反应叫还原反应。
(1)根据得失氧说,在 化学变化中,H2发生了_______反应。
(2)电子转移是元素化合价改变的本质原因。失电子后,元素的化合价会_______(填“升高”或“降低”)。
氧化
升高
(3)根据化合价升降说,化学反应的四种基本类型与氧化还原反应之间的关系如图所示,其中乙是_______反应。
(4)关于氧化还原反应的认识,下列理解正确的是________。
A.氧化和还原是相互对立又
辩证统一的关系
B.电子转移说是从微观视角来
探析和建构氧化还原反应的概念
C.自然界中发生的氧化还原反应对人类的生活和生产都是有利的
D.人类对氧化还原反应的认识过程是一个逐步发展、延伸和完善的过程
置换
ABD
2023浙江中考科学一轮复习
第38讲 常见的化学反应
物质的变化和性质(七上教材P159)
1.物理变化和化学变化
没有新物质
变化类型 物理变化 化学变化
概念 ______________产生
的变化 __________产生的变化
本质区别
宏观 没有新物质生成 有新物质生成
微观 构成物质的微粒本身
____________变化,微
粒的间隔、位置可能发
生变化 构成物质的微粒______变化,变成了__________的微粒
有新物质
没有发生
发生
新物质
外观特征 多表现为状态、形状等的变化 常伴随变色、生成气体、产生沉淀等现象及吸热、放热、发光等能量变化
举例 冰雪融化、雕刻楠木、铁丝弯折、火腿切块等 食物霉变、燃放烟花、氢气燃烧、菜刀生锈、电解水等
判断依据 是否有新物质生成
联系 化学变化和物理变化往往同时发生,在化学变化的过程中同时发生物理变化,物理变化过程中不一定发生化学变化
2.物质的性质和用途
(1)物理性质
a.概念:物质不需要发生__________就能表现出来的性质。
b.举例:物质的颜色、气味、状态、沸点、硬度、熔点、密度等。
(2)化学性质
a.概念:物质在_________中才表现出来的性质。
b.举例:可燃性、助燃性、热稳定性、氧化性、酸碱性等。
(3)性质和用途的关系:
化学性质
化学性质
1.(2022,丽水)丽水市拥有众多地方特产,如龙泉青瓷、遂
昌竹炭、青田石雕、景宁山哈酒等。下列地方特产的制作过
程中,主要发生物理变化的是( )
A.煅烧青瓷 B.烧制竹炭
C.打磨石雕 D.酿山哈酒
C
2.下列物质的用途中既利用物理性质又利用化学性质的是( )
A.活性炭除异味
B.氢气作燃料
C.二氧化碳灭火
D.小苏打治疗胃酸过多
C
3.选用“物理变化、化学变化、物理性质、化学性质”之一填写在下列空格中:
(1)铜能在潮湿的空气中生成铜绿是__________。
(2)铜与氧气反应生成了氧化铜是__________。
(3)水蒸气遇冷变成水,水在0 ℃时结成冰是_________。
(4)水的凝固点是0 ℃,沸点为100 ℃,4 ℃时密度最大是
____________。
化学性质
化学变化
物理变化
物理性质
氧化性和还原性(八下教材P81)
1.氧化反应和还原反应
(1)物质_________的反应叫氧化反应,物质__________的反应叫还原反应。
(2)在 中,氢气得到氧化铜中的氧,被氧化,具有_________;氧化铜失去氧,被还原,具有_______。
2.氧化反应中________、具有氧化性的物质叫做________。氧气、氧化铜等是在反应中提供氧的物质,具有________,是常见的________。
得到氧
失去氧
还原性
氧化性
提供氧
氧化剂
氧化性
氧化剂
3.常见还原剂还原氧化铜实验
化学方程式 实验装置图 现象 注意事项
a.黑色粉末变为红色b.试管口有水珠生成 氢气把空气排净后再给氧化铜加热,反应完成后停止加热,继续通氢气直到试管冷却
CuO+CO
Cu+CO2 a.黑色粉末变为红色b.生成的气体使澄清石灰水变浑浊 CO有毒,因此尾气不能大量排向大气中,可点燃处理
2CuO+C
2Cu+CO2↑ a.黑色粉末变为红色b.生成的气体使澄清石灰水变浑浊
【注意】H2、CO等可燃性气体在使用前必须先_______,防止与空气混合受热时发生_______。H2的燃烧产物只有水,可用无水硫酸铜鉴别;CO的燃烧产物只有二氧化碳,可用澄清石灰水鉴别。
验纯
爆炸
4.(2022,重庆)工业炼铁原理为 ,其中CO体现还原性。下列化学反应中有物质体现还原性的是( )
A.SO3+H2O===H2SO4
B.H2+CuO Cu+H2O
C.CuSO4+BaCl2===BaSO4↓+CuCl2
D.H2SO4+2NaOH===Na2SO4+2H2O
B
5.对于H2、CO还原氧化铜的实验,下列说法错误的是( )
A.实验均需加热
B.反应类型都是置换反应
C.实验均有紫红色固体生成
D.H2和CO均体现出还原性
B
化学反应的基本类型
两种或两种以上
反应类型 概念 表达式
化合反应 由________________的物质生成另______物质的反应 A+B→AB(多变一)
分解反应 由一种物质生成
__________________其他物质的反应 AB→A+B(一变多)
置换反应 由一种单质跟一种
__________反应,生成______________和另一种化合物的反应 A+BC→B+AC
(一换一)
复分解反应 由两种化合物
________________,生成另外两种化合物的反应 AB+CD→AD+CB(相互交换)
一种
两种或两种以上
化合物
另一种单质
相互交换成分
复分解反应是发生在化合物之间的反应,反应前后各元素的化合价不改变,可简记为“两交换,价不变”。
6.(2022,温州)我国古代用火法炼硫,其主要反应的化学方程式是 。该反应属于( )
A.化合反应
B.分解反应
C.置换反应
D.复分解反应
B
化学反应中的能量变化(八下教材P85)
1.化学反应中往往伴随着______的变化。有热量放出的化学反应叫_________,吸收热量的化学反应叫________。
常见的放热反应:
①所有的燃烧反应、物质的缓慢氧化。
②生石灰溶于水 。
③金属跟酸的置换反应,如Mg+2HCl===MgCl2+H2↑。
④酸碱反应。
这些反应是化学能转化为______。
能量
放热反应
吸热反应
内能
常见吸热反应:
反应条件为高温或加热的反应大多数是吸热反应,内能转化为________。
2.光合作用太阳能转化为化学能;呼吸作用_______转化为其他形式的能;酸碱反应化学能转化为_____。
【注】物质溶解于水也会有吸热、放热现象,这是物理变化。氢氧化钠固体溶于水、浓硫酸溶于水放热;硝酸铵(NH4NO3)等铵盐溶于水吸热。溶于水既不吸热也不放热:氯化钠(NaCl)。所以利用固体溶于水是否放热可以用来鉴别物质。
化学能
化学能
内能
7.(2021,益阳)物质发生化学变化时伴随有能量变化。下列说法正确的是( )
A.化学反应过程中都会有放热现象
B.人类利用的能量都是通过化学反应获得的
C.化学能可转变成电能,如天然气燃料电池已被应用于城市客车的驱动电源
D.人体能维持恒定体温,主要是蛋白质在酶的催化下转变成CO2和H2O,放出热量
C
燃烧和缓慢氧化
1.缓慢氧化:速度缓慢、不易觉察、没有发光但有发热的一种氧化反应。如橡胶制品的老化、金属的生锈、生物呼吸、食物的腐败等。
2.剧烈的氧化现象
(1)燃烧是指可燃物与空气中的氧气发生发光、发热的剧烈的氧化反应。
(2)爆炸:在有限的空间内_________。如火药爆炸。
(3)自燃:可燃物缓慢氧化产生的热量聚集使温度达到______________________而引起的自发燃烧。
急速燃烧
可燃
物的着火点
【注意】爆炸不一定属于化学变化,如高压锅爆炸,轮胎爆炸。
3.可燃物燃烧的条件:①有可燃物;②可燃物与______(或空气)充分接触;③温度达到可燃物的________。(三者缺一不可)
4.灭火原理的方法:隔绝______、降低温度至_______________以下、撤离________。(破坏任何一个条件即可)
【注意】①着火点是物质的一种特性,不同可燃物的着火点不同,且一般不会改变,所以不能说“降低可燃物的着火点”。②助燃剂也不一定是氧气或者空气,如:镁在二氧化碳中燃烧,此时二氧化碳是助燃剂。
氧气
着火点
氧气
可燃物着火点
可燃物
5.火灾自救的一般方法
(1)浓烟密布时,应匍匐前进,并用湿毛巾掩盖口鼻。
(2)用湿毛巾等物品塞住门和窗缝隙。
(3)在窗前呼救。
8.(2021,广州)用如图所示实验探究燃烧的条件,下列说法正确的是( )
A.对比①③说明燃烧的条件之一是可燃物接触氧气
B.对比①④说明燃烧的条件之一是需要有可燃物
C.对比③④说明燃烧的条件之一是达到可燃物的着火点
D.本实验用盘成螺旋状的细铁丝替代白磷,能得到相同的实验结论
C
物质的变化和性质
化学变化和物理变化的区别是前者有新物质(分子)产生,物理性质和化学性质的区别是前者不需要发生化学变化就能表现出来。性质和变化最大的区别是前者表示一种可能性或趋势,常有“能”“会”等,而变化表示一种过程。
【例1】 (2022,威海)2022年2月,北京成功举办第24届冬奥会。大量创新技术的应用为“绿色奥运”增光添彩。下列过程中涉及化学变化的是( )
A.利用二氧化碳跨临界制冷技术为比赛场馆制冰
B.利用氢燃料电池为奥运村客车提供动力
C.利用加压技术将氢气液化储存在“飞扬”火炬中
D.利用模具压制“冰墩墩”硅胶外壳
B
1.(2022,成都)智能手表的部分信息如图,下列描述中相关性质属于化学性质的是( )
A. 玻璃透光性好作表镜
B.钛合金耐腐蚀作表框
C.不锈钢硬度大作表扣
D.橡胶弹性良好作表带
B
氢气和一氧化碳的性质
解答此类题目时,需要熟知一氧化碳和氢气的性质,掌握一氧化碳和氢气还原氧化物的实验原理和实验中的一些注意事项,作出正确分析和判断。
【例2】 (2022,绍兴)春秋初期,绍兴一带是南方的一个冶铁中心,其炼铁方法是在1000 ℃左右的温度下,使木炭和铁矿石(主要成分为Fe2O3)发生一系列的反应生成含较多杂质的海绵铁。其中主要化学反应为: 。下列说法正确的是( )
A.海绵铁是一种纯净物
B.Fe2O3中铁元素的化合价为+3价
C.上述反应中涉及的氧化物只有2种
D.炼铁过程中,木炭只是作为燃料使用
B
2.(2021,苏州)利用如图所示实验装置模拟工业炼铁。下列说法正确的是( )
A.实验时应先点燃酒精灯后通CO
B.充分加热,a处固体由黑色变为红色
C.b处可用澄清石灰水检验生成的CO2
D.可用NaOH溶液吸收尾气中的CO
C
四类基本反应的判断
化学反应划分为四大基本反应类型和是否是氧化还原反应是两种不同的分类方法,四大基本反应类型没有包含全部反应,如二氧化碳和氢氧化钠的反应、一氧化碳冶炼金属的反应等都不属于四大基本反应。
【例3】 在化学反应前后,物质所含元素化合价发生变化的反应属于氧化还原反应。氧化还原反应与四种基本化学反应类型间的关系如图所示,下列举例中错误的是( )
C
3.关于化学反应类型的说法正确的是( )
A.分解反应一定有单质生成
B.化合反应一定是两种物质生成另一种物质
C.置换反应一定有元素的化合价发生改变
D.两种化合物生成另外两种化合物的反应一定是复分解反应
C
燃烧和缓慢氧化
燃烧是初中科学中重要的化学现象,燃烧需要具备的条件中着火点是不可改变的。灭火措施和燃烧的条件具有对应关系。
【例4】 已知红磷、白磷的着火点分别为240 ℃、40 ℃。为探究燃烧的条件设计如图装置并将一定质量的白磷、红磷分别浸入80 ℃热水中。下列有关该实验的描述错误的是( )
A.实验开始时,白磷、红磷都不燃烧
B.升高右漏斗,红磷露出水面后,不会燃烧
C.升高左漏斗,白磷露出水面后,发生燃烧
D.调节左右漏斗高度,能观察到“白磷在水下燃烧”
D
4.(2021,北京)用如图实验验证可燃物燃烧的条件,已知:白磷的着火点为40 ℃。
(1)实验1,能验证可燃物燃烧需要O2的现象是
__________________________________。
(2)实验2,①中纸片燃烧,②中纸片未燃烧,②中纸片未燃烧的原因是___________________________________________。
①中白磷不燃烧,②中的白磷燃烧
水吸收了部分的热量,未达到纸片的着火点
【例】 (2022,绍兴)如图是人类对氧化还原反应的认识过程中的三个阶段。
【阶段Ⅰ】得失氧说:物质跟氧发生的反应叫氧化反应,含氧化合物中的氧被夺取的反应叫还原反应。
【阶段Ⅱ】化合价升降说:凡是出现元素化合价升降的化学反应都是氧化还原反应。化合价升高的反应叫氧化反应,化合价降低的反应叫还原反应。
【阶段Ⅲ】电子转移说:化合价升降的原因是电子的转移。凡有电子转移发生的化学反应都是氧化还原反应。失电子的反应叫氧化反应,得电子的反应叫还原反应。
(1)根据得失氧说,在 化学变化中,H2发生了_______反应。
(2)电子转移是元素化合价改变的本质原因。失电子后,元素的化合价会_______(填“升高”或“降低”)。
氧化
升高
(3)根据化合价升降说,化学反应的四种基本类型与氧化还原反应之间的关系如图所示,其中乙是_______反应。
(4)关于氧化还原反应的认识,下列理解正确的是________。
A.氧化和还原是相互对立又
辩证统一的关系
B.电子转移说是从微观视角来
探析和建构氧化还原反应的概念
C.自然界中发生的氧化还原反应对人类的生活和生产都是有利的
D.人类对氧化还原反应的认识过程是一个逐步发展、延伸和完善的过程
置换
ABD
同课章节目录
