人教版(2019)高中化学必修二 5.1 硫及其化合物 第一课时 课件(41张ppt)
文档属性
| 名称 | 人教版(2019)高中化学必修二 5.1 硫及其化合物 第一课时 课件(41张ppt) |  | |
| 格式 | ppt | ||
| 文件大小 | 19.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-18 17:19:50 | ||
图片预览









文档简介
(共41张PPT)
第一节 硫及其化合物
第一课时
第五章
化工生产中的重要非金属元素
硫的存在
游离态
化合态
硫铁矿(FeS2)
石膏(CaSO4 2H2O)
黄铜矿(CuFeS2)
芒硝(Na2SO4 10H2O)
硫还是一种生命元素,组成某些蛋白质离不开它
蛋白质中的硫:蛋黄内含硫,如果煮鸡蛋的时间过长,硫会转移到蛋黄的边缘,形成灰色的细环。硫是增强人们体质的蛋白质中至关重要的一部分。蛋白质分解后会产生硫化氢,有臭蛋味的有毒气体。
生活常识:
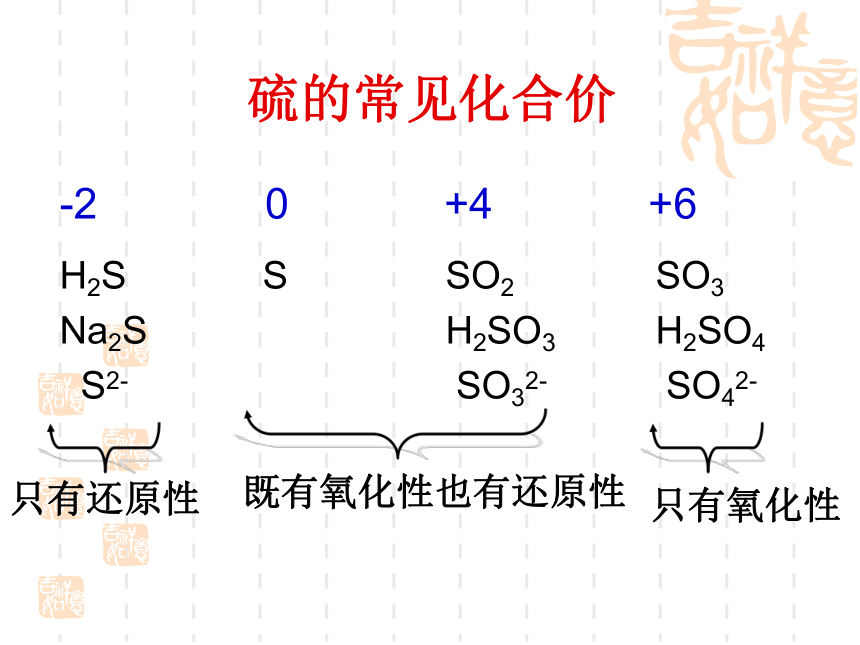
硫的常见化合价
-2 0 +4 +6
H2S
Na2S
S2-
S
SO2
H2SO3
SO32-
SO3
H2SO4
SO42-
只有还原性
既有氧化性也有还原性
只有氧化性
1.物理性质:黄色晶体,俗称硫黄,质脆,易研成粉末。不溶于水,微溶于酒精,易溶于CS2。
一、硫和二氧化硫
★、可以用CS2来清洗沾满硫的试管。
(一)硫
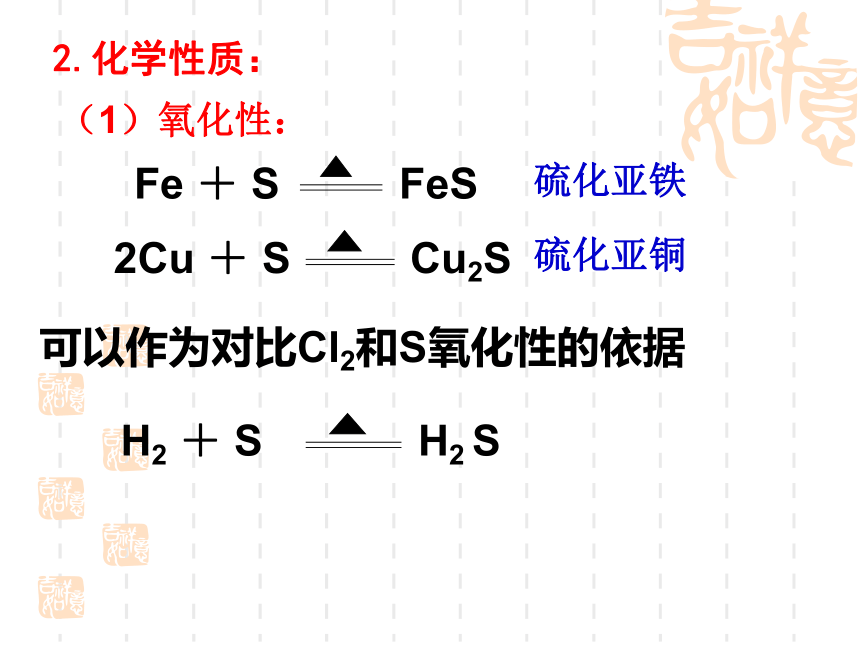
(1)氧化性:
2.化学性质:
Fe + S FeS
可以作为对比Cl2和S氧化性的依据
2Cu + S Cu2S
H2 + S H2 S
硫化亚铁
硫化亚铜
在氧气中燃烧发出明亮的蓝紫色火焰,空气中燃烧发出淡蓝色火焰,生成有刺激性气味的SO2
点燃
S + O2 === SO2
(2)还原性:
硫在氧气中燃烧
1、物理性质
无色、有刺激性气味的有毒气体,密度比空气
大,易液化,易溶于水(常温常压下,1体积水能
溶解40体积的二氧化硫,即1:40).
(二) 二氧化硫
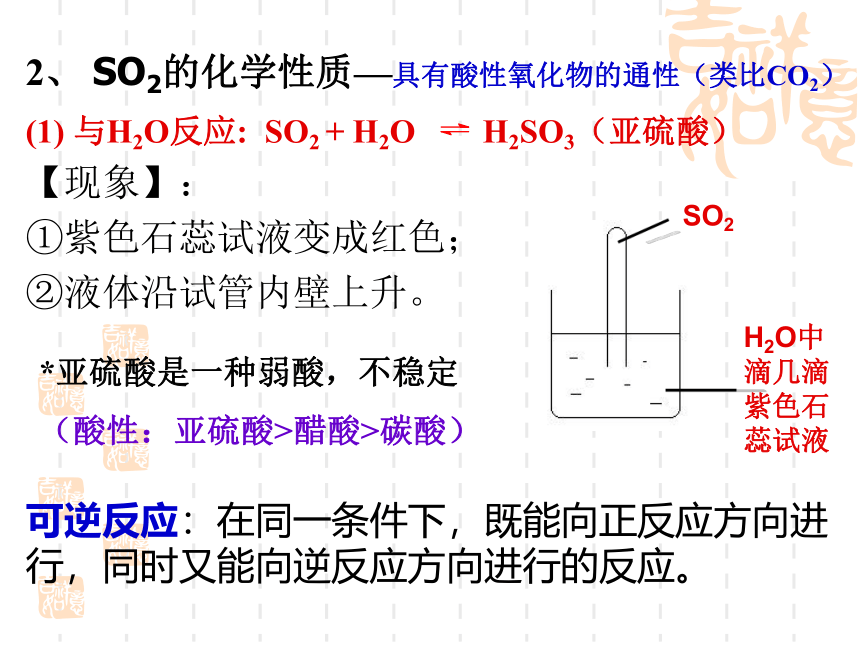
*亚硫酸是一种弱酸,不稳定
(酸性:亚硫酸>醋酸>碳酸)
2、 SO2的化学性质—具有酸性氧化物的通性(类比CO2)
(1) 与H2O反应: SO2 + H2O H2SO3(亚硫酸)
【现象】:
①紫色石蕊试液变成红色;
②液体沿试管内壁上升。
SO2
H2O中滴几滴紫色石蕊试液
可逆反应:在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应。
把向生成物方向进行的反应叫做正反应,
把向反应物方向进行的反应叫做逆反应。
可逆反应:在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应。
正反应和逆反应均不彻底,
反应物和生成物共存。
特点
说明: SO2与H2O反应生成H2SO3的同时, H2SO3也在分解生成SO2与H2O。
(2) 与碱反应 (类比CO2)
SO2不足:SO2+2NaOH=Na2SO3+H2O (吸收尾气)
SO2过量: SO2 + NaOH = NaHSO3
SO2不足: SO2 + Ca(OH)2= CaSO3 ↓+ H2O
SO2过量: 2SO2+ Ca(OH)2 = Ca(HSO3 )2
SO2+Na2SO3 +H2O = 2NaHSO3
燃煤烟气中含有SO2为了减少它的污染排放我们通常在燃煤中添加一定量的生石灰(或石灰石)
SO2 +CaO==CaSO3 (亚硫酸钙)
+
(3) 与碱性氧化物反应(燃煤污染的治理,钙基固硫)
2分30秒,SO2传感器爆表,超过20ppm
2分30秒,SO2传感器爆表,
超过20ppm
未处理的煤炭燃烧
处理的煤炭燃烧
加热到4分30秒,SO2传感器
不超过4ppm
SO2 + 2 H2S = 3 S + 2 H2O
(4)弱氧化性
(5) 还原性——较强
a. 与O2的反应:
2SO2 + O2 ===== 2SO3
催化剂
三氧化硫
三氧化硫是酸性氧化物,溶于水时剧烈反应,生成硫酸。
SO3 + H2O = H2SO4
5SO2 + 2KMnO4 + 2H2O = 2MnSO4 + K2SO4 + 2H2SO4
b. 与卤素单质的反应:
SO2 + Cl2 + 2 H2O = H2SO4 + 2HCl
SO2 + Br2 + 2 H2O = H2SO4 + 2HBr
SO2 + I2 + 2 H2O = H2SO4 + 2HI
溴水褪色
氯水褪色
c. 与其他氧化剂反应:
如:SO2使KMnO4 溶液褪色
碘水褪色
(经常用于除去CO2中混有的SO2)
SO2 + NaHCO3 = NaHSO3 +CO2
药品:1、饱和的NaHCO3溶液。(强酸制弱酸)
怎样除去CO2中混有的SO2
延伸:
类推—括号中是杂质
CO2(HCl)——
SO2(SO3)——
饱和的NaHCO3溶液
饱和的NaHSO3溶液
2、酸性KMnO4溶液
还原性数轴(需熟记,早记早轻松)
还原性:
S2- (H2S) > SO32- (SO2) > I- > Fe2+ > Br - > Cl-
Fe3+过量 : 2Fe3++S2-=2Fe2++S↓
S2-过量 : 2Fe3++3S2-=2FeS↓+S↓
如:
2Fe3++SO32-+H2O=2Fe2++SO42-+2H+
1、Fe3+与S2-不能共存
2、Fe3+与SO32-不能共存
H2SO3溶液
滴入品红溶液
轻轻振荡
加热
(6) SO2的漂白性
实验现象:
品红溶液褪色;加热,又恢复原来的颜色。
实验:将品红滴入亚硫酸溶液,再加热,观察现象
将SO2通入品红溶液中,品红溶液的红色褪去;加热后,溶液又恢复红色
这是检验SO2重要方法
(6) SO2的漂白性
SO2的漂白作用是SO2跟有色物质化合生成一种无色的不稳定化合物,遇热或长久防止易分解而恢复原来的颜色。
漂白原理:
——化合漂白
选择性:不能使紫色石蕊试液褪色
(只使石蕊变红)
思考:将SO2和Cl2按1:1混合后,通入
水中,漂白效果会不会增强?
1、HClO 、Na2O2 、 O3 、H2O2
—— 氧化漂白(稳定)
2、活性炭 ——— 吸附漂白
3、SO2—— 化合漂白(不稳定)
漂白原理的比较:
白得不正常,常用超量的二氧化硫漂白。
联合国粮农组织和世界卫生组织下食品添加剂联合专家委员会
二氧化硫长期每日允许摄入量(ADI)为
0∽0.7 mg/kg
×
原理:
3、 SO2的实验室制法
H2SO4 (浓) + Na2SO3 = SO2 ↑ +H2O+ Na2SO4
其他:Cu+2 H2SO4(浓)=== CuSO4+ SO2 +2H2O
4、工业制法
煅烧黄铁矿(FeS2)或燃烧S可用于工业上制取SO2气体
4FeS2 + 11O2 === 2Fe2O3 + 8SO2
高温
5、工业制硫酸
4FeS2 + 11O2 === 2Fe2O3 + 8SO2
高温
点燃
S + O2 === SO2
生活小常识:
抗氧化剂
保鲜剂
防腐剂
葡萄酒中二氧化硫
的上限:
美国是350ppm,
中国是250ppm,
SO2的用途
杀菌、消毒、
干果防腐剂
制造硫酸
漂白纸浆、
毛、丝、
草帽
二氧化硫是怎样形成酸雨的?
延伸:
化学物质
化学学科
SO3 + H2O = H2SO4
无色固体, 熔点(16.8℃)和沸点(44.8℃) 比较低,易溶于水,且与水剧烈反应放出大量的热。
(工业生产 H2SO4)
与碱性氧化物或碱反应生成硫酸盐
SO3 + CaO =
CaSO4
SO3 + 2NaOH =
Na2SO4 +H2O
二、 三氧化硫
—酸性氧化物
三、硫化氢(H2S)
1、物理性质
常温下为无色有臭鸡蛋气味的剧毒气体,溶于水成为氢硫酸(二元弱酸)
2、化学性质
氧气不足: 2H2S + O2 = 2S + 2H2O
氧气充足: 2H2S + 3O2 = 2SO2 + 2H2O
H2S + 2FeCl3 = 2FeCl2 + 2HCl + S↓
H2S + CuSO4 = H2SO4 + CuS↓
1、指出下列反应或现象中,SO2所体现的性质:
(1)
(2)SO2+2H2S=3S+2H2O
(3)SO2+Cl2+2H2O=2HCl+H2SO4
(4)SO2使品红溶液褪色
(5)SO2使酸性高锰酸钾溶液褪色
(6)SO2使紫色石蕊试液变红色
2SO2 + O2 2 SO3
催化剂
△
还原性
[巩固训练]
氧化性
还原性
漂白性
还原性
水溶液呈酸性
2、将SO2依次通过下列实验装置,说出A、B、C、D各装置中的实验现象。
A B C D
褪色 褪色 红色
先浑浊
后澄清
延伸:
某混合气体由SO2 CO2 和水蒸气组成,为分别检验三
种气体,使用下列装置:
可供选择的药品为:酸性高锰酸钾溶液、品红溶液、澄清石灰水、无水硫酸铜,指明各容器中的药品,
D装置作用是___________________________
说明存在CO2的实验现象是___________________
a
b
c
d
e
无水硫酸铜
品红
高锰酸钾
品红
澄清石灰水
d中品红不褪色e中出现白色浑浊
检验SO2是否除净
某学生利用如图装置做如下实验:在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是 溶液。加热时溶液由无色变为红色的原因是 。
溶有SO2的品红
SO2气体逸出,品红恢复红色
延伸:
小结:
SO2
与CaO等反应
与碱反应
还原性
氧化性
酸性
氧化物
+4价
漂白性、毒性
特 性
杀菌、防腐、漂白、制硫酸
与水反应
用 途
第一节 硫及其化合物
第一课时
第五章
化工生产中的重要非金属元素
硫的存在
游离态
化合态
硫铁矿(FeS2)
石膏(CaSO4 2H2O)
黄铜矿(CuFeS2)
芒硝(Na2SO4 10H2O)
硫还是一种生命元素,组成某些蛋白质离不开它
蛋白质中的硫:蛋黄内含硫,如果煮鸡蛋的时间过长,硫会转移到蛋黄的边缘,形成灰色的细环。硫是增强人们体质的蛋白质中至关重要的一部分。蛋白质分解后会产生硫化氢,有臭蛋味的有毒气体。
生活常识:
硫的常见化合价
-2 0 +4 +6
H2S
Na2S
S2-
S
SO2
H2SO3
SO32-
SO3
H2SO4
SO42-
只有还原性
既有氧化性也有还原性
只有氧化性
1.物理性质:黄色晶体,俗称硫黄,质脆,易研成粉末。不溶于水,微溶于酒精,易溶于CS2。
一、硫和二氧化硫
★、可以用CS2来清洗沾满硫的试管。
(一)硫
(1)氧化性:
2.化学性质:
Fe + S FeS
可以作为对比Cl2和S氧化性的依据
2Cu + S Cu2S
H2 + S H2 S
硫化亚铁
硫化亚铜
在氧气中燃烧发出明亮的蓝紫色火焰,空气中燃烧发出淡蓝色火焰,生成有刺激性气味的SO2
点燃
S + O2 === SO2
(2)还原性:
硫在氧气中燃烧
1、物理性质
无色、有刺激性气味的有毒气体,密度比空气
大,易液化,易溶于水(常温常压下,1体积水能
溶解40体积的二氧化硫,即1:40).
(二) 二氧化硫
*亚硫酸是一种弱酸,不稳定
(酸性:亚硫酸>醋酸>碳酸)
2、 SO2的化学性质—具有酸性氧化物的通性(类比CO2)
(1) 与H2O反应: SO2 + H2O H2SO3(亚硫酸)
【现象】:
①紫色石蕊试液变成红色;
②液体沿试管内壁上升。
SO2
H2O中滴几滴紫色石蕊试液
可逆反应:在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应。
把向生成物方向进行的反应叫做正反应,
把向反应物方向进行的反应叫做逆反应。
可逆反应:在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应。
正反应和逆反应均不彻底,
反应物和生成物共存。
特点
说明: SO2与H2O反应生成H2SO3的同时, H2SO3也在分解生成SO2与H2O。
(2) 与碱反应 (类比CO2)
SO2不足:SO2+2NaOH=Na2SO3+H2O (吸收尾气)
SO2过量: SO2 + NaOH = NaHSO3
SO2不足: SO2 + Ca(OH)2= CaSO3 ↓+ H2O
SO2过量: 2SO2+ Ca(OH)2 = Ca(HSO3 )2
SO2+Na2SO3 +H2O = 2NaHSO3
燃煤烟气中含有SO2为了减少它的污染排放我们通常在燃煤中添加一定量的生石灰(或石灰石)
SO2 +CaO==CaSO3 (亚硫酸钙)
+
(3) 与碱性氧化物反应(燃煤污染的治理,钙基固硫)
2分30秒,SO2传感器爆表,超过20ppm
2分30秒,SO2传感器爆表,
超过20ppm
未处理的煤炭燃烧
处理的煤炭燃烧
加热到4分30秒,SO2传感器
不超过4ppm
SO2 + 2 H2S = 3 S + 2 H2O
(4)弱氧化性
(5) 还原性——较强
a. 与O2的反应:
2SO2 + O2 ===== 2SO3
催化剂
三氧化硫
三氧化硫是酸性氧化物,溶于水时剧烈反应,生成硫酸。
SO3 + H2O = H2SO4
5SO2 + 2KMnO4 + 2H2O = 2MnSO4 + K2SO4 + 2H2SO4
b. 与卤素单质的反应:
SO2 + Cl2 + 2 H2O = H2SO4 + 2HCl
SO2 + Br2 + 2 H2O = H2SO4 + 2HBr
SO2 + I2 + 2 H2O = H2SO4 + 2HI
溴水褪色
氯水褪色
c. 与其他氧化剂反应:
如:SO2使KMnO4 溶液褪色
碘水褪色
(经常用于除去CO2中混有的SO2)
SO2 + NaHCO3 = NaHSO3 +CO2
药品:1、饱和的NaHCO3溶液。(强酸制弱酸)
怎样除去CO2中混有的SO2
延伸:
类推—括号中是杂质
CO2(HCl)——
SO2(SO3)——
饱和的NaHCO3溶液
饱和的NaHSO3溶液
2、酸性KMnO4溶液
还原性数轴(需熟记,早记早轻松)
还原性:
S2- (H2S) > SO32- (SO2) > I- > Fe2+ > Br - > Cl-
Fe3+过量 : 2Fe3++S2-=2Fe2++S↓
S2-过量 : 2Fe3++3S2-=2FeS↓+S↓
如:
2Fe3++SO32-+H2O=2Fe2++SO42-+2H+
1、Fe3+与S2-不能共存
2、Fe3+与SO32-不能共存
H2SO3溶液
滴入品红溶液
轻轻振荡
加热
(6) SO2的漂白性
实验现象:
品红溶液褪色;加热,又恢复原来的颜色。
实验:将品红滴入亚硫酸溶液,再加热,观察现象
将SO2通入品红溶液中,品红溶液的红色褪去;加热后,溶液又恢复红色
这是检验SO2重要方法
(6) SO2的漂白性
SO2的漂白作用是SO2跟有色物质化合生成一种无色的不稳定化合物,遇热或长久防止易分解而恢复原来的颜色。
漂白原理:
——化合漂白
选择性:不能使紫色石蕊试液褪色
(只使石蕊变红)
思考:将SO2和Cl2按1:1混合后,通入
水中,漂白效果会不会增强?
1、HClO 、Na2O2 、 O3 、H2O2
—— 氧化漂白(稳定)
2、活性炭 ——— 吸附漂白
3、SO2—— 化合漂白(不稳定)
漂白原理的比较:
白得不正常,常用超量的二氧化硫漂白。
联合国粮农组织和世界卫生组织下食品添加剂联合专家委员会
二氧化硫长期每日允许摄入量(ADI)为
0∽0.7 mg/kg
×
原理:
3、 SO2的实验室制法
H2SO4 (浓) + Na2SO3 = SO2 ↑ +H2O+ Na2SO4
其他:Cu+2 H2SO4(浓)=== CuSO4+ SO2 +2H2O
4、工业制法
煅烧黄铁矿(FeS2)或燃烧S可用于工业上制取SO2气体
4FeS2 + 11O2 === 2Fe2O3 + 8SO2
高温
5、工业制硫酸
4FeS2 + 11O2 === 2Fe2O3 + 8SO2
高温
点燃
S + O2 === SO2
生活小常识:
抗氧化剂
保鲜剂
防腐剂
葡萄酒中二氧化硫
的上限:
美国是350ppm,
中国是250ppm,
SO2的用途
杀菌、消毒、
干果防腐剂
制造硫酸
漂白纸浆、
毛、丝、
草帽
二氧化硫是怎样形成酸雨的?
延伸:
化学物质
化学学科
SO3 + H2O = H2SO4
无色固体, 熔点(16.8℃)和沸点(44.8℃) 比较低,易溶于水,且与水剧烈反应放出大量的热。
(工业生产 H2SO4)
与碱性氧化物或碱反应生成硫酸盐
SO3 + CaO =
CaSO4
SO3 + 2NaOH =
Na2SO4 +H2O
二、 三氧化硫
—酸性氧化物
三、硫化氢(H2S)
1、物理性质
常温下为无色有臭鸡蛋气味的剧毒气体,溶于水成为氢硫酸(二元弱酸)
2、化学性质
氧气不足: 2H2S + O2 = 2S + 2H2O
氧气充足: 2H2S + 3O2 = 2SO2 + 2H2O
H2S + 2FeCl3 = 2FeCl2 + 2HCl + S↓
H2S + CuSO4 = H2SO4 + CuS↓
1、指出下列反应或现象中,SO2所体现的性质:
(1)
(2)SO2+2H2S=3S+2H2O
(3)SO2+Cl2+2H2O=2HCl+H2SO4
(4)SO2使品红溶液褪色
(5)SO2使酸性高锰酸钾溶液褪色
(6)SO2使紫色石蕊试液变红色
2SO2 + O2 2 SO3
催化剂
△
还原性
[巩固训练]
氧化性
还原性
漂白性
还原性
水溶液呈酸性
2、将SO2依次通过下列实验装置,说出A、B、C、D各装置中的实验现象。
A B C D
褪色 褪色 红色
先浑浊
后澄清
延伸:
某混合气体由SO2 CO2 和水蒸气组成,为分别检验三
种气体,使用下列装置:
可供选择的药品为:酸性高锰酸钾溶液、品红溶液、澄清石灰水、无水硫酸铜,指明各容器中的药品,
D装置作用是___________________________
说明存在CO2的实验现象是___________________
a
b
c
d
e
无水硫酸铜
品红
高锰酸钾
品红
澄清石灰水
d中品红不褪色e中出现白色浑浊
检验SO2是否除净
某学生利用如图装置做如下实验:在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是 溶液。加热时溶液由无色变为红色的原因是 。
溶有SO2的品红
SO2气体逸出,品红恢复红色
延伸:
小结:
SO2
与CaO等反应
与碱反应
还原性
氧化性
酸性
氧化物
+4价
漂白性、毒性
特 性
杀菌、防腐、漂白、制硫酸
与水反应
用 途
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
