水是常用的溶剂(饱和溶液与不饱和溶液)
文档属性
| 名称 | 水是常用的溶剂(饱和溶液与不饱和溶液) |  | |
| 格式 | zip | ||
| 文件大小 | 135.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2014-03-01 21:24:49 | ||
图片预览









文档简介
课件32张PPT。二、水是常用的溶剂
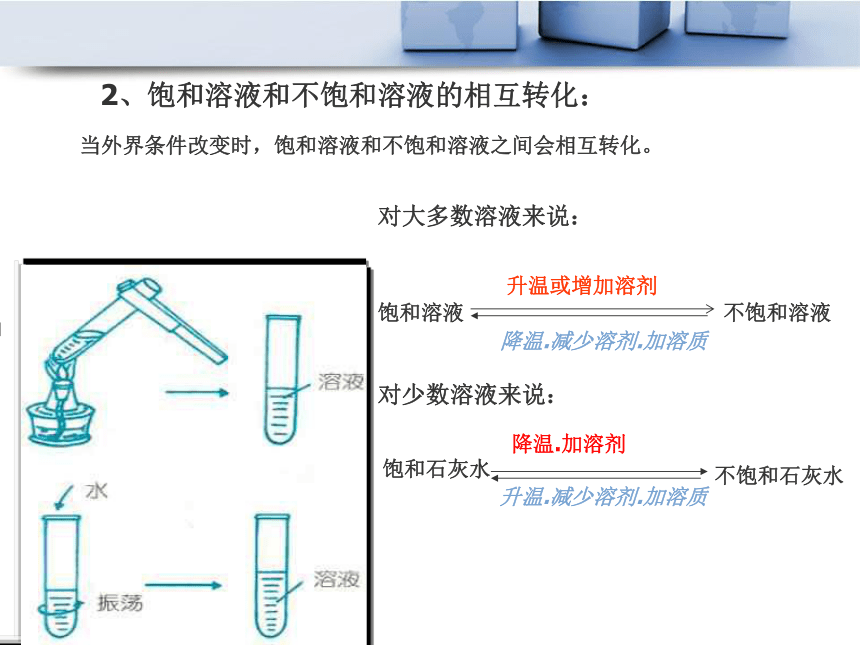
——饱和溶液和不饱和溶液猜想:1、水是一种很好的溶剂,许多物质可以溶解在其中,是不是所有物质在水中的溶解能力都一样?2、溶解能力强的物质能不能在一定量的水中无限制的溶解下去呢?讨论:怎样判断物质的溶解是否达到了最大限度?有没有条件限制?不同物质在同一溶剂中的溶解能力不同。1、概念:饱和溶液和不饱和溶液:在一定温度下,一定量的溶剂里不能再溶解某种溶质的溶液,叫做饱和溶液; 还能继续溶解某种溶质的溶液,叫做不饱和溶液。1.饱和溶液在用水稀释变成不饱和溶液的过程中,保持不变的量是 ,发生改变的是 和 。2.不饱和溶液在水分蒸发变成饱和溶液的过程中,保持不变的量是 ,发生改变的是 和 。3.不饱和溶液在加入溶质变成饱和溶液的过程中,保持不变的量是 ,发生改变的是 和 。思考:溶质的质量溶剂的质量溶液的质量溶质的质量溶剂的质量溶液的质量溶质的质量溶剂的质量溶液的质量2、饱和溶液和不饱和溶液的相互转化:对大多数溶液来说:饱和溶液不饱和溶液升温或增加溶剂降温.减少溶剂.加溶质对少数溶液来说:饱和石灰水不饱和石灰水降温.加溶剂升温.减少溶剂.加溶质当外界条件改变时,饱和溶液和不饱和溶液之间会相互转化。 练 习:室温下有一杯接近饱和的
蔗糖溶液,怎样把它变为不饱和溶液
设问生活中我们会碰到很甜的糖水,说明浓度很大,那这种浓度很大的糖水是否一定是饱和溶液呢? (1):在溶液中,溶有较多溶质的,称为浓溶液。
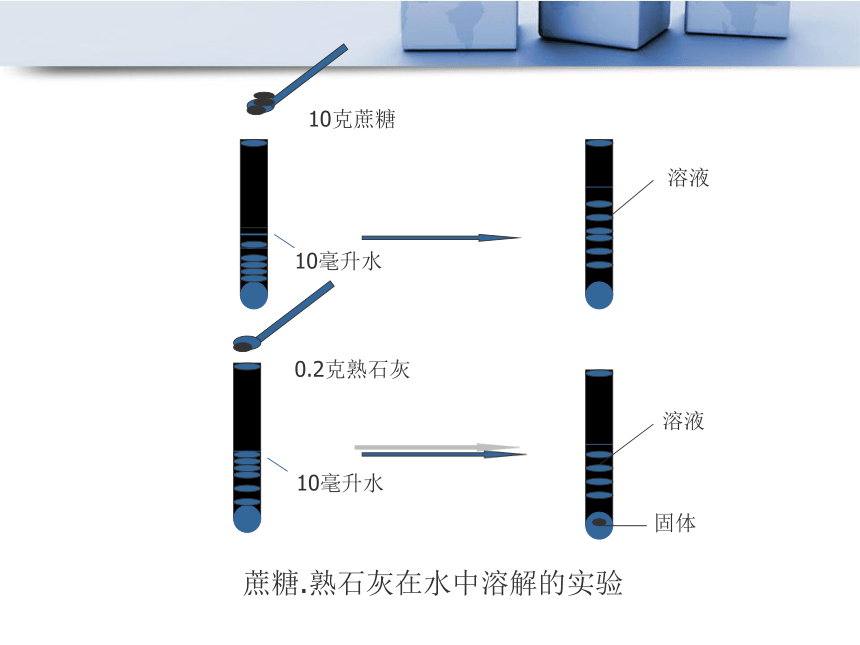
(2):在溶液中,溶有较少溶质的,称为稀溶液。3、浓溶液和稀溶液10克蔗糖10毫升水10毫升水0.2克熟石灰溶液溶液固体蔗糖.熟石灰在水中溶解的实验 10克蔗糖在水中溶解了,浓度很浓,但可以继续溶解蔗糖;
熟石灰在水中溶解的很少,溶液很稀,但已经饱和了不能继续溶解熟石灰。现象: 饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液,
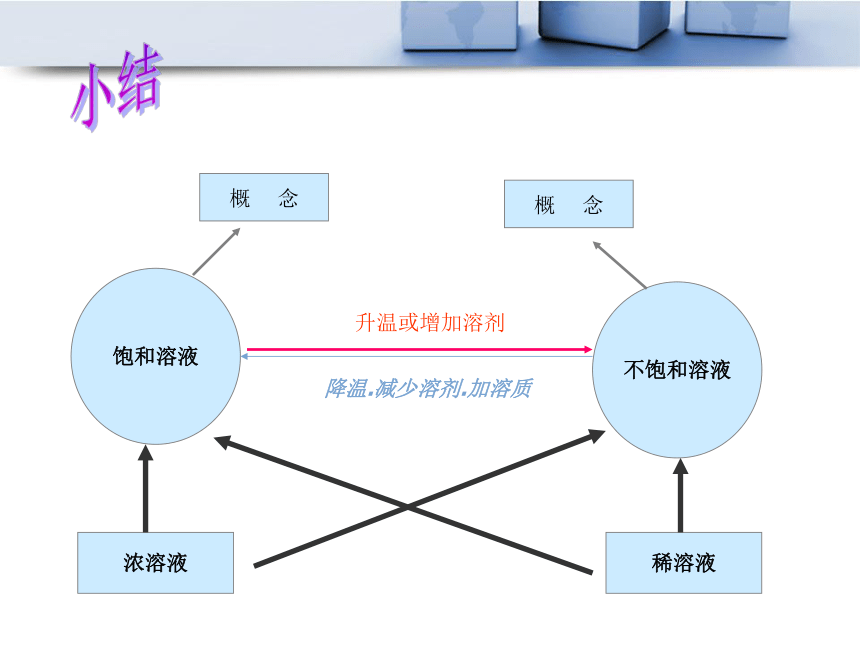
在同一条件下,对同一物质而言,饱和溶液比不饱和溶液浓一些。结论:小结饱和溶液不饱和溶液浓溶液稀溶液概 念概 念升温或增加溶剂降温.减少溶剂.加溶质巩固练习:1.在一定 _________下,一定量的_________ 里 ________
再继续溶解某种溶质的溶液叫饱和溶液.2.要使饱和硝酸钾溶液变成不饱和溶液,可采取的措施有(1)________________________3、 30 C饱和硝酸钾溶液升高温度至100oc,则杯_______(有或无)晶体,则该 100oc的硝酸钾溶液是________溶液(填饱和.不饱和)(2)________________________温度溶剂不能升 温加 水无不饱和氯酸钾未全溶,已达到饱和;食盐全溶解完,未到达饱和。现象:结论:在相同的温度下,这两种溶质的溶解能力不一样。实验:室温下,在两只盛有100克水的烧杯中分别加入10克食盐和10克氯酸钾。 一般固体物质的溶解度指的是:
在一定的温度下,某固体物质在100g溶剂(一般为水)中达到饱和状态时所溶解的质量,就叫做这种物质在水里的溶解度。什么是溶解度溶解度计算公示:
溶质的质量:溶剂的质量=溶解度:100克 20 c时,100克食盐溶液里含有20克食盐,求此时食盐的溶解度?练习: 溶质的质量:溶剂的质量=溶解度:100克
20克食盐:80克水=溶解度:100克
溶解度=20/80*100=25克
溶解度曲线:反映物质的溶解度随温度变化的情况。什么是溶解度曲线(1)每个点------表示某温度下某溶质的溶解度(2)曲线-----表示某物质的溶解度受温度影响大小的情况(3)交点------表示在该温度下两种物质的溶解度相等(4)曲线上每个点是该温度下该溶质的饱和溶液,曲线下方的点表示对应温度下该溶质的不饱和溶液。1、溶解度曲线的意义(5)可确定从饱和溶液中析出晶体或进行混合物分离的方法。1、大多数物质的溶解度随温度升高而增大。从溶解度曲线可知:(1)有的影响很大<曲线较陡>如:硝酸钾(2)有的影响不大<曲线平缓>如:食盐2、极少数物质及气体的溶解度随温度升高而减小。如:熟石灰50
10
20
30
40
0
60
70
808
90
100
50
10
20
30
40
80
60
70
8 0
90
100
110
180
170
160
150
140
130
120
190
200
硝酸铵
硝酸钾
硝酸钠
氯化铵
氯化钾
氯化钠
硼酸
100硼酸硝酸铵硝酸钠硝酸钾氯化铵氯化钾氯化钠6070501020304080901001101801701601501401301201902005010203040090607080温度/℃固体的溶解度曲线:1、横坐标60,纵坐标110 的A点表示什么意义? 练习:2、40℃时氯化铵的溶解度为______, 70℃时氯化铵的溶解度为______。 70℃时氯化钾的溶解度为____。47g44g60gA.B.3、B点表示什么意思?表示在该点所示的温度(68 ℃ )时,硝酸钠和硝酸钾两种物质的溶解度相等(134克)。 读图:
1、大多数固体的溶解度与温度的关是 ;
2、温度对溶解度影响最大的物质是 ,影响最小的物质是 ;
3、极少数固体的溶解度(如 )随温度的升高而 。随温度的升高而增大硝酸钾熟石灰减少氯化钠氢氧化钙的溶解度曲线四、水是常用的溶剂——浊液复习:1、溶液的概念。2、溶液的特点。3、举出几种常见的溶液。4、溶液中溶质是什么,溶剂是什么?探究一:把不同的物质放入水中,都能形成溶液吗?实验:观察泥土、植物油、蔗糖和食盐的状态,
把他们分别加入4支各装有10毫升水的试
管里按下表1、2、3三步操作,认真、细
致地观察变化的全过程,记录并比较产生
的实验现象。1、把四种物质分别放入水中2、充分振荡3、放置一段时间泥土沉到水底植物油漂浮在水面蔗糖沉到水底食盐沉到水底混浊,有泥土小颗粒悬浮在水中
不均一混浊,有小油滴悬浮在水中
不均一透明,蔗糖溶在水中,均一透明,食盐溶在水中,均一不稳定,有泥土沉淀下来不稳定,油与水分上下两层稳定,无蔗糖析出稳定,无食盐析出结论:不同物质放入水中,不是都能形成溶液。一、浊液1、悬浊液:
固体小颗粒悬浮在液体里的混合物。2、乳浊液:
液体小液滴悬浮在液体里的混合物。3、溶液、悬浊液、乳浊液的区别:固、液、气固液分子或离子许多分子的集合体许多分子的集合体均一、
稳定不均一、
不稳定不均一、
不稳定食盐水、糖水、碘酒泥浆、豆浆牛奶二、其他常用的溶剂探究二: 在两个试管中,各加入5毫升的水和
汽油,然后分别滴入两滴植物油,振荡
后观察现象。现象:植物油不溶于水,植物油溶于汽油。结论:汽油可以作为溶剂。溶质对溶剂是有选择性的。探究三: 在两个试管中,各加入5毫升的水和
酒精,然后分别加入一块碘晶体和一些
蔗糖,振荡后观察现象。悬浊液悬浊液蔗糖溶液碘酒溶液结论:1、同种物质在不同种溶剂中的溶解能力不同。2、不同种物质在同种溶剂中的溶解能力不同。三、溶液的命名法则1、水作溶剂的溶液,叫做某某的水溶液。例:蔗糖溶于水,叫做蔗糖的水溶液。2、通常不指明溶剂的溶液,一般指的是水溶液。例:高锰酸钾溶液3、当水和其他液体相互溶解时,通常不论液体
的含量多少,都把水看作溶剂,另一种看作溶质。
即:有水的水作溶剂。例:75%的酒精,叫做酒精的水溶液。
表示:100克溶液中,含75克酒精,25克水。4、两种液体相互溶解时,量多的为溶剂,量少
的为溶质。例:5ml汽油中,滴入2滴机油。
叫做:机油的汽油溶液。
——饱和溶液和不饱和溶液猜想:1、水是一种很好的溶剂,许多物质可以溶解在其中,是不是所有物质在水中的溶解能力都一样?2、溶解能力强的物质能不能在一定量的水中无限制的溶解下去呢?讨论:怎样判断物质的溶解是否达到了最大限度?有没有条件限制?不同物质在同一溶剂中的溶解能力不同。1、概念:饱和溶液和不饱和溶液:在一定温度下,一定量的溶剂里不能再溶解某种溶质的溶液,叫做饱和溶液; 还能继续溶解某种溶质的溶液,叫做不饱和溶液。1.饱和溶液在用水稀释变成不饱和溶液的过程中,保持不变的量是 ,发生改变的是 和 。2.不饱和溶液在水分蒸发变成饱和溶液的过程中,保持不变的量是 ,发生改变的是 和 。3.不饱和溶液在加入溶质变成饱和溶液的过程中,保持不变的量是 ,发生改变的是 和 。思考:溶质的质量溶剂的质量溶液的质量溶质的质量溶剂的质量溶液的质量溶质的质量溶剂的质量溶液的质量2、饱和溶液和不饱和溶液的相互转化:对大多数溶液来说:饱和溶液不饱和溶液升温或增加溶剂降温.减少溶剂.加溶质对少数溶液来说:饱和石灰水不饱和石灰水降温.加溶剂升温.减少溶剂.加溶质当外界条件改变时,饱和溶液和不饱和溶液之间会相互转化。 练 习:室温下有一杯接近饱和的
蔗糖溶液,怎样把它变为不饱和溶液
设问生活中我们会碰到很甜的糖水,说明浓度很大,那这种浓度很大的糖水是否一定是饱和溶液呢? (1):在溶液中,溶有较多溶质的,称为浓溶液。
(2):在溶液中,溶有较少溶质的,称为稀溶液。3、浓溶液和稀溶液10克蔗糖10毫升水10毫升水0.2克熟石灰溶液溶液固体蔗糖.熟石灰在水中溶解的实验 10克蔗糖在水中溶解了,浓度很浓,但可以继续溶解蔗糖;
熟石灰在水中溶解的很少,溶液很稀,但已经饱和了不能继续溶解熟石灰。现象: 饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液,
在同一条件下,对同一物质而言,饱和溶液比不饱和溶液浓一些。结论:小结饱和溶液不饱和溶液浓溶液稀溶液概 念概 念升温或增加溶剂降温.减少溶剂.加溶质巩固练习:1.在一定 _________下,一定量的_________ 里 ________
再继续溶解某种溶质的溶液叫饱和溶液.2.要使饱和硝酸钾溶液变成不饱和溶液,可采取的措施有(1)________________________3、 30 C饱和硝酸钾溶液升高温度至100oc,则杯_______(有或无)晶体,则该 100oc的硝酸钾溶液是________溶液(填饱和.不饱和)(2)________________________温度溶剂不能升 温加 水无不饱和氯酸钾未全溶,已达到饱和;食盐全溶解完,未到达饱和。现象:结论:在相同的温度下,这两种溶质的溶解能力不一样。实验:室温下,在两只盛有100克水的烧杯中分别加入10克食盐和10克氯酸钾。 一般固体物质的溶解度指的是:
在一定的温度下,某固体物质在100g溶剂(一般为水)中达到饱和状态时所溶解的质量,就叫做这种物质在水里的溶解度。什么是溶解度溶解度计算公示:
溶质的质量:溶剂的质量=溶解度:100克 20 c时,100克食盐溶液里含有20克食盐,求此时食盐的溶解度?练习: 溶质的质量:溶剂的质量=溶解度:100克
20克食盐:80克水=溶解度:100克
溶解度=20/80*100=25克
溶解度曲线:反映物质的溶解度随温度变化的情况。什么是溶解度曲线(1)每个点------表示某温度下某溶质的溶解度(2)曲线-----表示某物质的溶解度受温度影响大小的情况(3)交点------表示在该温度下两种物质的溶解度相等(4)曲线上每个点是该温度下该溶质的饱和溶液,曲线下方的点表示对应温度下该溶质的不饱和溶液。1、溶解度曲线的意义(5)可确定从饱和溶液中析出晶体或进行混合物分离的方法。1、大多数物质的溶解度随温度升高而增大。从溶解度曲线可知:(1)有的影响很大<曲线较陡>如:硝酸钾(2)有的影响不大<曲线平缓>如:食盐2、极少数物质及气体的溶解度随温度升高而减小。如:熟石灰50
10
20
30
40
0
60
70
808
90
100
50
10
20
30
40
80
60
70
8 0
90
100
110
180
170
160
150
140
130
120
190
200
硝酸铵
硝酸钾
硝酸钠
氯化铵
氯化钾
氯化钠
硼酸
100硼酸硝酸铵硝酸钠硝酸钾氯化铵氯化钾氯化钠6070501020304080901001101801701601501401301201902005010203040090607080温度/℃固体的溶解度曲线:1、横坐标60,纵坐标110 的A点表示什么意义? 练习:2、40℃时氯化铵的溶解度为______, 70℃时氯化铵的溶解度为______。 70℃时氯化钾的溶解度为____。47g44g60gA.B.3、B点表示什么意思?表示在该点所示的温度(68 ℃ )时,硝酸钠和硝酸钾两种物质的溶解度相等(134克)。 读图:
1、大多数固体的溶解度与温度的关是 ;
2、温度对溶解度影响最大的物质是 ,影响最小的物质是 ;
3、极少数固体的溶解度(如 )随温度的升高而 。随温度的升高而增大硝酸钾熟石灰减少氯化钠氢氧化钙的溶解度曲线四、水是常用的溶剂——浊液复习:1、溶液的概念。2、溶液的特点。3、举出几种常见的溶液。4、溶液中溶质是什么,溶剂是什么?探究一:把不同的物质放入水中,都能形成溶液吗?实验:观察泥土、植物油、蔗糖和食盐的状态,
把他们分别加入4支各装有10毫升水的试
管里按下表1、2、3三步操作,认真、细
致地观察变化的全过程,记录并比较产生
的实验现象。1、把四种物质分别放入水中2、充分振荡3、放置一段时间泥土沉到水底植物油漂浮在水面蔗糖沉到水底食盐沉到水底混浊,有泥土小颗粒悬浮在水中
不均一混浊,有小油滴悬浮在水中
不均一透明,蔗糖溶在水中,均一透明,食盐溶在水中,均一不稳定,有泥土沉淀下来不稳定,油与水分上下两层稳定,无蔗糖析出稳定,无食盐析出结论:不同物质放入水中,不是都能形成溶液。一、浊液1、悬浊液:
固体小颗粒悬浮在液体里的混合物。2、乳浊液:
液体小液滴悬浮在液体里的混合物。3、溶液、悬浊液、乳浊液的区别:固、液、气固液分子或离子许多分子的集合体许多分子的集合体均一、
稳定不均一、
不稳定不均一、
不稳定食盐水、糖水、碘酒泥浆、豆浆牛奶二、其他常用的溶剂探究二: 在两个试管中,各加入5毫升的水和
汽油,然后分别滴入两滴植物油,振荡
后观察现象。现象:植物油不溶于水,植物油溶于汽油。结论:汽油可以作为溶剂。溶质对溶剂是有选择性的。探究三: 在两个试管中,各加入5毫升的水和
酒精,然后分别加入一块碘晶体和一些
蔗糖,振荡后观察现象。悬浊液悬浊液蔗糖溶液碘酒溶液结论:1、同种物质在不同种溶剂中的溶解能力不同。2、不同种物质在同种溶剂中的溶解能力不同。三、溶液的命名法则1、水作溶剂的溶液,叫做某某的水溶液。例:蔗糖溶于水,叫做蔗糖的水溶液。2、通常不指明溶剂的溶液,一般指的是水溶液。例:高锰酸钾溶液3、当水和其他液体相互溶解时,通常不论液体
的含量多少,都把水看作溶剂,另一种看作溶质。
即:有水的水作溶剂。例:75%的酒精,叫做酒精的水溶液。
表示:100克溶液中,含75克酒精,25克水。4、两种液体相互溶解时,量多的为溶剂,量少
的为溶质。例:5ml汽油中,滴入2滴机油。
叫做:机油的汽油溶液。
同课章节目录
- 第1章 水
- 1 地球上的水
- 2 水的三态变化
- 3 水是常用的溶剂
- 4 配制溶液
- 5 水的组成
- 6 水资源的利用和保护
- 第2章 空气
- 1 空气的存在
- 2 空气的成分
- 3 氧气
- 4 二氧化碳
- 5 保护大气圈
- 第3章 阳光
- 1 太阳辐射能
- 2 阳光的传播
- 3 阳光的组成
- 第4章 土壤
- 1 土壤的组成和性状
- 2 土壤与植物
- 3 人类活动与土壤
- 第5章 生态系统
- 1 种群和群落
- 2 生态系统
- 3 生物圈
- 第6章 动物和人的生殖与发育
- 1 动物的生殖与发育
- 2 人的生殖与发育
- 第7章 植物和微生物的生殖与发育
- 1 绿色开花植物的有性生殖和发育
- 2 种子的萌发和幼苗形成
- 3 植物的无性生殖
- 4 细菌和真菌的繁殖
