人教版化学九下:10.1 常见的酸和碱(第2课时)学案(无答案)
文档属性
| 名称 | 人教版化学九下:10.1 常见的酸和碱(第2课时)学案(无答案) |

|
|
| 格式 | zip | ||
| 文件大小 | 93.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-18 21:00:49 | ||
图片预览


文档简介
课题1 常见的酸和碱
第2课时 常见的酸
一、学习目标
1.熟悉常见的酸——盐酸和硫酸的物理性质和用途。
2.了解浓硫酸的特性,掌握浓硫酸的稀释方法。
3.通过活动与探究,掌握酸的化学性质。
二、学习重难点
重点:酸的化学性质。
难点:浓硫酸的稀释方法。
三、学习过程
【旧知回顾】
1.酸碱指示剂(指示剂):能跟__________或__________起作用而显示不同的颜色的物质。常见的指示剂有__________和__________。
2.常见酸碱指示剂的变色规律:
紫色石蕊溶液:遇酸__________,遇碱__________;
无色酚酞溶液:遇酸__________,遇碱__________。
3.请写出有酸参与的化学反应的化学方程式。
【课堂探究】
一、几种常见的酸
浓盐酸 浓硫酸
颜色、状态
打开试剂瓶后的现象
气味
浓度
密度
用途 重要化工产品。用于金属表面____、制造药物等; 人体胃液中含有____,可以帮助消化。 重要化工原料。用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和金属除锈等。 浓硫酸有____,在实验室中常用它做____。
交流讨论:
1.浓盐酸打开瓶塞出现的是白烟还是白雾?为什么会有这样的现象出现?
2.敞口放置一段时间后的浓盐酸和浓硫酸溶质的质量分数(即溶液的浓度)会发生怎样的变化?为什么?
总结:浓盐酸和浓硫酸必须________保存,因为浓盐酸具有很强的________性,浓硫酸具有________性。
二、浓硫酸的腐蚀性
实验 放置一会儿后的现象
用玻璃棒蘸浓酸在纸上写字
用小木棍蘸少量浓硫酸
将浓酸滴到一小块布上
1.总结:浓硫酸具有强烈的_________性,它能夺取纸张、木材、布料、皮肤里的_________,生产黑色物质_________,这一特性叫作“_________”。
2.思考:
(1)浓硫酸的吸水性属于_________性质(填“物理”或“化学”,下同);
(2)脱水性、腐蚀性属于_________性质。
【练一练】(2021·门头沟模拟)下列液体在敞口的容器中放置一段时间后,溶液质量会变大的是( )
A.浓硫酸 B.浓盐酸
C.氯化钠溶液 D.澄清石灰水
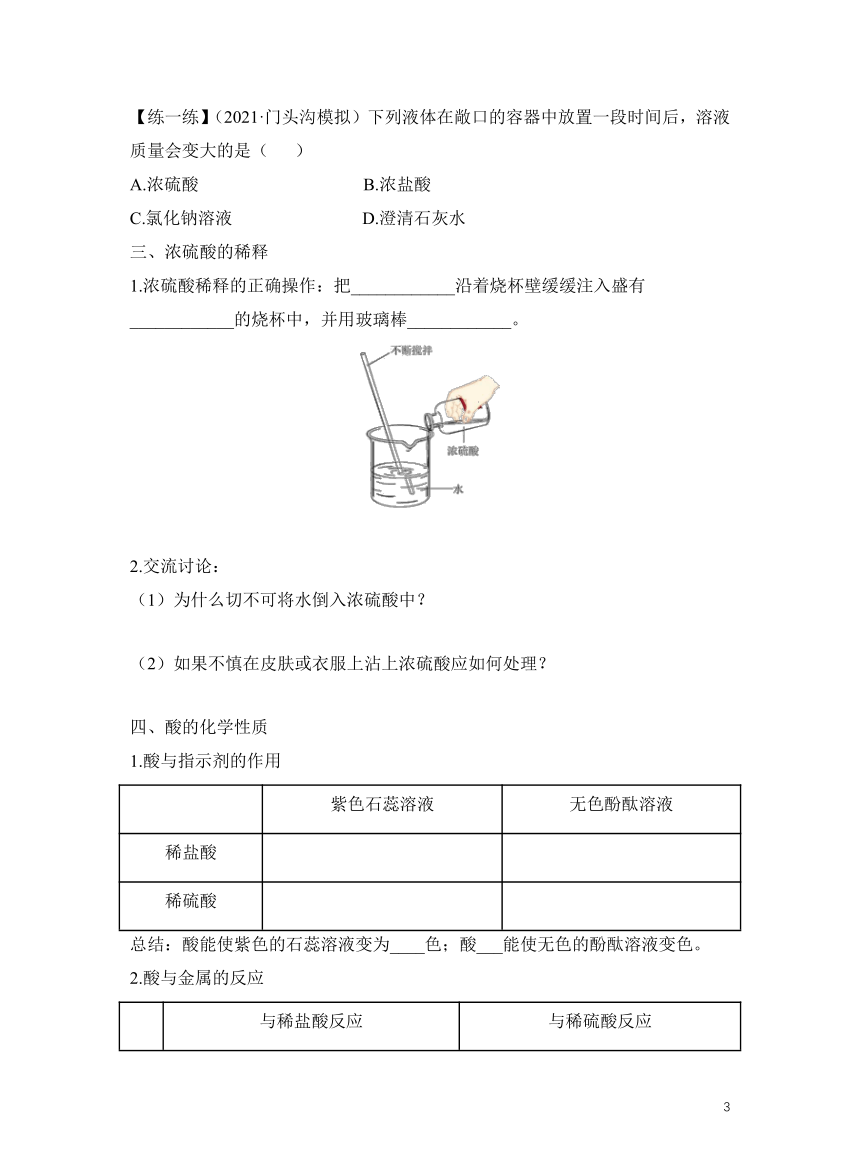
三、浓硫酸的稀释
1.浓硫酸稀释的正确操作:把____________沿着烧杯壁缓缓注入盛有____________的烧杯中,并用玻璃棒____________。
2.交流讨论:
(1)为什么切不可将水倒入浓硫酸中?
(2)如果不慎在皮肤或衣服上沾上浓硫酸应如何处理?
四、酸的化学性质
1.酸与指示剂的作用
紫色石蕊溶液 无色酚酞溶液
稀盐酸
稀硫酸
总结:酸能使紫色的石蕊溶液变为____色;酸___能使无色的酚酞溶液变色。
2.酸与金属的反应
与稀盐酸反应 与稀硫酸反应
镁
锌
铁
总结:通常情况下,酸溶液能与_________反应,生成_______和盐。
3.酸与金属氧化物的反应
现象 化学方程式
铁锈+盐酸
铁锈+硫酸
总结:酸能与某些金属氧化物反应生成水和盐。
交流讨论:利用上面的反应可以清除金属制品表面的锈,能否将生锈的铁钉长时间浸泡在酸中?为什么?
总结:酸有一些相似的化学性质
①酸能使紫色石蕊试液变红,不能使无色酚酞溶液变色;
②酸能与较活泼的金属反应生成盐和氢气;
③酸能与某些金属氧化物反应生成盐和水。
【练一练】物质的性质决定其用途。稀盐酸常用于除铁锈,是利用了酸的一种化学通性,下列酸的用途中也利用了该通性的是( )
A. 用锌粒和稀硫酸制取氢气
B. 用氧化铜和稀硫酸制备硫酸铜
C. 用稀盐酸除去氯化钠中的碳酸钠
D. 用硼酸处理皮肤上沾有的碱
【学后反思】通过本节课的学习,你收获了什么?
【测评反馈】
1.(2021·朝阳模拟)下列物质长时间暴露在空气中,质量会减少的是( )
A.木炭 B.烧碱
C.石灰石 D.浓盐酸
2.(2021·门头沟模拟)下列能与稀盐酸反应的物质是( )
A. NaCl B. CO2
C. Fe2O3 D. H2SO4
3.下列对实验现象的描述错误的是( )
A. 打开盛有浓硫酸的试剂瓶,瓶口产生大量白雾
B. 将二氧化碳通入紫色石蕊试液中,溶液变红
C. 打开盛有浓盐酸的试剂瓶,瓶口产生大量白雾
D. 镁和稀盐酸反应产生大量气泡,放出热量
4.(2021·黄石)下列实验操作正确的是( )
A. 浓硫酸稀释 B. 液体读数
C. 收集氢气 D. 熄灭酒精灯
5.(2021·杨浦模拟)利用传感器探究在密闭环境中铝片和少量稀盐酸反应过程中温度和压强的变化,结果如图。下列说法错误的是( )
A.50~100 s,压强变大是反应放出热量导致的
B.100 s时,容器内温度最高
C.100 s之后,溶液中溶质为AlCl3
D.100 s之后,压强减小是因为温度降低导致的
6.(2021·常州模拟)利用图所示实验装置对酸的化学性质进行探究。
(1)标号为①的仪器名称是________。
(2)实验Ⅰ中,在点滴板的a、b穴中滴入稀盐酸后,溶液变红的是________(填“a”“b”)。
(3)实验Ⅱ中,在仪器①、②中均可观察到的现象是________________________。仪器②中发生反应的化学方程式是________________________。
(4)用100 g溶质质量分数为10.95%的废盐酸,最多可以除去多少铁锈(以Fe2O3计)________。
1
第2课时 常见的酸
一、学习目标
1.熟悉常见的酸——盐酸和硫酸的物理性质和用途。
2.了解浓硫酸的特性,掌握浓硫酸的稀释方法。
3.通过活动与探究,掌握酸的化学性质。
二、学习重难点
重点:酸的化学性质。
难点:浓硫酸的稀释方法。
三、学习过程
【旧知回顾】
1.酸碱指示剂(指示剂):能跟__________或__________起作用而显示不同的颜色的物质。常见的指示剂有__________和__________。
2.常见酸碱指示剂的变色规律:
紫色石蕊溶液:遇酸__________,遇碱__________;
无色酚酞溶液:遇酸__________,遇碱__________。
3.请写出有酸参与的化学反应的化学方程式。
【课堂探究】
一、几种常见的酸
浓盐酸 浓硫酸
颜色、状态
打开试剂瓶后的现象
气味
浓度
密度
用途 重要化工产品。用于金属表面____、制造药物等; 人体胃液中含有____,可以帮助消化。 重要化工原料。用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和金属除锈等。 浓硫酸有____,在实验室中常用它做____。
交流讨论:
1.浓盐酸打开瓶塞出现的是白烟还是白雾?为什么会有这样的现象出现?
2.敞口放置一段时间后的浓盐酸和浓硫酸溶质的质量分数(即溶液的浓度)会发生怎样的变化?为什么?
总结:浓盐酸和浓硫酸必须________保存,因为浓盐酸具有很强的________性,浓硫酸具有________性。
二、浓硫酸的腐蚀性
实验 放置一会儿后的现象
用玻璃棒蘸浓酸在纸上写字
用小木棍蘸少量浓硫酸
将浓酸滴到一小块布上
1.总结:浓硫酸具有强烈的_________性,它能夺取纸张、木材、布料、皮肤里的_________,生产黑色物质_________,这一特性叫作“_________”。
2.思考:
(1)浓硫酸的吸水性属于_________性质(填“物理”或“化学”,下同);
(2)脱水性、腐蚀性属于_________性质。
【练一练】(2021·门头沟模拟)下列液体在敞口的容器中放置一段时间后,溶液质量会变大的是( )
A.浓硫酸 B.浓盐酸
C.氯化钠溶液 D.澄清石灰水
三、浓硫酸的稀释
1.浓硫酸稀释的正确操作:把____________沿着烧杯壁缓缓注入盛有____________的烧杯中,并用玻璃棒____________。
2.交流讨论:
(1)为什么切不可将水倒入浓硫酸中?
(2)如果不慎在皮肤或衣服上沾上浓硫酸应如何处理?
四、酸的化学性质
1.酸与指示剂的作用
紫色石蕊溶液 无色酚酞溶液
稀盐酸
稀硫酸
总结:酸能使紫色的石蕊溶液变为____色;酸___能使无色的酚酞溶液变色。
2.酸与金属的反应
与稀盐酸反应 与稀硫酸反应
镁
锌
铁
总结:通常情况下,酸溶液能与_________反应,生成_______和盐。
3.酸与金属氧化物的反应
现象 化学方程式
铁锈+盐酸
铁锈+硫酸
总结:酸能与某些金属氧化物反应生成水和盐。
交流讨论:利用上面的反应可以清除金属制品表面的锈,能否将生锈的铁钉长时间浸泡在酸中?为什么?
总结:酸有一些相似的化学性质
①酸能使紫色石蕊试液变红,不能使无色酚酞溶液变色;
②酸能与较活泼的金属反应生成盐和氢气;
③酸能与某些金属氧化物反应生成盐和水。
【练一练】物质的性质决定其用途。稀盐酸常用于除铁锈,是利用了酸的一种化学通性,下列酸的用途中也利用了该通性的是( )
A. 用锌粒和稀硫酸制取氢气
B. 用氧化铜和稀硫酸制备硫酸铜
C. 用稀盐酸除去氯化钠中的碳酸钠
D. 用硼酸处理皮肤上沾有的碱
【学后反思】通过本节课的学习,你收获了什么?
【测评反馈】
1.(2021·朝阳模拟)下列物质长时间暴露在空气中,质量会减少的是( )
A.木炭 B.烧碱
C.石灰石 D.浓盐酸
2.(2021·门头沟模拟)下列能与稀盐酸反应的物质是( )
A. NaCl B. CO2
C. Fe2O3 D. H2SO4
3.下列对实验现象的描述错误的是( )
A. 打开盛有浓硫酸的试剂瓶,瓶口产生大量白雾
B. 将二氧化碳通入紫色石蕊试液中,溶液变红
C. 打开盛有浓盐酸的试剂瓶,瓶口产生大量白雾
D. 镁和稀盐酸反应产生大量气泡,放出热量
4.(2021·黄石)下列实验操作正确的是( )
A. 浓硫酸稀释 B. 液体读数
C. 收集氢气 D. 熄灭酒精灯
5.(2021·杨浦模拟)利用传感器探究在密闭环境中铝片和少量稀盐酸反应过程中温度和压强的变化,结果如图。下列说法错误的是( )
A.50~100 s,压强变大是反应放出热量导致的
B.100 s时,容器内温度最高
C.100 s之后,溶液中溶质为AlCl3
D.100 s之后,压强减小是因为温度降低导致的
6.(2021·常州模拟)利用图所示实验装置对酸的化学性质进行探究。
(1)标号为①的仪器名称是________。
(2)实验Ⅰ中,在点滴板的a、b穴中滴入稀盐酸后,溶液变红的是________(填“a”“b”)。
(3)实验Ⅱ中,在仪器①、②中均可观察到的现象是________________________。仪器②中发生反应的化学方程式是________________________。
(4)用100 g溶质质量分数为10.95%的废盐酸,最多可以除去多少铁锈(以Fe2O3计)________。
1
同课章节目录
