化学人教版(2019)必修第二册6.1.3化学电池(共22张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册6.1.3化学电池(共22张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 25.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-19 11:00:03 | ||
图片预览






文档简介
(共22张PPT)
化学电池
第3课时
第一节 化学反应与能量变化
情景引入
电池多种多样,其实质和原理是都是通过氧化还原反应将化学能转变成电能。
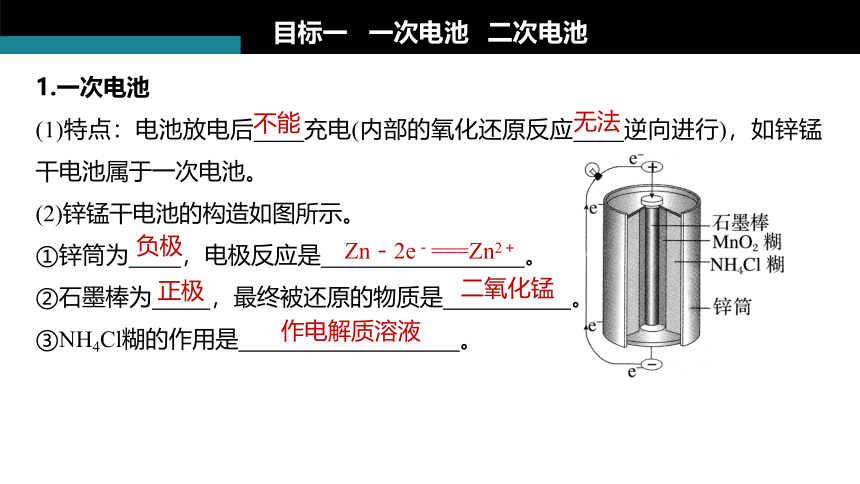
1.一次电池
(1)特点:电池放电后 充电(内部的氧化还原反应 逆向进行),如锌锰干电池属于一次电池。
(2)锌锰干电池的构造如图所示。
①锌筒为 ,电极反应是 。
②石墨棒为 ,最终被还原的物质是 。
③NH4Cl糊的作用是 。
目标一 一次电池 二次电池
不能
无法
负极
Zn-2e-===Zn2+
正极
二氧化锰
作电解质溶液
锌锰干电池在使用过程中,锌会逐渐溶解,锌外壳变薄,最后内部的糊状电解质会泄露出来,使电器腐蚀。为了延长电池寿命和提高其性能,人们将电池内的电解质NH4Cl糊换成湿的KOH,制成了碱性锌锰电池。
总反应:Zn+2MnO2+2H2O===Zn(OH)2+2MnO(OH)。
写出负极的电极反应式:____________________________。
思考1
Zn-2e-+2OH-===Zn(OH)2
2.二次电池(充电电池)
(1)特点:二次电池在放电时所进行的 ,在充电时可以 ,使电池恢复到放电前的状态,从而实现放电与充电的循环。
(3)常见的充电电池: 电池、 电池、 电池等。
氧化还原反应
逆向进行
铅酸蓄
镍氢
锂离子
铅酸蓄电池常用作汽车电瓶,其构造如图所示,工作时该电池总反应为Pb+PbO2+2H2SO4 2PbSO4+2H2O。
按要求回答下列问题:
(1)负极材料是_____,正极材料是______,电解质溶液是______。
(2)工作时,电解质溶液中的H+移向___________极。
思考2
(3)工作时,电解质溶液中硫酸的浓度_____(填“增大”“减小”或“不变”)。
Pb
PbO2
硫酸
PbO2(或正)
减小
负极每个铅原子失去2e-,就生成一个PbSO4 ,负极增加一个。
(4)当铅酸蓄电池向外电路提供2 mol电子时,理论上负极板的质量增加____ g。
96
铅酸蓄电池的电极反应:
某普通锌锰干电池的结构如图所示。下列说法正确的是
A.锌筒是原电池的正极
B.石墨电极上发生氧化反应
C.铵根离子流向石墨电极
D.电子经石墨棒沿电解质溶液流向锌筒
练习1
√
锌筒作负极
石墨棒作正极,正极上二氧化锰得电子发生还原反应
电子经导线由负极锌筒流向石墨棒
(2022·浙江舟山调研)氟离子电池是一种前景广阔的新型电池,其能量密度是目前锂电池的十倍以上。其中一种氟离子电池的工作原理为3Mg+2BiF3
3MgF2+2Bi(MgF2为难溶盐),电解质为熔融氟化物。下列说法正确的是
A.放电时,负极的电极反应式为Mg-2e-+2F-===MgF2
B.放电时,电子从镁电极流出,经电解质流向正极
C.放电时,化学能完全转化为电能
D.放电时,F-向正极移动
√
练习2
电子从镁电极流出,经导线流向正极
还有部分转化为热能等
F-向负极移动
1.概念
一种将燃料(如氢气、甲烷、乙醇)和氧化剂(如氧气)的化学能直接转化为电能的电化学反应装置。
目标二 燃料电池
与其他电池区别:
反应物不是储存在电池内。
小型高性能燃料电池
2.特点
(1)清洁、安全、高效等。
(2)能量转化率可以达到 以上。
(3)反应物不是储存在电池内部,而是从
外部提供,供电量易于调节。
3.应用
在航天、军事、交通等领域有广阔的应用
前景。
目标二 燃料电池
80%
(1)氢氧燃料电池的总反应方程式如何书写?
思考1
提示 燃料电池相当于燃料的燃烧,氢氧燃料电池的总反应为2H2+O2===2H2O。
4.氢氧燃料电池
(2)如何判断氢氧燃料电池的正、负极?
提示 分析总反应的方程式可知,氢气失电子化合价升高,在负极上反应,氧气得电子化合价降低,在正极上反应。其规律是通燃料的一极做负极,通氧气的一极做正极。
氢氧燃料电池正、负极反应如下:
电解质溶液 负极 正极
酸性(H+)
碱性(OH-)
特别提醒 在书写电极反应式时应看清溶液的酸碱性;
酸性条件下不出现OH-,碱性条件下不出现H+。
2H2-4e-===4H+
O2+4H++4e-===2H2O
2H2-4e-+4OH-===4H2O
O2+2H2O+4e-===4OH-
氢氧燃料电池在不同介质中的总反应相同,但正、负极反应与电解质溶液有关,写出导电介质为固体电解质时的正、负极反应。
思考2
介质 电池反应:2H2+O2===2H2O
负极 ________________________
正极 _________________
负极 _________________
正极 _______________________
2H2-4e-+2O2-===2H2O
O2+4e-===2O2-
2H2-4e-===4H+
O2+4H++4e-===2H2O
正误判断
(1)燃料电池是利用燃料的燃烧发电( )
(2)燃料电池中,燃料在正极上发生氧化反应( )
(3)氢氧燃料电池将热能直接转变为电能( )
(4)原电池中正极材料一定发生还原反应( )
(5)原电池中的负极反应一定是电极材料失电子( )
练习1
×
×
×
×
×
(2022·江西新余第一中学高一期末)国家电投氢能公司全自主研发的“氢腾”燃料电池系统广泛应用于氢能大巴。某种氢燃料电池的内部结构如图,下列说法正确的是
练习2
A.电池工作时,电解质溶液中的H+向b极移动
B.a极发生的电极反应为H2+2e-+2OH-===2H2O
C.b极为正极,发生氧化反应
D.当外电路有1 mol电子转移时,b极消耗5.6 L O2
√
H2-2e-===2H+
发生还原反应
未说明是否是标准状况
课堂小结
化学电池
干电池
(一次电池)
充电电池(二次电池)
燃料电池
碱性锌锰电池
铅蓄电池(Pb-PbO2-H2SO4)
氢氧燃料电池
锂离子电池
镍氢电池
普通锌锰干电池
甲烷燃料电池
1
2
3
自我测试
1.下列电池工作时,O2在正极得电子的是
4
A B C D
锌锰干电池 铅酸蓄电池 氢氧燃料电池 镍镉电池
√
2.镍氢电池是可充电电池,它的总反应是 H2+NiO(OH)===Ni(OH)2,根据此反应判断,下列说法正确的是
A.电池放电时,电池负极周围溶液的碱性不断增大
B.电池放电时,镍元素被氧化
C.电池放电时,氢元素被还原
D.电池放电时,通入H2的一极是负极
自我测试
1
2
3
√
4
负极反应式为H2-2e-+2OH-===2H2O
正极反应式为NiO(OH)+H2O+e-===OH-+Ni(OH)2
自我测试
1
2
3
3.(2022·黑龙江大庆中学高一期中)纽扣电池可作计算器、电子表等的电源。有一种纽扣电池,其电极分别为Zn和Ag2O,用KOH溶液作电解质溶液,电池的总反应为Zn+Ag2O===2Ag+ZnO。关于该电池下列叙述不正确的是
A.电池的正极发生还原反应
B.Zn为负极,发生氧化反应,反应过程中失去电子
C.电池工作时,电解质溶液中的阳离子移向正极
D.电池使用时,电子由Zn极经电解质溶液流向Ag2O极
4
√
牢记:电子不下水,离子不上岸
自我测试
1
2
3
4.燃料电池是燃料(如CO、H2、CH4等)跟氧气(或空气)起反应将化学能转变为电能的装置,若电解质溶液是强碱溶液,下面关于甲烷燃料电池的说法正确的是
A.负极反应式:O2+2H2O+4e-===4OH-
B.负极反应式:CH4+8OH--8e-===CO2+6H2O
C.随着放电的进行,溶液的OH-浓度不变
D.放电时溶液中的阴离子向负极移动
4
√
为正极反应式
CO2不可能从强碱溶液中逸出,它将进一步反应转化成
部分碱和二氧化碳反应,溶液的c(OH-)将减小
化学电池
第3课时
第一节 化学反应与能量变化
情景引入
电池多种多样,其实质和原理是都是通过氧化还原反应将化学能转变成电能。
1.一次电池
(1)特点:电池放电后 充电(内部的氧化还原反应 逆向进行),如锌锰干电池属于一次电池。
(2)锌锰干电池的构造如图所示。
①锌筒为 ,电极反应是 。
②石墨棒为 ,最终被还原的物质是 。
③NH4Cl糊的作用是 。
目标一 一次电池 二次电池
不能
无法
负极
Zn-2e-===Zn2+
正极
二氧化锰
作电解质溶液
锌锰干电池在使用过程中,锌会逐渐溶解,锌外壳变薄,最后内部的糊状电解质会泄露出来,使电器腐蚀。为了延长电池寿命和提高其性能,人们将电池内的电解质NH4Cl糊换成湿的KOH,制成了碱性锌锰电池。
总反应:Zn+2MnO2+2H2O===Zn(OH)2+2MnO(OH)。
写出负极的电极反应式:____________________________。
思考1
Zn-2e-+2OH-===Zn(OH)2
2.二次电池(充电电池)
(1)特点:二次电池在放电时所进行的 ,在充电时可以 ,使电池恢复到放电前的状态,从而实现放电与充电的循环。
(3)常见的充电电池: 电池、 电池、 电池等。
氧化还原反应
逆向进行
铅酸蓄
镍氢
锂离子
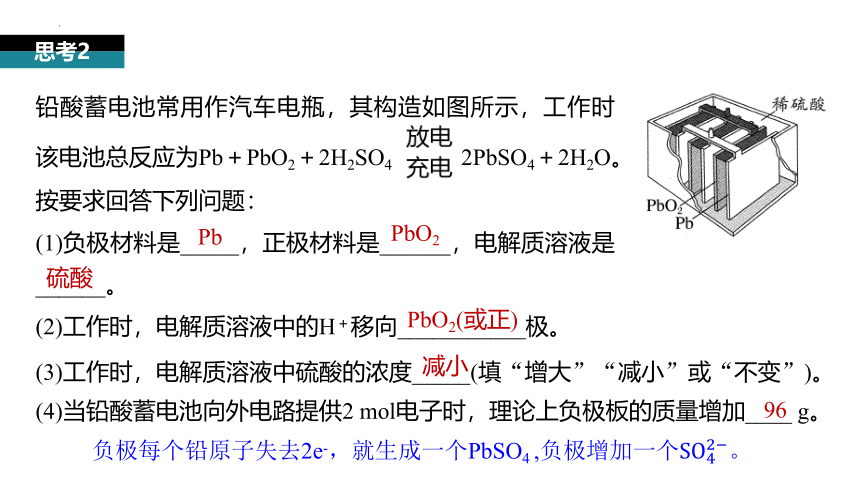
铅酸蓄电池常用作汽车电瓶,其构造如图所示,工作时该电池总反应为Pb+PbO2+2H2SO4 2PbSO4+2H2O。
按要求回答下列问题:
(1)负极材料是_____,正极材料是______,电解质溶液是______。
(2)工作时,电解质溶液中的H+移向___________极。
思考2
(3)工作时,电解质溶液中硫酸的浓度_____(填“增大”“减小”或“不变”)。
Pb
PbO2
硫酸
PbO2(或正)
减小
负极每个铅原子失去2e-,就生成一个PbSO4 ,负极增加一个。
(4)当铅酸蓄电池向外电路提供2 mol电子时,理论上负极板的质量增加____ g。
96
铅酸蓄电池的电极反应:
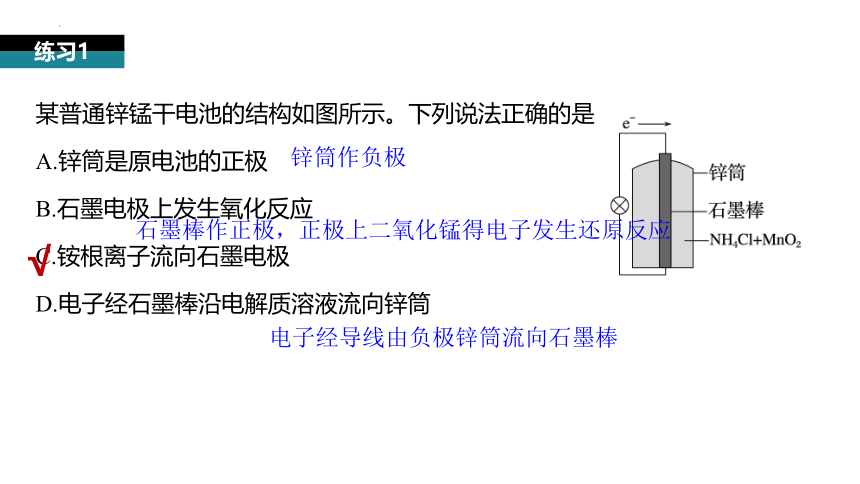
某普通锌锰干电池的结构如图所示。下列说法正确的是
A.锌筒是原电池的正极
B.石墨电极上发生氧化反应
C.铵根离子流向石墨电极
D.电子经石墨棒沿电解质溶液流向锌筒
练习1
√
锌筒作负极
石墨棒作正极,正极上二氧化锰得电子发生还原反应
电子经导线由负极锌筒流向石墨棒
(2022·浙江舟山调研)氟离子电池是一种前景广阔的新型电池,其能量密度是目前锂电池的十倍以上。其中一种氟离子电池的工作原理为3Mg+2BiF3
3MgF2+2Bi(MgF2为难溶盐),电解质为熔融氟化物。下列说法正确的是
A.放电时,负极的电极反应式为Mg-2e-+2F-===MgF2
B.放电时,电子从镁电极流出,经电解质流向正极
C.放电时,化学能完全转化为电能
D.放电时,F-向正极移动
√
练习2
电子从镁电极流出,经导线流向正极
还有部分转化为热能等
F-向负极移动
1.概念
一种将燃料(如氢气、甲烷、乙醇)和氧化剂(如氧气)的化学能直接转化为电能的电化学反应装置。
目标二 燃料电池
与其他电池区别:
反应物不是储存在电池内。
小型高性能燃料电池
2.特点
(1)清洁、安全、高效等。
(2)能量转化率可以达到 以上。
(3)反应物不是储存在电池内部,而是从
外部提供,供电量易于调节。
3.应用
在航天、军事、交通等领域有广阔的应用
前景。
目标二 燃料电池
80%
(1)氢氧燃料电池的总反应方程式如何书写?
思考1
提示 燃料电池相当于燃料的燃烧,氢氧燃料电池的总反应为2H2+O2===2H2O。
4.氢氧燃料电池
(2)如何判断氢氧燃料电池的正、负极?
提示 分析总反应的方程式可知,氢气失电子化合价升高,在负极上反应,氧气得电子化合价降低,在正极上反应。其规律是通燃料的一极做负极,通氧气的一极做正极。
氢氧燃料电池正、负极反应如下:
电解质溶液 负极 正极
酸性(H+)
碱性(OH-)
特别提醒 在书写电极反应式时应看清溶液的酸碱性;
酸性条件下不出现OH-,碱性条件下不出现H+。
2H2-4e-===4H+
O2+4H++4e-===2H2O
2H2-4e-+4OH-===4H2O
O2+2H2O+4e-===4OH-
氢氧燃料电池在不同介质中的总反应相同,但正、负极反应与电解质溶液有关,写出导电介质为固体电解质时的正、负极反应。
思考2
介质 电池反应:2H2+O2===2H2O
负极 ________________________
正极 _________________
负极 _________________
正极 _______________________
2H2-4e-+2O2-===2H2O
O2+4e-===2O2-
2H2-4e-===4H+
O2+4H++4e-===2H2O
正误判断
(1)燃料电池是利用燃料的燃烧发电( )
(2)燃料电池中,燃料在正极上发生氧化反应( )
(3)氢氧燃料电池将热能直接转变为电能( )
(4)原电池中正极材料一定发生还原反应( )
(5)原电池中的负极反应一定是电极材料失电子( )
练习1
×
×
×
×
×
(2022·江西新余第一中学高一期末)国家电投氢能公司全自主研发的“氢腾”燃料电池系统广泛应用于氢能大巴。某种氢燃料电池的内部结构如图,下列说法正确的是
练习2
A.电池工作时,电解质溶液中的H+向b极移动
B.a极发生的电极反应为H2+2e-+2OH-===2H2O
C.b极为正极,发生氧化反应
D.当外电路有1 mol电子转移时,b极消耗5.6 L O2
√
H2-2e-===2H+
发生还原反应
未说明是否是标准状况
课堂小结
化学电池
干电池
(一次电池)
充电电池(二次电池)
燃料电池
碱性锌锰电池
铅蓄电池(Pb-PbO2-H2SO4)
氢氧燃料电池
锂离子电池
镍氢电池
普通锌锰干电池
甲烷燃料电池
1
2
3
自我测试
1.下列电池工作时,O2在正极得电子的是
4
A B C D
锌锰干电池 铅酸蓄电池 氢氧燃料电池 镍镉电池
√
2.镍氢电池是可充电电池,它的总反应是 H2+NiO(OH)===Ni(OH)2,根据此反应判断,下列说法正确的是
A.电池放电时,电池负极周围溶液的碱性不断增大
B.电池放电时,镍元素被氧化
C.电池放电时,氢元素被还原
D.电池放电时,通入H2的一极是负极
自我测试
1
2
3
√
4
负极反应式为H2-2e-+2OH-===2H2O
正极反应式为NiO(OH)+H2O+e-===OH-+Ni(OH)2
自我测试
1
2
3
3.(2022·黑龙江大庆中学高一期中)纽扣电池可作计算器、电子表等的电源。有一种纽扣电池,其电极分别为Zn和Ag2O,用KOH溶液作电解质溶液,电池的总反应为Zn+Ag2O===2Ag+ZnO。关于该电池下列叙述不正确的是
A.电池的正极发生还原反应
B.Zn为负极,发生氧化反应,反应过程中失去电子
C.电池工作时,电解质溶液中的阳离子移向正极
D.电池使用时,电子由Zn极经电解质溶液流向Ag2O极
4
√
牢记:电子不下水,离子不上岸
自我测试
1
2
3
4.燃料电池是燃料(如CO、H2、CH4等)跟氧气(或空气)起反应将化学能转变为电能的装置,若电解质溶液是强碱溶液,下面关于甲烷燃料电池的说法正确的是
A.负极反应式:O2+2H2O+4e-===4OH-
B.负极反应式:CH4+8OH--8e-===CO2+6H2O
C.随着放电的进行,溶液的OH-浓度不变
D.放电时溶液中的阴离子向负极移动
4
√
为正极反应式
CO2不可能从强碱溶液中逸出,它将进一步反应转化成
部分碱和二氧化碳反应,溶液的c(OH-)将减小
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
