化学人教版(2019)必修第二册6.2.1化学反应的速率(共29张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册6.2.1化学反应的速率(共29张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 25.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-19 11:00:34 | ||
图片预览






文档简介
(共29张PPT)
第二节 化学反应的速率与限度
第1课时
化学反应的速率
情境导入
很快
较快
较慢
很慢
在化学实验和日常生活中,我们经常观察到这样的现象:
核弹爆炸
钢铁生锈
溶洞形成
牛奶变质
如何定量描述一个化学反应的快慢?今天,我们就一起来学习
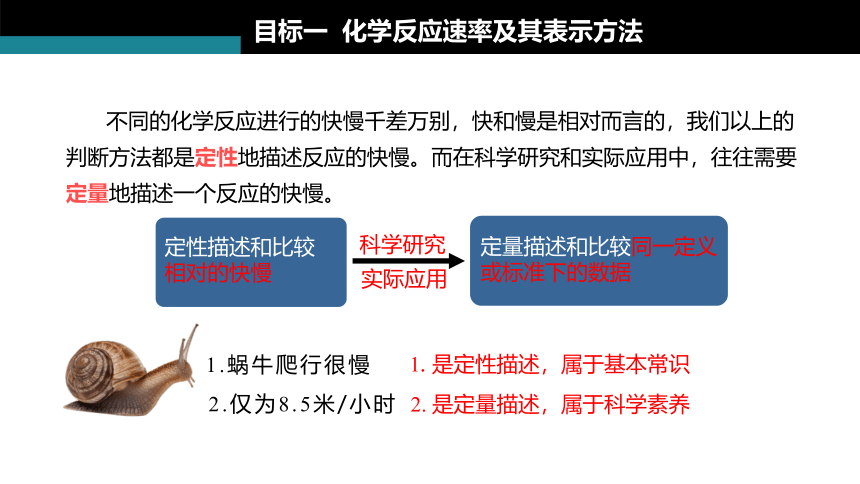
目标一 化学反应速率及其表示方法
定性描述和比较
相对的快慢
科学研究
实际应用
定量描述和比较同一定义或标准下的数据
2. 是定量描述,属于科学素养
不同的化学反应进行的快慢千差万别,快和慢是相对而言的,我们以上的判断方法都是定性地描述反应的快慢。而在科学研究和实际应用中,往往需要定量地描述一个反应的快慢。
2.仅为8.5米/小时
1.蜗牛爬行很慢
1. 是定性描述,属于基本常识
1. 概念
用来衡量化学反应过程进行快慢程度的物理量
2. 表示方法
通常用单位时间内反应物浓度的减小或生成物浓度的增大来表示(取正值)
3. 定义式
4. 常用单位
v=或v=
mol· L-1·s-1或mol· L-1·min-1
化学反应速率
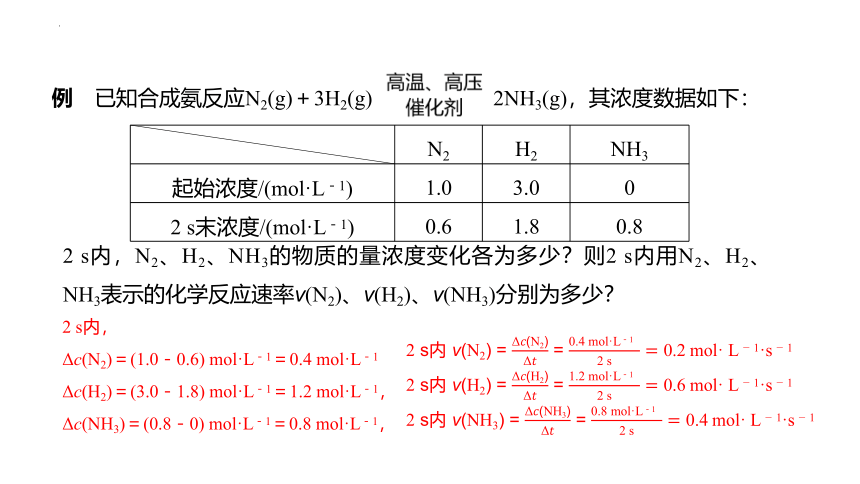
例 已知合成氨反应N2(g)+3H2(g) 2NH3(g),其浓度数据如下:
N2 H2 NH3
起始浓度/(mol·L-1) 1.0 3.0 0
2 s末浓度/(mol·L-1) 0.6 1.8 0.8
2 s内,N2、H2、NH3的物质的量浓度变化各为多少?则2 s内用N2、H2、NH3表示的化学反应速率v(N2)、v(H2)、v(NH3)分别为多少?
2 s内,
Δc(N2)=(1.0-0.6) mol·L-1=0.4 mol·L-1
Δc(H2)=(3.0-1.8) mol·L-1=1.2 mol·L-1,
Δc(NH3)=(0.8-0) mol·L-1=0.8 mol·L-1,
2 s内 v(N2) = =
2 s内 v(H2) = =
2 s内 v(NH3) = =
思考
根据上述计算:同一反应在相同时间内,用不同物质表示的反应速率,其数值是否相同?表示的反应快慢是否相同?用不同物质表示同一反应的反应速率其数值有什么规律?
提示 同一反应在相同时间内,用不同物质表示的反应速率,其数值可能不同,但都表示该反应的反应速率,意义相同;用不同物质表示化学反应速率时,化学反应速率之比等于其化学计量数之比。
练习1
正误判断
(1)对于任何化学反应来说,反应速率越大,反应现象就越明显( )
(2)对有固体参加的化学反应,可用单位时间内固体浓度的改变量表示化学反应速率( )
(3)化学反应速率的单位通常为mol·s-1或mol·min-1( )
(4)反应速率是指某反应在某时刻的瞬时速率( )
×
×
×
×
一般固体或纯液体浓度为常数, Δc为0,不表示速率
某一时间段内的平均速率
练习2
已知反应4CO(g)+2NO2(g) N2(g)+4CO2(g)在不同条件下的化学反应
速率如下:
①v(CO)=1.5 mol·L-1·min-1 ②v(NO2)=0.01 mol·L-1·s-1
③v(N2)=0.4 mol·L-1·min-1 ④v(CO2)=1.1 mol·L-1·min-1
请比较上述4种情况反应的快慢:___________(由大到小的顺序)。
③①②④
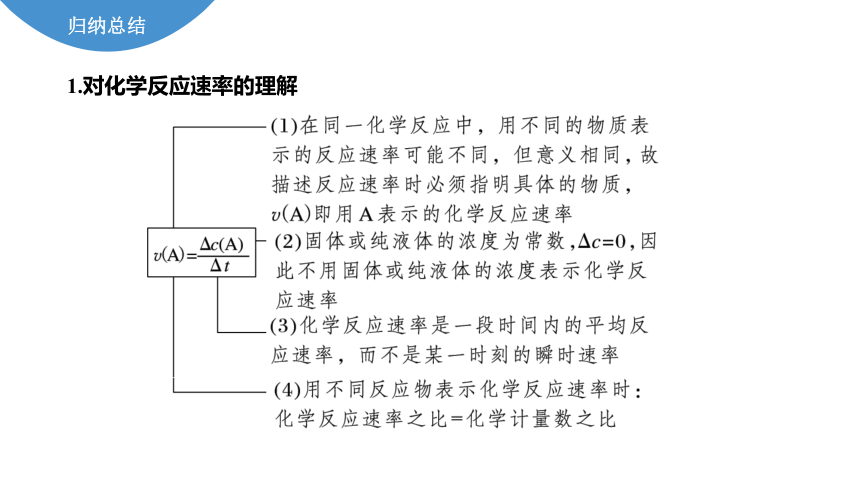
归纳总结
1.对化学反应速率的理解
归纳总结
(1)归一法:若单位不统一,则要换算成相同的单位;若为不同物质表示的反应速率,则要换算成同一物质来表示反应速率;再比较数值的大小。
(2)比值法:比较化学反应速率与化学计量数的比值,如
aA(g)+bB(g)=== cC(g)+dD(g),比较与,若,则说明用A表示的化学反应速率大于用B表示的化学反应速率。
2. 化学反应速率大小的比较方法
过渡
对于下列反应,我们希望它反应速率是快还是慢呢
食物变质
橡胶老化
炼钢
工业合成氨
慢
慢
快
快
如果能人为控制化学反应速率,将对化学实验和化工生产有着重大的意义。
目标二 影响化学反应速率的因素
1. 影响化学反应速率的因素
(1)内因
不同的金属和冷水反应,剧烈程度不同,这意味着 是决定化学反应速率的主要因素。
物质自身的性质
知识回顾:比较金属和水的反应
钠和冷水反应 ;
镁和冷水反应 ;
铝和冷水、热水都 。
剧烈
缓慢
不反应
蜂窝煤比普通煤块燃烧效率更高
影响速率的因素为________________
1. 影响化学反应速率的因素
(2)外因
食物直接暴露在常温空气中易变质,用冰箱保存延长其保质期
影响速率的因素为___________
温度
固体的表面积
使用酵母来加速面团的发酵
影响速率的因素为_________
腌制咸鸭蛋,泥土中的盐分越高,咸鸭蛋成熟得越快
影响速率的因素为_________
催化剂
浓度
2. 实验探究——外界条件对化学反应速率的影响
探究温度、浓度、催化剂对化学反应速率的影响
实验现象 实验结论
冷水中: 热水中: 对于反应2H2O2 2H2O+O2↑来说,温度升高,H2O2的分解速率 。
产生气泡速率较慢
产生气泡速率较快
加快
方法引导——控制变量方法
对于多因素的问题,常常采用只改变其中某一个因素,控制其它因素不变的研究方法,把多因素问题变成单因素问题。
探究温度、浓度、催化剂对化学反应速率的影响
实验现象 实验结论
滴加1 mol·L-1盐酸的试管产生气泡速率更快
增大反应物盐酸的浓度,生成CO2的速率加快
探究温度、浓度、催化剂对化学反应速率的影响
实验现象 实验结论
无MnO2: 有MnO2:
无明显现象
能产生大量气泡
MnO2可以使H2O2的分解速率加快
思考1
提示 有气体参加的反应,增大压强,容器的体积缩小,浓度增大,化学反应速率加快。
在1 L密闭容器中充入一定量的N2和H2,在一定的温度和压强下反应生成氨气。当使容器的体积缩小时,化学反应的速率会发生如何变化?
归纳总结
影响化学反应速率的因素
(1)内因:反应物本身的性质 (主要因素)
(2)外因(控制变量法:其他条件不变,只改变一个条件)
影响因素 如何影响
浓度
压强
温度
催化剂
其他因素
增大反应物的浓度,化学反应速率增大,反之减小
对于有气体参加的反应,在相同温度下,增大压强,化学反应速率增大,反之减小
升高温度,化学反应速率增大,反之减小
固体反应物的表面积、光波、电磁波、溶剂等
使用催化剂,能改变化学反应速率
下列现象体现了哪些影响化学反应速率的因素?
(1)向炉膛内鼓风,用煤粉代替煤块可以使炉火更旺。
鼓风: ;煤粉代替煤块: 。
(2)把食品存放到冰箱内,糕点包装内放除氧剂可以延长食品保质期。
冰箱: ;除氧剂: 。
(3)利用H2O2分解制氧气时加入固体MnO2 。
固体MnO2: 。
(4)铁在空气中和在纯氧中反应的剧烈程度明显不同。
纯氧: 。
思考2
增大氧气浓度
增大反应物的接触面积
降温
降低反应物的浓度
催化剂
纯氧的氧气浓度更大
判断正误
(1)无论是吸热反应还是放热反应,温度升高,反应速率一定增大( )
(2)对一定条件下发生的反应:C(s)+O2(g)===CO2(g),增加C的量,化学反应速率加快( )
(3)改变压强,化学反应速率一定改变( )
(4)铁和硫酸反应时,硫酸浓度越大,产生H2的速率越大( )
(5)增加水的量,能使Mg与H2O的反应速率大于Na与H2O的反应速率( )
(6)Fe与盐酸反应时,加入NaCl固体,由于c(Cl-)增大而使反应速率加快( )
练习1
√
×
×
×
×
×
在带有活塞的密闭容器中发生如下反应:3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g),分析改变下列条件,化学反应速率如何改变(填“变大”“变小”或“不变”),阐述理由:
(1)增加铁片的质量(不考虑表面积的变化):_____,理由:________________
____________________________________。
(2)保持容器的体积不变,增加水蒸气的通入量:______,理由:___________
______________________。
(3)保持容器内压强不变,充入一定量的氩气:______,理由:_____________
___________________________________________________________________。
(4)保持容器的容积不变,充入一定量的氩气:______,理由:_____________
_________________________________________________________________。
练习2
不变
纯固体的浓度视
为常数,改变用量不影响化学反应速率
变大
增大反应物
浓度加快化学反应速率
变小
保持压强不
变,充入氩气,容器体积增大,水蒸气的浓度变小,因而化学反应速率变小
不变
容器的容积不
变,充入氩气,反应物和生成物的浓度均不改变,因而化学反应速率不变
归纳总结
对于有气体物质参加的反应,改变反应体系的压强,对化学反应速率的影响常有以下几种情况:
①恒温时,增大压强容积减小浓度增大化学反应速率增大。
②恒温恒容时,充入气体反应物总压强增大浓度增大化学反应速率增大。
③恒温恒容时,充入“惰性气体”总压强增大,但各物质的浓度不发生变化,所以化学反应速率不变。
④恒温恒压时,充入“惰性气体”容器容积增大浓度减小化学反应速率减小。
指不参与反应的气体
课堂总结
化学反应速率
外因
温度
浓度
催化剂
接触面积
压强(气体)
影响因素
内因:
反应物本身的性质
概念
单位:
公式:
mol· L-1·s-1或mol· L-1·min-1
v=或v=
1
2
3
自我测试
1.(2022·连云港锦屏高级中学高一期中)对于反应4NH3(g)+5O2(g)===4NO(g)+6H2O(g),下列反应速率的关系正确的是( )
D
自我测试
1
2
2.为了探究温度对化学反应速率的影响,下列实验方案可行的是( )
D
没有对比实验
催化剂不同,温度不同,无法比较
前者没有催化剂,后者有催化剂,无法比较
只有温度不同
3
(1)由图像可知0~A、A~B、B~C段的反应速率最大的是_______。1 min后A~B段反应速率逐渐加快,除产物可能有催化作用外,其主要原因还有:__
______________________________________________________。2 min后B~C段反应速率又逐渐变慢的原因是_______________________________________
____________________________________________________________________。
自我测试
1
2
3
3.(2022·河北邯郸高一期中)某学生用纯净的Cu与50 mL过量浓HNO3反应制取NO2 (不考虑NO气体的影响),实验结果如图所示(气体体积均为标准状况下测定,且忽略溶液体积变化)。回答下列问题:
A~B
该
反应是放热反应,1 min后溶液温度明显升高,反应速率加快
2 min后反应物硝酸浓度的减小成为影响反应
速率的主要原因,反应物浓度逐渐减小,反应速率逐渐变慢
自我测试
1
2
3.(2022·河北邯郸高一期中)某学生用纯净的Cu与50 mL过量浓HNO3反应制取NO2 (不考虑NO气体的影响),实验结果如图所示(气体体积均为标准状况下测定,且忽略溶液体积变化)。回答下列问题:
(2)计算在1~3 min内的反应速率: v(H+)=____________ mol·L-1·min-1。
0.225
1~3 min内生成的V(NO2)=252 mL,n(NO2)=0.011 25 mol,由离子方程式可知n(H+)=2n(NO2)=0.022 5 mol,v(H+)==0.225 mol·L-1·min-1。
3
自我测试
1
2
3.(2022·河北邯郸高一期中)某学生用纯净的Cu与50 mL过量浓HNO3反应制取NO2 (不考虑NO气体的影响),实验结果如图所示(气体体积均为标准状况下测定,且忽略溶液体积变化)。回答下列问题:
(3)若开始向反应溶液中加入固体KNO3,则1 min时测得V(NO2)________(填“大于”“小于”“等于”或“不确定”)84 mL。
(4)下列措施不能加快v(NO2)的是________。
A.使用Cu粉代替Cu块 B.使用含有石墨的粗铜代替纯铜
C.使用稀硝酸代替浓硝酸 D.在硝酸中加入少量浓硫酸
大于
C
硝酸根离子浓度增大,反应速率加快
接触面积增大
构成原电池
反应产生NO
H+的浓度增大
3
第二节 化学反应的速率与限度
第1课时
化学反应的速率
情境导入
很快
较快
较慢
很慢
在化学实验和日常生活中,我们经常观察到这样的现象:
核弹爆炸
钢铁生锈
溶洞形成
牛奶变质
如何定量描述一个化学反应的快慢?今天,我们就一起来学习
目标一 化学反应速率及其表示方法
定性描述和比较
相对的快慢
科学研究
实际应用
定量描述和比较同一定义或标准下的数据
2. 是定量描述,属于科学素养
不同的化学反应进行的快慢千差万别,快和慢是相对而言的,我们以上的判断方法都是定性地描述反应的快慢。而在科学研究和实际应用中,往往需要定量地描述一个反应的快慢。
2.仅为8.5米/小时
1.蜗牛爬行很慢
1. 是定性描述,属于基本常识
1. 概念
用来衡量化学反应过程进行快慢程度的物理量
2. 表示方法
通常用单位时间内反应物浓度的减小或生成物浓度的增大来表示(取正值)
3. 定义式
4. 常用单位
v=或v=
mol· L-1·s-1或mol· L-1·min-1
化学反应速率
例 已知合成氨反应N2(g)+3H2(g) 2NH3(g),其浓度数据如下:
N2 H2 NH3
起始浓度/(mol·L-1) 1.0 3.0 0
2 s末浓度/(mol·L-1) 0.6 1.8 0.8
2 s内,N2、H2、NH3的物质的量浓度变化各为多少?则2 s内用N2、H2、NH3表示的化学反应速率v(N2)、v(H2)、v(NH3)分别为多少?
2 s内,
Δc(N2)=(1.0-0.6) mol·L-1=0.4 mol·L-1
Δc(H2)=(3.0-1.8) mol·L-1=1.2 mol·L-1,
Δc(NH3)=(0.8-0) mol·L-1=0.8 mol·L-1,
2 s内 v(N2) = =
2 s内 v(H2) = =
2 s内 v(NH3) = =
思考
根据上述计算:同一反应在相同时间内,用不同物质表示的反应速率,其数值是否相同?表示的反应快慢是否相同?用不同物质表示同一反应的反应速率其数值有什么规律?
提示 同一反应在相同时间内,用不同物质表示的反应速率,其数值可能不同,但都表示该反应的反应速率,意义相同;用不同物质表示化学反应速率时,化学反应速率之比等于其化学计量数之比。
练习1
正误判断
(1)对于任何化学反应来说,反应速率越大,反应现象就越明显( )
(2)对有固体参加的化学反应,可用单位时间内固体浓度的改变量表示化学反应速率( )
(3)化学反应速率的单位通常为mol·s-1或mol·min-1( )
(4)反应速率是指某反应在某时刻的瞬时速率( )
×
×
×
×
一般固体或纯液体浓度为常数, Δc为0,不表示速率
某一时间段内的平均速率
练习2
已知反应4CO(g)+2NO2(g) N2(g)+4CO2(g)在不同条件下的化学反应
速率如下:
①v(CO)=1.5 mol·L-1·min-1 ②v(NO2)=0.01 mol·L-1·s-1
③v(N2)=0.4 mol·L-1·min-1 ④v(CO2)=1.1 mol·L-1·min-1
请比较上述4种情况反应的快慢:___________(由大到小的顺序)。
③①②④
归纳总结
1.对化学反应速率的理解
归纳总结
(1)归一法:若单位不统一,则要换算成相同的单位;若为不同物质表示的反应速率,则要换算成同一物质来表示反应速率;再比较数值的大小。
(2)比值法:比较化学反应速率与化学计量数的比值,如
aA(g)+bB(g)=== cC(g)+dD(g),比较与,若,则说明用A表示的化学反应速率大于用B表示的化学反应速率。
2. 化学反应速率大小的比较方法
过渡
对于下列反应,我们希望它反应速率是快还是慢呢
食物变质
橡胶老化
炼钢
工业合成氨
慢
慢
快
快
如果能人为控制化学反应速率,将对化学实验和化工生产有着重大的意义。
目标二 影响化学反应速率的因素
1. 影响化学反应速率的因素
(1)内因
不同的金属和冷水反应,剧烈程度不同,这意味着 是决定化学反应速率的主要因素。
物质自身的性质
知识回顾:比较金属和水的反应
钠和冷水反应 ;
镁和冷水反应 ;
铝和冷水、热水都 。
剧烈
缓慢
不反应
蜂窝煤比普通煤块燃烧效率更高
影响速率的因素为________________
1. 影响化学反应速率的因素
(2)外因
食物直接暴露在常温空气中易变质,用冰箱保存延长其保质期
影响速率的因素为___________
温度
固体的表面积
使用酵母来加速面团的发酵
影响速率的因素为_________
腌制咸鸭蛋,泥土中的盐分越高,咸鸭蛋成熟得越快
影响速率的因素为_________
催化剂
浓度
2. 实验探究——外界条件对化学反应速率的影响
探究温度、浓度、催化剂对化学反应速率的影响
实验现象 实验结论
冷水中: 热水中: 对于反应2H2O2 2H2O+O2↑来说,温度升高,H2O2的分解速率 。
产生气泡速率较慢
产生气泡速率较快
加快
方法引导——控制变量方法
对于多因素的问题,常常采用只改变其中某一个因素,控制其它因素不变的研究方法,把多因素问题变成单因素问题。
探究温度、浓度、催化剂对化学反应速率的影响
实验现象 实验结论
滴加1 mol·L-1盐酸的试管产生气泡速率更快
增大反应物盐酸的浓度,生成CO2的速率加快
探究温度、浓度、催化剂对化学反应速率的影响
实验现象 实验结论
无MnO2: 有MnO2:
无明显现象
能产生大量气泡
MnO2可以使H2O2的分解速率加快
思考1
提示 有气体参加的反应,增大压强,容器的体积缩小,浓度增大,化学反应速率加快。
在1 L密闭容器中充入一定量的N2和H2,在一定的温度和压强下反应生成氨气。当使容器的体积缩小时,化学反应的速率会发生如何变化?
归纳总结
影响化学反应速率的因素
(1)内因:反应物本身的性质 (主要因素)
(2)外因(控制变量法:其他条件不变,只改变一个条件)
影响因素 如何影响
浓度
压强
温度
催化剂
其他因素
增大反应物的浓度,化学反应速率增大,反之减小
对于有气体参加的反应,在相同温度下,增大压强,化学反应速率增大,反之减小
升高温度,化学反应速率增大,反之减小
固体反应物的表面积、光波、电磁波、溶剂等
使用催化剂,能改变化学反应速率
下列现象体现了哪些影响化学反应速率的因素?
(1)向炉膛内鼓风,用煤粉代替煤块可以使炉火更旺。
鼓风: ;煤粉代替煤块: 。
(2)把食品存放到冰箱内,糕点包装内放除氧剂可以延长食品保质期。
冰箱: ;除氧剂: 。
(3)利用H2O2分解制氧气时加入固体MnO2 。
固体MnO2: 。
(4)铁在空气中和在纯氧中反应的剧烈程度明显不同。
纯氧: 。
思考2
增大氧气浓度
增大反应物的接触面积
降温
降低反应物的浓度
催化剂
纯氧的氧气浓度更大
判断正误
(1)无论是吸热反应还是放热反应,温度升高,反应速率一定增大( )
(2)对一定条件下发生的反应:C(s)+O2(g)===CO2(g),增加C的量,化学反应速率加快( )
(3)改变压强,化学反应速率一定改变( )
(4)铁和硫酸反应时,硫酸浓度越大,产生H2的速率越大( )
(5)增加水的量,能使Mg与H2O的反应速率大于Na与H2O的反应速率( )
(6)Fe与盐酸反应时,加入NaCl固体,由于c(Cl-)增大而使反应速率加快( )
练习1
√
×
×
×
×
×
在带有活塞的密闭容器中发生如下反应:3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g),分析改变下列条件,化学反应速率如何改变(填“变大”“变小”或“不变”),阐述理由:
(1)增加铁片的质量(不考虑表面积的变化):_____,理由:________________
____________________________________。
(2)保持容器的体积不变,增加水蒸气的通入量:______,理由:___________
______________________。
(3)保持容器内压强不变,充入一定量的氩气:______,理由:_____________
___________________________________________________________________。
(4)保持容器的容积不变,充入一定量的氩气:______,理由:_____________
_________________________________________________________________。
练习2
不变
纯固体的浓度视
为常数,改变用量不影响化学反应速率
变大
增大反应物
浓度加快化学反应速率
变小
保持压强不
变,充入氩气,容器体积增大,水蒸气的浓度变小,因而化学反应速率变小
不变
容器的容积不
变,充入氩气,反应物和生成物的浓度均不改变,因而化学反应速率不变
归纳总结
对于有气体物质参加的反应,改变反应体系的压强,对化学反应速率的影响常有以下几种情况:
①恒温时,增大压强容积减小浓度增大化学反应速率增大。
②恒温恒容时,充入气体反应物总压强增大浓度增大化学反应速率增大。
③恒温恒容时,充入“惰性气体”总压强增大,但各物质的浓度不发生变化,所以化学反应速率不变。
④恒温恒压时,充入“惰性气体”容器容积增大浓度减小化学反应速率减小。
指不参与反应的气体
课堂总结
化学反应速率
外因
温度
浓度
催化剂
接触面积
压强(气体)
影响因素
内因:
反应物本身的性质
概念
单位:
公式:
mol· L-1·s-1或mol· L-1·min-1
v=或v=
1
2
3
自我测试
1.(2022·连云港锦屏高级中学高一期中)对于反应4NH3(g)+5O2(g)===4NO(g)+6H2O(g),下列反应速率的关系正确的是( )
D
自我测试
1
2
2.为了探究温度对化学反应速率的影响,下列实验方案可行的是( )
D
没有对比实验
催化剂不同,温度不同,无法比较
前者没有催化剂,后者有催化剂,无法比较
只有温度不同
3
(1)由图像可知0~A、A~B、B~C段的反应速率最大的是_______。1 min后A~B段反应速率逐渐加快,除产物可能有催化作用外,其主要原因还有:__
______________________________________________________。2 min后B~C段反应速率又逐渐变慢的原因是_______________________________________
____________________________________________________________________。
自我测试
1
2
3
3.(2022·河北邯郸高一期中)某学生用纯净的Cu与50 mL过量浓HNO3反应制取NO2 (不考虑NO气体的影响),实验结果如图所示(气体体积均为标准状况下测定,且忽略溶液体积变化)。回答下列问题:
A~B
该
反应是放热反应,1 min后溶液温度明显升高,反应速率加快
2 min后反应物硝酸浓度的减小成为影响反应
速率的主要原因,反应物浓度逐渐减小,反应速率逐渐变慢
自我测试
1
2
3.(2022·河北邯郸高一期中)某学生用纯净的Cu与50 mL过量浓HNO3反应制取NO2 (不考虑NO气体的影响),实验结果如图所示(气体体积均为标准状况下测定,且忽略溶液体积变化)。回答下列问题:
(2)计算在1~3 min内的反应速率: v(H+)=____________ mol·L-1·min-1。
0.225
1~3 min内生成的V(NO2)=252 mL,n(NO2)=0.011 25 mol,由离子方程式可知n(H+)=2n(NO2)=0.022 5 mol,v(H+)==0.225 mol·L-1·min-1。
3
自我测试
1
2
3.(2022·河北邯郸高一期中)某学生用纯净的Cu与50 mL过量浓HNO3反应制取NO2 (不考虑NO气体的影响),实验结果如图所示(气体体积均为标准状况下测定,且忽略溶液体积变化)。回答下列问题:
(3)若开始向反应溶液中加入固体KNO3,则1 min时测得V(NO2)________(填“大于”“小于”“等于”或“不确定”)84 mL。
(4)下列措施不能加快v(NO2)的是________。
A.使用Cu粉代替Cu块 B.使用含有石墨的粗铜代替纯铜
C.使用稀硝酸代替浓硝酸 D.在硝酸中加入少量浓硫酸
大于
C
硝酸根离子浓度增大,反应速率加快
接触面积增大
构成原电池
反应产生NO
H+的浓度增大
3
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
