人教版(2019)高中化学必修二 6.1 化学反应与能量变化 第二课时 化学反应与电能 课件(33张ppt)
文档属性
| 名称 | 人教版(2019)高中化学必修二 6.1 化学反应与能量变化 第二课时 化学反应与电能 课件(33张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-19 11:01:45 | ||
图片预览






文档简介
(共33张PPT)
第六章 化学反应与能量
第一节 化学反应与能量变化
第二课时
化学反应与与电能
核心素养
1.通过对比火力发电,认识化学能直接转变为电能的装置——原电池的优势,了解化学电源在实际生活中的应用及废旧电池的处理和利用。培养科学态度与社会责任的学科核心素养。
2、能从氧化还原反应的角度理解原电池的工作原理,提升证据推理能力。
3.通过实验探究,掌握构成原电池装置的条件。培养科学探究与创新意识的学科核心素养。
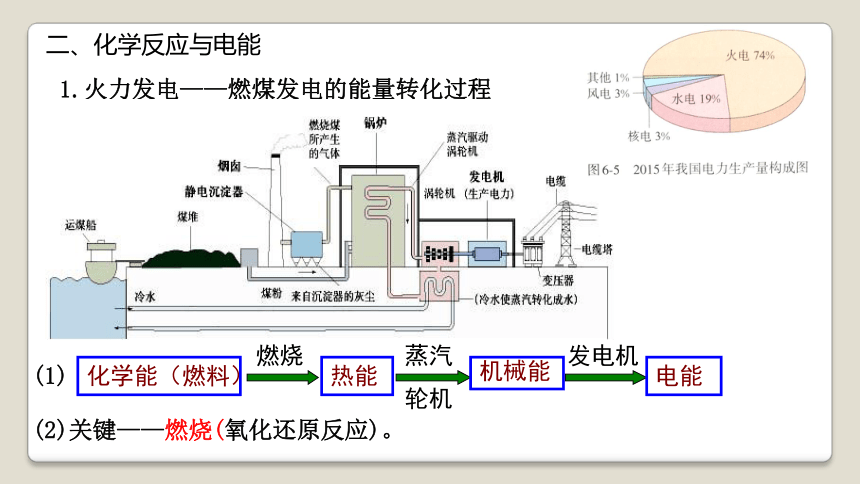
二、化学反应与电能
1.火力发电——燃煤发电的能量转化过程
化学能(燃料)
燃烧
热能
蒸汽
轮机
机械能
发电机
电能
(2)关键——燃烧(氧化还原反应)。
(1)
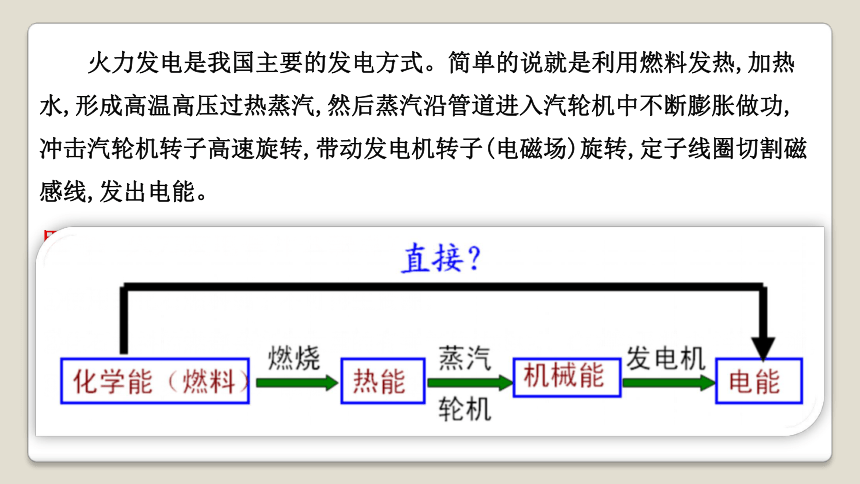
火力发电是我国主要的发电方式。简单的说就是利用燃料发热,加热水,形成高温高压过热蒸汽,然后蒸汽沿管道进入汽轮机中不断膨胀做功,冲击汽轮机转子高速旋转,带动发电机转子(电磁场)旋转,定子线圈切割磁感线,发出电能。
①使用的化石燃料属于不可再生资源;
②化石燃料的燃烧会产生大量的有害气体(如SO2、CO等)及粉尘,污染环境;
③能量经过多次转化,能量利用率低。
思考:火力发电有什么缺点?
[实验6-3]
(1)将锌片和铜片插入盛有稀硫酸的烧杯中,观察现象。
Cu
Zn
稀H2SO4
锌片溶解,表面有气泡,铜片表面没有气泡
Zn+H2SO4=ZnSO4+H2
铜与稀硫酸不反应
结论:
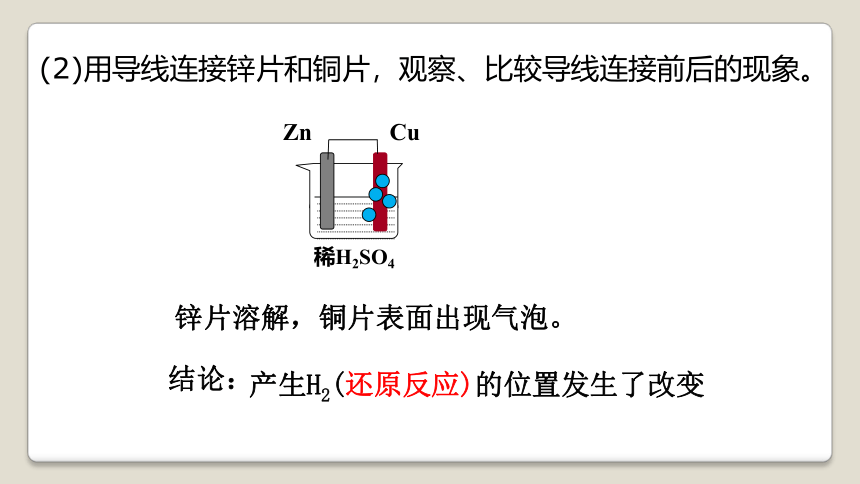
(2)用导线连接锌片和铜片,观察、比较导线连接前后的现象。
Cu
Zn
稀H2SO4
锌片溶解,铜片表面出现气泡。
结论:
产生H2(还原反应)的位置发生了改变
(3) 如图6-6所示,用导线在锌片和铜片之间串联一个电流表,观察电流表的指针是否偏转。
Cu
Zn
稀H2SO4
锌片溶解,铜片表面出现气泡。电流计指针偏转
结论:
有电流产生,装置中化学能转变为电能。
指针偏转,电路中有电流通过,说明发生了电子定向移动。
Zn 比Cu活泼,用导线连在一起时,Zn片失去的电子( Zn-2e- = Zn2+)变成Zn2+进入溶液,电子经导线流向Cu片, 溶液中的H+由于电场作用下移向Cu片得电子被还原成H2(2H++2e- = H2 ↑)
2、原电池
(1)定义:能把化学能转变为电能的装置,
叫做原电池。
(2)电极——正负极
电子流进入(或电流流出)的一极,如铜片,H+在正极被还原,发生还原反应。
电子流出(或电流流进)的一极,
如锌片,被氧化,发生氧化反应。
负极:
正极:
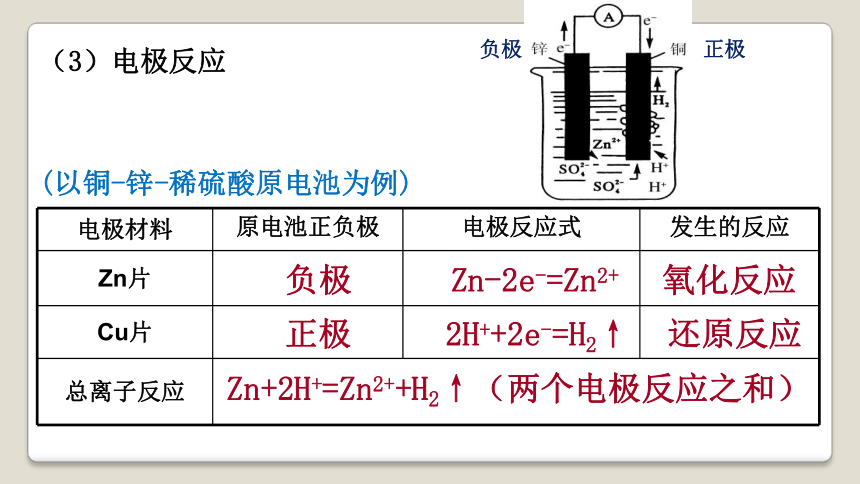
(3)电极反应
电极材料 原电池正负极 电极反应式 发生的反应
Zn片
Cu片
总离子反应 负极
正极
Zn-2e-=Zn2+
2H++2e-=H2↑
氧化反应
还原反应
Zn+2H+=Zn2++H2↑(两个电极反应之和)
负极
正极
(以铜-锌-稀硫酸原电池为例)
(4)工作原理
e-
↑
e-→
e-
↓
_
外电路:
内电路(电解质溶液中):
电子从负极→正极
电流从正极→负极
阳离子→正极
阴离子→负极
反应本质:自发进行的氧化还原反应。
这样整个电路构成了闭合回路,带电粒子的定向移动产生电流
电子不下水,离子不上岸
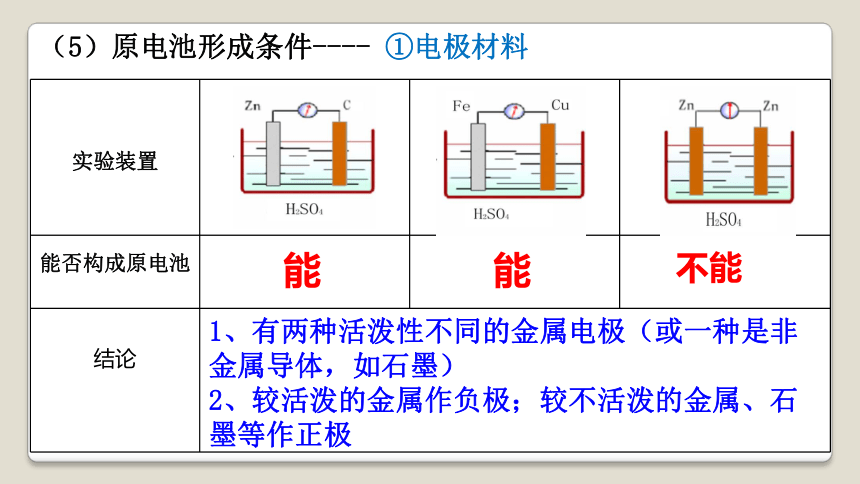
(5)原电池形成条件---- ①电极材料
实验装置
能否构成原电池
结论 能
能
不能
1、有两种活泼性不同的金属电极(或一种是非金属导体,如石墨)
2、较活泼的金属作负极;较不活泼的金属、石墨等作正极
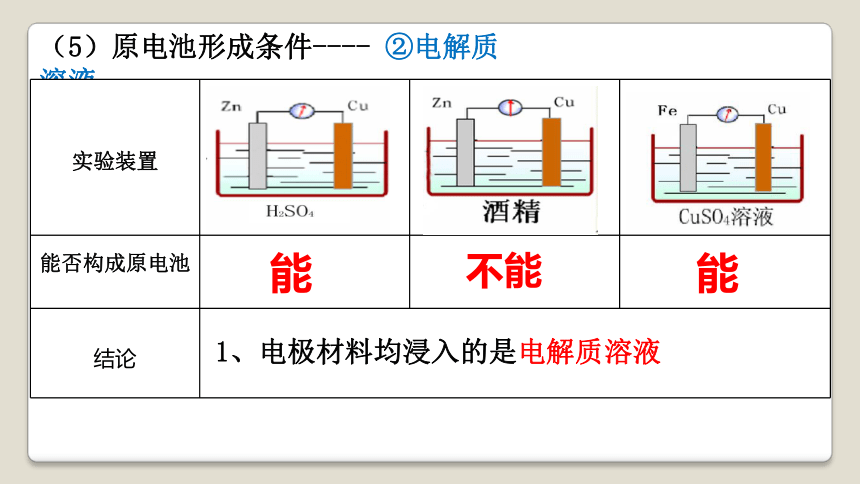
(5)原电池形成条件---- ②电解质溶液
实验装置
能否构成原电池
结论 能
能
不能
1、电极材料均浸入的是电解质溶液
(5)原电池形成条件---- ③氧化还原反应
实验装置
能否构成原电池
结论 能
不能
1、自发进行的氧化还原反应
2、反应实质:原电池的负极和电解质溶液发生氧化还原反应
(5)原电池形成条件---- ④闭合回路
实验装置
能否构成原电池
结论 能
不能
整个装置应构成闭合电路
小结:原电池形成条件
① 两种活泼性不同的金属作电极(或其中一种为能导电的非金属,如“碳棒”)其中较活泼金属为负极。较不活泼金属(或非金属)为正极(正极一般不参与电极反应,只起导电作用);
② 电解质溶液
酒精、蔗糖、四氯化碳不是电解质
③ 形成闭合回路
④ 能自发地发生氧化还原反应
如: Al / NaOH / Mg 原电池 : 是Al作负极
Cu / HNO3 (浓) / Fe 原电池 : 是Cu作负极
两极一液一连线
补充:电极反应的书写方法:
负极:还原剂 - ne- = 氧化产物
正极:氧化剂 + ne- = 还原产物
正极材料一般不参与反应,起传导电子的作用
CuSO4 (aq)
Zn
Cu
负极( ): .
正极( ): .
总反应式: .
Zn
Cu
Zn-2e - = Zn2+
Cu2+ +2e - = Cu
Zn+Cu2+ = Zn2 ++ Cu
练习:请结合组成原电池的条件,将氧化还原反应:
CuSO4 + Fe = Cu + FeSO4 设计成一个原电池。
( )
( )
( )
1、电解液:
2、电极材料:
正极:
负极:
3、电极反应式 :
负极:
正极:
C棒或者比Fe不活泼的金属,如:Cu
Fe - 2e - = Fe 2+
Cu2+ + 2e - = Cu
现象:?
CuSO4
铁棒
判断原电池正、负极的方法
1、由组成原电池的两极材料判断:
一般是活泼的金属为负极;活泼性较弱的金属或能导电的非金属为正极
2、根据电流方向或电子流动方向判断:
电子流出的一极是负极,电子流进的一极是正极
4、根据原电池两极发生的变化来判断:
发生氧化反应的是负极,发生还原反应的是正极
【归纳小结】
5、电极反应现象:
负极:不断溶解,质量减少;正极:有气体产生(质量不变)或质量增加
3、根据内电路离子移动的方向判断:
阳离子移向的一极为正极,阴离子移向的为负极
Zn
A
Zn
SO42-
H+
H+
A
Zn
SO42-
H+
H+
C
A
Zn
Cu
煤油
SO42-
H+
H+
SO42—
Zn
H+
H+
Cu
A
(x)
(x)
(√)
(x)
A
Zn
SO42-
H+
H+
木条
(x)
练习1:
2.某金属能跟稀盐酸作用放出氢气,该金属与锌组成原电池时,锌为负极,此金属是( )
A.Mg B.Fe C.Al D.Cu
B
3.由铜锌和稀硫酸组成的原电池工作时,电解质溶液的 PH( )
A.不 变 B.先变大后变小
C逐渐变大 D.逐渐变小
C
4.如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液构成原电池。下列叙述正确的是( )
A.Zn是负极,发生还原反应
B.电流从锌片流向铜片
C.一段时间后,铜片质量减轻
D.该装置将化学能转变为电能
D
5、如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下。在卡片上描述合理的是 ( )
实验后的记录:
①Zn为正极,Cu为负极 ②H+向负极移动
③电子流动方向,由Zn经外电路流向Cu
④Cu极上有H2产生
⑤若有1 mol电子流过导线,则产生H2的物质的量为0.5 mol
⑥正极的电极反应式为Zn-2e- === Zn2+
A.①②③ B.③④⑤ C.④⑤⑥ D.②③④
B
6.把a,b,c,d四块金属浸泡在稀硫酸中,用导线两两相连可以组成多个原电池。若a,b相连时,a为负极;c,d相连时,d上有气体逸出;a,c相连时,a极减轻;b,d相连时,b为正极。则四种金属的活动顺序是( )
A.a>b>c>d B.a>c>b>d
C.a>c>d>b D.b>d>c>a
C
7.一个电池反应的离子方程式是 Zn+Cu2+=Zn2+ +Cu,
该反应的的原电池正确组合是( )
A B C D
正极 Zn Cu Cu Fe
负极 Cu Zn Zn Zn
电解质溶液 CuCl2 H2SO4 CuSO4 HCl
C
3、化学电池——新能源和可再生能源的重要组成部分
(1)一次电池——锌锰干电池
①氯化铵糊作电解质溶液,锌筒作负极,发生氧化反应,石墨棒作正极,二氧化锰不断被还原,电子由锌筒流向石墨棒。
②特点:
放电后不能充电;便于携带,价格低。
随着用电器朝着小型化、多功能化发展的要求,对电池的发展也提出了小型化、多功能化发展的要求。体积小、性能好的碱性锌-锰电池应运而生。这类电池的重要特征是电解质溶液由原来的中性变为离子导电性更好的碱性,负极也由锌片改为锌粉,反应面积成倍增长,使放电电流大幅度提高。
小知识:
(2)二次电池——充电电池
①特点:它在放电时进行氧化还原反应,在充电时可以逆向进行,使电池恢复到放电前的状态。从而实现放电(化学能转化为电能)与充电(电能转化为化学能)的循环。
②实例:铅酸蓄电池、镍氢电池、锂离子电池等。目前汽车上使用的多数是铅酸蓄电池。手机、笔记本电脑、照相机和摄像机等电器所用的电池多数为锂离子电池。
(3)发展中的燃料电池
练习1:日常所用干电池的电极分别为石墨棒(上面有铜帽)和锌皮,以糊状NH4Cl和ZnCl2作电解质(其中加入MnO2吸收H2),电极反应式可简化为:
Zn-2e-===Zn2+,2NH4++2e-===2NH3↑+H2↑(NH3与Zn2+能反应生成一种稳定的物质)。根据上述判断,下列结论正确的是( )
①锌为负极,石墨为正极
②干电池可以实现化学能向电能的转化和电能向化学能的转化
③工作时,电子由石墨极经过外电路流向锌极
④长时间连续使用时,内装糊状物可能流出而腐蚀用电器
A.①③ B.②③ C.③④ D.①④
D
2.下列说法中正确的是( )
①燃料电池的反应物可不储存在电池的内部
②锌锰干电池是一次电池,铅蓄电池是二次电池
③锂电池是新一代可充电电池
④燃料电池作为汽车驱动能源已研制成功
A.②③④ B.①②③④ C.①②③ D.①③④
B
3.下列有关电池的叙述正确的是 ( )
A.水果电池是高效环保的家用电池
B.锌锰干电池是一种常用的二次电池
C.锌锰干电池中碳棒是负极,锌是正极
D.锌锰干电池工作一段时间后锌外壳逐渐变薄
D
谢 谢 观 看
第六章 化学反应与能量
第一节 化学反应与能量变化
第二课时
化学反应与与电能
核心素养
1.通过对比火力发电,认识化学能直接转变为电能的装置——原电池的优势,了解化学电源在实际生活中的应用及废旧电池的处理和利用。培养科学态度与社会责任的学科核心素养。
2、能从氧化还原反应的角度理解原电池的工作原理,提升证据推理能力。
3.通过实验探究,掌握构成原电池装置的条件。培养科学探究与创新意识的学科核心素养。
二、化学反应与电能
1.火力发电——燃煤发电的能量转化过程
化学能(燃料)
燃烧
热能
蒸汽
轮机
机械能
发电机
电能
(2)关键——燃烧(氧化还原反应)。
(1)
火力发电是我国主要的发电方式。简单的说就是利用燃料发热,加热水,形成高温高压过热蒸汽,然后蒸汽沿管道进入汽轮机中不断膨胀做功,冲击汽轮机转子高速旋转,带动发电机转子(电磁场)旋转,定子线圈切割磁感线,发出电能。
①使用的化石燃料属于不可再生资源;
②化石燃料的燃烧会产生大量的有害气体(如SO2、CO等)及粉尘,污染环境;
③能量经过多次转化,能量利用率低。
思考:火力发电有什么缺点?
[实验6-3]
(1)将锌片和铜片插入盛有稀硫酸的烧杯中,观察现象。
Cu
Zn
稀H2SO4
锌片溶解,表面有气泡,铜片表面没有气泡
Zn+H2SO4=ZnSO4+H2
铜与稀硫酸不反应
结论:
(2)用导线连接锌片和铜片,观察、比较导线连接前后的现象。
Cu
Zn
稀H2SO4
锌片溶解,铜片表面出现气泡。
结论:
产生H2(还原反应)的位置发生了改变
(3) 如图6-6所示,用导线在锌片和铜片之间串联一个电流表,观察电流表的指针是否偏转。
Cu
Zn
稀H2SO4
锌片溶解,铜片表面出现气泡。电流计指针偏转
结论:
有电流产生,装置中化学能转变为电能。
指针偏转,电路中有电流通过,说明发生了电子定向移动。
Zn 比Cu活泼,用导线连在一起时,Zn片失去的电子( Zn-2e- = Zn2+)变成Zn2+进入溶液,电子经导线流向Cu片, 溶液中的H+由于电场作用下移向Cu片得电子被还原成H2(2H++2e- = H2 ↑)
2、原电池
(1)定义:能把化学能转变为电能的装置,
叫做原电池。
(2)电极——正负极
电子流进入(或电流流出)的一极,如铜片,H+在正极被还原,发生还原反应。
电子流出(或电流流进)的一极,
如锌片,被氧化,发生氧化反应。
负极:
正极:
(3)电极反应
电极材料 原电池正负极 电极反应式 发生的反应
Zn片
Cu片
总离子反应 负极
正极
Zn-2e-=Zn2+
2H++2e-=H2↑
氧化反应
还原反应
Zn+2H+=Zn2++H2↑(两个电极反应之和)
负极
正极
(以铜-锌-稀硫酸原电池为例)
(4)工作原理
e-
↑
e-→
e-
↓
_
外电路:
内电路(电解质溶液中):
电子从负极→正极
电流从正极→负极
阳离子→正极
阴离子→负极
反应本质:自发进行的氧化还原反应。
这样整个电路构成了闭合回路,带电粒子的定向移动产生电流
电子不下水,离子不上岸
(5)原电池形成条件---- ①电极材料
实验装置
能否构成原电池
结论 能
能
不能
1、有两种活泼性不同的金属电极(或一种是非金属导体,如石墨)
2、较活泼的金属作负极;较不活泼的金属、石墨等作正极
(5)原电池形成条件---- ②电解质溶液
实验装置
能否构成原电池
结论 能
能
不能
1、电极材料均浸入的是电解质溶液
(5)原电池形成条件---- ③氧化还原反应
实验装置
能否构成原电池
结论 能
不能
1、自发进行的氧化还原反应
2、反应实质:原电池的负极和电解质溶液发生氧化还原反应
(5)原电池形成条件---- ④闭合回路
实验装置
能否构成原电池
结论 能
不能
整个装置应构成闭合电路
小结:原电池形成条件
① 两种活泼性不同的金属作电极(或其中一种为能导电的非金属,如“碳棒”)其中较活泼金属为负极。较不活泼金属(或非金属)为正极(正极一般不参与电极反应,只起导电作用);
② 电解质溶液
酒精、蔗糖、四氯化碳不是电解质
③ 形成闭合回路
④ 能自发地发生氧化还原反应
如: Al / NaOH / Mg 原电池 : 是Al作负极
Cu / HNO3 (浓) / Fe 原电池 : 是Cu作负极
两极一液一连线
补充:电极反应的书写方法:
负极:还原剂 - ne- = 氧化产物
正极:氧化剂 + ne- = 还原产物
正极材料一般不参与反应,起传导电子的作用
CuSO4 (aq)
Zn
Cu
负极( ): .
正极( ): .
总反应式: .
Zn
Cu
Zn-2e - = Zn2+
Cu2+ +2e - = Cu
Zn+Cu2+ = Zn2 ++ Cu
练习:请结合组成原电池的条件,将氧化还原反应:
CuSO4 + Fe = Cu + FeSO4 设计成一个原电池。
( )
( )
( )
1、电解液:
2、电极材料:
正极:
负极:
3、电极反应式 :
负极:
正极:
C棒或者比Fe不活泼的金属,如:Cu
Fe - 2e - = Fe 2+
Cu2+ + 2e - = Cu
现象:?
CuSO4
铁棒
判断原电池正、负极的方法
1、由组成原电池的两极材料判断:
一般是活泼的金属为负极;活泼性较弱的金属或能导电的非金属为正极
2、根据电流方向或电子流动方向判断:
电子流出的一极是负极,电子流进的一极是正极
4、根据原电池两极发生的变化来判断:
发生氧化反应的是负极,发生还原反应的是正极
【归纳小结】
5、电极反应现象:
负极:不断溶解,质量减少;正极:有气体产生(质量不变)或质量增加
3、根据内电路离子移动的方向判断:
阳离子移向的一极为正极,阴离子移向的为负极
Zn
A
Zn
SO42-
H+
H+
A
Zn
SO42-
H+
H+
C
A
Zn
Cu
煤油
SO42-
H+
H+
SO42—
Zn
H+
H+
Cu
A
(x)
(x)
(√)
(x)
A
Zn
SO42-
H+
H+
木条
(x)
练习1:
2.某金属能跟稀盐酸作用放出氢气,该金属与锌组成原电池时,锌为负极,此金属是( )
A.Mg B.Fe C.Al D.Cu
B
3.由铜锌和稀硫酸组成的原电池工作时,电解质溶液的 PH( )
A.不 变 B.先变大后变小
C逐渐变大 D.逐渐变小
C
4.如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液构成原电池。下列叙述正确的是( )
A.Zn是负极,发生还原反应
B.电流从锌片流向铜片
C.一段时间后,铜片质量减轻
D.该装置将化学能转变为电能
D
5、如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下。在卡片上描述合理的是 ( )
实验后的记录:
①Zn为正极,Cu为负极 ②H+向负极移动
③电子流动方向,由Zn经外电路流向Cu
④Cu极上有H2产生
⑤若有1 mol电子流过导线,则产生H2的物质的量为0.5 mol
⑥正极的电极反应式为Zn-2e- === Zn2+
A.①②③ B.③④⑤ C.④⑤⑥ D.②③④
B
6.把a,b,c,d四块金属浸泡在稀硫酸中,用导线两两相连可以组成多个原电池。若a,b相连时,a为负极;c,d相连时,d上有气体逸出;a,c相连时,a极减轻;b,d相连时,b为正极。则四种金属的活动顺序是( )
A.a>b>c>d B.a>c>b>d
C.a>c>d>b D.b>d>c>a
C
7.一个电池反应的离子方程式是 Zn+Cu2+=Zn2+ +Cu,
该反应的的原电池正确组合是( )
A B C D
正极 Zn Cu Cu Fe
负极 Cu Zn Zn Zn
电解质溶液 CuCl2 H2SO4 CuSO4 HCl
C
3、化学电池——新能源和可再生能源的重要组成部分
(1)一次电池——锌锰干电池
①氯化铵糊作电解质溶液,锌筒作负极,发生氧化反应,石墨棒作正极,二氧化锰不断被还原,电子由锌筒流向石墨棒。
②特点:
放电后不能充电;便于携带,价格低。
随着用电器朝着小型化、多功能化发展的要求,对电池的发展也提出了小型化、多功能化发展的要求。体积小、性能好的碱性锌-锰电池应运而生。这类电池的重要特征是电解质溶液由原来的中性变为离子导电性更好的碱性,负极也由锌片改为锌粉,反应面积成倍增长,使放电电流大幅度提高。
小知识:
(2)二次电池——充电电池
①特点:它在放电时进行氧化还原反应,在充电时可以逆向进行,使电池恢复到放电前的状态。从而实现放电(化学能转化为电能)与充电(电能转化为化学能)的循环。
②实例:铅酸蓄电池、镍氢电池、锂离子电池等。目前汽车上使用的多数是铅酸蓄电池。手机、笔记本电脑、照相机和摄像机等电器所用的电池多数为锂离子电池。
(3)发展中的燃料电池
练习1:日常所用干电池的电极分别为石墨棒(上面有铜帽)和锌皮,以糊状NH4Cl和ZnCl2作电解质(其中加入MnO2吸收H2),电极反应式可简化为:
Zn-2e-===Zn2+,2NH4++2e-===2NH3↑+H2↑(NH3与Zn2+能反应生成一种稳定的物质)。根据上述判断,下列结论正确的是( )
①锌为负极,石墨为正极
②干电池可以实现化学能向电能的转化和电能向化学能的转化
③工作时,电子由石墨极经过外电路流向锌极
④长时间连续使用时,内装糊状物可能流出而腐蚀用电器
A.①③ B.②③ C.③④ D.①④
D
2.下列说法中正确的是( )
①燃料电池的反应物可不储存在电池的内部
②锌锰干电池是一次电池,铅蓄电池是二次电池
③锂电池是新一代可充电电池
④燃料电池作为汽车驱动能源已研制成功
A.②③④ B.①②③④ C.①②③ D.①③④
B
3.下列有关电池的叙述正确的是 ( )
A.水果电池是高效环保的家用电池
B.锌锰干电池是一种常用的二次电池
C.锌锰干电池中碳棒是负极,锌是正极
D.锌锰干电池工作一段时间后锌外壳逐渐变薄
D
谢 谢 观 看
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
