化学人教版(2019)选择性必修2 1.2.2对角线规则 原子半径的比较规律(共25张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 1.2.2对角线规则 原子半径的比较规律(共25张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 3.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-19 00:00:00 | ||
图片预览







文档简介
(共25张PPT)
对角线规则 原子半径的比较规律
第2课时
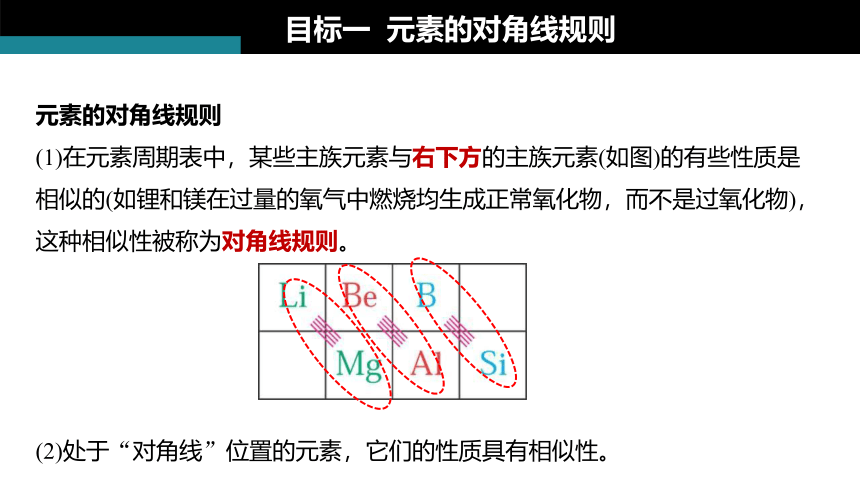
元素的对角线规则
(1)在元素周期表中,某些主族元素与右下方的主族元素(如图)的有些性质是相似的(如锂和镁在过量的氧气中燃烧均生成正常氧化物,而不是过氧化物),这种相似性被称为对角线规则。
(2)处于“对角线”位置的元素,它们的性质具有相似性。
目标一 元素的对角线规则
与酸反应 与碱反应
单质
氧化物
氢氧化物
如铍、铝两元素的性质相似性:
1.锂和镁在元素周期表中有特殊“对角线”关系,它们的性质相似。下列有关锂及其化合物叙述正确的是
A.Li2SO4难溶于水
B.Li与N2反应产物是Li3N
C.LiOH易溶于水
D.LiOH与Li2CO3受热都很难分解
√
导练
元素周期表中,处于对角线位置的元素具有相似的性质,则根据MgSO4、Mg、Mg(OH)2、MgCO3的性质可推断Li2SO4、Li、LiOH、Li2CO3的性质。
2.仔细观察右图,回答下列问题:
(1)B的原子结构示意图为________,B元素位于元素周期表的第______周期第______族。
二
ⅢA
(2)铍的最高价氧化物对应的水化物是______(填“酸性”“碱性”或“两性”)化合物,证明这一结论的有关离子方程式是_____________________________
______________________________________。
两性
Be(OH)2+2OH-=== +2H2O,
Be(OH)2+2H+===Be2++2H2O
(3)根据元素周期律知识,硼酸酸性比碳酸____,理由是__________________。
弱
硼的非金属性比碳弱
(4)根据Mg在空气中的燃烧情况,Li在空气中燃烧生成的产物为_____________(用化学式表示)。
Li2O、Li3N
目标二 原子半径的比较规律
元素化合价的周期性变化
Na Mg Al Si P S Cl
+1 +2 +3 +4 +5 +6 +7
-4 -3 -2 -1
温故知新
元素的性质随核电荷数的递增发生周期性的递变,称为元素的周期律。
元素周期律
元素周期律主要体现在核外电子排布、 主要化合价、金属性、非金属性等周期性变化。
②除了O、F外,元素的最高正价=最外层电子数=主族序数
①金属元素无负价,氟无正价,氧无最高正价
③最高正价+ ︱最低负价 ︱= 8
1
B
Al
Si
Ge
As
Sb
Te
2
3
4
5
6
7
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
Po
At
非金属性逐渐增强
金属性逐渐减弱
金属性逐渐增强
非金属区
金属区
0
族
元
素
最强
非金属性逐渐减弱
最强
金属性、非金属性周期性变化
我们将从原子半径、电离能、电负性方面系统研究元素周期律。
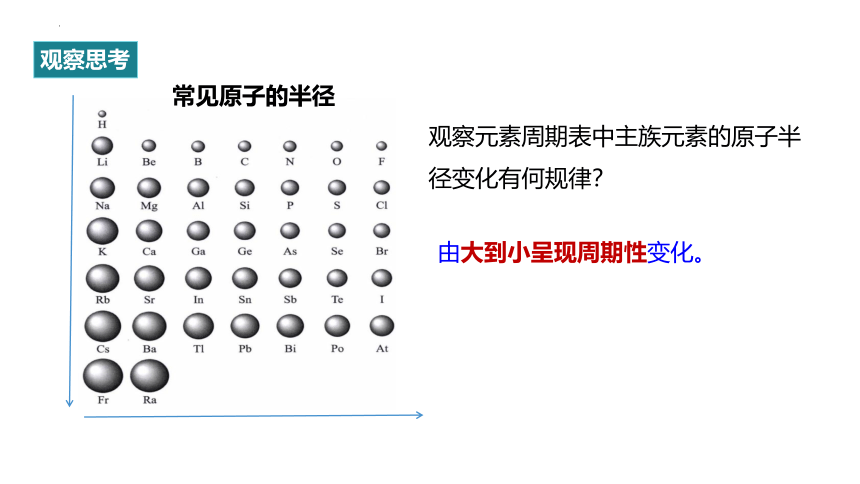
观察元素周期表中主族元素的原子半径变化有何规律?
由大到小呈现周期性变化。
常见原子的半径
观察思考
原子半径
电子的能层数
核电荷数
取决于
核电荷数越大,核对电子的吸引作用也就越大,将使原子的半径减小。
电子的能层越多,电子之间的排斥作用越大,将使原子的半径增大。
常见原子的半径
1.影响原子半径大小的因素
2.比较(主族元素)原子半径大小的方法
(1)同周期元素,随着原子序数递增,其原子半径逐渐减小 (稀有气体元素除外)。
例:r(Na)>r(Mg)>r(Al)>r(Si)>r(P)>r(S)>r(Cl)
(2)同主族元素,随着能层数递增,其原子半径逐渐增大。
例:r(Li)(3)不是同周期也不是同主族的元素原子可借助某种原子参照比较。
例:r(K)>r(Na),r(Na)>r(Al),则r(K)>r(Al)
3.比较离子半径大小的方法
(1)同种元素的粒子半径,阴离子大于原子,原子大于阳离子,低价阳离子大于高价阳离子。例:r(Cl-)>r(Cl),r(Fe)>r(Fe2+)>r(Fe3+)
(2)能层结构相同的微粒,核电荷数越大,半径越小。
例:r(O2-)>r(F-)>r(Na+)>r(Mg2+)>r(Al3+)
(4)核电荷数、能层数均不同的离子可选一种离子参照比较。
例:比较r(K+)与r(Mg2+)可选r(Na+)为参照:r(K+)>r(Na+)>r(Mg2+)
(3)带相同电荷的离子,能层数越多,半径越大。
例:r(Li+)“三看”法快速判断简单微粒半径大小
“一看”能层数:最外层电子数相同时,能层数越多,半径越大。
“二看”核电荷数:当能层结构相同时,核电荷数越大,半径越小。
“三看”核外电子数:当能层数和核电荷数均相同时,核外电子数越多,半径越大。
方法规律
1.原子能层数多的元素的原子半径是否一定大于原子能层数少的元素的原子半径?
提示 不一定,原子半径的大小由核电荷数与原子的能层数两个因素综合决定,如碱金属元素的原子半径比它下一周期卤素原子的半径大。
2.比较Na与Na+、Cl与Cl-的半径大小,并说明理由。
提示 Na半径大于Na+半径。Na失去1个e-变为Na+,能层由三层变成两层,所以半径减小。Cl半径小于Cl-半径。Cl得到1个e-变为Cl-,核电荷数未变,最外层多了一个电子,电子间的斥力增大,半径增大。
导思
导练
1.正误判断
(1)核外能层结构相同的单核粒子,半径相同( )
(2)质子数相同的不同单核粒子,电子数越多,半径越大( )
(3)同周期元素从左到右,原子半径、离子半径均逐渐减小( )
×
√
×
2.下列各组微粒半径大小比较中,不正确的是
A.r(K)>r(Na)>r(Li)
B.r(Mg2+)>r(Na+)>r(F-)
C.r(Na+)>r(Mg2+)>r(Al3+)
D.r(Cl-)>r(F-)>r(F)
√
导练
同主族元素,从上到下,原子半径(或离子半径)逐渐增大,故A正确;
Mg2+、Na+、F-能层数相同,核电荷数越大离子半径越小,故B错误;
Na+、Mg2+、Al3+能层数相同,核电荷数越大离子半径越小,故C正确;
最外层电子数相同时,电子层数越多,半径越大,故r(Cl-)>r(F-),核电荷数相同时,核外电子数越多,半径越大,所以r(F-)>r(F),故D正确。
3.电子层结构相同的An+、Bn-、C,下列说法正确的是
A.原子序数:C>B>A B.半径:An+>Bn-
C.C是稀有气体原子 D.原子半径:A√
设C的原子序数为Z,则A的原子序数为Z+n,B的原子序数为Z-n,则原子序数为A>C>B,故A错误;
因An+、Bn-具有相同的电子层结构,核电荷数越大半径越小,阴离子半径大于阳离子半径,即r(Bn-)>r(An+),故B错误;
An+、Bn-都应具有稀有气体的电子层结构,C的电子层结构与An+、Bn-相同,所以C必为稀有气体元素的原子,故C正确;
B、C为同一周期的元素,而A应处于B、C的下一周期,A元素的能层数多于B,所以原子半径:A>B,故D错误。
1.四种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p3;④1s22s22p5,则四种原子的半径按由大到小的顺序排列正确的是
A.①>②>③>④
B.②>①>③>④
C.②>①>④>③
D.①>②>④>③
√
1
2
3
自我测试
4
由四种元素基态原子的电子排布式可知,①为S原子,②为P原子,③为N原子,④为F原子,其中P、S元素处于第三周期,P原子的核电荷数小于S,则P的原子半径大于S;N和F元素处于第二周期,N原子的核电荷数小于F,则N的原子半径大于F;S原子比N原子多一个电子层,则S的原子半径大于N原子,综上所述,原子半径由大到小的顺序为P>S>N>F。
1
2
3
自我测试
4
2.X元素的阳离子和Y元素的阴离子的核外电子层结构相同,下列叙述正确的是
A.离子半径:X>Y
B.原子半径:XC.原子序数:XD.原子最外层电子数:X√
自我测试
1
2
3
4
核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,离子半径:XX原子的电子层比Y原子的电子层多一层,所以原子半径:X>Y,B不正确;
X是金属,Y是非金属,Y位于X的上一周期的右侧,则原子序数:X>Y,C不正确。
自我测试
1
2
3
4
3.下列化合物中阳离子半径与阴离子半径比值最小的是
A.NaF B.MgI2
C.BaI2 D.KBr
自我测试
1
2
3
√
4
比较d、e常见离子的半径大小(用化学符号表示):________>__________。
4.随原子序数的递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。
r(O2-) r(Na+)
自我测试
1
2
3
4
由图可知d是氧元素,e是Na元素,O2-和Na+的离子结构相同,电子数相同,核电荷数越大,原子核对电子的吸引作用就越大,将使原子的半径减小,或者根据微粒的半径比较规律:能层数相同,则看核电荷数,核电荷数越大,微粒半径越小。
自我测试
1
2
3
4
对角线规则 原子半径的比较规律
第2课时
元素的对角线规则
(1)在元素周期表中,某些主族元素与右下方的主族元素(如图)的有些性质是相似的(如锂和镁在过量的氧气中燃烧均生成正常氧化物,而不是过氧化物),这种相似性被称为对角线规则。
(2)处于“对角线”位置的元素,它们的性质具有相似性。
目标一 元素的对角线规则
与酸反应 与碱反应
单质
氧化物
氢氧化物
如铍、铝两元素的性质相似性:
1.锂和镁在元素周期表中有特殊“对角线”关系,它们的性质相似。下列有关锂及其化合物叙述正确的是
A.Li2SO4难溶于水
B.Li与N2反应产物是Li3N
C.LiOH易溶于水
D.LiOH与Li2CO3受热都很难分解
√
导练
元素周期表中,处于对角线位置的元素具有相似的性质,则根据MgSO4、Mg、Mg(OH)2、MgCO3的性质可推断Li2SO4、Li、LiOH、Li2CO3的性质。
2.仔细观察右图,回答下列问题:
(1)B的原子结构示意图为________,B元素位于元素周期表的第______周期第______族。
二
ⅢA
(2)铍的最高价氧化物对应的水化物是______(填“酸性”“碱性”或“两性”)化合物,证明这一结论的有关离子方程式是_____________________________
______________________________________。
两性
Be(OH)2+2OH-=== +2H2O,
Be(OH)2+2H+===Be2++2H2O
(3)根据元素周期律知识,硼酸酸性比碳酸____,理由是__________________。
弱
硼的非金属性比碳弱
(4)根据Mg在空气中的燃烧情况,Li在空气中燃烧生成的产物为_____________(用化学式表示)。
Li2O、Li3N
目标二 原子半径的比较规律
元素化合价的周期性变化
Na Mg Al Si P S Cl
+1 +2 +3 +4 +5 +6 +7
-4 -3 -2 -1
温故知新
元素的性质随核电荷数的递增发生周期性的递变,称为元素的周期律。
元素周期律
元素周期律主要体现在核外电子排布、 主要化合价、金属性、非金属性等周期性变化。
②除了O、F外,元素的最高正价=最外层电子数=主族序数
①金属元素无负价,氟无正价,氧无最高正价
③最高正价+ ︱最低负价 ︱= 8
1
B
Al
Si
Ge
As
Sb
Te
2
3
4
5
6
7
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
Po
At
非金属性逐渐增强
金属性逐渐减弱
金属性逐渐增强
非金属区
金属区
0
族
元
素
最强
非金属性逐渐减弱
最强
金属性、非金属性周期性变化
我们将从原子半径、电离能、电负性方面系统研究元素周期律。
观察元素周期表中主族元素的原子半径变化有何规律?
由大到小呈现周期性变化。
常见原子的半径
观察思考
原子半径
电子的能层数
核电荷数
取决于
核电荷数越大,核对电子的吸引作用也就越大,将使原子的半径减小。
电子的能层越多,电子之间的排斥作用越大,将使原子的半径增大。
常见原子的半径
1.影响原子半径大小的因素
2.比较(主族元素)原子半径大小的方法
(1)同周期元素,随着原子序数递增,其原子半径逐渐减小 (稀有气体元素除外)。
例:r(Na)>r(Mg)>r(Al)>r(Si)>r(P)>r(S)>r(Cl)
(2)同主族元素,随着能层数递增,其原子半径逐渐增大。
例:r(Li)
例:r(K)>r(Na),r(Na)>r(Al),则r(K)>r(Al)
3.比较离子半径大小的方法
(1)同种元素的粒子半径,阴离子大于原子,原子大于阳离子,低价阳离子大于高价阳离子。例:r(Cl-)>r(Cl),r(Fe)>r(Fe2+)>r(Fe3+)
(2)能层结构相同的微粒,核电荷数越大,半径越小。
例:r(O2-)>r(F-)>r(Na+)>r(Mg2+)>r(Al3+)
(4)核电荷数、能层数均不同的离子可选一种离子参照比较。
例:比较r(K+)与r(Mg2+)可选r(Na+)为参照:r(K+)>r(Na+)>r(Mg2+)
(3)带相同电荷的离子,能层数越多,半径越大。
例:r(Li+)
“一看”能层数:最外层电子数相同时,能层数越多,半径越大。
“二看”核电荷数:当能层结构相同时,核电荷数越大,半径越小。
“三看”核外电子数:当能层数和核电荷数均相同时,核外电子数越多,半径越大。
方法规律
1.原子能层数多的元素的原子半径是否一定大于原子能层数少的元素的原子半径?
提示 不一定,原子半径的大小由核电荷数与原子的能层数两个因素综合决定,如碱金属元素的原子半径比它下一周期卤素原子的半径大。
2.比较Na与Na+、Cl与Cl-的半径大小,并说明理由。
提示 Na半径大于Na+半径。Na失去1个e-变为Na+,能层由三层变成两层,所以半径减小。Cl半径小于Cl-半径。Cl得到1个e-变为Cl-,核电荷数未变,最外层多了一个电子,电子间的斥力增大,半径增大。
导思
导练
1.正误判断
(1)核外能层结构相同的单核粒子,半径相同( )
(2)质子数相同的不同单核粒子,电子数越多,半径越大( )
(3)同周期元素从左到右,原子半径、离子半径均逐渐减小( )
×
√
×
2.下列各组微粒半径大小比较中,不正确的是
A.r(K)>r(Na)>r(Li)
B.r(Mg2+)>r(Na+)>r(F-)
C.r(Na+)>r(Mg2+)>r(Al3+)
D.r(Cl-)>r(F-)>r(F)
√
导练
同主族元素,从上到下,原子半径(或离子半径)逐渐增大,故A正确;
Mg2+、Na+、F-能层数相同,核电荷数越大离子半径越小,故B错误;
Na+、Mg2+、Al3+能层数相同,核电荷数越大离子半径越小,故C正确;
最外层电子数相同时,电子层数越多,半径越大,故r(Cl-)>r(F-),核电荷数相同时,核外电子数越多,半径越大,所以r(F-)>r(F),故D正确。
3.电子层结构相同的An+、Bn-、C,下列说法正确的是
A.原子序数:C>B>A B.半径:An+>Bn-
C.C是稀有气体原子 D.原子半径:A
设C的原子序数为Z,则A的原子序数为Z+n,B的原子序数为Z-n,则原子序数为A>C>B,故A错误;
因An+、Bn-具有相同的电子层结构,核电荷数越大半径越小,阴离子半径大于阳离子半径,即r(Bn-)>r(An+),故B错误;
An+、Bn-都应具有稀有气体的电子层结构,C的电子层结构与An+、Bn-相同,所以C必为稀有气体元素的原子,故C正确;
B、C为同一周期的元素,而A应处于B、C的下一周期,A元素的能层数多于B,所以原子半径:A>B,故D错误。
1.四种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p3;④1s22s22p5,则四种原子的半径按由大到小的顺序排列正确的是
A.①>②>③>④
B.②>①>③>④
C.②>①>④>③
D.①>②>④>③
√
1
2
3
自我测试
4
由四种元素基态原子的电子排布式可知,①为S原子,②为P原子,③为N原子,④为F原子,其中P、S元素处于第三周期,P原子的核电荷数小于S,则P的原子半径大于S;N和F元素处于第二周期,N原子的核电荷数小于F,则N的原子半径大于F;S原子比N原子多一个电子层,则S的原子半径大于N原子,综上所述,原子半径由大到小的顺序为P>S>N>F。
1
2
3
自我测试
4
2.X元素的阳离子和Y元素的阴离子的核外电子层结构相同,下列叙述正确的是
A.离子半径:X>Y
B.原子半径:X
自我测试
1
2
3
4
核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,离子半径:X
X是金属,Y是非金属,Y位于X的上一周期的右侧,则原子序数:X>Y,C不正确。
自我测试
1
2
3
4
3.下列化合物中阳离子半径与阴离子半径比值最小的是
A.NaF B.MgI2
C.BaI2 D.KBr
自我测试
1
2
3
√
4
比较d、e常见离子的半径大小(用化学符号表示):________>__________。
4.随原子序数的递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。
r(O2-) r(Na+)
自我测试
1
2
3
4
由图可知d是氧元素,e是Na元素,O2-和Na+的离子结构相同,电子数相同,核电荷数越大,原子核对电子的吸引作用就越大,将使原子的半径减小,或者根据微粒的半径比较规律:能层数相同,则看核电荷数,核电荷数越大,微粒半径越小。
自我测试
1
2
3
4
