2022-2023学年高二化学人教版(2019)选择性必修31.1.2 有机化合物中的共价键和同分异构现象课件(30张PPT)
文档属性
| 名称 | 2022-2023学年高二化学人教版(2019)选择性必修31.1.2 有机化合物中的共价键和同分异构现象课件(30张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-20 17:07:23 | ||
图片预览






文档简介
(共30张PPT)
有机化合物中的共价键和同分异构现象
第2课时
第一节 有机化合物的结构特点
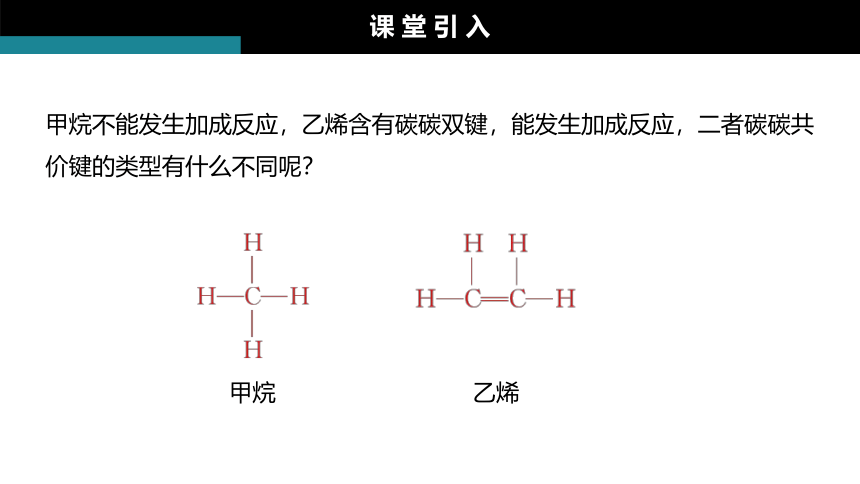
课 堂 引 入
甲烷不能发生加成反应,乙烯含有碳碳双键,能发生加成反应,二者碳碳共价键的类型有什么不同呢?
甲烷
乙烯
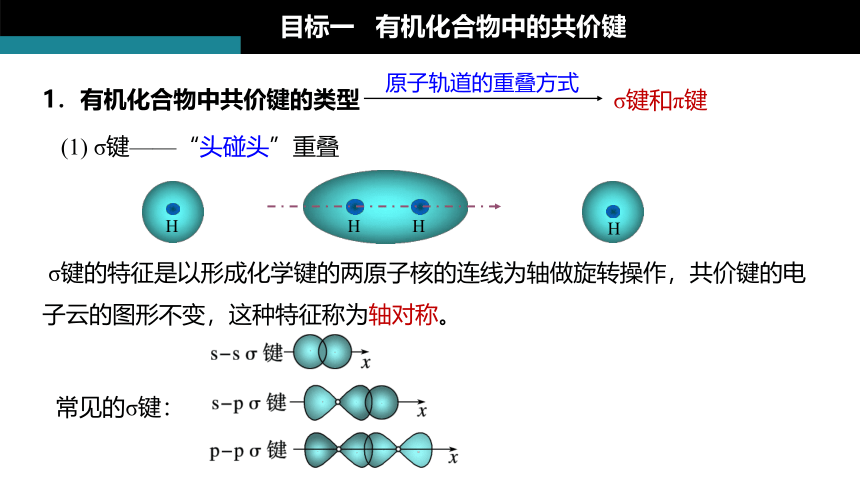
1.有机化合物中共价键的类型
原子轨道的重叠方式
σ键和π键
目标一 有机化合物中的共价键
(1) σ键——“头碰头”重叠
σ键的特征是以形成化学键的两原子核的连线为轴做旋转操作,共价键的电子云的图形不变,这种特征称为轴对称。
常见的σ键:
H
H
H
H
109°28′
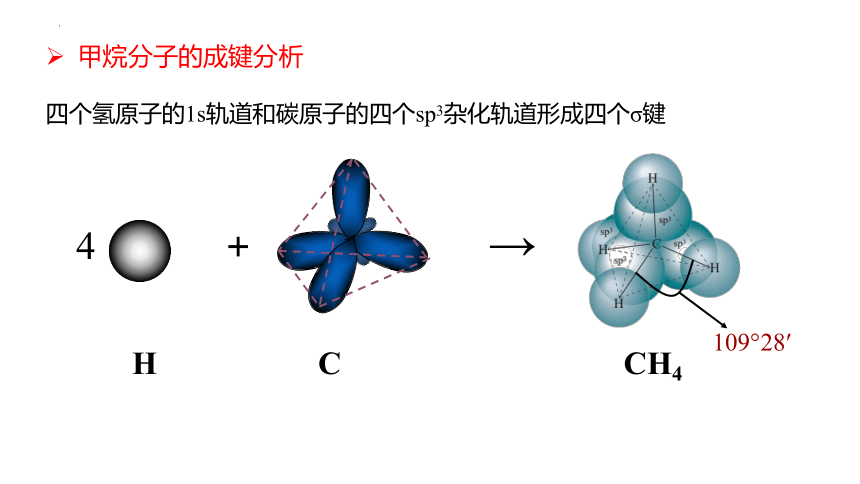
四个氢原子的1s轨道和碳原子的四个sp3杂化轨道形成四个σ键
甲烷分子的成键分析
4 + →
H C CH4
p-p π键的形成的过程:
(2) π键——“肩并肩”重叠
②“肩并肩”重叠:轨道重叠程度小于σ键,π键没有σ键稳定,比较容易断裂而发生化学反应。
π键的特征:
①轨道重叠部分垂直于键轴呈镜面对称。通过π键连接的原子不能绕键轴旋转,否则会导致π键的破坏。
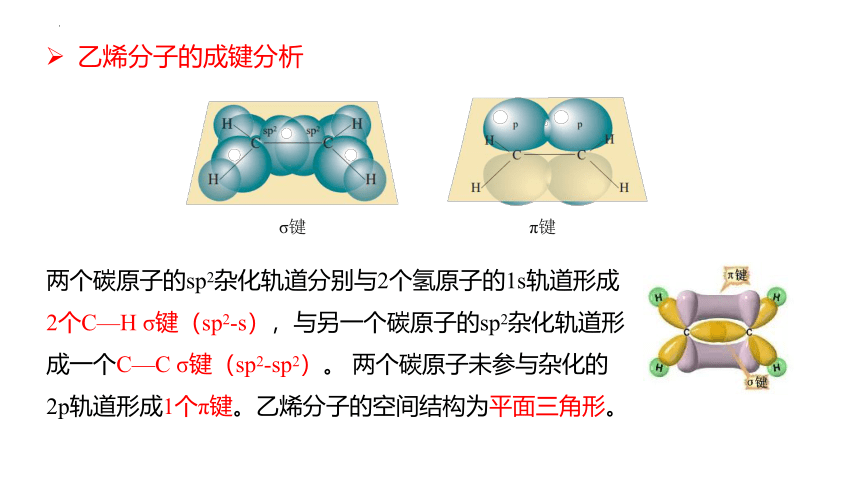
两个碳原子的sp2杂化轨道分别与2个氢原子的1s轨道形成2个C—H σ键(sp2-s),与另一个碳原子的sp2杂化轨道形成一个C—C σ键(sp2-sp2)。 两个碳原子未参与杂化的2p轨道形成1个π键。乙烯分子的空间结构为平面三角形。
σ键
π键
乙烯分子的成键分析
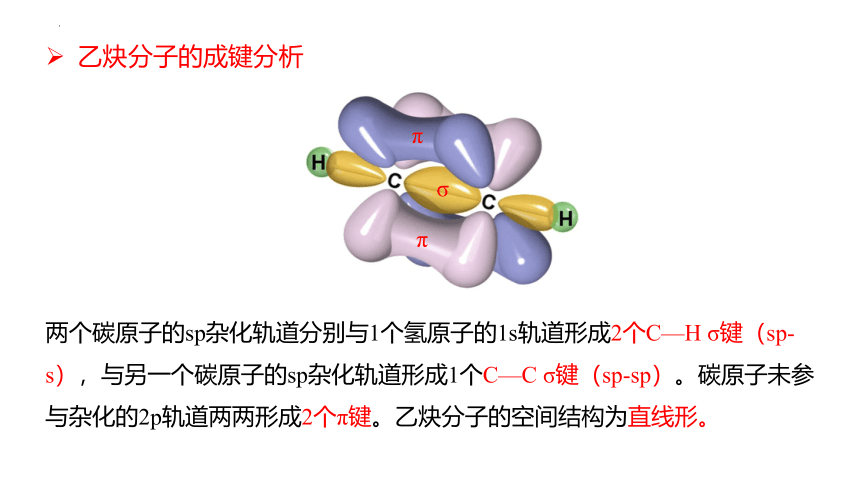
两个碳原子的sp杂化轨道分别与1个氢原子的1s轨道形成2个C—H σ键(sp-s),与另一个碳原子的sp杂化轨道形成1个C—C σ键(sp-sp)。碳原子未参与杂化的2p轨道两两形成2个π键。乙炔分子的空间结构为直线形。
σ
π
π
乙炔分子的成键分析
(3)根据成键原子形成共用电子对的数目可分为单键、双键、三键。
(4)共价键类型与有机反应类型的关系
①甲烷含有C—H σ键,能发生取代反应。
②π键的轨道重叠程度比σ键的小,比较容易断裂,π键更活泼,如乙烯和乙炔含有π键,能发生加成反应。
有机化合物中的共价键
单键只含σ键
双键中含有一个σ键和一个π键
三键中含有一个σ键和两个π键
2.共价键极性与有机反应
共价键极性越强,有机反应越容易发生。
(1)乙醇、水分别与钠反应的比较
在反应时,乙醇分子和水分子中的O—H断裂。同样条件,水与钠反应较剧烈,其原因是乙醇分子中氢氧键的极性比水分子中氢氧键的极性弱。
基团之间的相互影响使官能团中化学键的极性发生变化,从而影响官能团和物质的性质。
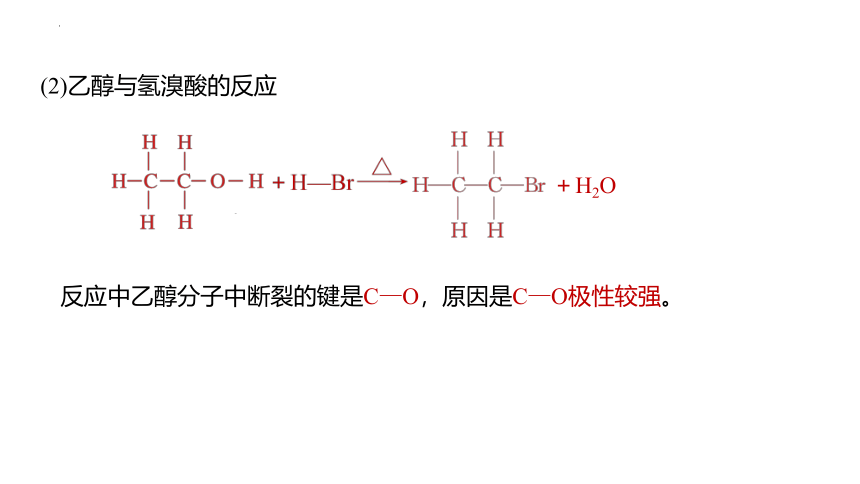
(2)乙醇与氢溴酸的反应
+H2O
反应中乙醇分子中断裂的键是C—O,原因是C—O极性较强。
3.有机反应的特点
共价键的断裂需要吸收能量,而且有机化合物分子中共价键断裂的位置存在多种可能。相对无机反应,有机反应一般反应速率较小,副反应较多,产物比较复杂。
1.某有机物分子的结构简式为 ,该分子中有 个σ键, 个π键, (填“有”或“没有”)非极性键。根据共价键的类型和极性可推测该物质可发生 反应和 反应,与钠反应的剧烈程度比水与钠反应的
剧烈程度 。原因是_________________________________________________
。
8
2
有
加成
取代
大
CH2==CHCOOH中 中的氢氧键受酮羰基影响,
极性更强,更易断裂
导思
2.请从化学键和官能团的角度分析下列反应中有机化合物的变化。
提示 化学键:甲烷分子中的C—H σ键能发生取代反应;在乙烯分子中,碳碳双键含有π键能发生加成反应。
官能团:甲烷无官能团,一氯甲烷的官能团是碳氯键;乙烯的官能团是碳碳双键,加成反应产物的官能团是碳溴键。
导思
1.正误判断
(1)σ键比π键牢固,所以不会断裂( )
(2)甲烷分子中只有C—H σ键,只能发生取代反应( )
(3)乙烯分子中含有π键,所以化学性质比甲烷活泼( )
(4)乙酸与钠反应比水与钠反应更剧烈,是因为乙酸分子中氢氧键的极性更强
( )
×
×
√
√
导练
2.下列关于有机化合物中化学键的说法不正确的是
A.烷烃中的化学键均为σ键
B.CH3NH2中C—H的极性比N—H的极性弱
C.乙烯分子中含有极性键和非极性键
D.1个丙炔分子中含有5个σ键和3个π键
√
导练
电负性:N > C
HC≡C—CH3
6个σ键、2个π键
物质名称 正戊烷 异戊烷 新戊烷
结构简式
相同点 不同点 沸 点 【思考与讨论】试分析以下三种分子模型,确定它们的分子式和相互关系。
分子式相同,通式相同,都属于烷烃
碳骨架不同(碳原子间的连接顺序不同)
物理性质不同,支链越多,沸点越低
正戊烷(沸点36.1℃)
异戊烷(沸点27.9℃)
新戊烷(沸点9.5℃)
目标二 有机化合物的同分异构现象
CH3CH2CH2CH2CH3
1.同分异构现象和同分异构体
一般情况下,有机化合物中的碳原子数目越多,其同分异构体的数目也越多。
碳原子数 1 2 3 4 5 6 7 8 9 10
同分异体数 无 无 无 2 3 5 9 18 35 75
烷烃的碳原子数与其对应的同分异构体数
化合物具有相同的分子式,但结构不同的现象叫同分异构现象。具有同分异构现象的化合物互为同分异构体。
同分异构现象
构造异构
立体异构
碳架异构
顺反异构
对映异构
位置异构
官能团异构
碳骨架不同
官能团的位置不同
官能团不同
2.同分异构现象的类型
异构类型 实例
碳架异构
CH3—CH2—CH2—CH3
异丁烷
CH3—CH—CH3
CH3
正丁烷
C4H10
3.构造异构现象
异构类型 实例
位置异构
1-丁烯
2-丁烯
CH2=CH—CH2—CH3
1
2
3
4
CH3—CH=CH—CH3
1
2
3
4
C4H8
C6H4Cl2
邻二氯苯
间二氯苯
对二氯苯
异构类型 实例
官能团异构
C2H6O
乙醇
二甲醚
在表示有机化合物的组成和结构时,将碳、氢元素符号省略,只表示分子中键的连接情况和官能团,每个拐点或终点均表示有一个碳原子,这样得到的式子称为键线式。例如:丙烯可表示为 ,乙醇可表示为 。
4.键线式
知识拓展
对映异构
氯溴碘代甲烷,有两种异构体,互为镜像却不能重合,这种现象称为对映异构。一般来说,若碳原子连接四个不同的原子或原子团则称为手性碳原子,含有手性碳原子的化合物存在对映异构。
1.具有相同相对分子质量的两种化合物一定是同分异构体吗?
提示 不一定。因为相对分子质量相同的两种化合物,分子式不一定相同(如CO和C2H4)。判断是否为同分异构体的关键是看是不是具有相同的分子式和不同的结构。
导思
提示 不互为同分异构体,由于二者均为四面体结构,为同一种物质。
2. 与 是否互为同分异构体?说明理由。
提示 是,属于官能团异构。CH3COOH与HCOOCH3的分子式相同,官能团分别为羧基和酯基。
3.CH3COOH与HCOOCH3是否互为同分异构体?若是,属于哪种类型的同分异构体?
导思
1.正误判断
(1)分子式相同,各元素质量分数也相同的物质是同种物质( )
(2)同素异形体、同分异构体之间的转化是物理变化( )
(3)同系物之间可以互为同分异构体( )
(4)淀粉与纤维素是分子式为(C6H10O5)n的同分异构体( )
(5)CH3CH2CH2Cl与CH3CHClCH3互为位置异构( )
导练
×
×
×
×
√
2.已知下列有机化合物:①CH3—CH2—CH2—CH3和
②CH2==CH—CH2—CH3和CH3—CH==CH—CH3
③CH3—CH2—OH和CH3—O—CH3
④ 和
⑤CH3—CH2—CH==CH—CH3和
⑥CH2==CH—CH==CH2和CH3—CH2—C≡CH
(1)其中属于同分异构体的是____________(填序号,下同)。
(2)其中属于碳架异构的是____________。
(3)其中属于位置异构的是____________。
①②③⑤⑥
①
②
导练
①CH3—CH2—CH2—CH3和
②CH2==CH—CH2—CH3和CH3—CH==CH—CH3
③CH3—CH2—OH和CH3—O—CH3
④ 和
⑤CH3—CH2—CH==CH—CH3和
⑥CH2==CH—CH==CH2和CH3—CH2—C≡CH
(4)其中属于官能团异构的是____________。
(5)其中属于同一种物质的是_________。
(6)②中1-丁烯的键线式为____________。
③⑤⑥
④
导练
1.(2022·烟台高二月考)世界卫生组织(WHO)宣布,将新型冠状病毒感染的肺炎疫情列为国际关注的突发公共卫生事件。防疫专家表示,医用酒精、含氯消毒剂(如“84”消毒液)等可以有效杀灭病毒。关于酒精和含氯消毒剂的有关说法正确的是
A.乙醇分子中与羟基相连的C原子是sp2杂化,另一个C原子是sp3杂化
B.乙醇是非极性分子,可与水以任意比例互溶
C.1个HClO分子中含有2个σ键
D.1个乙醇分子中含有6个σ键,1个π键
√
1
2
自我测试
H—O—Cl
2.光气(COCl2),又称碳酰氯,常温下为无色气体,有剧毒。光气化学性质不稳定,反应活性较高,常用作合成农药、药物、染料及其他化工产品的中间体。氯仿(CHCl3)被氧化可产生光气:2CHCl3+O2―→2HCl+2COCl2。下列说法正确的是
A.CHCl3的空间结构为正四面体
B.COCl2为平面形分子,中心C原子采用sp2杂化
C.CHCl3和COCl2分子中所有原子的最外层都满足8电子稳定结构
D.CHCl3是手性分子,存在对映异构体
自我测试
1
2
√
H原子:2电子
四面体
不存在手性碳原子
有机化合物中的共价键和同分异构现象
第2课时
第一节 有机化合物的结构特点
课 堂 引 入
甲烷不能发生加成反应,乙烯含有碳碳双键,能发生加成反应,二者碳碳共价键的类型有什么不同呢?
甲烷
乙烯
1.有机化合物中共价键的类型
原子轨道的重叠方式
σ键和π键
目标一 有机化合物中的共价键
(1) σ键——“头碰头”重叠
σ键的特征是以形成化学键的两原子核的连线为轴做旋转操作,共价键的电子云的图形不变,这种特征称为轴对称。
常见的σ键:
H
H
H
H
109°28′
四个氢原子的1s轨道和碳原子的四个sp3杂化轨道形成四个σ键
甲烷分子的成键分析
4 + →
H C CH4
p-p π键的形成的过程:
(2) π键——“肩并肩”重叠
②“肩并肩”重叠:轨道重叠程度小于σ键,π键没有σ键稳定,比较容易断裂而发生化学反应。
π键的特征:
①轨道重叠部分垂直于键轴呈镜面对称。通过π键连接的原子不能绕键轴旋转,否则会导致π键的破坏。
两个碳原子的sp2杂化轨道分别与2个氢原子的1s轨道形成2个C—H σ键(sp2-s),与另一个碳原子的sp2杂化轨道形成一个C—C σ键(sp2-sp2)。 两个碳原子未参与杂化的2p轨道形成1个π键。乙烯分子的空间结构为平面三角形。
σ键
π键
乙烯分子的成键分析
两个碳原子的sp杂化轨道分别与1个氢原子的1s轨道形成2个C—H σ键(sp-s),与另一个碳原子的sp杂化轨道形成1个C—C σ键(sp-sp)。碳原子未参与杂化的2p轨道两两形成2个π键。乙炔分子的空间结构为直线形。
σ
π
π
乙炔分子的成键分析
(3)根据成键原子形成共用电子对的数目可分为单键、双键、三键。
(4)共价键类型与有机反应类型的关系
①甲烷含有C—H σ键,能发生取代反应。
②π键的轨道重叠程度比σ键的小,比较容易断裂,π键更活泼,如乙烯和乙炔含有π键,能发生加成反应。
有机化合物中的共价键
单键只含σ键
双键中含有一个σ键和一个π键
三键中含有一个σ键和两个π键
2.共价键极性与有机反应
共价键极性越强,有机反应越容易发生。
(1)乙醇、水分别与钠反应的比较
在反应时,乙醇分子和水分子中的O—H断裂。同样条件,水与钠反应较剧烈,其原因是乙醇分子中氢氧键的极性比水分子中氢氧键的极性弱。
基团之间的相互影响使官能团中化学键的极性发生变化,从而影响官能团和物质的性质。
(2)乙醇与氢溴酸的反应
+H2O
反应中乙醇分子中断裂的键是C—O,原因是C—O极性较强。
3.有机反应的特点
共价键的断裂需要吸收能量,而且有机化合物分子中共价键断裂的位置存在多种可能。相对无机反应,有机反应一般反应速率较小,副反应较多,产物比较复杂。
1.某有机物分子的结构简式为 ,该分子中有 个σ键, 个π键, (填“有”或“没有”)非极性键。根据共价键的类型和极性可推测该物质可发生 反应和 反应,与钠反应的剧烈程度比水与钠反应的
剧烈程度 。原因是_________________________________________________
。
8
2
有
加成
取代
大
CH2==CHCOOH中 中的氢氧键受酮羰基影响,
极性更强,更易断裂
导思
2.请从化学键和官能团的角度分析下列反应中有机化合物的变化。
提示 化学键:甲烷分子中的C—H σ键能发生取代反应;在乙烯分子中,碳碳双键含有π键能发生加成反应。
官能团:甲烷无官能团,一氯甲烷的官能团是碳氯键;乙烯的官能团是碳碳双键,加成反应产物的官能团是碳溴键。
导思
1.正误判断
(1)σ键比π键牢固,所以不会断裂( )
(2)甲烷分子中只有C—H σ键,只能发生取代反应( )
(3)乙烯分子中含有π键,所以化学性质比甲烷活泼( )
(4)乙酸与钠反应比水与钠反应更剧烈,是因为乙酸分子中氢氧键的极性更强
( )
×
×
√
√
导练
2.下列关于有机化合物中化学键的说法不正确的是
A.烷烃中的化学键均为σ键
B.CH3NH2中C—H的极性比N—H的极性弱
C.乙烯分子中含有极性键和非极性键
D.1个丙炔分子中含有5个σ键和3个π键
√
导练
电负性:N > C
HC≡C—CH3
6个σ键、2个π键
物质名称 正戊烷 异戊烷 新戊烷
结构简式
相同点 不同点 沸 点 【思考与讨论】试分析以下三种分子模型,确定它们的分子式和相互关系。
分子式相同,通式相同,都属于烷烃
碳骨架不同(碳原子间的连接顺序不同)
物理性质不同,支链越多,沸点越低
正戊烷(沸点36.1℃)
异戊烷(沸点27.9℃)
新戊烷(沸点9.5℃)
目标二 有机化合物的同分异构现象
CH3CH2CH2CH2CH3
1.同分异构现象和同分异构体
一般情况下,有机化合物中的碳原子数目越多,其同分异构体的数目也越多。
碳原子数 1 2 3 4 5 6 7 8 9 10
同分异体数 无 无 无 2 3 5 9 18 35 75
烷烃的碳原子数与其对应的同分异构体数
化合物具有相同的分子式,但结构不同的现象叫同分异构现象。具有同分异构现象的化合物互为同分异构体。
同分异构现象
构造异构
立体异构
碳架异构
顺反异构
对映异构
位置异构
官能团异构
碳骨架不同
官能团的位置不同
官能团不同
2.同分异构现象的类型
异构类型 实例
碳架异构
CH3—CH2—CH2—CH3
异丁烷
CH3—CH—CH3
CH3
正丁烷
C4H10
3.构造异构现象
异构类型 实例
位置异构
1-丁烯
2-丁烯
CH2=CH—CH2—CH3
1
2
3
4
CH3—CH=CH—CH3
1
2
3
4
C4H8
C6H4Cl2
邻二氯苯
间二氯苯
对二氯苯
异构类型 实例
官能团异构
C2H6O
乙醇
二甲醚
在表示有机化合物的组成和结构时,将碳、氢元素符号省略,只表示分子中键的连接情况和官能团,每个拐点或终点均表示有一个碳原子,这样得到的式子称为键线式。例如:丙烯可表示为 ,乙醇可表示为 。
4.键线式
知识拓展
对映异构
氯溴碘代甲烷,有两种异构体,互为镜像却不能重合,这种现象称为对映异构。一般来说,若碳原子连接四个不同的原子或原子团则称为手性碳原子,含有手性碳原子的化合物存在对映异构。
1.具有相同相对分子质量的两种化合物一定是同分异构体吗?
提示 不一定。因为相对分子质量相同的两种化合物,分子式不一定相同(如CO和C2H4)。判断是否为同分异构体的关键是看是不是具有相同的分子式和不同的结构。
导思
提示 不互为同分异构体,由于二者均为四面体结构,为同一种物质。
2. 与 是否互为同分异构体?说明理由。
提示 是,属于官能团异构。CH3COOH与HCOOCH3的分子式相同,官能团分别为羧基和酯基。
3.CH3COOH与HCOOCH3是否互为同分异构体?若是,属于哪种类型的同分异构体?
导思
1.正误判断
(1)分子式相同,各元素质量分数也相同的物质是同种物质( )
(2)同素异形体、同分异构体之间的转化是物理变化( )
(3)同系物之间可以互为同分异构体( )
(4)淀粉与纤维素是分子式为(C6H10O5)n的同分异构体( )
(5)CH3CH2CH2Cl与CH3CHClCH3互为位置异构( )
导练
×
×
×
×
√
2.已知下列有机化合物:①CH3—CH2—CH2—CH3和
②CH2==CH—CH2—CH3和CH3—CH==CH—CH3
③CH3—CH2—OH和CH3—O—CH3
④ 和
⑤CH3—CH2—CH==CH—CH3和
⑥CH2==CH—CH==CH2和CH3—CH2—C≡CH
(1)其中属于同分异构体的是____________(填序号,下同)。
(2)其中属于碳架异构的是____________。
(3)其中属于位置异构的是____________。
①②③⑤⑥
①
②
导练
①CH3—CH2—CH2—CH3和
②CH2==CH—CH2—CH3和CH3—CH==CH—CH3
③CH3—CH2—OH和CH3—O—CH3
④ 和
⑤CH3—CH2—CH==CH—CH3和
⑥CH2==CH—CH==CH2和CH3—CH2—C≡CH
(4)其中属于官能团异构的是____________。
(5)其中属于同一种物质的是_________。
(6)②中1-丁烯的键线式为____________。
③⑤⑥
④
导练
1.(2022·烟台高二月考)世界卫生组织(WHO)宣布,将新型冠状病毒感染的肺炎疫情列为国际关注的突发公共卫生事件。防疫专家表示,医用酒精、含氯消毒剂(如“84”消毒液)等可以有效杀灭病毒。关于酒精和含氯消毒剂的有关说法正确的是
A.乙醇分子中与羟基相连的C原子是sp2杂化,另一个C原子是sp3杂化
B.乙醇是非极性分子,可与水以任意比例互溶
C.1个HClO分子中含有2个σ键
D.1个乙醇分子中含有6个σ键,1个π键
√
1
2
自我测试
H—O—Cl
2.光气(COCl2),又称碳酰氯,常温下为无色气体,有剧毒。光气化学性质不稳定,反应活性较高,常用作合成农药、药物、染料及其他化工产品的中间体。氯仿(CHCl3)被氧化可产生光气:2CHCl3+O2―→2HCl+2COCl2。下列说法正确的是
A.CHCl3的空间结构为正四面体
B.COCl2为平面形分子,中心C原子采用sp2杂化
C.CHCl3和COCl2分子中所有原子的最外层都满足8电子稳定结构
D.CHCl3是手性分子,存在对映异构体
自我测试
1
2
√
H原子:2电子
四面体
不存在手性碳原子
