2022-2023学年高二化学人教版(2019)选择性必修23.4 配合物与超分子 课件(35张PPT)
文档属性
| 名称 | 2022-2023学年高二化学人教版(2019)选择性必修23.4 配合物与超分子 课件(35张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 7.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-20 17:09:36 | ||
图片预览







文档简介
(共35张PPT)
第三章
第四节
配合物与超分子
情境导入
无水CuSO4固体是白色的,但CuSO4·5H2O晶体却是蓝色的,为什么呢?
CuSO4 CuSO4·5H2O
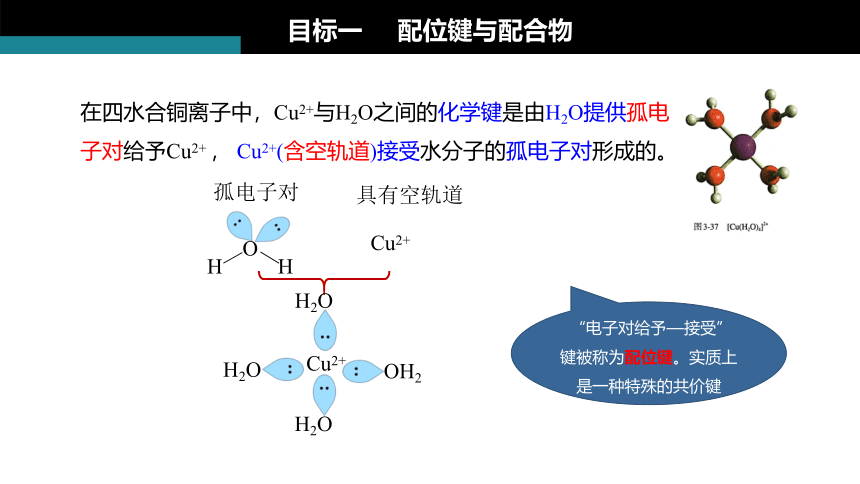
在四水合铜离子中,Cu2+与H2O之间的化学键是由H2O提供孤电子对给予Cu2+ , Cu2+(含空轨道)接受水分子的孤电子对形成的。
O
H
H
孤电子对
Cu2+
具有空轨道
Cu2+
H2O
H2O
H2O
OH2
“电子对给予—接受”键被称为配位键。实质上是一种特殊的共价键
目标一 配位键与配合物
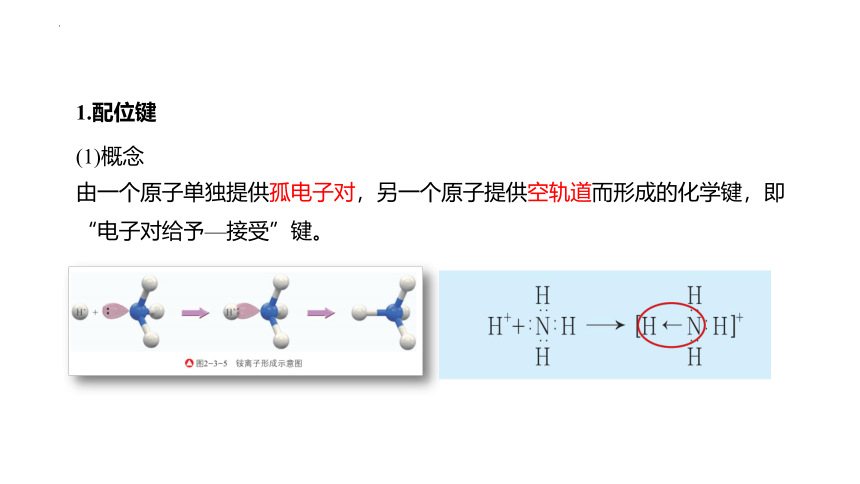
1.配位键
(1)概念
由一个原子单独提供孤电子对,另一个原子提供空轨道而形成的化学键,即“电子对给予—接受”键。
(2)形成条件
③配位键同样具有饱和性和方向性。一般来说,多数过渡金属元素的原子或离子形成配位键的数目是基本不变的,如Ag+形成2个配位键;Cu2+形成4个配位键等。
①成键原子一方能提供孤电子对(如分子有NH3、H2O、HF、CO等;离子有Cl-、OH-、CN-、SCN-等);
②成键原子另一方能提供空轨道(如H+、Al3+、B及过渡金属的原子或离子,如Fe、Ni、Fe3+、Cu2+、Zn2+、Ag+、Co3+、Cr3+等)
(3)表示方法
A—B
提供孤电子对的原子,叫配体
接受孤电子对的原子
(或A B)
例如:[Cu(H2O)4]2+中的配位键可表示为
2. 配合物
(1)概念
通常把金属离子或原子(称为中心离子或原子)与某些分子或离子(称为配体或配位体)以配位键结合形成的化合物称为配位化合物,简称配合物。如[Cu(NH3)4]SO4、[Ag(NH3)2]OH等均为配合物。
[Cu(NH3)4 ]SO4
配离子(内界)
离子(外界)
中
心
离
子
配
体
配
位
数
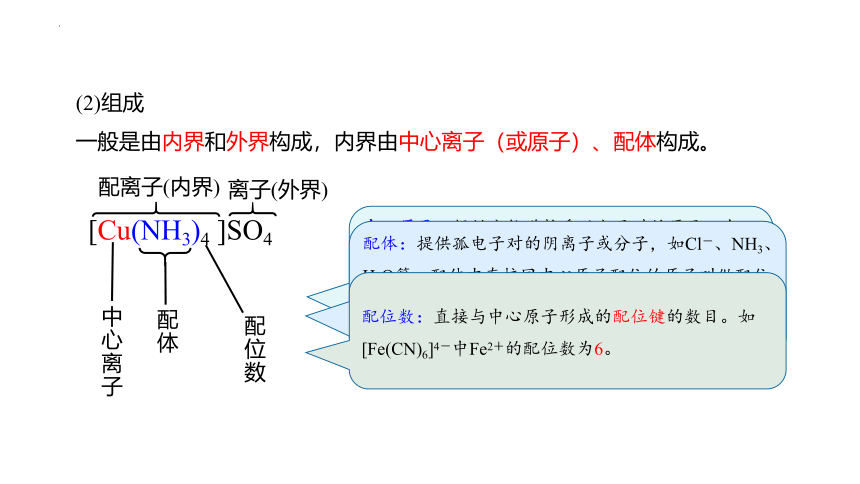
(2)组成
一般是由内界和外界构成,内界由中心离子(或原子)、配体构成。
中心原子:提供空轨道接受孤电子对的原子。中心原子一般都是带正电荷的阳离子(此时又叫中心离子),最常见的有过渡金属离子:Fe3+、Ag+、Cu2+、Zn2+等。
配体:提供孤电子对的阴离子或分子,如Cl-、NH3、H2O等。配体中直接同中心原子配位的原子叫做配位原子。配位原子必须是含有孤电子对的原子,如NH3中的N,H2O中的O等。
配位数:直接与中心原子形成的配位键的数目。如[Fe(CN)6]4-中Fe2+的配位数为6。
配合物 内界 外界 中心粒子 配体 配位数
[Ag(NH3)2]OH 氢氧化二氨合银
K3[Fe(CN)6] 六氰合铁酸钾
[Co(NH3)5Cl]Cl2
Ni(CO)4 四羰基镍
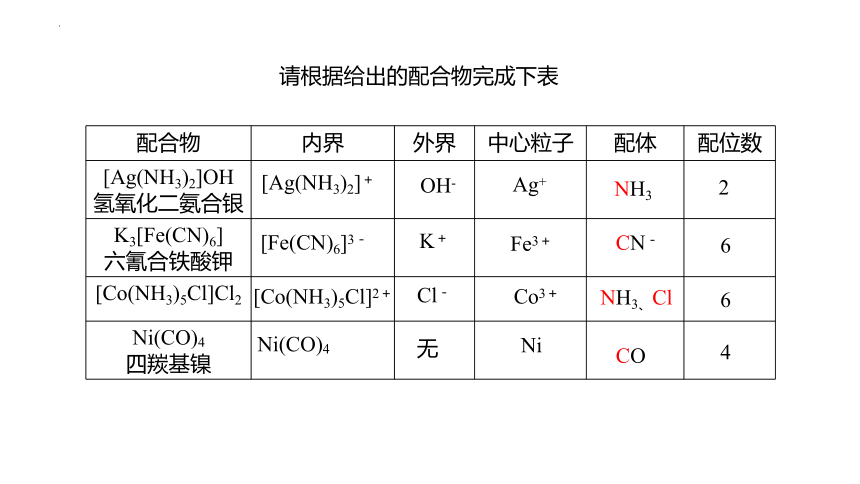
请根据给出的配合物完成下表
[Ag(NH3)2]+
OH-
Ag+
NH3
2
[Fe(CN)6]3-
K+
Fe3+
CN-
6
[Co(NH3)5Cl]2+
Cl-
Co3+
NH3、Cl
6
Ni(CO)4
无
Ni
CO
4
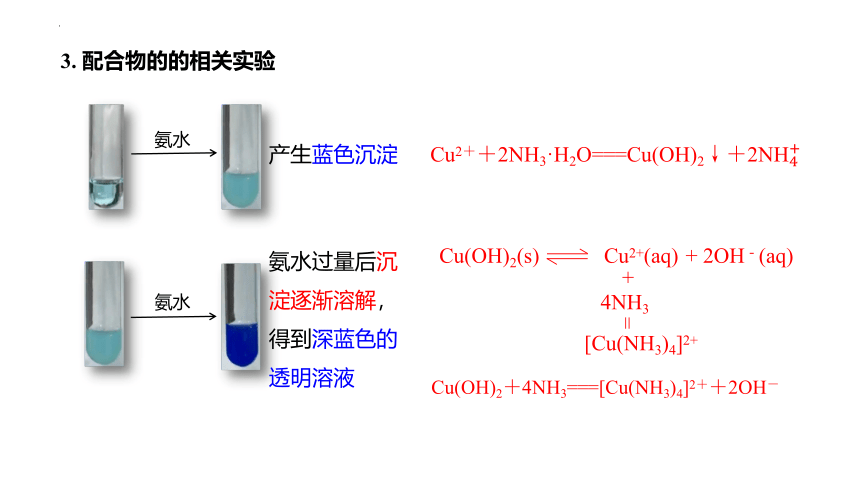
氨水
氨水
产生蓝色沉淀
Cu2++2NH3·H2O===Cu(OH)2↓+2
氨水过量后沉淀逐渐溶解,得到深蓝色的透明溶液
Cu(OH)2+4NH3===[Cu(NH3)4]2++2OH-
Cu(OH)2(s) Cu2+(aq) + 2OH-(aq)
+
4NH3
[Cu(NH3)4]2+
=
3. 配合物的的相关实验
[Cu(H2O)4]2+
[Cu(NH3)4]2+
Cu(OH)2
配位键的强度有大有小,有的配合物较稳定,有的配合物较不稳定。通常情况,较稳定的配合物可以转化为稳定性更强的配合物。
析出深蓝色的晶体
溶剂极性:乙醇 < 水
[Cu(NH3)4]SO4·H2O在乙醇中的溶解度小
铜氨配合物
氨水
氨水
95% 乙醇
[Cu(NH3)4]2+++H2O ===[Cu(NH3)4]SO4·H2O↓
乙醇
KSCN 溶液
溶液变为红色
Fe3++3SCN-===Fe(SCN)3
利用硫氰化铁配离子的颜色,可鉴定溶液中存在Fe3+;又由于该离子的颜色极似血液,常被用于电影特技和魔术表演。
AgCl(s) Ag+(aq) + Cl-(aq)
+
2NH3
[Ag(NH3)2]+
=
少量
AgNO3 溶液
氨水
出现白色沉淀
Ag++Cl-===AgCl↓
沉淀溶解,溶液呈无色
AgCl+2NH3===[Ag(NH3)2]++Cl-
电解氧化铝的助熔剂
Na3[AlF6]
热水瓶胆镀银(银镜反应)
[Ag(NH3)2]OH
(1)在生产、生活中的应用
4. 配合物的应用
叶绿素
(2)生命体中的应用
血红蛋白
维生素B12
(3)在医药中的应用
第二代铂类抗癌药(碳铂)
导思
1. 正误判断
(1)配位键实质上是一种特殊的共价键( )
(2)提供孤电子对的微粒既可以是分子,也可以是离子( )
(3)有配位键的化合物就是配位化合物( )
(4)配位化合物都很稳定( )
(5)在配合物[Co(NH3)5Cl]Cl2中的Cl-均可与AgNO3反应生成AgCl沉淀( )
(6)Ni(CO)4是配合物,它是由中心原子与配体构成的( )
√
×
×
×
√
√
2. H2O与H3O+相比
(1)中心原子的杂化方式是否相同?
提示 相同,都是sp3杂化。
(2)微粒空间结构是否相同?
提示 不同。H2O呈V形,H3O+呈三角锥形。
(3)微粒中的键角是否相同?若不同,哪个键角大?为什么?
提示 不同。H3O+中键角大。因为H2O中中心氧原子有2个孤电子对,而H3O+中中心氧原子有1个孤电子对,孤电子对对成键电子对的排斥作用大。
提示 电负性:F>H,使得NF3提供孤电子对的能力小于NH3。
3. (1)人体内血红蛋白是Fe2+卟啉配合物,Fe2+与O2结合形成配合物,而CO与血红蛋白中的Fe2+也能形成配合物。根据生活常识,比较其配合物的稳定性。
提示 血红蛋白中Fe2+与CO形成的配合物更稳定。
(2)[Cu(NH3)4]2+与[Cu(H2O)4]2+哪个配位离子更稳定?原因是什么?
提示 [Cu(NH3)4]2+更稳定。因为N和O都有孤电子对,但O的电负性大,吸引孤电子对的能力强,故NH3提供孤电子对的能力比H2O大。
(3)NH3与Cu2+形成配合物,但NF3很难与Cu2+形成配合物,原因是什么?
导练
1. 下列物质中,不能作为配合物的配位体的是( )
A.NH3 B. C.H2O D.SCN-
B
N原子有孤电子对
O原子有孤电子对
N、S原子有孤电子对
2. 按下图连接好装置,通电后发现铁电极附近
有蓝色沉淀生成。下列相关叙述中不正确的是
( )
A.铁电极上发生的反应为Fe-2e-===Fe2+
B.铁氰化钾{K3[Fe(CN)6]}溶液中Fe3+和CN-形成了配位键
C.生成蓝色沉淀的离子方程式为Fe2++K++[Fe(CN)6]3-===KFe[Fe(CN)6]↓
D.Fe2+与[Fe(CN)6]3-形成了配位键
D
离子键
3. 化合物NH3与BF3可以通过配位键形成NH3·BF3。
(1)配位键的形成条件是_______________________________________________
_________。
(2)在NH3·BF3中,________原子提供孤电子对,________原子接受孤电子对。
形成配位键的一方能够提供孤电子对,另一方能够提
供空轨道
氮(或N)
硼(或B)
归纳总结
(1)配合物的稳定性
配合物具有一定的稳定性。配合物中的配位键越强,配合物越稳定。当作为中心原子(或离子)的金属原子(或离子)相同时,配合物的稳定性与配体的性质有关。
(2)配位键的稳定性
①电子对给予体形成配位键的能力:NH3>H2O。
②接受体形成配位键的能力:H+>过渡金属>主族金属。
1. 定义
目标二 超分子
超分子有的是有限的,有的是无限伸展的
是由两种或两种以上的分子通过分子间相互作用形成的分子聚集体。
分子是广义的,包括离子。
主要是静电作用、范德华力和氢键等
(1)分子识别
2. 重要特征及其应用
a. 分离 C60 和 C70 b. 冠醚识别碱金属离子
C60
C70
(1)分子识别
a. 分离 C60 和 C70 b. 冠醚识别碱金属离子
15-冠-5
12-冠-4
C 原子是环的骨架,稳定了整个冠醚,
O 原子吸引阳离子。
冠醚环的大小与金属离子匹配,才能识别
冠醚能与阳离子尤其是碱金属阳离子作用,并且随环的大小不同而与不同的金属离子作用,将阳离子以及对应的阴离子都带入有机溶剂,因而成为有机反应中很好的催化剂。
(2)自组装
细胞和细胞器的双分子膜的自组装
极性基团(亲水)
非极性基团(疏水)
极性基团
导练
1. 下列关于超分子的说法不正确的是( )
A.超分子是由两种或两种以上的分子通过分子间相互作用形成的分子聚集体
B.超分子都是无限伸展的
C.冠醚是一种超分子,可以识别碱金属离子
D.细胞和细胞器的双分子膜具有自组装特征
B
超分子有的是有限的,有的是无限伸展的
导练
2. 我国科学家制得了SiO2超分子纳米管,微观结构如图所示。
下列叙述正确的是( )
A.SiO2与干冰的晶体结构相似
B.SiO2耐腐蚀,不与任何酸反应
C.该SiO2超分子纳米管具有分子识别和自组装的特征
D.光纤的主要成分是SiO2,具有导电性
C
SiO2是共价晶体而干冰是分子晶体,二者晶体结构不相似
可与HF反应
SiO2不导电
课堂小结
配合物与超分子
生产生活
生命体
可促进某些沉淀的溶解
定义
特征
医药
离子检验
[Cu(NH3)4]2+制备
Fe(SCN)3制备
[Ag(NH3)2]+制备
分子
识别
自组装
冠醚识别碱
金属离子
“杯酚”分离
C60 和 C70
1. 下列关于超分子和配合物的叙述不正确的是( )
A.利用超分子的分子识别特征,可以分离C60和C70
B.配合物中只含配位键
C.[Cu(H2O)4]2+中Cu2+提供空轨道,H2O中的氧原子提供孤电子对,从而形成
配位键
D.配合物在半导体等尖端技术、医药科学、催化反应和材料化学等领域都有
广泛应用
1
2
3
自我测试
4
B
配合物中不一定只含配位键,也可能含有其他化学键
自我测试
1
2
2. 下列不属于配位化合物的是( )
A.六氟合铝酸钠:Na3[AlF6]
B.氢氧化二氨合银:[Ag(NH3)2]OH
C.六氟合铁酸钾:K3[FeF6]
D.十二水硫酸铝钾:KAl(SO4)2·12H2O
D
铝离子提供空轨道,氟离子提供孤电子对
银离子提供空轨道,氨分子中氮原子提供孤电子对
铁离子提供空轨道,氟离子提供孤电子对
是由K+、Al3+、及H2O分子组成的离子化合物,属于复盐,不是配合物
3
4
自我测试
1
2
3
4
3. 氮及其化合物在生产生活中具有广泛用途。NH3是一种重要的化工原料,主要用于化肥工业,也广泛用于硝酸、纯碱等工业;合成氨反应为 N2(g)+3H2(g)===2NH3(g) ΔH=-92.4 kJ·mol-1。氮的氧化物对空气有污染,需要进行治理。已知NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4。下列说法不正确的是( )
A.该配合物中阴离子空间结构为正四面体形
B.配离子为[Fe(NO)(H2O)5]2+,配位数为6
C.Fe2+被氧化为Fe3+,失去的电子位于3d轨道
D.H2O分子是含有极性键的非极性分子
D
含有极性键的极性分子
自我测试
4
4. 臭氧(O3)在[Fe(H2O)6]2+催化下能将烟气中的SO2、NOx分别氧化为和
,NOx也可在其他条件下被还原为N2。
(1)中心原子轨道的杂化类型为_____;的空间结构为___________。
sp3
平面三角形
的价层电子对数为4+=4,sp3杂化
的价层电子对数为3+=3,sp2杂化,平面三角形
(2)[Fe(H2O)6]2+的配位数是____。
(3)N2分子中σ键与π键的数目比为______。
6
1∶2
3
1
2
第三章
第四节
配合物与超分子
情境导入
无水CuSO4固体是白色的,但CuSO4·5H2O晶体却是蓝色的,为什么呢?
CuSO4 CuSO4·5H2O
在四水合铜离子中,Cu2+与H2O之间的化学键是由H2O提供孤电子对给予Cu2+ , Cu2+(含空轨道)接受水分子的孤电子对形成的。
O
H
H
孤电子对
Cu2+
具有空轨道
Cu2+
H2O
H2O
H2O
OH2
“电子对给予—接受”键被称为配位键。实质上是一种特殊的共价键
目标一 配位键与配合物
1.配位键
(1)概念
由一个原子单独提供孤电子对,另一个原子提供空轨道而形成的化学键,即“电子对给予—接受”键。
(2)形成条件
③配位键同样具有饱和性和方向性。一般来说,多数过渡金属元素的原子或离子形成配位键的数目是基本不变的,如Ag+形成2个配位键;Cu2+形成4个配位键等。
①成键原子一方能提供孤电子对(如分子有NH3、H2O、HF、CO等;离子有Cl-、OH-、CN-、SCN-等);
②成键原子另一方能提供空轨道(如H+、Al3+、B及过渡金属的原子或离子,如Fe、Ni、Fe3+、Cu2+、Zn2+、Ag+、Co3+、Cr3+等)
(3)表示方法
A—B
提供孤电子对的原子,叫配体
接受孤电子对的原子
(或A B)
例如:[Cu(H2O)4]2+中的配位键可表示为
2. 配合物
(1)概念
通常把金属离子或原子(称为中心离子或原子)与某些分子或离子(称为配体或配位体)以配位键结合形成的化合物称为配位化合物,简称配合物。如[Cu(NH3)4]SO4、[Ag(NH3)2]OH等均为配合物。
[Cu(NH3)4 ]SO4
配离子(内界)
离子(外界)
中
心
离
子
配
体
配
位
数
(2)组成
一般是由内界和外界构成,内界由中心离子(或原子)、配体构成。
中心原子:提供空轨道接受孤电子对的原子。中心原子一般都是带正电荷的阳离子(此时又叫中心离子),最常见的有过渡金属离子:Fe3+、Ag+、Cu2+、Zn2+等。
配体:提供孤电子对的阴离子或分子,如Cl-、NH3、H2O等。配体中直接同中心原子配位的原子叫做配位原子。配位原子必须是含有孤电子对的原子,如NH3中的N,H2O中的O等。
配位数:直接与中心原子形成的配位键的数目。如[Fe(CN)6]4-中Fe2+的配位数为6。
配合物 内界 外界 中心粒子 配体 配位数
[Ag(NH3)2]OH 氢氧化二氨合银
K3[Fe(CN)6] 六氰合铁酸钾
[Co(NH3)5Cl]Cl2
Ni(CO)4 四羰基镍
请根据给出的配合物完成下表
[Ag(NH3)2]+
OH-
Ag+
NH3
2
[Fe(CN)6]3-
K+
Fe3+
CN-
6
[Co(NH3)5Cl]2+
Cl-
Co3+
NH3、Cl
6
Ni(CO)4
无
Ni
CO
4
氨水
氨水
产生蓝色沉淀
Cu2++2NH3·H2O===Cu(OH)2↓+2
氨水过量后沉淀逐渐溶解,得到深蓝色的透明溶液
Cu(OH)2+4NH3===[Cu(NH3)4]2++2OH-
Cu(OH)2(s) Cu2+(aq) + 2OH-(aq)
+
4NH3
[Cu(NH3)4]2+
=
3. 配合物的的相关实验
[Cu(H2O)4]2+
[Cu(NH3)4]2+
Cu(OH)2
配位键的强度有大有小,有的配合物较稳定,有的配合物较不稳定。通常情况,较稳定的配合物可以转化为稳定性更强的配合物。
析出深蓝色的晶体
溶剂极性:乙醇 < 水
[Cu(NH3)4]SO4·H2O在乙醇中的溶解度小
铜氨配合物
氨水
氨水
95% 乙醇
[Cu(NH3)4]2+++H2O ===[Cu(NH3)4]SO4·H2O↓
乙醇
KSCN 溶液
溶液变为红色
Fe3++3SCN-===Fe(SCN)3
利用硫氰化铁配离子的颜色,可鉴定溶液中存在Fe3+;又由于该离子的颜色极似血液,常被用于电影特技和魔术表演。
AgCl(s) Ag+(aq) + Cl-(aq)
+
2NH3
[Ag(NH3)2]+
=
少量
AgNO3 溶液
氨水
出现白色沉淀
Ag++Cl-===AgCl↓
沉淀溶解,溶液呈无色
AgCl+2NH3===[Ag(NH3)2]++Cl-
电解氧化铝的助熔剂
Na3[AlF6]
热水瓶胆镀银(银镜反应)
[Ag(NH3)2]OH
(1)在生产、生活中的应用
4. 配合物的应用
叶绿素
(2)生命体中的应用
血红蛋白
维生素B12
(3)在医药中的应用
第二代铂类抗癌药(碳铂)
导思
1. 正误判断
(1)配位键实质上是一种特殊的共价键( )
(2)提供孤电子对的微粒既可以是分子,也可以是离子( )
(3)有配位键的化合物就是配位化合物( )
(4)配位化合物都很稳定( )
(5)在配合物[Co(NH3)5Cl]Cl2中的Cl-均可与AgNO3反应生成AgCl沉淀( )
(6)Ni(CO)4是配合物,它是由中心原子与配体构成的( )
√
×
×
×
√
√
2. H2O与H3O+相比
(1)中心原子的杂化方式是否相同?
提示 相同,都是sp3杂化。
(2)微粒空间结构是否相同?
提示 不同。H2O呈V形,H3O+呈三角锥形。
(3)微粒中的键角是否相同?若不同,哪个键角大?为什么?
提示 不同。H3O+中键角大。因为H2O中中心氧原子有2个孤电子对,而H3O+中中心氧原子有1个孤电子对,孤电子对对成键电子对的排斥作用大。
提示 电负性:F>H,使得NF3提供孤电子对的能力小于NH3。
3. (1)人体内血红蛋白是Fe2+卟啉配合物,Fe2+与O2结合形成配合物,而CO与血红蛋白中的Fe2+也能形成配合物。根据生活常识,比较其配合物的稳定性。
提示 血红蛋白中Fe2+与CO形成的配合物更稳定。
(2)[Cu(NH3)4]2+与[Cu(H2O)4]2+哪个配位离子更稳定?原因是什么?
提示 [Cu(NH3)4]2+更稳定。因为N和O都有孤电子对,但O的电负性大,吸引孤电子对的能力强,故NH3提供孤电子对的能力比H2O大。
(3)NH3与Cu2+形成配合物,但NF3很难与Cu2+形成配合物,原因是什么?
导练
1. 下列物质中,不能作为配合物的配位体的是( )
A.NH3 B. C.H2O D.SCN-
B
N原子有孤电子对
O原子有孤电子对
N、S原子有孤电子对
2. 按下图连接好装置,通电后发现铁电极附近
有蓝色沉淀生成。下列相关叙述中不正确的是
( )
A.铁电极上发生的反应为Fe-2e-===Fe2+
B.铁氰化钾{K3[Fe(CN)6]}溶液中Fe3+和CN-形成了配位键
C.生成蓝色沉淀的离子方程式为Fe2++K++[Fe(CN)6]3-===KFe[Fe(CN)6]↓
D.Fe2+与[Fe(CN)6]3-形成了配位键
D
离子键
3. 化合物NH3与BF3可以通过配位键形成NH3·BF3。
(1)配位键的形成条件是_______________________________________________
_________。
(2)在NH3·BF3中,________原子提供孤电子对,________原子接受孤电子对。
形成配位键的一方能够提供孤电子对,另一方能够提
供空轨道
氮(或N)
硼(或B)
归纳总结
(1)配合物的稳定性
配合物具有一定的稳定性。配合物中的配位键越强,配合物越稳定。当作为中心原子(或离子)的金属原子(或离子)相同时,配合物的稳定性与配体的性质有关。
(2)配位键的稳定性
①电子对给予体形成配位键的能力:NH3>H2O。
②接受体形成配位键的能力:H+>过渡金属>主族金属。
1. 定义
目标二 超分子
超分子有的是有限的,有的是无限伸展的
是由两种或两种以上的分子通过分子间相互作用形成的分子聚集体。
分子是广义的,包括离子。
主要是静电作用、范德华力和氢键等
(1)分子识别
2. 重要特征及其应用
a. 分离 C60 和 C70 b. 冠醚识别碱金属离子
C60
C70
(1)分子识别
a. 分离 C60 和 C70 b. 冠醚识别碱金属离子
15-冠-5
12-冠-4
C 原子是环的骨架,稳定了整个冠醚,
O 原子吸引阳离子。
冠醚环的大小与金属离子匹配,才能识别
冠醚能与阳离子尤其是碱金属阳离子作用,并且随环的大小不同而与不同的金属离子作用,将阳离子以及对应的阴离子都带入有机溶剂,因而成为有机反应中很好的催化剂。
(2)自组装
细胞和细胞器的双分子膜的自组装
极性基团(亲水)
非极性基团(疏水)
极性基团
导练
1. 下列关于超分子的说法不正确的是( )
A.超分子是由两种或两种以上的分子通过分子间相互作用形成的分子聚集体
B.超分子都是无限伸展的
C.冠醚是一种超分子,可以识别碱金属离子
D.细胞和细胞器的双分子膜具有自组装特征
B
超分子有的是有限的,有的是无限伸展的
导练
2. 我国科学家制得了SiO2超分子纳米管,微观结构如图所示。
下列叙述正确的是( )
A.SiO2与干冰的晶体结构相似
B.SiO2耐腐蚀,不与任何酸反应
C.该SiO2超分子纳米管具有分子识别和自组装的特征
D.光纤的主要成分是SiO2,具有导电性
C
SiO2是共价晶体而干冰是分子晶体,二者晶体结构不相似
可与HF反应
SiO2不导电
课堂小结
配合物与超分子
生产生活
生命体
可促进某些沉淀的溶解
定义
特征
医药
离子检验
[Cu(NH3)4]2+制备
Fe(SCN)3制备
[Ag(NH3)2]+制备
分子
识别
自组装
冠醚识别碱
金属离子
“杯酚”分离
C60 和 C70
1. 下列关于超分子和配合物的叙述不正确的是( )
A.利用超分子的分子识别特征,可以分离C60和C70
B.配合物中只含配位键
C.[Cu(H2O)4]2+中Cu2+提供空轨道,H2O中的氧原子提供孤电子对,从而形成
配位键
D.配合物在半导体等尖端技术、医药科学、催化反应和材料化学等领域都有
广泛应用
1
2
3
自我测试
4
B
配合物中不一定只含配位键,也可能含有其他化学键
自我测试
1
2
2. 下列不属于配位化合物的是( )
A.六氟合铝酸钠:Na3[AlF6]
B.氢氧化二氨合银:[Ag(NH3)2]OH
C.六氟合铁酸钾:K3[FeF6]
D.十二水硫酸铝钾:KAl(SO4)2·12H2O
D
铝离子提供空轨道,氟离子提供孤电子对
银离子提供空轨道,氨分子中氮原子提供孤电子对
铁离子提供空轨道,氟离子提供孤电子对
是由K+、Al3+、及H2O分子组成的离子化合物,属于复盐,不是配合物
3
4
自我测试
1
2
3
4
3. 氮及其化合物在生产生活中具有广泛用途。NH3是一种重要的化工原料,主要用于化肥工业,也广泛用于硝酸、纯碱等工业;合成氨反应为 N2(g)+3H2(g)===2NH3(g) ΔH=-92.4 kJ·mol-1。氮的氧化物对空气有污染,需要进行治理。已知NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4。下列说法不正确的是( )
A.该配合物中阴离子空间结构为正四面体形
B.配离子为[Fe(NO)(H2O)5]2+,配位数为6
C.Fe2+被氧化为Fe3+,失去的电子位于3d轨道
D.H2O分子是含有极性键的非极性分子
D
含有极性键的极性分子
自我测试
4
4. 臭氧(O3)在[Fe(H2O)6]2+催化下能将烟气中的SO2、NOx分别氧化为和
,NOx也可在其他条件下被还原为N2。
(1)中心原子轨道的杂化类型为_____;的空间结构为___________。
sp3
平面三角形
的价层电子对数为4+=4,sp3杂化
的价层电子对数为3+=3,sp2杂化,平面三角形
(2)[Fe(H2O)6]2+的配位数是____。
(3)N2分子中σ键与π键的数目比为______。
6
1∶2
3
1
2
