2022-2023学年高二化学人教版(2019)选择性必修23.3.4 晶体类型的比较 课件(25张PPT)
文档属性
| 名称 | 2022-2023学年高二化学人教版(2019)选择性必修23.3.4 晶体类型的比较 课件(25张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-20 17:10:21 | ||
图片预览







文档简介
(共25张PPT)
晶体类型的比较
第4课时
第三节 金属晶体与离子晶体
晶体类型的比较
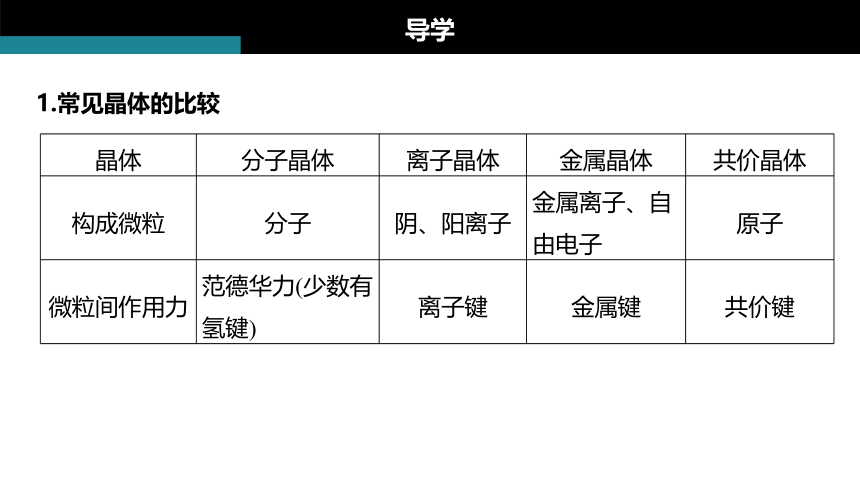
1.常见晶体的比较
导学
晶体 分子晶体 离子晶体 金属晶体 共价晶体
构成微粒 分子 阴、阳离子 金属离子、自由电子 原子
微粒间作用力 范德华力(少数有氢键) 离子键 金属键 共价键
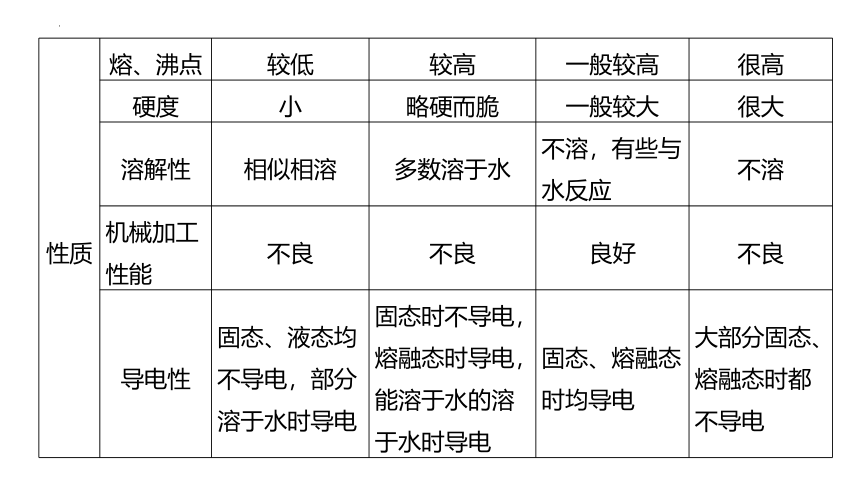
性质 熔、沸点 较低 较高 一般较高 很高
硬度 小 略硬而脆 一般较大 很大
溶解性 相似相溶 多数溶于水 不溶,有些与水反应 不溶
机械加工性能 不良 不良 良好 不良
导电性 固态、液态均不导电,部分溶于水时导电 固态时不导电,熔融态时导电,能溶于水的溶于水时导电 固态、熔融态时均导电 大部分固态、熔融态时都不导电
作用力大小规律 组成和结构相似的分子,相对分子质量大的范德华力大 离子所带电荷数多、半径小的离子键强 金属原子的价电子数多、半径小的金属离子与自由电子间的作用力强 共价键键长短(电子云重叠多)、原子半径小的共价键稳定
典型实例 干冰、白磷、冰、硫黄、HCl、CH4等 NaCl、NaOH、Na2O、Na2O2等 Na、Mg、Al、Fe、Cu、Zn等 金刚石、晶体硅、二氧化硅等
2.分类比较晶体的熔、沸点高低的方法
(1)不同类型晶体的熔、沸点高低的一般规律
共价晶体>离子晶体>分子晶体。金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点很高,如汞、镓、铯等熔、沸点很低,金属晶体一般不参与比较。
(2)共价晶体
由共价键形成的共价晶体中,原子半径小的键长短,键能大,晶体的熔、沸点高。如熔点:金刚石>碳化硅>硅。
(3)离子晶体
一般地说,阴、阳离子所带电荷数越多,离子半径越小,则离子键就越强,其离子晶体的熔、沸点就越高。如熔点:MgO>MgCl2>NaCl>CsCl。
(4)分子晶体
①分子间作用力越大,物质的熔、沸点越高;具有氢键的分子晶体熔、沸点反常的高。如熔、沸点:H2O>H2Te>H2Se>H2S。
②组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高,如熔、沸点:SnH4>GeH4>SiH4>CH4,F2③组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔、沸点越高,如熔、沸点:CO>N2,CH3OH>CH3CH3。
导练
1.下列关于晶体的说法中正确的是
①在晶体中只要有阴离子就一定有阳离子,只要有阳离子就一定有阴离子
②分子晶体的熔点一定比金属晶体的低
③晶体中分子间作用力越大,分子越稳定
④离子晶体中一定存在离子键
⑤分子晶体中一定存在共价键
⑥共价晶体中一定存在共价键
A.②④⑥ B.④⑤
C.④⑥ D.③④
√
晶体中只要有阴离子就一定有阳离子,但有阳离子,不一定有阴离子,如金属晶体中只有金属阳离子和自由电子,没有阴离子,①错误;
有些分子晶体的熔点高于金属晶体,如汞常温下为液态,碘常温下为固态,②错误;
分子稳定性与分子间作用力无关,③错误;
由0族元素形成的分子晶体中不存在化学键,⑤错误。
2.下列有关性质的比较正确的是
①硬度:BaO>CaO>MgO
②水溶性:CH3CH2OH>CH3CH2OCH2CH3
③沸点:HCl>HF
④熔点:NaCl>MgO
⑤分子或离子中键角:H2O⑥沸点:H2O>HF>NH3
⑦熔点:金刚石>生铁>纯铁>钠
⑧熔点:二氧化硅>NaCl>I2>冰
A.①②⑥⑧ B.①②⑤⑥⑧ C.②④⑤⑥ D.②⑤⑥⑧
√
r(Mg2+)乙醇分子中有亲水基团,乙醚分子中无亲水基团,故水溶性:CH3CH2OH>CH3CH2OCH2CH3,故②正确;
HF分子间能形成氢键,所以沸点高于HCl,故③错误;
MgO中离子电荷数比NaCl中离子电荷数大,且离子半径小,所以离子键:NaCl由分子结构可知,键角:H2O对于HF来讲,1 mol HF只有1 mol H,故只能形成1 mol氢键,NH3虽然具有三个H,但只有一个孤电子对,故也只能形成1 mol氢键,水分子则可以形成2 mol氢键,故水的熔、沸点最高,由于电负性原因,F—H…F氢键的强度>N—H…N氢键的强度,故HF的沸点高于氨的,所以沸点:H2O>HF>NH3,故⑥正确;
因生铁是合金,熔点小于纯金属,故⑦错误;
一般情况,熔点:共价晶体>离子晶体>分子晶体,所以熔点:二氧化硅>NaCl>I2>冰,故⑧正确。
晶体类型的判断方法
1.依据组成晶体的微观粒子和粒子间的作用力判断
(1)分子间通过分子间作用力形成的晶体属于分子晶体。
(2)由原子通过共价键形成的晶体属于共价晶体。
(3)由阴、阳离子通过离子键形成的晶体属于离子晶体。
(4)由金属阳离子和自由电子通过金属键形成的晶体属于金属晶体。
导学
2.依据物质的分类判断
(1)活泼金属的氧化物(如Na2O、MgO等)、强碱[如KOH、Ba(OH)2等]和绝大多数的盐类是离子晶体。
(2)部分非金属单质(除金刚石、石墨、晶体硼、晶体硅等外)、非金属氢化物、部分非金属氧化物(除SiO2等外)、几乎所有的酸、绝大多数有机物(除有机盐外)是分子晶体。
(3)常见的共价晶体单质有金刚石、晶体硼、晶体硅等;常见的共价晶体化合物有碳化硅、SiO2等。
(4)常温下金属单质(除汞外)与合金均属于金属晶体。
3.依据晶体的熔点判断
离子晶体的熔点较高,常在数百至几千摄氏度;共价晶体的熔点高,常在一千至几千摄氏度;分子晶体的熔点较低,常在数百摄氏度以下或很低温度;金属晶体多数熔点高,但也有熔点相当低的。
4.依据导电性判断
离子晶体在水溶液中和熔融状态下都导电;共价晶体一般为非导体,但晶体硅能导电;分子晶体为非导体,而分子晶体中的电解质(主要是酸)溶于水,使分子内的化学键断裂形成自由离子,也能导电;金属晶体是电的良导体。
5.依据硬度和机械性能判断
离子晶体硬度较大或略硬而脆;共价晶体硬度大;分子晶体硬度小且较脆;金属晶体多数硬度大,但也有硬度较小的,且具有延展性。
1.下列物质所属晶体类型分类正确的是
导练
选项 A B C D
共价晶体 石墨 生石灰 碳化硅 金刚石
分子晶体 冰 固态氨 氯化铯 干冰
离子晶体 氮化铝 食盐 明矾 胆矾
金属晶体 铜 汞 铝 铁
√
氮化铝为共价晶体,石墨为混合型晶体,故A错误;
生石灰为CaO,为离子晶体,故B错误;
氯化铯为活泼金属的氯化物,为离子晶体,故C错误。
2.下列物质中属于分子晶体的是
①二氧化硅 ②碘 ③镁 ④蔗糖 ⑤冰
A.①②④ B.②③⑤
C.②④⑤ D.①②④⑤
√
②碘、④蔗糖、⑤冰都是分子晶体。
3.具有下列原子序数的各组元素,能组成化学式为AB2型的化合物,并且该化合物在固态时为共价晶体的是
A.6和8 B.20和17 C.14和6 D.14和8
√
原子序数为6和8的元素分别为C、O,形成的化合物是CO2,在固态时为分子晶体,A错误;
原子序数为20和17的元素分别为Ca、Cl,形成的化合物是CaCl2,在固态时为离子晶体,B错误;
原子序数为14和6的元素分别为Si、C,形成的化合物是SiC,在固态时为共价晶体,C错误;
原子序数为14和8的元素分别为Si、O,形成的化合物是SiO2,在固态时为共价晶体,D正确。
1.下列说法正确的有几个
①氯化氢溶于水时共价键被破坏,属于物理变化
②金刚石、SiC、H2O、H2S晶体的熔点依次降低
③NaOH和MgCl2均含有共价键,但都属于离子晶体
④氯化钠晶体不导电,是因为无阴、阳离子
⑤SiO2晶体中每个硅原子与2个氧原子成键,每个氧原子与4个硅原子成键
⑥元素的金属性越强,则其构成金属单质的金属键也越强
A.1 B.2 C.3 D.4
1
2
3
自我测试
√
1
2
3
自我测试
氯化氢溶于水氯原子和氢原子之间的共价键被破坏,电离成离子,属于物理变化,故①正确;
金刚石、SiC属于原子晶体,键长C—C氯化镁中只含有离子键,无共价键,故③错误;
氯化钠晶体不导电,是因为氯化钠固体中没有自由移动的离子,氯化钠固体中存在钠离子和氯离子,故④错误;
1
2
3
自我测试
SiO2晶体中每个硅原子与4个氧原子成键,每个氧原子与两个硅原子成键,故⑤错误;
金属性强的元素原子核对外层电子吸引力弱,外层电子更活跃,容易脱离原子,从而发生化学反应,金属键就是金属离子和自由电子的相互作用,元素的金属性越强,其构成金属单质的金属键一般越弱,故⑥错误。
2.下列每组物质发生状态变化时所克服的粒子间的相互作用属于同种类型的是
A.食盐和蔗糖熔化 B.钠和硫熔化
C.碘和干冰升华 D.二氧化硅和氧化钠熔化
自我测试
1
2
3
A项,食盐为离子晶体,蔗糖为分子晶体;
B项,钠为金属晶体,硫为分子晶体;
D项,SiO2为共价晶体,Na2O为离子晶体,以上三组物质均不属于同类晶体,其粒子间的相互作用也就不属于同种类型;
C项,碘和干冰均属于分子晶体,它们升华时均需克服分子间作用力,属于同种类型。
√
3.为了确定SbCl3、SbCl5、SnCl4是否为离子晶体,进行下列实验,其中合理、可靠的是
A.观察常温下的状态,SbCl5是黄色液体,SnCl4为无色液体。结论:SbCl5和
SnCl4都是离子晶体
B.测定SbCl3、SbCl5、SnCl4的熔点依次为73.4 ℃、2.8 ℃、-33 ℃。结论:
SbCl3、SbCl5、SnCl4都不是离子晶体
C.将SbCl3、SbCl5、SnCl4溶解于水中,分别滴入HNO3酸化的AgNO3溶液,均
产生白色沉淀。结论:SbCl3、SbCl5、SnCl4都是离子晶体
D.测定SbCl3、SbCl5、SnCl4的水溶液的导电性,发现它们都可以导电。结论:
SbCl3、SbCl5、SnCl4都是离子晶体
自我测试
1
2
3
√
自我测试
1
2
3
离子晶体一般熔点较高,熔融时可导电;某些分子晶体溶于水后也可以发生电离而导电,若电离出Cl-,则能与HNO3酸化的AgNO3溶液反应,产生白色沉淀,故A、C、D都不正确。
晶体类型的比较
第4课时
第三节 金属晶体与离子晶体
晶体类型的比较
1.常见晶体的比较
导学
晶体 分子晶体 离子晶体 金属晶体 共价晶体
构成微粒 分子 阴、阳离子 金属离子、自由电子 原子
微粒间作用力 范德华力(少数有氢键) 离子键 金属键 共价键
性质 熔、沸点 较低 较高 一般较高 很高
硬度 小 略硬而脆 一般较大 很大
溶解性 相似相溶 多数溶于水 不溶,有些与水反应 不溶
机械加工性能 不良 不良 良好 不良
导电性 固态、液态均不导电,部分溶于水时导电 固态时不导电,熔融态时导电,能溶于水的溶于水时导电 固态、熔融态时均导电 大部分固态、熔融态时都不导电
作用力大小规律 组成和结构相似的分子,相对分子质量大的范德华力大 离子所带电荷数多、半径小的离子键强 金属原子的价电子数多、半径小的金属离子与自由电子间的作用力强 共价键键长短(电子云重叠多)、原子半径小的共价键稳定
典型实例 干冰、白磷、冰、硫黄、HCl、CH4等 NaCl、NaOH、Na2O、Na2O2等 Na、Mg、Al、Fe、Cu、Zn等 金刚石、晶体硅、二氧化硅等
2.分类比较晶体的熔、沸点高低的方法
(1)不同类型晶体的熔、沸点高低的一般规律
共价晶体>离子晶体>分子晶体。金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点很高,如汞、镓、铯等熔、沸点很低,金属晶体一般不参与比较。
(2)共价晶体
由共价键形成的共价晶体中,原子半径小的键长短,键能大,晶体的熔、沸点高。如熔点:金刚石>碳化硅>硅。
(3)离子晶体
一般地说,阴、阳离子所带电荷数越多,离子半径越小,则离子键就越强,其离子晶体的熔、沸点就越高。如熔点:MgO>MgCl2>NaCl>CsCl。
(4)分子晶体
①分子间作用力越大,物质的熔、沸点越高;具有氢键的分子晶体熔、沸点反常的高。如熔、沸点:H2O>H2Te>H2Se>H2S。
②组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高,如熔、沸点:SnH4>GeH4>SiH4>CH4,F2
导练
1.下列关于晶体的说法中正确的是
①在晶体中只要有阴离子就一定有阳离子,只要有阳离子就一定有阴离子
②分子晶体的熔点一定比金属晶体的低
③晶体中分子间作用力越大,分子越稳定
④离子晶体中一定存在离子键
⑤分子晶体中一定存在共价键
⑥共价晶体中一定存在共价键
A.②④⑥ B.④⑤
C.④⑥ D.③④
√
晶体中只要有阴离子就一定有阳离子,但有阳离子,不一定有阴离子,如金属晶体中只有金属阳离子和自由电子,没有阴离子,①错误;
有些分子晶体的熔点高于金属晶体,如汞常温下为液态,碘常温下为固态,②错误;
分子稳定性与分子间作用力无关,③错误;
由0族元素形成的分子晶体中不存在化学键,⑤错误。
2.下列有关性质的比较正确的是
①硬度:BaO>CaO>MgO
②水溶性:CH3CH2OH>CH3CH2OCH2CH3
③沸点:HCl>HF
④熔点:NaCl>MgO
⑤分子或离子中键角:H2O
⑦熔点:金刚石>生铁>纯铁>钠
⑧熔点:二氧化硅>NaCl>I2>冰
A.①②⑥⑧ B.①②⑤⑥⑧ C.②④⑤⑥ D.②⑤⑥⑧
√
r(Mg2+)
HF分子间能形成氢键,所以沸点高于HCl,故③错误;
MgO中离子电荷数比NaCl中离子电荷数大,且离子半径小,所以离子键:NaCl
因生铁是合金,熔点小于纯金属,故⑦错误;
一般情况,熔点:共价晶体>离子晶体>分子晶体,所以熔点:二氧化硅>NaCl>I2>冰,故⑧正确。
晶体类型的判断方法
1.依据组成晶体的微观粒子和粒子间的作用力判断
(1)分子间通过分子间作用力形成的晶体属于分子晶体。
(2)由原子通过共价键形成的晶体属于共价晶体。
(3)由阴、阳离子通过离子键形成的晶体属于离子晶体。
(4)由金属阳离子和自由电子通过金属键形成的晶体属于金属晶体。
导学
2.依据物质的分类判断
(1)活泼金属的氧化物(如Na2O、MgO等)、强碱[如KOH、Ba(OH)2等]和绝大多数的盐类是离子晶体。
(2)部分非金属单质(除金刚石、石墨、晶体硼、晶体硅等外)、非金属氢化物、部分非金属氧化物(除SiO2等外)、几乎所有的酸、绝大多数有机物(除有机盐外)是分子晶体。
(3)常见的共价晶体单质有金刚石、晶体硼、晶体硅等;常见的共价晶体化合物有碳化硅、SiO2等。
(4)常温下金属单质(除汞外)与合金均属于金属晶体。
3.依据晶体的熔点判断
离子晶体的熔点较高,常在数百至几千摄氏度;共价晶体的熔点高,常在一千至几千摄氏度;分子晶体的熔点较低,常在数百摄氏度以下或很低温度;金属晶体多数熔点高,但也有熔点相当低的。
4.依据导电性判断
离子晶体在水溶液中和熔融状态下都导电;共价晶体一般为非导体,但晶体硅能导电;分子晶体为非导体,而分子晶体中的电解质(主要是酸)溶于水,使分子内的化学键断裂形成自由离子,也能导电;金属晶体是电的良导体。
5.依据硬度和机械性能判断
离子晶体硬度较大或略硬而脆;共价晶体硬度大;分子晶体硬度小且较脆;金属晶体多数硬度大,但也有硬度较小的,且具有延展性。
1.下列物质所属晶体类型分类正确的是
导练
选项 A B C D
共价晶体 石墨 生石灰 碳化硅 金刚石
分子晶体 冰 固态氨 氯化铯 干冰
离子晶体 氮化铝 食盐 明矾 胆矾
金属晶体 铜 汞 铝 铁
√
氮化铝为共价晶体,石墨为混合型晶体,故A错误;
生石灰为CaO,为离子晶体,故B错误;
氯化铯为活泼金属的氯化物,为离子晶体,故C错误。
2.下列物质中属于分子晶体的是
①二氧化硅 ②碘 ③镁 ④蔗糖 ⑤冰
A.①②④ B.②③⑤
C.②④⑤ D.①②④⑤
√
②碘、④蔗糖、⑤冰都是分子晶体。
3.具有下列原子序数的各组元素,能组成化学式为AB2型的化合物,并且该化合物在固态时为共价晶体的是
A.6和8 B.20和17 C.14和6 D.14和8
√
原子序数为6和8的元素分别为C、O,形成的化合物是CO2,在固态时为分子晶体,A错误;
原子序数为20和17的元素分别为Ca、Cl,形成的化合物是CaCl2,在固态时为离子晶体,B错误;
原子序数为14和6的元素分别为Si、C,形成的化合物是SiC,在固态时为共价晶体,C错误;
原子序数为14和8的元素分别为Si、O,形成的化合物是SiO2,在固态时为共价晶体,D正确。
1.下列说法正确的有几个
①氯化氢溶于水时共价键被破坏,属于物理变化
②金刚石、SiC、H2O、H2S晶体的熔点依次降低
③NaOH和MgCl2均含有共价键,但都属于离子晶体
④氯化钠晶体不导电,是因为无阴、阳离子
⑤SiO2晶体中每个硅原子与2个氧原子成键,每个氧原子与4个硅原子成键
⑥元素的金属性越强,则其构成金属单质的金属键也越强
A.1 B.2 C.3 D.4
1
2
3
自我测试
√
1
2
3
自我测试
氯化氢溶于水氯原子和氢原子之间的共价键被破坏,电离成离子,属于物理变化,故①正确;
金刚石、SiC属于原子晶体,键长C—C
氯化钠晶体不导电,是因为氯化钠固体中没有自由移动的离子,氯化钠固体中存在钠离子和氯离子,故④错误;
1
2
3
自我测试
SiO2晶体中每个硅原子与4个氧原子成键,每个氧原子与两个硅原子成键,故⑤错误;
金属性强的元素原子核对外层电子吸引力弱,外层电子更活跃,容易脱离原子,从而发生化学反应,金属键就是金属离子和自由电子的相互作用,元素的金属性越强,其构成金属单质的金属键一般越弱,故⑥错误。
2.下列每组物质发生状态变化时所克服的粒子间的相互作用属于同种类型的是
A.食盐和蔗糖熔化 B.钠和硫熔化
C.碘和干冰升华 D.二氧化硅和氧化钠熔化
自我测试
1
2
3
A项,食盐为离子晶体,蔗糖为分子晶体;
B项,钠为金属晶体,硫为分子晶体;
D项,SiO2为共价晶体,Na2O为离子晶体,以上三组物质均不属于同类晶体,其粒子间的相互作用也就不属于同种类型;
C项,碘和干冰均属于分子晶体,它们升华时均需克服分子间作用力,属于同种类型。
√
3.为了确定SbCl3、SbCl5、SnCl4是否为离子晶体,进行下列实验,其中合理、可靠的是
A.观察常温下的状态,SbCl5是黄色液体,SnCl4为无色液体。结论:SbCl5和
SnCl4都是离子晶体
B.测定SbCl3、SbCl5、SnCl4的熔点依次为73.4 ℃、2.8 ℃、-33 ℃。结论:
SbCl3、SbCl5、SnCl4都不是离子晶体
C.将SbCl3、SbCl5、SnCl4溶解于水中,分别滴入HNO3酸化的AgNO3溶液,均
产生白色沉淀。结论:SbCl3、SbCl5、SnCl4都是离子晶体
D.测定SbCl3、SbCl5、SnCl4的水溶液的导电性,发现它们都可以导电。结论:
SbCl3、SbCl5、SnCl4都是离子晶体
自我测试
1
2
3
√
自我测试
1
2
3
离子晶体一般熔点较高,熔融时可导电;某些分子晶体溶于水后也可以发生电离而导电,若电离出Cl-,则能与HNO3酸化的AgNO3溶液反应,产生白色沉淀,故A、C、D都不正确。
