2023浙江中考科学一轮复习(基础版)第36讲 盐和化肥(课件 36张ppt)
文档属性
| 名称 | 2023浙江中考科学一轮复习(基础版)第36讲 盐和化肥(课件 36张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 508.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-01-19 19:19:04 | ||
图片预览








文档简介
(共26张PPT)
2023浙江中考科学一轮复习
第36讲 盐和化肥
重要的盐(九上教材P23)
1.盐的定义:由_____________(或铵根离子)和__________构成的化合物。盐实质上是____和_____反应的产物。
金属阳离子
酸根离子
酸
碱
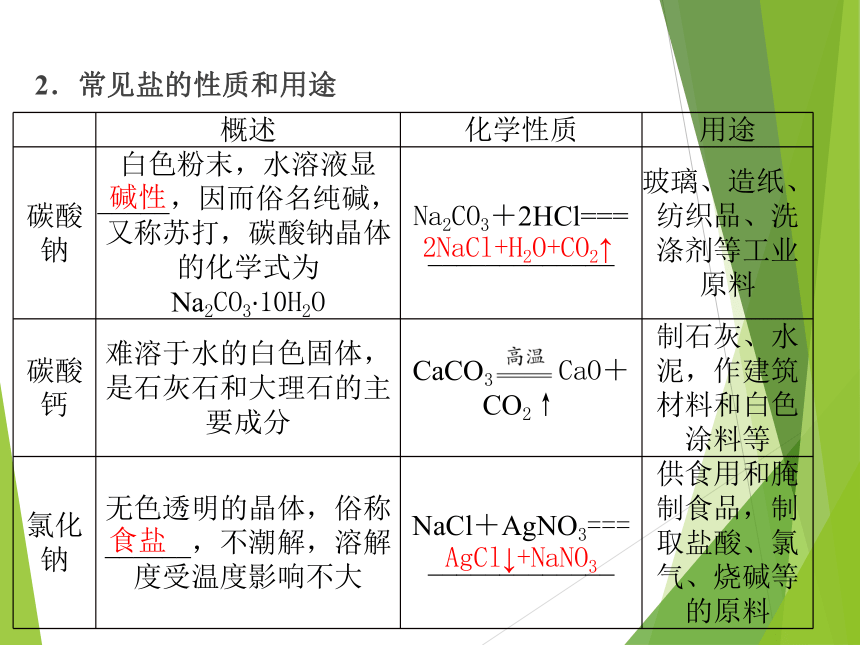
2.常见盐的性质和用途
碱性
概述 化学性质 用途
碳酸钠 白色粉末,水溶液显
_____,因而俗名纯碱,又称苏打,碳酸钠晶体的化学式为Na2CO3·10H2O Na2CO3+2HCl===
_____________ 玻璃、造纸、纺织品、洗涤剂等工业原料
碳酸钙 难溶于水的白色固体,是石灰石和大理石的主要成分 CaCO3 CaO+CO2↑ 制石灰、水泥,作建筑材料和白色涂料等
氯化钠 无色透明的晶体,俗称______,不潮解,溶解度受温度影响不大 NaCl+AgNO3===
_____________ 供食用和腌制食品,制取盐酸、氯气、烧碱等的原料
2NaCl+H2O+CO2↑
食盐
AgCl↓+NaNO3
1.小明想在鸡蛋壳(主要成分CaCO3)上腐蚀出一个“福”字
(如图),送给奶奶作为生日礼物。下列溶液能帮他实现愿望
的是( )
A.食盐水
B.白酒
C.蔗糖水
D.白醋
D
【盐的溶解性】
一般来说,钾盐、钠盐、铵盐、硝酸盐都______;而大多数碳酸盐都______于水;盐酸盐除______不溶,硫酸盐除_______不溶,其余均可溶(注:Ag2SO4、CaSO4为微溶物)。
易溶
不溶
AgCl
BaSO4
盐的性质(九上教材P24)
1.与某些金属反应
(1)规律:金属+盐→新金属+新盐
(2)举例:________________________
(3)反应条件:参加反应的金属比盐中金属______(除钾、钙、钠外)
2.与酸反应
(1)规律:盐+酸→新盐+新酸
(2)举例:Na2CO3+2HCl===___________________
Fe+CuSO4===FeSO4+Cu
活泼
2NaCl+H2O+CO2↑
3.与碱反应
(1)规律:盐+碱→新盐+新碱
(2)举例:2NaOH+CuSO4===_________________
4.与某些盐反应
(1)规律:盐1+盐2→新盐1+新盐2
(2)举例:CuSO4+BaCl2===________________
Cu(OH)2↓+Na2SO4
BaSO4↓+CuCl2
2.(2021,宁夏)及时归纳是学好化学的主要方法之一。利用如图所示的结构图归纳盐的四个方面的化学性质(图中编号①~④),请归纳有关知识。
(1)在性质③中,X代表_____类物质。
(2)在归纳性质④时,从“某些盐”中选取了硝酸银,写出与硝酸银反应的物质的化学式_______(写一个)。
酸
NaCl
几种常见离子的检验(九上教材P26)
1.Cl-的检验:取样,加入 AgNO3 溶液,有白色沉淀生成,再加稀硝酸沉淀不溶解,证明样品中含Cl-。例:AgNO3+HCl===AgCl↓+HNO3。
2.SO 的检验:取样,加入 Ba(NO3)2 溶液,有白色沉淀生
成,再加稀硝酸沉淀不溶解,说明样品中含有SO 。
例:Ba(NO3)2+H2SO4===BaSO4↓+2HNO3。
3.CO 的检验:取样,向试样中滴加______,有气体产生,将气体通入澄清的石灰水中变浑浊,说明样品中含有CO 。例:CaCO3+2HCl===CaCl2+H2O+CO2↑。
稀盐酸
3.下列各组物质的溶液,必须另加试剂才能鉴别出来的一
组是( )
A.K2CO3、NaCl、BaCl2
B.HCl、CaCl2、Na2CO3
C.NaOH、KNO3、CuSO4
D.NH4Cl、Ba(OH)2、Na2SO4
A
化肥(九上教材P28)
化肥主要包括氮肥、磷肥、钾肥、复合肥料等。
(1)氮肥
a.作用:氮是合成蛋白质、核酸和叶绿素的重要元素,氮肥充足会使植物枝繁叶茂、果实硕大。
b.缺氮:缺少氮元素,会使植物生长发育迟缓或停滞,光合作用减慢等。外观表现为植株矮小,瘦弱,叶片发黄,严重时叶脉为棕色。
(2)磷肥
a.作用:促进作物根系生长,还可增强作物的抗寒、抗旱能
力,促进作物穗数增多、籽粒饱满。
b.缺磷:生长迟缓,产量降低,根系不发达。
(3)钾肥
a.作用:保证各种代谢过程的顺利进行、促进植物生长、增强抗病虫害和抗倒伏能力。
b.缺钾:若缺乏钾元素,常表现为茎秆软弱、容易倒伏、叶片的边缘和尖端发黄,并逐渐焦枯。
(4)复合肥
a.定义:同时含有两种或两种以上营养元素的肥料。
b.种类:KNO3、NH4H2PO4、(NH4)2HPO4等。
4.下列化肥中属于复合肥料的是( )
A.CO(NH2)2
B.NH4H2PO4
C.K2SO4
D.NH4HCO3
B
盐的主要化学性质
盐有4条性质,分别是跟可溶性盐反应、跟酸反应、跟某些金属反应、跟可溶性碱反应,熟练应用这些性质,需要注意物质的溶解性,根据物质的溶解性判定反应是否发生。
【例1】 实验室有一包白色固体,其中除了碳酸钠以外,还可能含有硝酸钡、硫酸钠、氢氧化钠中的一种或几种。步骤①:取少量白色固体于烧杯中,向烧杯中加入足量水并不断搅拌,固体部分溶解。步骤②:接着向烧杯中加入足量稀硝酸并不断搅拌,此时固体质量变化如图。下列说法正确的是( )
A.A→B段对应的实验现象是固体部分溶解,无气泡冒出
B.B→C段对应溶液pH逐渐变大
C.C点对应溶液中一定含有的溶质是硝酸、硝酸钠、硝酸钡
D.原白色固体中一定含有碳酸钠、硫酸钠、硝酸钡、氢氧化钠
C
1.已知,常温下氯化钠、氯化钡的水溶液呈中性,向含有盐酸和氯化钡的混合溶液中逐滴滴入过量的X,溶液pH与滴入X的量的关系如图所示,则X可能是下列物质中的( )
A. NaOH溶液
B.H2O
C.AgNO3溶液
D.Na2CO3溶液
D
离子共存问题
两种离子不会结合生成沉淀、气体或水,则两种离子可以共
存。若题干中指出pH小于7的溶液,则可以推断出含有氢离
子;若题干中指出pH大于7的溶液,则可以推断出含有氢氧
根离子。
【例2】 (2022,眉山)某无色水溶液中可能含有以下离子中的几种:H+、Mg2+、Cu2+、Cl-、CO 、SO ,为确定其成
分,小芳进行了以下实验:
①经测定,溶液pH=1;
②取部分未知溶液加入过量NaOH溶液,有白色沉淀产生,过滤;
③取②的部分滤液加入BaCl2溶液,有白色沉淀产生。
分析上述实验,下列对溶液中含有离子的判断正确的是( )
A.一定含有H+、Mg2+,可能含有CO
B.一定含有H+、Mg2+,SO ,可能含有Cl-
C.一定含有H+、Mg2+,可能含有Cu2+
D.一定含有H+、Mg2+、SO ,可能含有Cu2+、Cl-
B
2.甲、乙两个排污口共排放了H2SO4、KNO3、MgCl2和NaOH四种物质,每个排污口各排放其中的两种不同物质。下列关于污水成分的分析合理的是( )
A.H2SO4和KNO3一定来自同一排污口
B.H2SO4和NaOH一定来自同一排污口
C.KNO3和NaOH一定来自同一排污口
D.将两处污水混合后,溶液一定呈中性
C
反应先后问题
【例3】 (2021,赤峰)向盐酸和氯化铜混合溶液中加入一定质量分数的氢氧化钠溶液,产生沉淀的质量与加入氢氧化钠溶液的质量关系如图所示。下列说法不正确的是( )
A.a点溶液中的pH<7
B.bc段(不含b、c点)反应的化学方程
式为CuCl2+2NaOH===Cu(OH)2↓+2NaCl
C.c点溶液中含有两种溶质
D.整个变化过程中氯离子的数目没有改变
C
3.已知碳酸钠溶液呈碱性,随着盐酸的滴入溶液碱性减弱(pH变小),反应存在两个过程:先发生Na2CO3+HCl===NaHCO3+NaCl,后发生NaHCO3+HCl===NaCl+CO2↑+H2O。碳酸钠溶液中滴入盐酸的反应过程中CO , 和H2CO3含量变化如图所示。据图回答下列问题:
(1)加入盐酸使溶液pH为10时,混合液中含碳元素的离子有_______________。
(2)曲线OAB段混合溶液中发生反应的化学方程式为______________________________________。
(3)混合溶液中当pH=8时没有逸出CO2气体,而pH=6时开始逸出CO2气体,这是为什么?
________________________________________________________________________________________________________。
Na2CO3+HCl===NaHCO3+NaCl
pH=8时碳酸钠和稀盐酸恰好完全反应生成碳酸氢钠和氯化
钠,而pH=6时碳酸氢钠和盐酸反应生成了二氧化碳
【例】 某化肥厂以“钾泻盐”(MgSO4·KCl·nH2O)为原料制造高质量钾肥,化肥中KCl含量的高低会直接影响着化肥的品质。某兴趣小组为了测定“钾泻盐”中KCl的质量分数及n的
值,设计了如下两种实验方案:
方案一:如图所示
方案二:如图所示
试回答下列问题:
(1)加入足量AgNO3溶液后,方案二中生成固体的质量大于方案一,原因是方案二中所得28.7 g固体物质中除生成了______外,还生成了微溶的Ag2SO4。
(2)方案一中,滴加足量的Ba(NO3)2溶液,过滤后所得滤液中除可能含有Ba(NO3)2外,一定含有的溶质是________________。
氯化银
硝酸镁、氯化钾
(3)该钾泻盐样品中KCl的质量分数为多少?(精确到1%)
解:设该样品中KCl的质量为x。
(4)该钾泻盐化学式中n的值是多少?(要写出计算过程)
2023浙江中考科学一轮复习
第36讲 盐和化肥
重要的盐(九上教材P23)
1.盐的定义:由_____________(或铵根离子)和__________构成的化合物。盐实质上是____和_____反应的产物。
金属阳离子
酸根离子
酸
碱
2.常见盐的性质和用途
碱性
概述 化学性质 用途
碳酸钠 白色粉末,水溶液显
_____,因而俗名纯碱,又称苏打,碳酸钠晶体的化学式为Na2CO3·10H2O Na2CO3+2HCl===
_____________ 玻璃、造纸、纺织品、洗涤剂等工业原料
碳酸钙 难溶于水的白色固体,是石灰石和大理石的主要成分 CaCO3 CaO+CO2↑ 制石灰、水泥,作建筑材料和白色涂料等
氯化钠 无色透明的晶体,俗称______,不潮解,溶解度受温度影响不大 NaCl+AgNO3===
_____________ 供食用和腌制食品,制取盐酸、氯气、烧碱等的原料
2NaCl+H2O+CO2↑
食盐
AgCl↓+NaNO3
1.小明想在鸡蛋壳(主要成分CaCO3)上腐蚀出一个“福”字
(如图),送给奶奶作为生日礼物。下列溶液能帮他实现愿望
的是( )
A.食盐水
B.白酒
C.蔗糖水
D.白醋
D
【盐的溶解性】
一般来说,钾盐、钠盐、铵盐、硝酸盐都______;而大多数碳酸盐都______于水;盐酸盐除______不溶,硫酸盐除_______不溶,其余均可溶(注:Ag2SO4、CaSO4为微溶物)。
易溶
不溶
AgCl
BaSO4
盐的性质(九上教材P24)
1.与某些金属反应
(1)规律:金属+盐→新金属+新盐
(2)举例:________________________
(3)反应条件:参加反应的金属比盐中金属______(除钾、钙、钠外)
2.与酸反应
(1)规律:盐+酸→新盐+新酸
(2)举例:Na2CO3+2HCl===___________________
Fe+CuSO4===FeSO4+Cu
活泼
2NaCl+H2O+CO2↑
3.与碱反应
(1)规律:盐+碱→新盐+新碱
(2)举例:2NaOH+CuSO4===_________________
4.与某些盐反应
(1)规律:盐1+盐2→新盐1+新盐2
(2)举例:CuSO4+BaCl2===________________
Cu(OH)2↓+Na2SO4
BaSO4↓+CuCl2
2.(2021,宁夏)及时归纳是学好化学的主要方法之一。利用如图所示的结构图归纳盐的四个方面的化学性质(图中编号①~④),请归纳有关知识。
(1)在性质③中,X代表_____类物质。
(2)在归纳性质④时,从“某些盐”中选取了硝酸银,写出与硝酸银反应的物质的化学式_______(写一个)。
酸
NaCl
几种常见离子的检验(九上教材P26)
1.Cl-的检验:取样,加入 AgNO3 溶液,有白色沉淀生成,再加稀硝酸沉淀不溶解,证明样品中含Cl-。例:AgNO3+HCl===AgCl↓+HNO3。
2.SO 的检验:取样,加入 Ba(NO3)2 溶液,有白色沉淀生
成,再加稀硝酸沉淀不溶解,说明样品中含有SO 。
例:Ba(NO3)2+H2SO4===BaSO4↓+2HNO3。
3.CO 的检验:取样,向试样中滴加______,有气体产生,将气体通入澄清的石灰水中变浑浊,说明样品中含有CO 。例:CaCO3+2HCl===CaCl2+H2O+CO2↑。
稀盐酸
3.下列各组物质的溶液,必须另加试剂才能鉴别出来的一
组是( )
A.K2CO3、NaCl、BaCl2
B.HCl、CaCl2、Na2CO3
C.NaOH、KNO3、CuSO4
D.NH4Cl、Ba(OH)2、Na2SO4
A
化肥(九上教材P28)
化肥主要包括氮肥、磷肥、钾肥、复合肥料等。
(1)氮肥
a.作用:氮是合成蛋白质、核酸和叶绿素的重要元素,氮肥充足会使植物枝繁叶茂、果实硕大。
b.缺氮:缺少氮元素,会使植物生长发育迟缓或停滞,光合作用减慢等。外观表现为植株矮小,瘦弱,叶片发黄,严重时叶脉为棕色。
(2)磷肥
a.作用:促进作物根系生长,还可增强作物的抗寒、抗旱能
力,促进作物穗数增多、籽粒饱满。
b.缺磷:生长迟缓,产量降低,根系不发达。
(3)钾肥
a.作用:保证各种代谢过程的顺利进行、促进植物生长、增强抗病虫害和抗倒伏能力。
b.缺钾:若缺乏钾元素,常表现为茎秆软弱、容易倒伏、叶片的边缘和尖端发黄,并逐渐焦枯。
(4)复合肥
a.定义:同时含有两种或两种以上营养元素的肥料。
b.种类:KNO3、NH4H2PO4、(NH4)2HPO4等。
4.下列化肥中属于复合肥料的是( )
A.CO(NH2)2
B.NH4H2PO4
C.K2SO4
D.NH4HCO3
B
盐的主要化学性质
盐有4条性质,分别是跟可溶性盐反应、跟酸反应、跟某些金属反应、跟可溶性碱反应,熟练应用这些性质,需要注意物质的溶解性,根据物质的溶解性判定反应是否发生。
【例1】 实验室有一包白色固体,其中除了碳酸钠以外,还可能含有硝酸钡、硫酸钠、氢氧化钠中的一种或几种。步骤①:取少量白色固体于烧杯中,向烧杯中加入足量水并不断搅拌,固体部分溶解。步骤②:接着向烧杯中加入足量稀硝酸并不断搅拌,此时固体质量变化如图。下列说法正确的是( )
A.A→B段对应的实验现象是固体部分溶解,无气泡冒出
B.B→C段对应溶液pH逐渐变大
C.C点对应溶液中一定含有的溶质是硝酸、硝酸钠、硝酸钡
D.原白色固体中一定含有碳酸钠、硫酸钠、硝酸钡、氢氧化钠
C
1.已知,常温下氯化钠、氯化钡的水溶液呈中性,向含有盐酸和氯化钡的混合溶液中逐滴滴入过量的X,溶液pH与滴入X的量的关系如图所示,则X可能是下列物质中的( )
A. NaOH溶液
B.H2O
C.AgNO3溶液
D.Na2CO3溶液
D
离子共存问题
两种离子不会结合生成沉淀、气体或水,则两种离子可以共
存。若题干中指出pH小于7的溶液,则可以推断出含有氢离
子;若题干中指出pH大于7的溶液,则可以推断出含有氢氧
根离子。
【例2】 (2022,眉山)某无色水溶液中可能含有以下离子中的几种:H+、Mg2+、Cu2+、Cl-、CO 、SO ,为确定其成
分,小芳进行了以下实验:
①经测定,溶液pH=1;
②取部分未知溶液加入过量NaOH溶液,有白色沉淀产生,过滤;
③取②的部分滤液加入BaCl2溶液,有白色沉淀产生。
分析上述实验,下列对溶液中含有离子的判断正确的是( )
A.一定含有H+、Mg2+,可能含有CO
B.一定含有H+、Mg2+,SO ,可能含有Cl-
C.一定含有H+、Mg2+,可能含有Cu2+
D.一定含有H+、Mg2+、SO ,可能含有Cu2+、Cl-
B
2.甲、乙两个排污口共排放了H2SO4、KNO3、MgCl2和NaOH四种物质,每个排污口各排放其中的两种不同物质。下列关于污水成分的分析合理的是( )
A.H2SO4和KNO3一定来自同一排污口
B.H2SO4和NaOH一定来自同一排污口
C.KNO3和NaOH一定来自同一排污口
D.将两处污水混合后,溶液一定呈中性
C
反应先后问题
【例3】 (2021,赤峰)向盐酸和氯化铜混合溶液中加入一定质量分数的氢氧化钠溶液,产生沉淀的质量与加入氢氧化钠溶液的质量关系如图所示。下列说法不正确的是( )
A.a点溶液中的pH<7
B.bc段(不含b、c点)反应的化学方程
式为CuCl2+2NaOH===Cu(OH)2↓+2NaCl
C.c点溶液中含有两种溶质
D.整个变化过程中氯离子的数目没有改变
C
3.已知碳酸钠溶液呈碱性,随着盐酸的滴入溶液碱性减弱(pH变小),反应存在两个过程:先发生Na2CO3+HCl===NaHCO3+NaCl,后发生NaHCO3+HCl===NaCl+CO2↑+H2O。碳酸钠溶液中滴入盐酸的反应过程中CO , 和H2CO3含量变化如图所示。据图回答下列问题:
(1)加入盐酸使溶液pH为10时,混合液中含碳元素的离子有_______________。
(2)曲线OAB段混合溶液中发生反应的化学方程式为______________________________________。
(3)混合溶液中当pH=8时没有逸出CO2气体,而pH=6时开始逸出CO2气体,这是为什么?
________________________________________________________________________________________________________。
Na2CO3+HCl===NaHCO3+NaCl
pH=8时碳酸钠和稀盐酸恰好完全反应生成碳酸氢钠和氯化
钠,而pH=6时碳酸氢钠和盐酸反应生成了二氧化碳
【例】 某化肥厂以“钾泻盐”(MgSO4·KCl·nH2O)为原料制造高质量钾肥,化肥中KCl含量的高低会直接影响着化肥的品质。某兴趣小组为了测定“钾泻盐”中KCl的质量分数及n的
值,设计了如下两种实验方案:
方案一:如图所示
方案二:如图所示
试回答下列问题:
(1)加入足量AgNO3溶液后,方案二中生成固体的质量大于方案一,原因是方案二中所得28.7 g固体物质中除生成了______外,还生成了微溶的Ag2SO4。
(2)方案一中,滴加足量的Ba(NO3)2溶液,过滤后所得滤液中除可能含有Ba(NO3)2外,一定含有的溶质是________________。
氯化银
硝酸镁、氯化钾
(3)该钾泻盐样品中KCl的质量分数为多少?(精确到1%)
解:设该样品中KCl的质量为x。
(4)该钾泻盐化学式中n的值是多少?(要写出计算过程)
同课章节目录
